Журнал «Боль. Суставы. Позвоночник» Том 9, №3, 2019
Вернуться к номеру
Менеджмент пациентов с ревматоидным артритом в периоперационном периоде
Авторы: Синяченко О.В. (1), Головач И.Ю. (2), Егудина Е.Д. (3)
1 - Донецкий национальный медицинский университет МЗ Украины, г. Лиман, Украина
2 - Клиническая больница «Феофания» Государственного управления делами, г. Киев, Украина
3 - Образовательный центр Клиники современной ревматологии, г. Киев, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Пацієнти з ревматоїдним артритом (РА), незважаючи на успіх консервативної терапії, мають високу потребу у проведенні ортопедичних хірургічних втручань, а також операцій за соматичними показаннями. Таким пацієнтам необхідна ретельна періопераційна оцінка та підготовка для досягнення сприятливих результатів оперативного лікування й менеджменту в післяопераційному періоді. Повинен бути зібраний детальний анамнез, проведено детальне фізикальне обстеження з відповідною лабораторною оцінкою функції органів і систем, з диференціюванням ураження органів, вторинного щодо РА або пов’язаного з коморбідними станами. Слід поінформувати пацієнтів про потенційні ризики хірургічного втручання, зокрема підвищення ризику інфікування, уповільнення загоєння ран і розвиток венозних тромбоемболій, а також про основні можливі серцево-судинні, легеневі й неврологічні порушення, що можуть бути зумовлені хірургічним втручанням. В оглядовій статті підбито підсумки останніх досягнень у цій галузі та розглянуто останні рекомендації, запропоновані Американською колегією ревматологів і Американською асоціацією хірургів, щодо періопераційного ведення й тактики антиревматичної терапії в пацієнтів перед тотальним ендопротезуванням колінних і кульшових суглобів 2017 року і керівництво з біологічної безпеки хворобомодифікуючих антиревматичних препаратів (ХМАРП) Британського товариства ревматологів при запальних артритах. Менеджмент ХМАРП у передопераційному періоді має здійснюватися згідно з рекомендаціями основних провідних ревматологічних спільнот, але підхід повинен бути індивідуалізований, із залученням мультидисциплінарної команди. На сьогодні рекомендації підтримують продовження прийому синтетичних ХМАРП упродовж усього періопераційного періоду й рекомендують короткочасне переривання біологічної терапії на один інтервал дозування перед операцією з продовженням прийому через 14 днів після операції. Більш високі дози глюкокортикоїдів роблять значно більший внесок у ризик післяопераційної інфекції, аніж біологічна терапія. Рекомендується уникати планової операції в пацієнтів, які приймають преднізолон в дозі більше за 20 мг/д. Рекомендується зниження дози глюкокортикоїдів до мінімально можливої перед операцією. Незважаючи на те, що невизначеність залишається, ці недавні дослідження та рекомендації дозволяють більш раціонально і науково обґрунтовано підходити до ведення пацієнтів з РА, яким заплановано хірургічне втручання або яким необхідно провести її терміново.
Пациенты с ревматоидным артритом (РА), несмотря на успех консервативной терапии, имеют высокую потребность в ортопедических хирургических вмешательствах, а также в операциях по соматическим показаниям. Эти пациенты нуждаются в тщательной периоперационной оценке и подготовке для достижения благоприятных результатов оперативного лечения и менеджмента в послеоперационном периоде. Должен быть тщательно собран анамнез, проведено скрупулезное физическое обследование с соответствующей лабораторной оценкой функций органов и систем, дифференциацией вторичных поражений органов или коморбидных состояний. Пациенты должны быть проинформированы о потенциальных рисках хирургического вмешательства, включая повышенный риск инфицирования, замедления заживления ран и венозной тромбоэмболии, а также об основных возможных сердечно-сосудистых, легочных и неврологических нарушениях, которые могут быть вызваны хирургическим вмешательством. В обзорной статье подведены итоги последних достижений в этой области и рассмотрены последние рекомендации, предложенные Американской коллегией ревматологов и Американской ассоциацией хирургов, по поводу периоперационного ведения и тактики антиревматической терапии у пациентов перед тотальным эндопротезированием коленных и тазобедренных суставов 2017 года и руководство по биологической безопасности болезньмодифицирующих антиревматических препаратов (БМАРП) Британского общества ревматологов при воспалительных артритах. Назначение БМАРП в предоперационном периоде должно осуществляться в соответствии с рекомендациями основных ведущих ревматологических сообществ, но подход должен быть индивидуализированным, с привлечением многопрофильной команды. Сегодня рекомендации поддерживают продолжение приема синтетических БМАРП на протяжении всего периоперационного периода и рекомендуют кратковременное прерывание биологической терапии на один интервал дозировки перед операцией с продолжением приема через 14 дней после операции. Более высокие дозы глюкокортикоидов вносят значительно больший вклад в риск послеоперационной инфекции, чем биологическая терапия. Рекомендуется избегать плановой операции у пациентов, получающих преднизолон в дозе более 20 мг/д. До операции рекомендуется снизить дозу глюкокортикоидов до минимально возможного уровня. Несмотря на то, что неопределенность остается, эти недавние исследования и рекомендации позволяют более рационально и научно обоснованно подходить к ведению пациентов с РА, которым запланировано хирургическое вмешательство или которым необходимо провести его срочно.
Patients with rheumatoid arthritis (RA), despite the success of conservative therapy, have an urgent need for the orthopedic surgical interventions, as well as operations for somatic indications. These patients need a careful perioperative assessment and instruction for the favorable results of surgical treatment and management to be achieved in the postoperative period. A detailed history should be compiled, a thorough physical examination with appropriate laboratory evaluation of the organic and systemic functions, differentiation of the organic damage secondary to the RA or associated with comorbidity, should be carried out. Patients should be informed about the potential risks of surgery, including an increased risk of infection, delayed wound healing and development of venous thromboembolism events, as well as the key possibilities in terms of cardiovascular, pulmonary and neurological disorders that may be caused by surgery. Clinical studies over the past few years have improved our understanding of the proper perioperative management of patients with the RA. This article summarizes the latest advances in this field and considers the latest recommendations proposed by the American College of Rheumatology and the American Association of Hip and Knee Surgeons guidelines (2017) for the perioperative management of antirheumatic therapy in patients with rheumatic diseases undergoing elective total hip or total knee arthroplasty, and The British Society for Rheumatology guidelines on the disease-modifying antirheumatic drugs (DMARD) safety in inflammatory arthritis. The management of DMARDs in the preoperative period should be carried out under the recommendations of the leading rheumatological societies, but the approach should be individualized with the involvement of a multidisciplinary team. Today, the recommendations support the continuation of synthetic DMARDs throughout the entire perioperative period and recommend a short-term interruption of biological therapy at one dosing interval before surgery with a continuation of administration within 14 days after surgery. The higher doses of glucocorticoids contribute to the risk of postoperative infection more significantly than the biological therapy. It is recommended to avoid the planned surgery if the patients are receiving prednisone at a dose of more than 20 mg per day. Before surgery, it is recommended to reduce the dose of glucocorticoids to the lowest possible level. Even though uncertainty remains, these recent studies and recommendations allow a more rational and scientifically sound approach to the management of RA patients who are scheduled for surgery or who need to get operated urgently.
періопераційний менеджмент; ревматоїдний артрит; ендопротезування суглобів; інфекція; ризик; хворобомодифікуючі антиревматичні препарати; глюкокортикоїди; біологічна терапія; інгібітори фактора некрозу пухлини
периоперационный менеджмент; ревматоидный артрит; эндопротезирование суставов; инфекция; риск; болезньмодифицирующие антиревматические препараты; глюкокортикоиды; биологическая терапия; ингибиторы фактора некроза опухоли
perioperative management; rheumatoid arthritis; joint replacement; infection, risk; disease modifying antirheumatic drugs; glucocorticoids; biological therapy; tumor necrosis factor inhibitors
Несмотря на стремительное развитие биологической терапии и активное внедрение этих препаратов в менеджмент пациентов с ревматическими заболеваниями, больные с ревматоидным артритом (РА) часто подвергаются ортопедическим хирургическим вмешательствам [1]. Эндопротезирование суставов, артропластика, артроскопический дебридмент, реконструкция сухожилий, удаление ревматоидных узелков, декомпрессия туннельного и запястного каналов — это неполный перечень ортопедических вмешательств при РА. Кроме того, пациентам с РА проводят оперативное лечение и по соматическим показаниям, причем чаще, чем в популяции в целом [1]. Периоперационный период является периодом высокого риска для инфекционных процессов, таких как хирургическая раневая инфекция и пневмонии. Артропластика и другие операции, которые включают использование протезного материала, вызывают особую озабоченность из–за потенциальной возможности инфицирования эндопротезов. Важным вопросом и вызовом, стоящим перед клиницистами, является определение объема исследований, частоты мониторинга и необходимости коррекции терапии у пациентов с РА, готовящихся к оперативным вмешательствам и перенесших таковые.
Безусловно, необходима тщательная предоперационная оценка пациентов с РА независимо от ремиссии заболевания и фармакологического контроля клинических симптомов. Часто пациенты с РА могут подвергаться ургентным хирургическим вмешательствам даже на фоне активности воспалительного ауто–иммунного процесса. С учетом того, что пациентов с РА относят к группе высокого риска, многими руководящими сообществами по ведению пациентов с ревматологическими заболеваниями было принято решение, что периоперационное ведение таких больных следует проводить с использованием междисциплинарного подхода. Такая междисциплинарная –команда должна включать ревматолога, анестезиолога, кардиолога, гематолога и оперирующего хирурга–ортопеда [2].
Мы представляем анализ и обобщение рекомендаций ведущих мировых сообществ по медикаментозному лечению РА в периоперационный период, основная цель которых — минимизация риска ятрогенных и послеоперационных осложнений.
Исследования, опубликованные за последние несколько лет, включая обновленные рекомендации, расширили наше понимание риска инфекции у пациентов с РА, подвергающихся хирургическому вмешательству, и роли иммуносупрессантов, глюкокортикоидов (ГК) и биологической терапии в этом процессе. Несмотря на сохраняющуюся неопределенность и несогласованность по некоторым вопросам последних рекомендаций, именно они позволяют более рационально и научно обоснованно подходить к ведению пациентов с РА, которым запланировано хирургическое вмешательство или которым необходимо провести его ургентно.
Рекомендации в предоперационный период
Анамнез и объективное исследование
В случае плановых оперативных вмешательств должна быть выполнена всесторонняя оценка жалоб, проведены детализация и анализ анамнеза и физикальных данных. Соответствующие детали в анамнезе жизни и болезни пациента, включая возраст, длительность заболевания, функциональное состояние, специфическое поражение суставов и внесуставные проявления, могут обосновать необходимость назначения дополнительных методов исследования. Обязательно должна быть собрана информация о приеме лекарственных препаратов с учетом продолжительности применения ГК, осложнениях после предшествующих хирургических вмешательств, сопутствующих заболеваниях. Такие сопутствующие заболевания, которые требуют обязательного учета и возможных лабораторно–инструментальных уточнений, включают анемию, синдром Фелти, интерстициальные заболевания легких, плеврит, невропатии, сосудистые заболевания, ишемическую болезнь сердца, перикардит, увеит/склерит, синдром Шегрена, поражение шейного отдела позвоночника и перстнечерпаловидный артрит [3]. В дополнение к обычному предоперационному объективному исследованию акцент делается на осанку, походку, подвижность суставов и целостность кожных покровов.
Предоперационное тестирование
Соответствующее рутинное предоперационное тестирование может быть полезно для понимания степени прогрессирования заболевания у пациентов с РА, особенно тех, которые длительно принимали болезньмодифицирующие антиревматические препараты (БМАРП), нестероидные противовоспалительные препараты (НПВП) и ГК.
При оценке общего анализа крови следует обратить внимание на частое наличие у таких пациентов анемии, как вследствие основного заболевания, так и в результате побочных эффектов лекарственных препаратов, и на лейкопению [3]. Необходима также оценка биохимического анализа крови с обязательным выполнением почечно–печеночных тестов, особенно при наличии гепаторенальных нарушений, вторичных по отношению как к основному заболеванию, так и, что отмечается более часто, к противоревматическим препаратам. Другие рутинные предоперационные исследования включают анализ мочи, бактериальный посев мочи, электрокардиограмму и рентгенографию органов грудной клетки. Предоперационная оценка других сопутствующих заболеваний целесообразна в плане снижения осложнений в результате хирургической заболеваемости и смертности [4].
Сопутствующие заболевания
Оценка и скрининг на ассоциированные с РА заболевания шейного отдела позвоночника, сердца, легких и нервной системы могут помочь снизить вероятность возникновения неблагоприятных послеоперационных осложнений.
Шейный отдел позвоночника
Атланто–аксиальная нестабильность
Распространенность поражения шейного отдела позвоночника у пациентов с РА колеблется от 25 до 86 % и представляет собой риск повреждения спинного мозга во время интубации дыхательных путей [5]. В пред–операционном периоде критически важно исключить заболевания шейного отдела позвоночника, а также оценить наличие или отсутствие вовлечения нервной системы. Это обусловлено тем, что до 80 % пациентов с РА имеют рентгенологические признаки заболевания шейного отдела позвоночника, при том что у половины нет клинических симптомов [5], а у 36 % пациентов с характерными симптомами наблюдается быстрое прогрессирование неврологической симптоматики [6].
Для невролога или анестезиолога важно проведение полного неврологического обследования этих пациентов для клинического понимания уровня неврологических проявлений вовлечения шейного отдела позвоночника и, что не менее важно, установление неврологического исходного уровня, с которым можно сравнивать любые послеоперационные изменения в статусе больного.
Наблюдаются три наиболее распространенные деформации шейного отдела позвоночника при РА: атланто–аксиальный подвывих (65 %), вертикальное смещение зубовидного отростка (20 %) и субаксиальный подвывих (15 %) [5]. Необходимо проведение предоперационной оценки наличия атланто–аксиального подвывиха для исключения гипермобильности шеи. Более высокая частота атланто–аксиального подвывиха была отмечена у пациентов с длительным анамнезом заболевания, наличием эрозий периферических суставов, длительной ГК терапией и подкожными узелками [6]. Вертикальное смещение зубовидного отростка и атланто–аксиальный подвывих являются вторичными вследствие эрозии затылочного бугра и изменения суставов на уровне C1–C2. Данные нарушения приводят к прямому сдавливанию ствола мозга зубовидным отростком и развитию тяжелых неврологических повреждений или даже к смерти. Субаксиальная нестабильность и подвывих позвонков в сегментах от С2 до С7 обычно связаны с кифозом в грудном отделе [5].
Стандартные статические рентгенограммы шейного отдела позвоночника, а также динамические боковые рентгенограммы с оценкой сгибания и разгибания должны быть проведены до операции у пациентов с предрасполагающими факторами для оценки наличия нестабильности С1–С2. Рентгенография также должна быть выполнена у лиц с болями в шее, при ограничении объема движений в шее, у пациентов с корешковым синдромом, болью и слабостью в конечностях [6].
Передний атланто–дентальный интервал (AADI) — расстояние от заднего края дуги C1 до передней поверхности зубовидного отростка — является наиболее распространенным измерением для оценки этих аномалий. Нормальные значения составляют менее 3 мм. При нестабильности этот показатель будет увеличиваться при сгибании на боковом снимке. Хотя AADI является неспецифичным для установления неврологического дефицита, этот метод исследования необходим для определения дальнейшей терапии атланто–аксиальной нестабильности в периоперационном периоде у пациентов с РА.
Анестезиолог должен быть проинформирован в до– и периоперационном периодах, если AADI превышает 2,5 мм. У пациентов с наличием атланто–аксиальной нестабильности необходимо распознавание любых новых неврологических симптомов, прогрессирующей деформации, которая при отсутствии лечения может прогрессировать вплоть до разрушения атланта. Это приводит к сдавлению спинного мозга и предрасположенности периоперационного пациента к неврологическому повреждению. В случае наличия у пациента с РА неврологических симптомов должна быть проведена МРТ шейного отдела позвоночника для оценки компрессии спинного мозга [5]. Пациентам со сдавлением спинного мозга в периоперационном периоде могут потребоваться дополнительные меры предосторожности, включая мягкий шейный воротник и минимальные манипуляции при транспортировке [5].
Артрит перстнечерпаловидного сустава
Артрит перстнечерпаловидного сустава (ПЧС) является широко распространенным поражением у пациентов с РА (26–86 %) [6]. РА является единственным аутоиммунным системным заболеванием, при котором в патологический процесс могут вовлекаться суставы и хрящи гортани. Несмотря на высокую распространенность поражения ПЧС, формирование острой непроходимости дыхательных путей остается достаточно редким, но опасным для жизни осложнением в этой популяции пациентов. Если возникает двусторонний артрит ПЧС, то при парамедиальном положении наступают приступы удушья, нередко требующие экстренной трахеотомии. Пациенты с РА с жалобами на чувство комка или напряжения в горле, охриплость голоса, одинофагию или боль при разговоре должны быть исследованы на наличие артрита ПЧС в предоперационном периоде. Боль, иррадиирующая в уши из–за ущемления глоссофарингеального и блуждающего нервов перстнечерпаловидным суставом, также является частой жалобой. Как правило, хронический артрит ПЧС может быть бессимптомным или даже неправильно диагностированным — как хронический бронхит или астма. При РА в периоперационном периоде артрит ПЧС может привести к острому нарушению дыхания во время интубации или экстубации, что потребует ургентных действий вплоть до трахеотомии [6].
Оценка сердечно-сосудистой системы
Оценка факторов риска, связанных с сердечно–сосудистыми заболеваниями (ССЗ), является обязательной для хирурга и анестезиолога в предоперационном и периоперационном периодах. Пациенты с РА, а также с другими воспалительными заболеваниями суставов имеют значительно более высокий риск смертности, связанной с ССЗ, — примерно на 50 % выше по сравнению с населением в целом [7]. Это требует их соответствующего менеджмента в предоперационном периоде.
Установлена корреляция между активностью РА и более высоким риском развития ССЗ, что демонстрирует ряд исследований: наблюдается относительное увеличение риска не только ССЗ, но и ранней смертности от всех причин по сравнению со здоровыми лицами [9]. Еще в одном исследовании сообщалось о повышении риска развития стенокардии и инфаркта миокарда (как нераспознанного, так и приводящего к госпитализации) у пациентов с РА по сравнению с неревматоидными пациентами [10]. Следует отметить, что, по данным недавнего исследования, пациенты с низкой активностью РА и отсутствием анамнеза ССЗ также имели высокий риск смертности, связанной с сердечно–сосудистыми причинами [11]. Все вышеперечисленные факты подчеркивают важность раннего распознавания и лечения ССЗ у пациентов с РА, особенно в условиях предстоящего оперативного лечения.
Для оценки кардиоваскулярных рисков у пациентов с РА в предоперационном периоде должны быть выполнены три важные диагностические процедуры:
1) электрокардиограмма, являющаяся важным диагностическим инструментом, который следует использовать до операции у пациента с РА для оценки явных аритмий, а также для оценки длительности интервала QT. Пациенты с РА особенно подвержены риску удлинения интервала QT, что является неблагоприятным прогностическим признаком аритмий и внезапной сердечной смерти [11];
2) хотя системная оценка коронарного риска по шкале SCORE для прогнозирования сердечно–сосудистых заболеваний в течение 10 лет не входит в компетенцию хирурга–ортопеда, это полезный прогностический инструмент, который может принести пользу пациентам в предоперационном периоде [12]. Данные, полученные при оценке по шкале SCORE, для пациентов с РА следует умножить на 1,5, чтобы учесть 50% увеличение риска, связанного с РА, по сравнению с общей популяцией [12]. Для оценки СС риска может быть привлечен кардиолог в рамках междисциплинарной бригады;
3) оценка активности воспалительного процесса у пациента с РА, являющаяся важным маркером прогрессирования заболевания. Основной сердечно–сосудистой дисфункцией, ассоциированной с РА и повышенными маркерами воспаления, является увеличение толщины интима–медиа сонной артерии. Хотя клиническая полезность этого измерения менее применяема, важно осознавать эту связь как дополнительный фактор риска для пациента с РА [12]. Ультразвуковое исследование сосудов шеи позволит рассчитать показатель КИМ — толщину комплекса интима–медиа сон–ной артерии.
Заболевания периферических сосудов также являются потенциальным риском развития послеоперационных осложнений у пациентов с РА. Это связано с двумя основными моментами. Во–первых, у пациентов с РА повышен риск развития таких сопутствующих заболеваний, как васкулит, спазм сосудов или болезнь Рейно. Следовательно, необходимо избегать применения льда в области хирургических вмешательств в послеоперационном периоде. Во–вторых, в случаях оперативного лечения по поводу деформаций мелких суставов кистей и стоп послеоперационный восстановительный период имеет более длительный характер, и после хирургического вмешательства следует проводить мониторинг пациентов на предмет сосудистых нарушений для предотвращения ишемии [13]. Это особенно важно в случае коррекции предшествующих тяжелых и давних деформаций.
РА является сложной и многофакторной болезнью, которая поражает многие системы и органы, включая сердечно–сосудистую. Хотя в компетенцию хирурга–ортопеда не входит лечение ССЗ, чрезвычайно важно распознать эту коморбидность у пациентов с РА, поскольку только целостное восприятие ревматоидного пациента позволяет более эффективно интегрировать участие хирурга–ортопеда в многопрофильной команде.
Оценка поражения органов дыхания
С РА ассоциированы различные поражения легких, включая интерстициальное поражение и лекарственно–индуцированные заболевания, вторичные по отношению к длительному применению БМАРП. Согласно одной из теорий, поражение легких у пациентов с РА связано с выработкой антител против циклического цитруллинированного пептида (ЦЦП). Цитруллинсодержащие белки образуются в процессе посттрансляционной модификации аргининовых остатков в реакции, катализируемой ферментом пептидил–аргининдеиминазой. Этот фермент в синовиальной жидкости при воспалении катализирует превращение аргинина в цитруллин. При РА фермент пептидил–аргининдеиминаза вызывает локальное цитруллинирование белков синовиальной оболочки, что является одним из основных факторов, запускающих продукцию аутоантител. Cиновиальные белки виментин, филаггрин и фибронектин могут стать цитруллинированными, в результате чего образуются антитела, что, как полагают, тоже ассоциировано с развитием заболеваний легких при РА [14]. Считается, что процесс цитруллирования — показатель воспаления соединительной ткани — ассоциируется с другими воспалительными состояниями, такими как идиопатический легочный фиброз и рассеянный склероз [14]. Известными факторами риска поражения легких при РА являются пожилой возраст, мужской пол, курение в анамнезе и в настоящее время, а также длительное применение метотрексата. В последнее время существует гипотеза, что антитела к ЦЦП являются предиктором экстраартикулярных проявления при РА, в частности, поражения легких [14, 15].
Интерстициальное заболевание легких, ассоциированное с РА
Наиболее частым поражением легких при РА является интерстициальное заболевание легких (РА–ИЗЛ). РА–ИЗЛ чаще всего проявляется идиопатической интерстициальной пневмонией, что затрудняет проведение дифференциального диагноза. Другими клиническими проявлениями могут быть острая –эозинофильная пневмония, апикальное фибробуллезное заболевание, ревматоидные узелки и амилоидоз. Острые респираторные симптомы у пациентов с РА в периоперационном периоде должны настораживать и требуют дальнейшей диагностики, такой как рентгенография грудной клетки и компьютерная томография [15]. Очень часто имеет место несоответствие между мало– или бессимптомным течением поражения легких и инструментальными данными, в связи с чем актуальным является сопоставление клинической картины и данных инструментальных методов обследования с целью раннего выявления и адекватной терапии поражения легких при РА.
Лекарственно-индуцированные заболевания легких
БМАРП являются основой терапии при РА, однако они способны индуцировать ятрогенные поражения/заболевания легких. Пневмонии, заболевания верхних дыхательных путей и легочные узелки являются известными побочными эффектами применения БМАПР [14, 15]. Другие серьезные побочные эффекты, характерные для биологических БМАРП, обусловлены их легочной токсичностью, уровень смертности вследствие которой составляет 35,5 % [16]. Токсическое поражение легких наиболее часто регистрируется при применении метотрексата, солей золота, сульфосалазина и пеницилламина. Также возможно поражение легких при использовании препаратов биологического действия — ингибиторов фактора некроза опухоли (ФНО), которые увеличивают риск развития туберкулеза и других оппортунистических инфекций.
Факторами риска индуцированной метотрексатом патологии легких у больных РА являются: пожилой возраст, диабет, ревматоидные плевро–легочные изменения, предшествующий прием БМАРП, гипоальбуминемия. Cпециально проведенное исследование позволило сделать заключение, что предшествовавшие изменения на рентгеновских снимках в виде интерстициальных инфильтратов предрасполагают к развитию метотрексатного пневмонита (МТХ–пневмонита). Предложены критерии, позволяющие отличить МТХ–пневмонит от РА–ИЗЛ: 1) применение метотрексата не менее 4 нед. до развития симптомов поражения легких (обязательный критерий); 2) исключение других легочных заболеваний (в том числе инфекционной природы); 3) вновь возникшие или изменившиеся инфильтраты на повторных рентгенограммах грудной клетки; 4) клиническое течение, характерное для реакций гиперчувствительности; 5) морфологическая картина легких, характерная для патологии, вызываемой лекарственными препаратами.
Таким образом, при РА поражение легких может быть обусловлено самим заболеванием, инфекцией и применением современных базисных противовоспалительных препаратов. В предоперационном периоде необходимо провести тщательный сбор анамнеза, оценить риски поражения легких в данный момент, провести спирографию, рентгенологическое исследование легких и/или компьютерную томографию.
Неврологические осложнения
Пациенты с РА могут иметь различные поражения нервной системы, вторичные по отношению к основному заболеванию. Часто встречаются компрессионная и периферическая невропатии, причем последняя может быть лекарственно–индуцированной. Оценка этих состояний должна быть выполнена до оперативного лечения, чтобы определить, требуются ли дополнительные хирургические процедуры во время операции, например, высвобождение тарзального канала перед латеральной остеотомией пяточной кости при выраженной дистальной невропатии [13].
Профилактика венозной тромбоэмболии
Венозная тромбоэмболия (ВТЭ), особенно тромбоз глубоких вен (ТГВ) и легочная эмболия, являются возможными осложнениями у пациентов с РА в пери– и послеоперационный периоды, риск которых достаточно высок у данной категории больных [17, 18]. В метаанализе оценки риска ВТЭ среди пациентов с РА W.S. Chung с соавт. (2013) обнаружили, что частота ассоциированных с РА ВТЭ на 2,18 % выше, чем в общей популяции. Тем не менее при оценке пациентов через 1 год после операции повышенного риска госпитализаций по поводу ВТЭ не наблюдалось, что позволяет предположить, что стандартная профилактика ВТЭ в периоперационном периоде для пациентов с РА является достаточной.
Риск послеоперационной инфекции у пациентов с РА
Ряд исследований продемонстрировал, что у пациентов с РА повышен риск развития послеоперационной инфекции в результате ортопедических оперативных вмешательств [19–22]. R. L. Cordtz с соавт. (2018) [20] включили в исследование 3913 пациентов с РА, перенесших эндопротезирование тазобедренного и коленного суставов, из датского регистра и обнаружили более высокий риск инфекции протезированных суставов (отношение рисков (ОР) — 1,46). Аналогичное исследование с использованием данных из общенациональной выборки для стационарных больных установило более высокие показатели послеоперационной инфекции, несостоятельности швов, длительного незаживления раны и системных осложнений после протезирования тазобедренного и коленного суставов при РА по сравнению с пациентами с остеоартритом [21]. Распространяя данные на другие ортопедические операции, J.A. Horowitz с соавт. (2018) [22] обнаружили, что пациенты с РА имели более высокие показатели послеоперационной инфекции после артродеза шейки бедренной кости (2,6 против 1,5 %). Остается неясным, с чем в первую очередь связан повышенный риск послеоперационных инфекционных осложнений при РА — с приемом лекарственных препаратов, хроническим системным и локальным воспалением суставов или различными коморбидными состояниями.
Рекомендации, касающиеся приема лекарственных препаратов в периоперационном периоде у пациентов с РА
Пациенты с РА используют широкий спектр лекарственных препаратов, которые могут оказать влияние как во время операции, так и в послеоперационном периоде. Наиболее распространенными препаратами, назначаемыми пациентам с РА, являются НПВП, ГК, синтетические БМАРП и биологические агенты. Многие из этих препаратов используют в комбинированной терапии [23]. По оценкам некоторых авторов, количество пациентов с РА, подвергающихся артропластике во время приема традиционных или биологических БМАРП, составляет от 75 до 84 %. Аналогичным образом использование ГК в той же группе оценивается в 80 % [24].
Одна из наиболее обсуждаемых проблем, связанных с курацией пациентов с РА, вращается вокруг периоперационного протокола применения различных лекарственных препаратов, используемых для лечения этого заболевания. Необходимо отметить, что рекомендации относительно начала и прекращения приема лекарственных средств во время операции постоянно меняются. Например, в прошлом рекомендовалось отменить метотрексат за 2 нед. до операции и возобновить его прием через 2 нед. после операции во избежание развития инфекционного процесса [25–27]. Эта же рекомендация касалась и лефлуномида [28]. В последних рекомендациях это положение больше не поддерживается, однако остается дискуссионной темой [29, 30].
Важно понимать, что подход к ведению каждого пациента должен быть индивидуализирован. Крайне важно, чтобы ревматолог, хирург/ортопед и, возможно, инфекционист совместно оценили необходимость периоперационного назначения лекарственной терапии каждому пациенту с РА. Изменения режима лечения в периоперационном периоде у пациента с РА может привести к ухудшению его состояния и возникновению обострения, поэтому следует рассмотреть вопрос о приемлемых альтернативных препаратах для замены прекращенных в периоперационном периоде. Это потенциально уменьшит негативный эффект прерывания приема необходимых лекарственных средств и будет способствовать быстрому восстановлению в периоперационном периоде.
Рекомендации по применению нестероидных противовоспалительных средств и ацетилсалициловой кислоты
Использование НПВП в лечении симптомов РА является традиционным подходом. Из–за неселективного ингибирующего действия на тромбоксан А2 при агрегации тромбоцитов существует повышенный риск хирургического кровотечения, следовательно, прием НПВП должен быть прекращен в периоперационном периоде, что особо касается коксибов. При приеме НПВП функция тромбоцитов обратимо ингибируется и возвращается к нормальной к периоду полувыведения препарата. НПВП имеют различный период полувыведения — от 2–6 ч (ибупрофен, кетопрофен, индометацин) до 7–15 ч (целекоксиб, напроксен) и до > 20 ч (мелоксикам, набуметон, пироксикам) [31]. Желательно отменить НПВП до операции на период, равный пяти периодам полувыведения лекарственного препарата, для обеспечения возврата к самостоятельному гемостазу и возобновить их прием через 2–3 дня после операции [32].
Селективные ингибиторы ЦОГ–2, также известные как коксибы, были разработаны для сведения к минимуму количества побочных эффектов, связанных с желудочно–кишечным трактом, и, по–видимому, значительно не увеличивают риск периоперационного кровотечения [31]. Однако коксибы и высокоселективные ингибиторы ЦОГ–2 в большей степени повышают риск сердечно–сосудистых событий [33]. Использование коксибов не рекомендовано пациентам с высоким кардиоваскулярным риском или имеющим тромбофилии [33]. В недавнем исследовании было обнаружено, что один из коксибов — целекоксиб — не уступает ибупрофену или напроксену в отношении безопасности сердечно–сосудистых заболеваний, если он назначается в умеренных/низких дозах [34].
Данные исследований на животных показывают, что ингибиторы ЦОГ–2 могут также оказывать негативное влияние на процесс заживления сухожилий [35]. Вероятно, это связано с ингибированием синтеза простагландинов, ответственных за образование кости, увеличение пролиферации и дифференцировку остеобластов [36].
Основываясь на этих результатах, периоперационное использование НПВП должно быть тщательно оценено и ограниченно у пациентов с РА из–за повышенного риска сердечно–сосудистых событий, а также из–за возможного вмешательства НПВП в процесс заживления ран, которое у пациентов с РА также может нарушаться из–за применения БМАРП и ГК. Сочетанное применение парацетамола с опиоидами в послеоперационном периоде может быть безопасной и эффективной альтернативой НПВП [37].
Аспирин (ацетилсалициловая кислота) необратимо связывается с циклооксигеназой тромбоцитов, и, таким образом, возврат функции агрегации тромбоцитов не зависит от периода полураспада препарата. Восстановление функции мегакариоцитов достигается за счет аутопроизводства через тотипотентные стволовые клетки, регулируемые тромбопоэтином, который вырабатывается в печени и почках. Исходя из этого, некоторые исследователи в связи с опасениями по поводу развития периоперационного кровотечения предлагают отменить аспирин за 10 дней до операции, чтобы обеспечить адекватное формирование новых тромбоцитов [2]. Однако в большом ретроспективном исследовании N.R. Smilowitz с соавт. (2016) обнаружили, что применение аспирина в периоперационном периоде не было связано с повышением риска кровотечений [38]. Американская коллегия специалистов в области торакальной медицины (ACCP) и Американская коллегия кардиологов (ACC/AHA) рекомендуют продолжить прием аспирина пациентам со средним и высоким риском сердечно–сосудистых событий, получающих терапию аспирином в качестве вторичной профилактики до предполагаемой операции [39, 40]. Такие пациенты со средним и высоким риском включают лиц с ишемической болезнью сердца, застойной сердечной недостаточностью, сахарным диабетом, почечной недостаточностью или цереброваскулярным заболеванием [39]. Тем не менее РА сам по себе является фактором риска сердечно–сосудистых заболеваний, поэтому, учитывая низкий риск угрожающего жизни кровотечения с аспирином, если нет серьезных противопоказаний, продолжение приема аспирина возможно и рекомендуется для всех пациентов с РА, которые уже находятся на лечении [39, 40].
Прием бета–адреноблокаторов следует продолжать у пациентов, которые получают их на постоянной основе [40]. Назначение бета–адреноблокаторов для конт–роля сердечного ритма и антиишемического действия, а статинов — для снижения риска повреждения эндотелия может обеспечить дополнительную защиту для пациентов с РА и ССЗ [40].
Синтетические стандартные болезньмодифицирующие противоревматические препараты
За последние годы принципы лечения пациентов с РА значительно изменились в связи со значительным прорывом в понимании патогенеза заболевания. Синтетические БМАРП (сБМАРП) являются одними из наиболее распространенных лекарственных препаратов, назначаемых для пациентов с РА. К сБМАРП относятся метотрексат, сульфасалазин, лефлуномид и гидроксихлорохин [24].
Механизмы действия сБМАРП различны. Хирург–ортопед должен иметь представление о том, как эти препараты в зависимости от фармакокинетики могут повлиять на состояние пациента во время операции. Метотрексат обладает механизмом ингибирования дигидрофолатредуктазы (ДГФР), которая, вызывая снижение концентрации тетрагидрофолата, в конечном итоге приводит к ингибированию синтеза пуринов и пиримидина. Метотрексат обладает рядом побочных эффектов, включающих ингибирование гемопоэза, гепатотоксичность и повышенный риск развития инфекционных процессов. Поэтому прием метотрексата должен быть дополнен фолиевой кислотой в связи с его ингибирующим влиянием на ДГФР [41]. Согласно данным последних исследований, метотрексат не имеет побочных эффектов в периоперационном периоде, и его прием не должен прекращаться до хирургического вмешательства и во время него [24, 29, 30]. Это положение подтверждено в последних рекомендациях, опубликованных Американской коллегией ревматологов (ACR) совместно с Американской ассоциацией хирургов бедра и коленного сустава (AAHK) и Британским обществом ревматологов [29]. Исключением из этой рекомендации являются пациенты с замедлением консолидации в послеоперационном периоде или с полным несрастанием. В научной литературе присутствуют противоречивые мнения относительно того, происходит ли ингибирование остеобластической активности метотрексатом. Из–за этого противоречия в некоторых литературных источниках по–прежнему рекомендуется прекратить использование метотрексата за 1 нед. до операции и возобновить прием через 1–2 нед. после нее [25–27].
Сульфасалазин является ингибитором синтеза пиримидина de novo посредством селективного ингибирования дигидрооротат–дегидрогеназы; он представляет собой комбинацию 5–аминосалициловой кислоты и сульфапиридина. Первоначально сульфасалазин использовался для лечения РА благодаря противовоспалительной активности и антимикробным свойствам, в настоящее время он продолжает активно применяться, в большей степени в комбинации с другими БМАРП [42]. ACR и AAHK рекомендуют продолжать прием сульфасалазина на протяжении всего периоперационного периода без пауз [29].
Хотя гидроксихлорохин (ГХХ) наиболее широко известен как антималярийный препарат, он также используется в лечении РА. Механизм действия ГХХ — ингибирование лизосомальной активности, презентации антигена и передачи сигналов Toll–подобного рецептора [43]. Исследования показали множественные положительные эффекты для пациентов с РA в результате терапии ГХХ: нормализация уровней липидного профиля, снижение рисков развития ССЗ, частоты развития диабета и общей частоты сердечно–сосудистых событий [43]. ACR и AAHK рекомендуют продолжать прием ГХХ в течение всего периоперационного периода без перерывов на операционное вмешательство [29].
Противоречивые результаты опубликованы в отношении лефлуномида [44–46]. Значительное увеличение инфекционных осложнений послеоперационной раны, замедление заживления ран было зарегистрировано у пациентов, получавших лефлуномид, по сравнению с пациентами, получавшими метотрексат [47]. Тем не менее не было обнаружено различий в риске развития инфекционных осложнений между пациентами, которые продолжали прием лефлуномида, и пациентами, которым лефлуномид отменили за 1 мес. до операции [48]. Неудивительно, что рекомендации относительно периоперационного использования лефлуномида отличаются [28]. M. Müller и W. Pippi–Ludwig (2014) предложили продолжать прием лефлуномида у пациентов, подвергающихся процедурам низкого риска, а при процедурах высокого риска — совместно с холестирамином [49]. Это нашло отражение и в современных рекомендациях ACR и AAHK, которые советуют продолжить прием лефлуномида в периоперационном периоде у пациентов с РА [29].
Использование глюкокортикоидов
В настоящих исследованиях уделялось относительно мало внимания ГК по сравнению с терапией БМАРП в периоперационном периоде. Наиболее серьезными потенциальными осложнениями в результате приема ГК, зависящими от дозы, являются хирургические инфекции, замедление заживления ран, снижение плотности костной ткани и гемодинамическая нестабильность, вторичная по отношению к надпочечниковой недостаточности [50, 51].
Минимальная доза ГК, способствующая иммуносупрессии и супрессии гипоталамус–гипофиз–надпочечниковой системы, давно обсуждается и окончательно не установлена [52]. Существуют доказательства того, что доза преднизолона 20 мг в течение 5 дней является достаточной для ингибирования эндогенного синтеза кортизола [52]. Установлено, что риск послеоперационной инфекции был примерно вдвое выше у пациентов, получавших преднизолон в дозе более 10 мг/д в течение 3 мес. до операции [53], а пациенты, получавшие более 15 мг/д преднизолона в течение 1 года, подвергаются послеоперационному риску инфекционных осложнений в 20 раз чаще, чем пациенты общей популяции, подвергшиеся артропластике; частота инфекции суставов после их протезирования в 2,5–3 раза выше, чем среди населения в целом [52]. Следовательно, доза преднизолона менее 10 мг/д является более безопасной в периоперационном периоде, чем дозы выше 10 мг.
Пациентам, находящимся на хроническом лечении ГК, перед большой ортопедической операцией часто назначают высокие периоперационные дозы ГК, называемые стресс–дозой, из–за страха развития острой недостаточности надпочечников во время оперативного вмешательства [54]. Полезность и необходимость высокой предоперационной дозы ГК обсуждается давно. На сегодня нет никаких доказательств повышенного риска побочных эффектов у пациентов, принимающих периоперационную стресс–дозу, по сравнению с –обычной дозой ГК [55]. Одновременно нет подтверждения концепции, что введение высокой дозы ГК может уменьшить риск гемодинамической нестабильности у пациентов с РА, перенесших серьезную ортопедическую операцию, по сравнению с лицами, получавшими обычную дозу преднизолона — ≤ 15 мг/д [56].
Основываясь на этих данных, ACR/AAKH рекомендуют не назначать пациентам предоперационную стрессовую дозу ГК, если они продолжают принимать обычную суточную дозу ГК, которая по возможности должна быть снижена до уровня < 20 мг/д преднизолона до операции [29]. Тем не менее пациенты с РА при постоянном лечении ГК должны тщательно контролироваться и получать дополнительные дозы стероидов, если у них развиваются признаки гемодинамической нестабильности, такие как гипотензия или тахикардия [56]. Рекомендации не относятся к пациентам с первичной недостаточностью надпочечников или первичным заболеванием гипоталамуса [56].
Тем пациентам, которые принимают суточную дозу стероидов > 10 мг преднизолона и не могут уменьшить дозировку из–за риска обострения заболевания, особенно важно обеспечить тщательные стерильные методы, осторожное интраоперационное обращение с кожей, плотное закрытие раны и надлежащую антибиотикопрофилактику [57]. Использование других нефармакологических стратегий, таких как костный цемент, импрегнированный антибиотиками, было предложено почти 10 лет назад в качестве подходящего метода для пациентов с высоким риском предрасположенности к периоперационным инфекциям и в настоящее время широко используется [58].
У тех пациентов, которые принимают лечение ГК в высоких дозах и которые планируют пройти плановое хирургическое вмешательство, рекомендуется, если это возможно, подождать, пока не будет достигнут лучший контроль активности заболевания и будет возможность снизить дозу ГК < 20 мг/д в преднизолоновом эквиваленте [29].
Чрезвычайно важно, чтобы хирург обсудил вопрос о приеме ГК в периоперационном периоде с пациентом, ревматологом и анестезиологом на предмет возможного введения дополнительных периоперационных ГК с целью противодействовать гипотонии, связанной с подавленной эндогенной функцией надпочечников, у больных, которые получали ежедневную терапию стероидами.
Биологические болезньмодифицирующие антиревматические препараты
Биологические болезньмодифицирующие антиревматические препараты (бБМАРП) представляют собой большую группу современных лекарственных средств и включают пять ингибиторов фактора некроза опухоли (ФНО) альфа (инфликсимаб, адалимумаб, этанерцепт, цертолизумаба пэгол, голимумаб), ингибитор Т–клеточной костимуляции (абатацепт), препарат анти–В–клеточной терапии (ритуксимаб), моноклональное антитело, блокирующее рецептор интерлейкина (ИЛ)–6 (тоцилизумаб), а также ингибитор ИЛ–1 (анакинра) [29]. Использование бБМАРП обусловило прорыв в лечении РА, способствовало значительному улучшению результатов лечения, однако существенно повлияло на периоперационное ведение пациентов с РА.
Риск послеоперационной инфекции у пациентов, получающих биологическую терапию
Известно, что использование бБМАРП связано с риском инфицирования в нехирургических условиях [59] и ассоциируется с инфекциями кожи и мягких тканей и колонизацией стафилококка [60]. Риск инфицирования особенно повышен в первые месяцы после начала биологической терапии, что может быть связано с большей активностью заболевания и большей дозировкой ГК (как мост–терапия) в начале лечения [61].
ББМАРП имеют различные механизмы действия и определенные различия степени инфекционных рисков, однако в настоящее время недостаточно доказательств, чтобы убедительно показать клинически значимое различие в риске инфицирования между различными биологическими препаратами во время терапии [62]. Предварительные данные свидетельствуют о том, что риск послеоперационной инфекции одинаков у пациентов, получающих различные биологические агенты [63]. Поскольку ингибиторы ФНО остаются самыми «старыми», наиболее изученными и наиболее часто назначаемыми биологическими препаратами, текущие данные о периоперационном риске при использовании бБМАРП в основном получены из исследований препаратов этой группы.
В нескольких обсервационных исследованиях сравнивали риск послеоперационной инфекции у пациентов с РА, получавших лечение ингибитором ФНО, и лиц, которые не получали биологическую терапию. S.M. Goodman с соавт. (2016) [64] провели метаанализ этих исследований с участием в общей сложности 7991 пациента с РА, которые перенесли большую ортопедическую операцию. Пациенты, получавшие ингибитор ФНО, имели более высокую частоту возникновения поверхностной и глубокой раневой инфекции по сравнению с лицами, не получавшими биологическое лечение (ОР 2,47, 95% доверительный интервал (ДИ) 1,66–3,68). Последующий метаанализ, проведенный C. Mabille с –соавт. (2017), продемонстрировал схожие результаты [65]. Совсем недавно R.L. Cordtz с соавт. (2018) [1] оценивали риск развития инфицирования протезированного сустава (ИПС) у пациентов с РА, получавших и не получавших биологическую терапию в течение 90 дней после эндопротезирования тазобедренного или коленного сустава. Авторы изучили несколько датских реестров. Было обнаружено, что ИПС отмечалось намного чаще у пациентов, получавших биологическое лечение (2,8 против 1,9 на 100 человеко–лет у пациентов, получавших биологическое и небиологическое лечение), хотя различия не были статистически значимыми (скорректированный ОР 1,61, 95% ДИ 0,70–3,69). Тем не менее важно отметить, что пациенты, получавшие бБМАРП, имели более высокую активность заболевания и с большей вероятностью получали лечение ГК и иммуносупрессантами до операции. Примечательно, что показатели инфицирования были выше у пациентов, получавших ГК (скорректированный ОР 2,12, 95% ДИ 0,90–4,98), и у лиц с более высокой активностью заболевания, оцененной по DAS28 (скорректированное соотношение рисков 2,00, 95% ДИ 1,28–3,13). ГК и активность РА (но не использование биологических агентов) также были связаны с повышенным риском смерти в течение 1 года после операции.
Ведение пациентов, получающих биологическую терапию, в периоперационном периоде
Хотя предыдущие исследования демонстрировали некоторую обеспокоенность в отношении риска послеоперационной инфекции у пациентов, получающих биологическую терапию, более важный вопрос, стоящий перед клиницистами, заключается не в том, повышен ли риск у пациентов, получающих биологические препараты, а в том, снизит ли этот риск прекращение/приостановление биологической терапии до операции. В большинстве исследований сравнивались пациенты, получавшие и не получавшие биологическое лечение, но эти группы довольно сильно отличались друг от друга с точки зрения активности заболевания, сопутствующих заболеваний и проведенной терапии (в том числе приема ГК). В результате даже самые сложные статистические методы вряд ли смогут создать полностью сопоставимые группы.
Поскольку случаи развития серьезных инфекций после операции относительно редки (приблизительно 1% риск инфекции протезированного сустава после его замены), в настоящее время не представляется возможным провести рандомизацию пациентов с целью одно–значного решения — либо прекратить, либо продолжать биологическую терапию. Обнаружение умеренной разницы в случаях серьезных инфекций (например, 5 против 7 %) или ИПС (например, 1 против 2 %) потребовало бы выборки с участием более 4000 пациентов.
Однако в нескольких недавних обсервационных исследованиях начали оцениваться сроки биологической терапии, дающие некоторое представление о роли прерывания терапии перед операцией. А. Zahr с соавт. (2015) [66] оценили 6024 пациента с РА, получавших БМАРП, в том числе 896, получавших биологические препараты, и перенесших операцию. Ни прерывание приема традиционных (синтетических) БМАРП, ни прерывание приема биологических БМАРП не было связано с уменьшением риска послеоперационной инфекции.
Для решения проблем, связанных с точным измерением времени действия биологического агента, и точного определения времени отмены препарата до операции группа исследователей во главе с M.D. George (2017) отобрала 4288 пациентов, перенесших эндопротезирование тазобедренного или коленного сустава, которым была проведена инфузия инфликсимаба за 6 мес. до оперативного вмешательства [53]. Установлено, что у пациентов, получивших инфликсимаб за 4 нед. до операции, не было различий в риске развития 30–дневной или 1–летней послеоперационной инфекции протезированного сустава по сравнению с лицами, которым инфликсимаб в последний раз назначали хотя бы за один интервал дозирования (8–12 нед.) до операции (ОР 0,90, 95% ДИ 0,60–1,34 и ОР 0,98, 95% ДИ 0,52–1,87 соответственно для двух исходов). Исследование контролировало и ряд других потенциальных факторов, в том числе сопутствующие заболевания, медицинские манипуляции и другие лекарственные препараты, которые принимали пациенты.
В интересном исследовании с участием 311 пациентов с воспалительным заболеванием кишечника, перенесших операцию на брюшной полости, была оценена связь между дозой инфликсимаба и риском послеоперационной инфекции [67]. Высокие уровни инфликсимаба, по крайней мере 3 мг/мл, были связаны с большим риском инфекции, но только у пациентов с болезнью Крона, а не с язвенным колитом.
В небольших исследованиях с участием пациентов, получавших тоцилизумаб [68] и ритуксимаб [69], было слишком мало результатов для адекватной оценки факторов риска инфекции; авторы отмечали, что риск инфицирования не связан со временем между последней инфузией ритуксимаба и тоцилизумаба перед операцией. Аналогичные результаты получены при оценке французского реестра 263 пациентов, получавших внутривенный абатацепт и подвергшихся хирургическому вмешательству. Обнаружено, что время приема абатацепта перед операцией не было связано с изменением риска осложнений, хотя размер выборки был небольшим, а способность обнаруживать различия — ограниченной [70]. Предварительные результаты исследования 1537 пациентов, получавших внутривенный абатацепт и подвергшихся эндопротезированию тазобедренного или коленного сустава, продемонстрировали аналогичные данные: пациенты, получавшие абатацепт в течение 4 нед. до операции, имели сходные показатели послеоперационной инфекции и регоспитализаций по сравнению с лицами, которые последний раз получили абатацепт более чем за 4 нед. (один интервал дозирования) до операции [71]. Результаты этих исследований свидетельствуют о том, что длительное прерывание биологического лечения не может существенно улучшить результаты после операции.
Существующие исследования и метаанализы крупных обсервационных исследований не могут однозначно доказать, что продолжающееся лечение биологическими агентами хорошо переносится и не повлияет на риск возникновения серьезных инфекций. Однако в целом данные свидетельствуют о том, что польза от прерывания биологической терапии, скорее всего, будет небольшой.
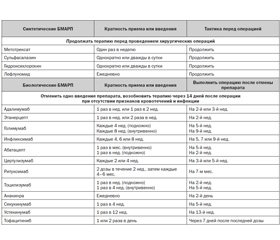
Из–за известного риска инфицирования, связанного с бБМАРП, группа ACR/AAHKS рекомендовала отменить все существующие бБМАРП до планового оперативного вмешательства и выполнять операцию, пропустив одно введение препарата [29]. Для определения этой рекомендации использовался интервал дозирования, а не период полураспада препаратов, потому что период полураспада не коррелирует с продолжительностью действия препаратов. В соответствии с этими руководящими принципами пациент, получающий инфликсимаб каждые 8 нед., должен в последний раз получать лекарство за 9 нед. до операции, тогда как пациент, получающий адалимумаб каждые 2 нед., должен получить лекарственный препарат последний раз за 3 нед. до операции. Возобновление лечения биологическими агентами следует проводить через 14 дней после операции, если послеоперационная рана хорошо заживает и нет признаков местной или системной инфекции. В обновленных руководствах по биологической безопасности бБМАРП Британского общества ревматологов (BSR) принят аналогичный подход, в котором рекомендуется прерывание бБМАРП на один интервал введения для большинства биологических препаратов (за исключением 2 нед. для тоцилизумаба для подкожного введения и 4 нед. — для внутривенного и 3–6 мес. для инфликсимаба). В случае оперативных вмешательств у пациентов высокого риска следует рассмотреть прекращение приема препарата за 3–5 периодов полураспада (если этот период времени длиннее одного интервала дозирования) [30]. В табл. 1 представлены сроки отмены и возобновления лечения пациентов с РА бБМАРП в периоперационном пе–риоде.
Выводы
Тщательная периоперационная оценка пациента с РА чрезвычайно важна для достижения благоприятных результатов лечения в послеоперационном периоде и для последующего менеджмента. Детально собранный анамнез, физикальное обследование с соответствующей лабораторной оценкой функции органов и систем, дифференциальный диагноз коморбидных состояний составляют основу такого подхода. Следует проинформировать пациентов о потенциальных рисках хирургического вмешательства, в том числе о повышенном риске инфицирования, замедления заживления ран и развития ВТЭ событий, а также об основных возможных сердечно–сосудистых, легочных и неврологических нарушениях, которые могут быть обусловлены хирургическим вмешательством.
Клинические исследования, проведенные за последние несколько лет, улучшили наше понимание надлежащего периоперационного менеджмента пациентов с РА, хотя в отношении биологической терапии остается еще много неопределенностей. Недавние данные подтвердили, что пациенты с РА подвергаются большему риску инфекции после операции, но прием лекарственных препаратов, вероятно, объясняет только часть этого риска. Менеджмент БМАРП в предоперационном периоде должен осуществляться в соответствии с рекомендациями основных ведущих ревматологических сообществ, но подход должен быть индивидуализирован, с привлечением мультидисциплинарной команды. В руководящих принципах предоставлена отправная точка для рассмотрения вопроса о минимизации риска в периоперационном периоде, однако важно интерпретировать фактические данные в контексте каждого отдельного пациента. В настоящее время рекомендации поддерживают продолжение приема синтетических традиционных БМАРП в течение всего периоперационного периода и рекомендуют кратковременные прерывания биологической терапии за один интервал дозирования перед операцией с во–зобновлением через 14 дней после нее.
Может показаться, что основной подход заключается в том, чтобы остановить биологическую терапию перед операцией, несмотря на многочисленные современные исследования, не продемонстрировавшие явной пользы от прерывания лечения. Этот подход является ра–зумным для многих пациентов, но у некоторых больных прерывание терапии бБМАП может не быть лучшим способом для минимизации риска. Например, пациенты, которые часто имеют обострения заболевания, требующие лечения более высокими дозами глюкокортикоидов, могут иметь лучшие результаты, если в периоперационном периоде биологические методы лечения продолжаются, а не прерываются. Для некоторых пациентов опасения по поводу обострения заболевания, которые часто встречаются в послеоперационном периоде, могут перевешивать проблему возможного развития инфекционного осложнения, особенно при операциях с низким риском без протезного материала. Напротив, пациенты с длительной ремиссией заболевания, но с множественными инфекционными осложнениями в прошлом, могут с большей вероятностью выиграть от прерывания лечения. К счастью, прекращение лечения за один интервал дозирования до операции и возобновление через 14 дней после нее (как предполагают современные рекомендации) приводят к кратковременному прерыванию лечения у большинства пациентов. А данные наблюдений, безусловно, подтверждают гипотезу о том, что в более длительных перерывах, вероятно, нет необходимости.
Несмотря на то, что проблема необходимости прекращения приема биологических препаратов в периоперационном периоде все еще обсуждается, существует консенсусное мнение, что риск инфицирования значителен при приеме высоких доз глюкокортикоидов. Эти результаты позволяют предположить, что длительное прерывание лечения биологическими препаратами может на самом деле быть контрпродуктивным, так как способно вызывать обострение заболевания у пациентов, требующее назначения глюкокортикоидов. Эти данные также подтверждают цель сокращения использования глюкокортикоидов до хирургического вмешательства, когда это возможно.
Следует подчеркнуть, что более высокие дозы глюкокортикоидов, по–видимому, вносят значительно больший негативный вклад в риск послеоперационной инфекции, чем биологическая терапия. Хотя в рекомендациях ACR рекомендуется избегать плановой операции у пациентов, которым требуется преднизолон в дозе более 20 мг/д, риск возрастает даже при более низких дозах. Необходимо приложить все усилия, чтобы снизить дозу глюкокортикоидов до минимально возможной перед операцией. Более поздние наблюдения дают подтверждающие данные, что длительное прекращение биологической терапии не улучшает результаты и что ограничение воздействия глюкокортикоидов за счет снижения дозы < 20 мг/д преднизолона перед операцией имеет первостепенное значение. Пациентам, получающим более высокие дозы, следует рассмотреть возможность отсрочки плановых операций до тех пор, пока заболевание станет менее активным. Предлагаемый подход к пациенту с РА, перенесшему хирургическое вмешательство, основанный на существующих данных и рекомендациях, показан на рис. 1.
Таким образом, существующие современные рекомендации могут помочь в ведении пациентов с РА с предстоящим хирургическим вмешательством; одно–временно продолжается ряд исследований, которые в будущем, мы надеемся, внесут большую ясность в менеджмент таких пациентов.
Конфликт интересов. Авторы заявляют об отсутствии какого–либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Информация о вкладе каждого участника: Синяченко О.В. — концепция и дизайн работы; Головач И.Ю. — концепция и дизайн работы, обзор литературы по проблеме, коррекция текста, подготовка статьи к печати; Егудина Е.Д. — обзор литературы по проблеме, написание текста, подготовка статьи к печати.
1. Cordtz R.L., Hawley S., Prieto–Alhambra D. et al. Incidence of hip and knee replacement in patients with rheumatoid arthritis following the introduction of biological DMARDs: an interrupted time–series analysis using nationwide Danish healthcare registers. Ann. Rheum. Dis. 2018. Vol. 77, № 5. P. 684–689.
2. Gualtierotti R., Parisi M., Ingegnoli F. Perioperative Management of Patients with Inflammatory Rheumatic Diseases Undergoing Major Orthopaedic Surgery: A Practical Overview Adv Ther. 2018. Vol. 35. P. 439–456.
3. Bissar L., Almoallim H., Albazli K. et al. Perioperative management of patients with rheumatic diseases. Open Rheumatol. J. 2013. Vol. 7. P. 42.
4. Bushnell B.D., Horton K.J., McDonald M.F., Ro–bertson P.G. Perioperative medical comorbidities in the orthopaedic patient. J. Am. Acad. Orthop. Surg. 2008. Vol. 16, № 4. P. 216–27.
5. Nguyen H.V., Ludwig S.C., Silber J. et al. Rheumatoid arthritis of the cervical spine. Spine J. 2004. Vol. 4, № 3. P. 329–34.
6. Gillick J.L., Wainwright J., Das K. Rheumatoid Arthritis and the Cervical Spine: A Review on the Role of Surgery. Int. J. Rheumatol. 2015. Vol. 2015. P. 252456.
7. Kolman J., Morris I. Cricoarytenoid arthritis: a cause of acute upper airway obstruction in rheumatoid arthritis. Can. J. Anaesth. 2002. Vol. 49, № 7. P. 729–32.
8. Avin˜a–Zubieta J.A., Choi H.K., Sadatsafavi M. et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis: a meta–analysis of observational studies. Arthritis Care Res. 2008. Vol. 59, № 12. P. 1690–7.
9. Roubille C., Richer V., Starnino T. et al. The effects of tumour necrosis factor inhibitors, methotrexate, non–steroidal anti–inflammatory drugs and corticosteroids on cardiovascular events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a systematic review and meta–analysis. Ann. Rheum. Dis. 2015. Vol. 74, № 3. P. 480–9.
10. Maradit–Kremers H., Nicola P.J., Crowson C.S. et al. Cardiovascular death in rheumatoid arthritis: a po–pulation–based study. Arthritis. Rheum. 2005. Vol. 52, № 3. P. 722–32.
11. Biskup M., Biskup W., Majdan M., Targońska–Stępniak B. Cardiovascular system changes in rheumatoid arthritis patients with continued low disease activity. Rheumatol. Int. 2018. Vol. 38, № 7. P. 1207–15.
12. Agca R., Heslinga S.C., Rollefstad S. et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann. Rheum. Dis. 2016. Vol. 76, № 1. P. 17–28.
13. Jacobs A.M. Perioperative management of the patient with rheumatoid arthritis. Clin. Podiatr. Med. Surg. 2010. Vol. 27, № 2. P. 235–42.
14. Lake F., Proudman S. Rheumatoid arthritis and lung disease: from mechanisms to a practical approach. Semin. Respir. Crit. Care Med. 2014. Vol. 35, № 2. P. 222–38.
15. Mori S., Koga Y., Sugimoto M. Different risk factors between interstitial lung disease and airway disease in rheumatoid arthritis. Respir. Med. 2012. Vol. 106, № 11. P. 1591–9.
16. Roubille C., Haraoui B. Interstitial lung diseases induced or exacerbated by DMARDS and biologic agents in rheumatoid arthritis: a systematic literature review. Semin. Arthritis. Rheum. 2014. Vol. 43, № 5. P. 613–26.
17. Goodman S.M., Figgie M.A. Arthroplasty in patients with established rheumatoid arthritis (RA): mitigating risks and optimizing outcomes. Best Pract. Res. Clin. Rheumatol. 2015. Vol. 29, № 4–5. P. 628–42.
18. Chung W.S., Peng C.L., Lin C.L. et al. Rheumatoid arthritis increases the risk of deep vein thrombosis and pulmonary thromboembolism: a nationwide cohort study. Ann. Rheum. Dis. 2013. Vol. 73, № 10. P. 1774–80.
19. Stundner O., Chiu Y.L., Sun X. et al. Perioperative outcomes in patients with rheumatoid versus osteoarthritis for total hip arthroplasty: a population–based study. Clin. Exp. Rheumatol. 2013. Vol. 31, № 6. P. 889–95.
20. Cordtz R.L., Zobbe K., Højgaard P. et al. Predictors of revision, prosthetic joint infection and mortality following total hip or total knee arthroplasty in patients with rheumatoid arthritis: a nationwide cohort study using Danish healthcare registers. Ann. Rheum. Dis. 2018. Vol. 77, № 2. P. 281–288.
21. Kurdi A.J., Voss B.A., Tzeng T.H. et al. Rheumatoid Arthritis vs Osteoarthritis: Comparison of Demographics and Trends of Joint Replacement Data from the Nationwide Inpatient Sample. Am. J. Orthop (Belle Mead NJ). 2018. Vol. 47, № 7.
22. Horowitz J.A., Puvanesarajah V., Jain A. et al. Rheumatoid Arthritis Is Associated With an Increased Risk of Postoperative Infection and Revision Surgery in Elderly Patients Undergoing Anterior Cervical Fusion. Spine (Phila Pa 1976). 2018. Vol. 43, № 17. P. 1040–1044.
23. Diaper R., Wong E., Metcalfe S.A. The implications of biologic therapy for elective foot and ankle surgery in patients with rheumatoid arthritis. Foot (Edinb). 2017. Vol. 30. P. 53–8.
24. Smolen J.S., Landewé R., Bijlsma J. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease–modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017. Vol. 76, № 6. P. 960–77.
25. Goodman S.M. Rheumatoid arthritis: perioperative management of biologics and DMARDs. Semin Arthritis. Rheum. 2015. Vol. 44, № 6. P. 627–32.
26. Uehara R., Suzuki Y., Ichikawa Y. Methotrexate (MTX) inhibits osteoblastic differentiation in vitro: possible mechanism of MTX osteopathy. J. Rheumatol. 2001. Vol. 28, № 2. P. 251–6.
27. Annussek T., Kleinheinz J., Thomas S. et al. Short time administration of antirheumatic drugs — methotre–xate as a strong inhibitor of osteoblast’s proliferation in vitro. Head Face Med. 2012. Vol. 8, № 1. P. 26.
28. Sindhu K., Cohen B., Gil J.A. Perioperative management of rheumatoid medications in orthopedic surgery. Orthopedics. 2017. Vol. 40, № 5. P. 282–6.
29. Goodman S.M., Springer B., Guyatt G. et al. 2017 American College of Rheumatology/American Association of Hip and Knee Surgeons guideline for the perioperative management of antirheumatic medication in patients with rheumatic diseases undergoing elective total hip or total knee arthroplasty. Arthritis Care Res (Hoboken). 2017. Vol. 69, № 8. P. 1111–24.
30. Holroyd C.R., Seth R., Bukhari M. The British Society for Rheumatology biologic DMARD safety guidelines in inflammatory arthritis–Executive summary. Rheumato–logy (Oxford). 2019. Vol. 58, № 2. P. 220–226. doi: 10.1093/rheumatology/key207.
31. Lee J.K., Choi C.H. Total knee arthroplasty in rheumatoid arthritis. Knee Surg. Relat. Res. 2012. Vol. 24, № 1. P. 1–6.
32. Mak A. Orthopedic surgery and its complication in systemic lupus erythematosus. World J. Orthop. 2014. Vol. 5, № 1. P. 38–44.
33. Teerawattananon C., Tantayakom P., Suwanawiboon B., Katchamart W. Risk of perioperative bleeding related to highly selective cyclooxygenase–2 inhibitors: A systematic review and meta–analysis. Semin Arthritis Rheum. 2017. Vol. 46, № 4. P. 520–528.
34. Nissen S.E., Yeomans N.D., Solomon D.H. et al. Cardiovascular Safety of Celecoxib, Naproxen, or Ibuprofen for Arthritis. PRECISION Trial Investigators. N. Engl. J. Med. 2016. Vol. 375, № 26. P. 2519–29.
35. Randelli P., Randelli F., Cabitza P., Vaienti L. The effects of COX–2 anti–inflammatory drugs on soft tissue healing: a review of the literature. J. Biol. Regul. Homeost Agents. 2010. Vol. 24, № 2. P. 107–14.
36. Chikazu D., Tomizuka K., Ogasawara T. et al. Cyclooxygenase–2 activity is essential for the osseointegration of dental implants. J. Oral Maxillofac Surg. 2007. Vol. 36, № 5. P. 441–6.
37. Mochizuki T., Yano K., Ikari K. et al. Tramadol hydrochloride/acetaminophen combination versus non–steroidal anti–inflammatory drug for the treatment of perioperative pain after total knee arthroplasty: A prospective, randomized, open–label clinical trial. J. Orthop. Sci. 2016. Vol. 21, № 5. P. 625–9.
38. Smilowitz N.R., Oberweis B.S., Nukala S. et al. Perioperative antiplatelet therapy and cardiovascular outcomes in patients undergoing joint and spine surgery. J. Clin. –Anesth. 2016. Vol. 35. P. 163–169.
39. Douketis J.D., Spyropoulos A.C., Spencer F.A. et al. Perioperative management of antithrombotic therapy: antithrombotic therapy and prevention of thrombosis, 9th ed.: American College of Chest Physicians evidence–based cli–nical practice guidelines. Chest. 2012. Vol. 141, № 2. P. 326–350.
40. Fleisher L.A., Fleischmann K.E., Auerbach A.D. et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014. Vol. 130, № 24. P. 278–333.
41. Fleury G., Mania S., Hannouche D., Gabay C. The perioperative use of synthetic and biological disease–mo–difying antirheumatic drugs in patients with rheumatoid arthritis. Swiss Med. Wkly. 2017. Vol. 147. P. 14563.
42. Wiese M.D., Alotaibi N., O’doherty C. et al. Pharmacogenomics of NAT2 and ABCG2 influence the toxicity and efficacy of sulphasalazine containing DMARD regimens in early rheumatoid arthritis. Pharmacogenomics J. 2014. Vol. 14, № 4. P. 350.
43. Rempenault C., Combe B., Barnetche T. et al. Metabolic and cardiovascular benefits of hydroxychloroquine in patients with rheumatoid arthritis: a systematic review and meta–analysis. Ann. Rheum. Dis. 2018. Vol. 77, № 1. P. 98–103.
44. Jenks K.A., Stamp L.K., O’Donnell J.L. et al. Leflunomide–associated infections in rheumatoid arthritis. J. Rheumatol. 2007. Vol. 34, № 11. P. 2201–2203.
45. Strand V., Cohen S., Schiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Leflunomide Rheumatoid Arthritis Investigators Group. Arch. Intern. Med. 1999. Vol. 159, № 21. P. 2542–2550.
46. Smolen J.S., Kalden J.R., Scott D.L. et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double–blind, randomised, multicentre trial. European Leflunomide Study Group. Lancet. 1999. Vol. 353, № 9149. P. 259–266.
47. Fuerst M., Mohl H., Baumgartel K., Ruther W. Leflunomide increases the risk of early healing complications in patients with rheumatoid arthritis undergoing elective orthopedic surgery. Rheumatol. Int. 2006. Vol. 26, № 12. P. 1138–1142.
48. Tanaka N., Sakahashi H., Sato E. et al. Examination of the risk of continuous leflunomide treatment on the incidence of infectious complications after joint arthroplasty in patients with rheumatoid arthritis. J. Clin. Rheumatol. 2003. Vol. 9, № 2. P. 115–118.
49. Muller M., Pippi–Ludwig W. Perioperative management of patients with rheumatoid arthritis. Anaesthesist. 2014. Vol. 63, № 11. P. 883–894.
50. Lin J.A., Liao C.C., Lee Y.J. et al. Adverse outcomes after major surgery in patients with systemic lupus erythematosus: a nationwide population–based study. Ann. Rheum. Dis. 2014. Vol. 73, № 9. P. 1646–51.
51. Lenguerrand E., Whitehouse M.R., Beswick A.D. et al. Risk factors associated with revision for prosthetic joint infection after hip replacement: a prospective observational cohort study. Lancet Infect. Dis. 2018. Vol. 18, № 9. P. 1004–1014.
52. Somayaji R., Barnabe C., Martin L. Risk factors for infection following total joint arthroplasty in rheumatoid arthritis. Open Rheumatol J. 2013. Vol. 7. P. 119–24.
53. George M.D., Baker J.F., Winthrop K. et al. Risk of Biologics and Glucocorticoids in Patients With Rheumatoid Arthritis Undergoing Arthroplasty: A Cohort Study. Ann. Intern. Med. 2019. [Epub ahead of print].
54. Kirwan J.R., Hickey S.H., Hällgren R. et al. The effect of therapeutic glucocorticoids on the adrenal response in a randomized controlled trial in patients with rheumatoid arthritis. Arthriti Rheum. 2006. Vol. 54, № 5. P. 1415–21.
55. Fein A.W., Figgie C.A., Dodds T.R. et al. Systemic Lupus Erythematosus Does Not Increase Risk of Adverse Events in the First 6 Months After Total Knee Arthroplasty. J. Clin. Rheumatol. 2016. Vol. 22, № 7. P. 355–9.
56. Marik P.E., Varon J. Requirement of perioperative stress doses of corticosteroids: a systematic review of the literature. Arch. Surg. 2008. Vol. 143, № 12. P. 1222–6.
57. Danoff J.R., Moss G., Liabaud B., Geller J.A. Тotal knee arthroplasty considerations in rheumatoid arthritis. Autoimmune Dis. 2013. Vol. 2013. P. 185340.
58. Randelli P., Evola F.R., Cabitza P. et al. Prophylactic use of antibiotic–loaded bone cement in primary total knee replacement. Knee Surg Sports Traumatol Arthrosc. 2010. Vol. 18, № 2. P. 181–6.
59. Singh J.A., Cameron C., Noorbaloochi S. et al. Risk of serious infection in biological treatment of patients with rheumatoid arthritis: a systematic review and meta–analysis. Lancet. 2015. Vol. 386, № 9990. P. 258–65.
60. Galloway J.B., Mercer L.K., Moseley A. et al. Risk of skin and soft tissue infections (including shingles) in patients exposed to anti–tumour necrosis factor therapy: results from the British Society for Rheumatology Biologics Register. Ann. Rheum. Dis. 2013. Vol. 72, № 2. P. 229–34.
61. Strangfeld A., Eveslage M., Schneider M. et al. Treatment benefit or survival of the fittest: what drives the time–dependent decrease in serious infection rates under TNF inhibition and what does this imply for the individual patient? Ann. Rheum. Dis. 2011. Vol. 70, № 11. P. 1914–20.
62. Yun H., Xie F., Delzell E. et al. Comparative Risk of Hospitalized Infection Associated With Biologic Agents in Rheumatoid Arthritis Patients Enrolled in Medicare. Arthritis. Rheumatol. 2016. Vol. 68, № 1. P. 56–66.
63. George M.D., Baker J.F., Hsu J.Y. et al. Perioperative Timing of Infliximab and the Risk of Serious Infection After Elective Hip and Knee Arthroplasty. Arthritis Care Res (Hoboken). 2017. Vol. 69, № 12. P. 1845–1854.
64. Goodman S.M., Menon I., Christos P.J. et al. Ma–nagement of perioperative tumour necrosis factor a inhibitors in rheumatoid arthritis patients undergoing arthroplasty: a systematic review and meta–analysis. Rheumatology (Oxford). 2016. Vol. 55, № 35. P. 73–82.
65. Mabille C., Degboe Y., Constantin A., et al. Infectious risk associated to orthopaedic surgery for rheumatoid arthritis patients treated by anti–TNF alpha. Joint Bone Spine. 2017. Vol. 84, № 4. P. 441–445.
66. Abou Zahr Z., Spiegelman A., Cantu M., Ng B. Perioperative use of anti–rheumatic agents does not increase early postoperative infection risks: a Veteran Affairs' admi–nistrative database study. Rheumatol. Int. 2015. Vol. 35, № 2. P. 265–72.
67. Lau C., Dubinsky M., Melmed G. et al. The impact of preoperative serum anti–TNFa therapy levels on early postoperative outcomes in inflammatory bowel disease surgery. Ann. Surg. 2015. Vol. 261, № 3. P. 487–96.
68. Momohara S., Hashimoto J., Tsuboi H. et al. Analysis of perioperative clinical features and complications after orthopaedic surgery in rheumatoid arthritis patients treated with tocilizumab in a real–world setting: results from the multicentre TOcilizumab in Perioperative Period (TOPP) study. Mod. Rheumatol. 2013. Vol. 23, № 3. P. 440–9.
69. Godot S., Gottenberg J.E., Paternotte S. et al. Safety of surgery after rituximab therapy in 133 patients with rheumatoid arthritis: data from the autoimmunity and rituximab registry. Arthritis. Care Res. (Hoboken). 2013. Vol. 65, № 11. P. 1874–9.
70. Latourte A., Gottenberg J.E., Luxembourger C. et al. Safety of surgery in patients with rheumatoid arthritis trea–ted by abatacept: data from the French Orencia in Rheumatoid Arthritis Registry. Rheumatology (Oxford). 2017. Vol. 56, № 4. P. 629–637.
71. George M.D., Baker J.F., Winthrop K. et al. Timing of Abatacept Before Elective Arthroplasty and Risk of Post–operative Outcomes. Arthritis Care Res (Hoboken). 2019. [Epub ahead of print].
72. George M.D., Baker J.F. Perioperative management of immunosuppression in patients with rheumatoid arthritis. Curr. Opin. Rheumatol. 2019. Vol. 31, № 3. P. 300–306.

/193-1.jpg)