Журнал "Гастроэнтерология" Том 53, №3, 2019
Вернуться к номеру
Ефективність та безпечність препарату адеметіоніну в корекції функції печінки в пацієнтів зі стеатогепатитом: результати відкритого багатоцентрового порівняльного постмаркетингового дослідження
Авторы: Фадєєнко Г.Д.(1), Скрипник І.М.(2), Осьодло Г.В.(3), Гріднєв О.Є.(1), Нікіфорова Я.В.(1)
(1) — ДУ «Національний інститут терапії ім. Л.Т. Малої НАМН України», м. Харків, Україна
(2) — ВДНЗ «Українська медична стоматологічна академія», м. Полтава, Україна
(3) — Українська військово-медична академія Міністерства оборони України, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Мета — дослідити ефективність та безпечність препарату адеметіоніну, ліофілізат для розчину для ін’єкцій, у пацієнтів із неалкогольним стеатогепатитом (НАСГ). Матеріали та методи. Обстежено 120 пацієнтів із НАСГ, яких було розподілено на дві групи. Пацієнтам основної групи (35 чоловіків і 27 жінок, середній вік (49,0 ± 2,1) року) призначали генеричний препарат адеметіоніну Гепаметіон («Артеріум») по 400 мг внутрішньовенно щодня протягом 2 тижнів; пацієнти групи порівняння (34 чоловіки і 24 жінки, середній вік (52,0 ± 2,3) року) як референтний лікарський засіб отримували оригінальний препарат адеметіоніну Гептрал по 400 мг внутрішньовенно щодня протягом 2 тижнів. Групи були реципрокні за статтю, віком, метаболічними показниками (р > 0,05). Діагноз неалкогольної жирової хвороби печінки встановлювали відповідно до міжнародних та національних протоколів і стандартів її діагностики. Рівень депресії визначали методом анкетування з використанням стандартного опитувальника Бека. Результати. На тлі призначення адеметіоніну вже на 18–22 день терапії в пацієнтів із НАСГ відзначена статистично значуща позитивна динаміка показників цитолізу (р < 0,05) і запалення (фактора некрозу пухлини α) (р < 0,001), яка зберігалася і при оцінці віддалених результатів на 48–52 день, порівняно з вихідними даними (р < 0,001); досягнуто усунення ознак депресії, про що свідчило статистично значуще зниження рівня депресії (р < 0,001). Висновки. Результати використання адеметіоніну дають змогу позитивно оцінити його ефективність у пацієнтів із НАСГ як патогенетичний лікарський засіб із додатковим вираженим антидепресивним ефектом. Досліджуваний препарат адеметіоніну порівнянний із референтним (р > 0,05).
Цель — исследование эффективности и безопасности препарата адеметионина, лиофилизата для раствора для инъекций, у пациентов с неалкогольным стеатогепатитом (НАСГ). Материалы и методы. Обследовано 120 пациентов с НАСГ, которых распределили на две группы. Пациентам основной группы (35 мужчин и 27 женщин, средний возраст (49,0 ± 2,1) года) назначали генерический препарат адеметионина Гепаметион («Артериум») по 400 мг внутривенно ежедневно в течение 2 недель; в качестве референтного препарата пациенты группы сравнения (34 мужчины и 24 женщины, средний возраст (52,0 ± 2,3) года) получали оригинальный препарат адеметионина Гептрал по 400 мг внутривенно ежедневно в течение 2 недель. Группы были сопоставимы по полу, возрасту, метаболическим показателям (р > 0,05). Диагноз неалкогольной жировой болезни печени устанавливали в соответствии с международными и национальными протоколами и стандартами ее диагностики. Уровень депрессии определяли методом анкетирования с использованием стандартного опросника Бека. Результаты. На фоне назначения адеметионина уже на 18–22 день терапии у пациентов с НАСГ отмечена статистически значимая положительная динамика показателей цитолиза (р < 0,05) и воспаления — фактора некроза опухоли α (р < 0,001), которая сохранялась и при оценке отдаленных результатов — на 48–52 день, по сравнению с исходными данными (р < 0,001), достигнуто купирование признаков депрессии, о чем свидетельствует статистически значимое снижение уровня депрессии (р < 0,001). Выводы. Результаты применения адеметионина позволяют положительно оценить его действие у пациентов с НАСГ в качестве патогенетического лекарственного средства с дополнительным выраженным антидепрессивным эффектом. Исследуемый препарат адеметионина сопоставим с референтным (р > 0,05).
Background. The purpose was to study the efficacy and safety of the drug of ademethionine, lyophilisate for solution for infusion in the patients with non-alcoholic steatohepatitis (NASH). Materials and methods. One-hundred and twenty patients with NASH were examined, which were divided into two groups. The patients of the basic group (35 men and 27 women, average age (49.0 ± 2.1) years) were prescribed ademethionine generic drug Hepamethion (Arterium) 400 mg intravenously daily for 2 weeks; as a reference drug the patients of comparison group (34 men and 24 women, average age (52.0 ± 2.3) years) received the original drug of ademethionine Heptral 400 mg intravenously daily for 2 weeks. The groups were matched by sex ratio, age, and metabolic indices (p > 0.05). The diagnosis of non-alcoholic fatty liver disease was established under the international and national protocols and standards for its diagnosis. The level of depression was determined by the method of questioning using the standard Beck questionnaire. Results. Against the backdrop of the administration of ademethionine in patients with NASH, there was a statistically significant positive tendency in cytolysis (p < 0.05) and inflammation — tumour necrosis factor α (p < 0.001) already on day 18–22 of the therapy, which persisted when evaluating long-term results — on day 48–52 compared with baseline data (p < 0.001), the relief of signs of depression was achieved, as evidenced by a statistically significant decrease in the level of depression (p < 0.001). Conclusions. The results of the use of ademethionine allow positively evaluate its effect in patients with NASH as a pathogenetic drug with an additional pronounced antidepressant effect. The drug of ademethionine is comparable to the reference one (p > 0.05).
адеметіонін; неалкогольний стеатогепатит; фактор некрозу пухлини α; показники цитолізу; рівень депресії
адеметионин; неалкогольный стеатогепатит; фактор некроза опухоли α; показатели цитолиза; уровень депрессии
ademethionine; non-alcoholic steatohepatitis; tumour necrosis factor α; cytolysis parameters; level of depression
Вступ
Неалкогольна жирова хвороба печінки (НАЖХП) є хронічним захворюванням печінки, в основі якого лежить накопичення ліпідів у гепатоцитах, що перевищує 5 % від маси печінки за відсутності як етіологічного фактора токсичної дії алкоголю (40 г/добу для чоловіків і 20 г/добу для жінок).
НАЖХП належить до поширених захворювань (17–46 % від загального числа населення країни) [8]. При метаболічних захворюваннях частка НАЖХП різко зростає: при ожирінні НАЖХП діагностують у більшості пацієнтів (70–100 %), при цукровому діабеті 2 типу — у 20–70 % [1–3, 8, 17].
На сучасному етапі НАЖХП розглядають як самостійний компонент метаболічного синдрому та як фактор ризику кардіоваскулярних ускладнень і підвищення рівня смертності від них [8, 16].
Відмінною особливістю НАЖХП є те, що захворювання не має характерних клінічних проявів і тривалий час не діагностується. Це є причиною пізнього звернення пацієнта по медичну допомогу і, відповідно, на більш пізній стадії хвороби. Як правило, захворювання має повільний (роки) тривалий перебіг та без адекватного лікування проходить послідовні стадії прогресування: стеатоз печінки, стеатогепатит, фіброз печінки, цироз печінки, гепатоцелюлярна карцинома.
В основі патогенезу НАЖХП лежать накопичення тригліцеридів (ТГ) у гепатоцитах унаслідок дисбалансу між імпортом/синтезом і швидкістю експорту/катаболізму жирних кислот, а також розвиток оксидативного стресу (під впливом вільних радикалів) із подальшим розвитком запалення й фіброзу. Активація оксидативного стресу асоційована з інсулінорезистентністю (ІР), прямою ліпотоксичністю, ендотоксемією кишкової мікробіоти (моносахариди грамнегативних бактерій, які, потрапляючи в портальний кровотік і активуючи толл-подібні рецептори 4 (TLR4), ініціюють імунну відповідь і прогресування запальних змін) і спадковою схильністю (PNPLA3, GCKR, LYPLAL1 й ін.) [3, 8, 11]. Таким чином, оксидативний стрес є ключовою ланкою, що підтримує запалення й призводить до розвитку фіброзу печінки.
Для лікування НАЖХП при стеатозі печінки рекомендоване зниження маси тіла переважно за рахунок дієти й помірних аеробних фізичних навантажень, тоді як стеатогепатит, крім виконання зазначених рекомендацій, вимагає призначення медикаментозної корекції [1, 3, 5, 8]. На даний час відсутня достатня доказова база для використовуваних препаратів щодо зменшення/усунення фіброзу печінки в пацієнтів із неалкогольним стеатогепатитом (НАСГ), що обумовлює актуальність вивчення інших підходів до лікування.
У зв’язку з цим вважаємо за доцільне оцінити ефективність відомих гепатопротекторів із доведеним механізмом патогенетичного впливу на так звану зону інтересу при лікуванні НАЖХП — на оксидативний стрес та ІР.
Одним із таких засобів є адеметіонін. Ця речовина ендогенно синтезується в організмі, переважно в печінці, шляхом ферментативної реакції між L-метіоніном і аденозинтрифосфатом (АТФ). У нормі адеметіонін відіграє важливу роль у забезпеченні функцій клітин печінки. Це метаболічно плейотропна молекула, що бере участь у різних клітинних реакціях і впливає на численні функції клітин (попередник для синтезу глутатіону, донатор метильних груп у реакціях метилювання фосфоліпідів клітинних мембран білків, гормонів, нейромедіаторів тощо) [15, 18]. У численних клінічних дослідженнях доведені його ефективність і безпека при низці хронічних захворювань печінки [4, 6, 7, 9, 10, 13, 15].
Фармакологічна дія адеметіоніну полягає в підвищенні антиоксидантної активності (за рахунок збільшення синтезу антиоксидантів — цистеїну й глутатіону), модуляції балансу між про- і протизапальними цитокінами в печінці, що забезпечує зниження активності запального процесу і зменшення рівня ендотоксемії, у поліпшенні процесів регенерації та проліферації гепатоцитів (вплив на процеси фіброзування), продукції й відтоку жовчі [9, 18].
Порушення метаболізму адеметіоніну може привести до дефіциту метилфолату, а отже, до дефіциту глутатіону — основного антиоксидантного та антитоксичного агента в кровотоку та тканинах. Зниження рівня адеметіоніну сприяє розвитку або збільшенню ураження печінки, прогресуванню запальних реакцій, формуванню її функціональних і необоротних структурних змін, включаючи оксидативний стрес у тканинах, мітохондріальну дисфункцію, гепатоцелюлярний апоптоз і злоякісну трансформацію [14]. Дефіцит адеметіоніну виявлений при всіх хронічних захворюваннях печінки, у тому числі при НАЖХП, при якій він може брати участь як попередник глутатіону й донатор метильних груп у синтезі фосфатидилхоліну, необхідного для експорту ТГ із гепатоцита [16, 17]. Для повноцінного функціонування печінки й уповільнення її структурних змін, обумовлених дефіцитом адеметіоніну, необхідне його екзогенне поповнення.
Екзогенний адеметіонін (лікарський препарат) доповнює дефіцит ендогенного метіоніну й стимулює його вироблення в організмі. Наявні відомості про роль адеметіоніну в організмі людини; експериментальні та клінічні дані щодо його застосування при хронічних захворюваннях печінки дозволяють широко його застосовувати при НАЖХП.
Метаболізм екзогенного адеметіоніну, що входить до складу препарату, відбувається тим же шляхом, без серйозних побічних ефектів, про що свідчать численні дані щодо ефективності й безпеки препарату при лікуванні хронічних захворювань печінки. Експериментальні та клінічні дані щодо застосування адеметіоніну при хронічних захворюваннях печінки дозволяють говорити про його ефективність при НАЖХП. Аналіз результатів рандомізованого клінічного дослідження T. Guo і співавт. (2015) свідчить про те, що препарат ефективно покращує функцію печінки й може бути основою терапії при патології цього органа [10].
У низці досліджень застосування адеметіоніну в пацієнтів із НАЖХП продемонстроване значне збільшення рівня глутатіону після лікування адеметіоніном за рахунок підвищення вмісту відновленого глутатіону в мікросомах печінки і пригнічення перекисного окислення ліпідів [4, 10]. Відомо, що глутатіон є одним з основних компонентів антиоксидантної системи і протективним фактором при розвитку стеатогепатиту [3]. В іншому дослідженні показано, що застосування адеметіоніну в пацієнтів із НАСГ і ожирінням при дотриманні дієтичних рекомендацій сприяло зменшенню активності печінкових трансаміназ, поліпшенню ультрасонографічної картини печінки та нівелюванню проявів астенії та депресії [4, 17].
Адеметіонін має низку переваг перед іншими гепатопротекторами, оскільки надає найшвидший терапевтичний ефект: через 7 днів — суб’єктивно, через 15 — об’єктивно (позитивна динаміка біохімічних показників (печінкових ферментів)). Ефект від лікування зберігається тривалий час (до 3–6 місяців) після закінчення лікування залежно від захворювання. Препарат показаний при захворюваннях печінки будь-якої етіології за рахунок патогенетичної дії адеметіоніну [8, 12, 19].
З нашої точки зору, препарати адеметіоніну доцільно використовувати для лікування запальних змін у печінці.
Мета — дослідити ефективність і безпеку адеметіоніну (препарату Гепаметіон ПАТ «Київмедпрепарат» корпорації «Артеріум», ліофілізат для розчину для ін’єкцій по 400 мг, та референтного препарату адеметіоніну) у пацієнтів із неалкогольним стеатогепатитом.
Попередні результати дослідження ефективності та безпеки препарату Гепаметіон у пацієнтів зі стеатогепатитом, яке проводили в ДУ «Національний інститут терапії ім. Л.Т. Малої НАМН України», були опубліковані в 2018 році [4].
Матеріали та методи
Наведені результати досліджень, проведених на базі трьох науково-дослідних центрів: ДУ «Національний інститут терапії ім. Л.Т. Малої НАМН України», кафедра внутрішньої медицини № 1 ВДНЗ «Українська медична стоматологічна академія», кафедра військової терапії Української військово-медичної академії.
Критерії включення хворих у дослідження: вік від 18 до 60 років; встановлений підтверджений діагноз НАЖХП (НАСГ); відсутність прийому будь-яких гепатопротективних препаратів протягом 12 тижнів, що передують включенню у дослідження; здатність до співпраці й згода пацієнта на участь у дослідженні.
Критерії виключення з дослідження: вік пацієнта менше ніж 18 чи понад 60 років; відома підвищена чутливість до компонентів препарату; наявність значущої і/або неконтрольованої патології внутрішніх органів, у тому числі супутні захворювання в стадії декомпенсації або гострі стани, наявність яких може вплинути на результати дослідження; гостра або хронічна вірусна інфекція, гостра бактеріальна інфекція; наявність онкологічної патології в анамнезі; наявність вірусних гепатитів в анамнезі; наявність ВІЛ-інфекції; зловживання алкоголем в анамнезі та на момент скринінгу; прийом пробіотиків протягом 5 тижнів, що передують включенню в дослідження; алкоголізм, наркоманія в анамнезі; вагітність, грудне вигодовування; участь у будь-якому іншому клінічному випробуванні в попередні 12 тижнів; нездатність пацієнта до адекватного співробітництва; незгода хворого брати участь у дослідженні.
До початку дослідження було отримано добровільну письмову згоду від кожного пацієнта.
Обстежено 120 пацієнтів із НАСГ, яких розподілили на дві групи. Пацієнтам основної групи (35 чоловіків і 27 жінок, середній вік (49,0 ± 2,1) року) призначали генеричний препарат адеметіоніну Гепаметіон («Артеріум») по 400 мг внутрішньовенно щодня протягом 2 тижнів; як референтний препарат пацієнтам групи порівняння (34 чоловіки і 24 жінки, середній вік (52,0 ± 2,3) року) призначали оригінальний препарат адеметіоніну Гептрал по 400 мг внутрішньовенно щодня протягом 2 тижнів.
Схема візитів і методи обстеження пацієнтів наведені в табл. 1.
Результати лікування оцінювали на 18–22 день та на 48–52 день від початку лікування.
Контроль активності запального процесу в печінці здійснювали за оцінкою показників печінкових ферментів і прозапального цитокіну — фактора некрозу пухлини α (ФНП-α), який найбільш чутливо реагує на вираженість активності запалення в тканині печінки.
Діагноз НАЖХП встановлювали відповідно до міжнародних і вітчизняних протоколів і стандартів діагностики НАЖХП (МКХ-10; Наказ МОЗ № 826 від 06.11.2014 р.); адаптованих клінічних рекомендацій на підставі критеріїв Американської асоціації з вивчення захворювань печінки (American Association for the Study of Liver Diseases, 2012) і рекомендацій Європейської асоціації з діагностики та лікування НАЖХП (European Association for the Study of the Liver et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease, 2016) [2, 5, 8].
Оцінку трофологічного статусу проводили за допомогою розрахунку індексу маси тіла (ІМТ) за формулою Кетле. Значення в інтервалі 18,5–24,99 кг/м2 розцінювали як нормальну вагу, 25–29,9 кг/м2 — як надлишкову масу тіла (передожиріння), вище від 30,0 кг/м2 — як ожиріння з визначенням ступеня згідно з критеріями ВООЗ. Розподіл жирової тканини вивчали за допомогою моніторування складу тіла (біоімпедансометрії) на електронному приладі ваги-монітор «Omron BF 511» (Японія, 2011). При перевищенні показників вісцеральної жирової тканини (ВЖТ) більше ніж 8 % у жінок і більше від 10 % у чоловіків діагностували вісцеральне ожиріння.
У всіх пацієнтів визначали клініко-лабораторні та біохімічні показники крові з визначенням маркерів порушення функції печінки: аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), гамма-глутамілтранспептидази (ГГТП), лужної фосфатази (ЛФ), білірубіну і його фракцій. Ліпідний обмін оцінювали за показниками загального холестерину (ХС), тригліцеридів, ліпопротеїдів низької щільності (ЛПНЩ) та ліпопротеїдів дуже низької щільності (ЛПДНЩ), ліпопротеїдів високої щільності (ЛПВЩ) ферментативним методом на біохімічному аналізаторі «Humalаyzer 2000» (зав. № 18300-5397, Німеччина) з використанням набору реактивів фірми «Human» (Німеччина).
Концентрацію маркера запалення — фактора некрозу пухлини альфа — визначали в сироватці крові за допомогою набору реагентів «Альфа-ФНП-ІФА- Бест» (АТ «Вектор-Бест», РФ) методом імуноферментного аналізу. Нормальні значення ФНП-α відповідали діапазону 0,00–6,00 пг/мл; контрольна сироватка — 87,69 пг/мл (84,0–114,0 пг/мл).
У всіх пацієнтів визначали рівень депресії методом анкетування з використанням стандартного опитувальника Бека. Опитувальник містить 21 питання, на кожне з яких є 4 варіанти відповіді. Кожен варіант відповідає певній категорії тяжкості (від 0 до 3 балів) відповідно до наростання тяжкості симптому. Сумарний бал при відповідях на всі питання становить від 0 до 62 і знижується відповідно до поліпшення стану. Залежно від отриманих даних результати тесту інтерпретували в такий спосіб: 0–9 балів — відсутність депресивних симптомів; 10–15 балів — легка депресія (субдепресія); 16–19 — помірна депресія; 20–29 — виражена (середньої тяжкості) і 30–63 — тяжка депресія.
Статистичну обробку результатів проводили за допомогою програм Microsoft Excel та Statistica 7.0 із використанням стандартних методів варіаційної статистики. Статистично значущими вважали відмінності при p < 0,05.
Результати та обговорення
До початку терапії пацієнти обох груп були реципрокними за віком, статтю, метаболічними показниками (ІМТ, окружність талії, відсоток ВЖТ, вихідні показники печінкових проб і ліпідограми) (р > 0,05) (табл. 2).
Усі обстежені пацієнти, включені в дослідження, мали надлишкову масу тіла або ожиріння І ступеня та вісцеральне ожиріння. Середні показники ІМТ становили (31,20 ± 0,59) кг/м2 та (31,57 ± 0,62) кг/м2 в основній групі та групі порівняння відповідно (р > 0,05). При моніторуванні складу тіла (біоімпедансометрія) виявлене значне перевищення відсотка ВЖТ без вірогідної різниці значень у чоловіків і жінок (р > 0,05), що дозволило об’єднати їх для розрахунку середніх показників у двох групах порівняння.
При аналізі вихідних показників печінкових проб і ФНО-α встановлена наявність помірної активності запалення печінки серед пацієнтів як основної групи, так і групи порівняння (р > 0,05).
При контрольному обстеженні на 18–22 день від початку терапії відзначена статистично значуща (р < 0,05) позитивна динаміка показників цитолізу в основній групі (АЛТ знизилася до (45,8 ± 1,1) Од/л порівняно з вихідними даними (р < 0,05), АСТ — до (35,5 ± 1,3) Од/л порівняно з вихідними (р < 0,05)), що була порівнянна з динамікою відповідних показників у групі порівняння (р > 0,05) (рівень АЛТ зменшився до (46,6 ± 1,2) Од/л порівняно з вихідним (р < 0,05), АСТ — до (36,1 ± 1,4) Од/л (р < 0,05)). На 48–52 день обстеження зберігалася позитивна динаміка щодо зниження показників цитолізу (рівень АЛТ зменшився до (34,6 ± 1,1) Од/л порівняно з вихідним (р < 0,05), АСТ — до (29,4 ± 1,1) Од/л порівняно з вихідним (р < 0,05)) без статистично значущих відмінностей між показниками груп порівняння (р > 0,05) (рис. 1).
У всіх пацієнтів обох груп ферментні показники холестазу початково не перевищували референтних значень (р > 0,05) і зберігалися в межах норми в динаміці лікування (рис. 2).
Показники ліпідограми (ЗХС, ТГ, ЛПНЩ, ЛПВЩ, КА, ЛПДНЩ) у пацієнтів основної групи були порівнянні з показниками пацієнтів із групи порівняння як до лікування, так і в його динаміці (р > 0,05) (рис. 3).
Після закінчення лікування відзначалася статистично значуща позитивна динаміка запального маркера — ФНП-α. На 18–22 день терапії показники ФНП-α в основній групі знизилися з (11,12 ± 0,85) пг/мл до (5,00 ± 0,39) пг/мл (р < 0,001) і з (11,05 ± 1,09) пг/мл до (5,3 ± 0,41) пг/мл в групі порівняння (р < 0,001). При аналізі віддалених результатів на 48–52 день зберігається позитивна тенденція до зменшення й стабілізації показників ФНО-α без статистично значущих відмінностей між показниками досліджуваних груп (до (4,14 ± 0,39) пг/мл і (3,96 ± 0,37) пг/мл відповідно) (р > 0,05).
Динаміка показників ФНП-α за весь період спостереження зображена на рис. 4.
Таким чином, як на 18–22 день, так і на 48–52 день від початку терапії отримана статистично значуща позитивна динаміка показників цитолізу й ФНП-α в сироватці крові, позитивна тенденція до зменшення показників холестазу, ліпідного спектра порівняно з вихідними даними. Результати, отримані в обох групах, були порівнянні (р > 0,05).
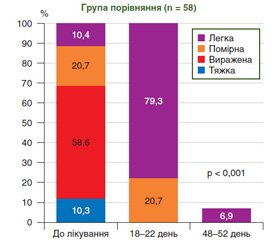
Крім позитивного впливу на стан печінки, наше дослідження підтвердило сприятливий антидепресивний ефект адеметіоніну в обох групах пацієнтів із НАСГ. Середній бал, що відображає ступінь тяжкості депресії, серед обстежених пацієнтів до моменту початку терапії становив (21,53 ± 0,88) бала в основній групі і (21,29 ± 0,92) бала в групі контролю (р > 0,05). Після проведеної терапії ступінь тяжкості депресії статистично значуще (р < 0,05) знизився у хворих обох груп порівняння — до (6,84 ± 0,44) і (6,36 ± 0,47) бала відповідно.
Динаміка перерозподілу частки пацієнтів із різним ступенем тяжкості депресії до і після лікування наведена на рис. 5.
Доведено, що досліджуваний препарат пригнічує симптоми депресії навіть при короткочасному лікуванні. Дані, отримані за допомогою опитувальника Бека на 18–22 день у пацієнтів основної групи, свідчать про статистично значуще зниження рівня депресії (р < 0,001): збільшення частки пацієнтів із помірним (16,1 %) і легким ступенем депресії (83,9 %) і відсутність пацієнтів із вираженою і тяжкою депресією порівняно з вихідними показниками (58,0 і 11,4 % відповідно). Аналіз віддалених результатів на 48–52 день від початку терапії виявив лише у 8,1 % досліджуваних пацієнтів легкий ступінь депресії, тоді як 91,9 % пацієнтів не мали ознак депресії. Антидепресивний ефект генеричного адеметіоніну був порівнянний із ефектом референтного препарату (р > 0,05). Переносимість досліджуваних препаратів була доброю, побічних ефектів не спостерігали. Усі пацієнти закінчили повний курс терапії.
Висновки
Результати використання як генеричного, так і референтного препарату адеметіоніну дозволяють позитивно оцінити його ефективність у пацієнтів із неалкогольним стеатогепатитом як патогенетичного лікарського засобу. За досліджуваними параметрами препарат Гепаметіон порівнянний із референтним препаратом адеметіоніну і є доступним ефективним вітчизняним лікарським засобом для патогенетичного лікування неалкогольного стеатогепатиту з додатковим вираженим антидепресивним ефектом.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті. Збір матеріалу, його аналіз і написання тексту проводились авторами сумісно.
Фінансування. Робота виконана за підтримки корпорації «Артеріум».
1. Наказ Міністерства охорони здоров’я України № 826 від 06 листопада 2014 року «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги «Неалкогольний стеатогепатит». Режим доступу: http://search.ligazakon.ua.
2. Зайченко О.Е. Терапевтические мишени при неалкогольной жировой болезни печени. Сучасна гастроентерологія. 2014. № 1 (75). С. 130-138.
3. Полухина А.В., Винницкая Е.В., Сандлер Ю.Г., Хайменова Т.Ю. Адеметионин в лечении неалкогольной жировой болезни печени. Медицинский совет. 2017. № 15. Режим доступу: https://cyberleninka.ru/article/n/ademetionin
4. Фадеенко Г.Д., Гриднев А.Е. Эффективность и безопасность адеметионина при коррекции функции печени у пациентов со стеатогепатитом. Результаты открытого постмаркетингового исследования. Сучасна гастроентерологія. 2018. № 1(99). С. 7-16.
5. Рекомендації AASLD2012 Hepatology. June 2012. Режим доступу: http:www.aasld.org/sites/default/files/guideline_documents/
6. Anstee Q.A., Day C.P. S-adenosylmethionine (SAMe) therapy in liver disease: A review of current evidence and clinical utility. J. of Hepatol. 2012. 57. 1097-1109.
7. Del Bas J.M. et al. Hepatic accumulation of S-adenosylmethionine in hamsters with non-alcoholic-fatty liver disease associated to metabolic syndrome under selenium and vitamin E deficiency. Clinical Science. 2017. CS20171039.
8. European Association for the Study of the Liver et al. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. Obesity facts. 2016. 9 (2). 65-90.
9. Fridel H.A., Goa K.L., Benfield P. S-adenosyl-L-methionine: a review of its pharmacological properties and therapeutic potentials in liver dysfunction and affective disorders in relation to its physiological role in cell metabolism. Drugs. 1989. 38. 389-416.
10. Guo T., Chang L., Xiao Y., Liu Q. S-adenosyl-L-methionine for the treatment of chronic liver disease: a systematic review and meta-analysis. PLoS One. 2015. Vol. 10. Published online 2015 Mar 16.
11. Lombardi R. et al. Pharmacological interventions for non-alcohol related fatty liver disease (NAFLD): an attempted network meta-analysis. The Cochrane Library. 2017.
12. Lyall M.J. et al. Methyl donor deficient diets cause distinct alterations in lipid metabolism but are poorly representative of human NAFLD. Wellcome Open Research. 2017. 2.
13. Martínez-Uña M. et al. S-adenosylmethionine increases circulating very-low density lipoprotein clearance in non-alcoholic fatty liver disease. Journal of Hepatology. 2015. 62. 3. 673-681.
14. Martinez-Chantar M.L. et al. Spontaneous oxidative stress and liver tumors in mice lacking methionine adenosyltransferase 1A. The FASEB Journal. 2002.
15. Mato J.M. et al. S-adenosylmethionine metabolism and liver disease. Ann. Hepatol. 2013. 12 (2). 183-189.
16. Meikle P.J., Summers S.A. Sphingolipids and phospholipids in insulin resistance and related metabolic disorders. Nature Reviews Endocrinology. 2017. 13 (2). 79.
17. Noureddin M., Mato J.M., Lu S.C. Nonalcoholic fatty liver disease: update on pathogenesis, diagnosis, treatment and the role of S-adenosylmethionine. Experimental Biology and Medicine. 2015. 240 (6). 809-820.
18. Ramani K., Lu S.C. Methionine adenosyltransferases in liver health and diseases. Liver Research. 2017.
19. Sookoian S. et al. Nonalcoholic steatohepatitis is associated with a state of betaine insufficiency. Liver International. 2017. 37 (4). 611-619.

/23-1.jpg)
/24-1.jpg)
/25-1.jpg)
/26-1.jpg)
/26-2.jpg)