Журнал "Гастроэнтерология" Том 53, №3, 2019
Вернуться к номеру
Синдром надлишкового бактеріального росту у хворих на хронічні дифузні захворювання печінки залежно від етіології й морфологічних особливостей
Авторы: Діденко В.І., Зигало Е.В., Гайдар Ю.А., Ягмур В.Б.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Низка досліджень вказує на підвищення ризику виникнення порушень з боку печінки при дисбіотичних порушеннях у кишечнику. У свою чергу, зміна фізіологічних процесів у печінці може стати поштовхом для виникнення синдрому надлишкового бактеріального росту (СНБР). Доведено, що СНБР в тонкому кишечнику може відігравати певну роль в патогенезі алкогольної хвороби печінки та ускладнень, пов’язаних із хронічним гепатитом С. Метою дослідження було оцінити частоту появи синдрому надлишкового бактеріального росту у хворих на хронічні дифузні захворювання печінки (ХДЗП) з урахуванням ступеня стеатозу, стадії фіброзу та ступеня активності запального процесу печінки. Матеріали та методи. 27 обстежених пацієнтів було розподілено на 2 групи: I — 12 хворих на хронічний гепатит, асоційований з вірусом С (ХГС); II — 15 хворих на алкогольну хворобу печінки (АХП) залежно від етіології при формуванні та прогресуванні стеатозу та фіброзу печінки з використанням даних гістологічних методів дослідження, комп’ютерної морфометрії, транзієнтної еластометрії та показника ступеня стеатозу САР на апараті FibroScan 502. Синдром надлишкового бактеріального росту визначали за допомогою водневого дихального тесту (ВДТ) з глюкозою. Результати. СНБР був виявлений у 51,8 % хворих на ХДЗП, вірогідно майже в 1,5 раза переважав у хворих на АХП (60,0 %) порівняно з хворими на ХГС, у яких тільки у 41,7 % виявлений СНБР. Відзначено переважання позитивних випадків ВДТ у групі S3 (70,0 %), що вірогідно відрізняло її від групи S1 (37,5 %). У хворих на ХГС із прогресуванням стеатозу збільшується кількість випадків СНБР, і навпаки, у більшості хворих із АХП, які мали гістологічно підтверджений мікровезикулярний та дрібнокрапельний стеатоз печінки, виявляли при дослідженні ВДТ порушення мікробіоти у тонкому кишечнику. Висновки. Між показниками водневого дихального тесту та індексом гістологічної активності, гістологічними показниками прогресування стеатозу печінки у хворих на хронічний гепатит С виявлений чіткий взаємозв’язок: із збільшенням активності запального процесу (9 балів) та ступеня стеатозу печінки (S3) зростає рівень порушень мікробіоти в тонкому кишечнику (> 20 ppm), тобто при ХГС рівень виділення водню адекватно відображує ступінь активності запального процесу в печінці.
Актуальность. Ряд исследований указывают на повышение риска появления нарушений со стороны печени при дисбиотических нарушениях в кишечнике. В свою очередь, изменение физиологических процессов в печени может стать толчком для возникновения синдрома избыточного бактериального роста (СИБР). Доказано, что СИБР в тонком кишечнике может играть определенную роль в патогенезе алкогольной болезни печени и осложнений, связанных с хроническим гепатитом С. Целью исследования было оценить частоту возникновения синдрома избыточного бактериального роста у больных хроническими диффузными заболеваниями печени (ХДЗП) с учетом степени стеатоза, стадии фиброза и степени активности воспалительного процесса в печени. Материалы и методы. 27 обследованных пациентов были распределены на 2 группы: I — 12 больных с хроническим гепатитом, ассоциированным с вирусом С (ХГС); II — 15 больных с алкогольной болезнью печени (АБП) в зависимости от этиологии при формировании и прогрессировании стеатоза и фиброза печени с использованием данных гистологических методов исследования, компьютерной морфометрии, транзиентной эластометрии и показателя степени стеатоза САР на аппарате FibroScan 502. Синдром избыточного бактериального роста определяли с помощью водородного дыхательного теста (ВДТ) с глюкозой. Результаты. СИБР был выявлен у 51,8 % больных с ХДЗП, достоверно почти в 1,5 раза преобладал у больных с АБП (60,0 %) по сравнению с ХГС, у которых только в 41,7 % случаев выявлен СИБР. Выявлено превалирование положительных случаев ВДТ в группе S3 (70,0 %), что достоверно отличалось от группы S1 (37,5 %). У больных ХГС с прогрессированием стеатоза увеличивается количество случаев СИБР, и наоборот, у большинства больных с АБП, у которых был выявлен гистологически подтвержденный микровезикулярный и мелкокапельный стеатоз печени, выявляли при ВДТ нарушения микробиоты в тонком кишечнике. Выводы. Между показателями водородного дыхательного теста и индексом гистологической активности, гистологическими показателями прогрессирования стеатоза печени у больных хроническим гепатитом С выявлена четкая взаимосвязь: с увеличением активности воспалительного процесса (9 баллов) и степени стеатоза печени (S3) повышается уровень нарушения микробиоты в тонком кишечнике (> 20 ppm), то есть при ХГС уровень выделения водорода адекватно отображает степень активности воспалительного процесса в печени.
Background. Previous studies have shown an increased risk of liver disease in intestinal dysbiosis. Damage to the liver in itself can be the cause of the bacterial overgrowth syndrome. It has been proven that bacterial overgrowth in the small intestine can play a role in the pathogenesis of alcoholic liver disease and complications associated with chronic hepatitis C. The purpose of the study was to assess the frequency of the small intestinal bacterial overgrowth (SIBO) in patients with chronic diffuse liver diseases (CDLD), depending on the degree of steatosis, the stage of fibrosis, and the activity of the hepatic inflammatory process. Materials and methods. Twenty-seven patients were divided into 2 groups: I — 12 patients with chronic hepatitis associated with the virus C (HCV); II — 15 patients with alcoholic liver disease (ALD) depending on the etiology and progression of steatosis and liver fibrosis using histological methods, computer morphometry, transient elastometry and an indicator of the degree of steatosis CAP using the FibroScan 502. Bacterial overgrowth syndrome was determined using a glucose hydrogen breath test. Results. SIBO was found in 51.8 % of CDLD patients. In patients with ALD, it occurred significantly more often (60.0 %) than in HCV, among which only 41.7 % patients had SIBO. A predominance (70.0 %) of a positive hydrogen breath test was noted in the group with severe steatosis (S3), which significantly distinguished it from the group with initial manifestations of steatosis S1 (37.5 %). In patients with chronic hepatitis C with progressive steatosis, the number of cases of SIBO increases and, conversely, the majority of patients with ALD who had histologically confirmed microvesicular and small-drop fatty liver dystrophy during the hydrogen breath test showed microbiota disturbances in the small intestine. Conclusions. There is a correlation between the indicators of the hydrogen breath test and the histological activity index, histological indicators of the progression of liver steatosis in patients with chronic hepatitis C. Thus, with an increase in the activity of the inflammatory process (9 points) and the degree of liver steatosis (S3), the severity of microbiota disturbances in the small intestine increases (> 20 ppm). The degree of SIBO in HCV reflects the severity of the inflammatory process in the liver.
синдром надлишкового бактеріального росту; алкогольна хвороба печінки; хронічний гепатит С; стеатоз печінки; фіброз печінки
синдром избыточного бактериального роста; алкогольная болезнь печени; хронический гепатит С; стеатоз печени; фиброз печени
bacterial overgrowth syndrome; alcoholic liver disease, chronic hepatitis C; liver steatosis, liver fibrosis
Вступ
Хронічні дифузні захворювання печінки (ХДЗП) відрізняються тривалим перебігом і несприятливим медико-соціальним прогнозом, тому що незалежно від етіологічного фактора (віруси, алкоголь, шкідливі хімічні речовини, радіація тощо) супроводжуються ураженням мембран гепатоцитів і порушенням функцій печінки. Доведено, що жирова дистрофія печінки є першою універсальною відповіддю на ураження печінки будь-якого походження. Постійне існування запального інфільтрату, осередків некрозу, апоптозу призводить до гіперпродукції сполучної тканини та розвитку фіброзу [1]. Тому в сучасній гепатології багато уваги приділяється морфологічним змінам в печінці як відображенню прогресування хвороби та її прогнозу. На даний час золотим стандартом діагностики при ХДЗП вважається черезшкірна пункційна трепанбіопсія печінки товстою голкою під ультразвуковим контролем з морфогістологічним дослідженням гепатопунктатів і визначенням імуногістологічної активності.
Стеатоз печінки є загальною гістологічною особливістю серед пацієнтів із хронічними захворюваннями печінки, зокрема у кожного другого з хронічним гепатитом, асоційованим з вірусом С. Жирова дистрофія печінки при цій патології асоційована з такими проблемами, як інсулінорезистентність, швидке прогресування фіброзу, низька відповідь на противірусну терапію та навіть зростання ризику гепатоцелюлярної карциноми. Простий стеатоз зазвичай є зворотним та доброякісним, але може бути передвісником більш зловісного стану в умовах розвитку запалення — стеатогепатиту, що може призводити до прогресування фіброзу, формування цирозу печінки та його численних фатальних ускладнень. Чутливе визначення наявності та стадії жирової хвороби печінки є незамінним для визначення прогнозу захворювання, необхідності лікування, моніторингу прогресування та відповіді на терапію [2, 3].
Існує тісний контакт між кишечником та печінкою під назвою «вісь кишечник — печінка» (axis gut-liver), заснований на тому, що ряд метаболітів, що продукуються печінкою, абсорбуються в кишечнику і 70 % кровотоку печінки забезпечується воротною веною, таким чином здійснючи венозний відтік з кишечника. При порушенні кишкового бар’єру печінка знаходиться під впливом токсичних чинників, що надходять з кишечника. У свою чергу, зміна фізіологічних процесів у печінці може стати поштовхом для мікробіотичних порушень у кишечнику [4, 5]. Доведено, що синдром надлишкового бактеріального росту (СНБР) в тонкому кишечнику може відігравати певну роль в патогенезі алкогольної жирової хвороби печінки та ускладнень, пов’язаних з хронічним гепатитом С [6–12]. Саме в цьому контексті при захворюваннях печінки актуальними є питання розпізнавання СНБР. У низці досліджень останніх років було доведено наявність експресії білків вірусу гепатиту С до епітеліальних клітин тонкої кишки [13]. З огляду на той факт, що у багатьох хворих на хронічний гепатит С та алкогольну хворобу печінки часто відзначаються прояви секреторної та осмотичної діареї, метеоризму й інші явища мальабсорбції, було проведено дослідження з метою оцінки частоти виявлення СНБР у цих хворих, а також пошуку можливого взаємозв’язку між розвитком дисбіотичних порушень і ступенем прогресування стеатозу та фіброзу печінки.
Мета роботи — оцінити частоту синдрому надлишкового бактеріального росту у хворих на ХДЗП з урахуванням ступеня стеатозу, стадії фіброзу та ступеня активності запального процесу печінки.
Матеріали та методи
Обстежених 27 хворих було розподілено на групи залежно від етіологічних факторів при формуванні та прогресуванні стеатозу та фіброзу печінки: I — хронічний гепатит, асоційований з вірусом С (ХГС) (n = 12); II — алкогольна хвороба печінки (АХП) (n = 15).
За допомогою методики черезшкірної пункційної трепанбіопсії печінки в кожного пацієнта взято 3 стовпчики тканини з VII сегмента правої частки органа. Для вибору місця пункції використовували сканер SAMSUNG MEDISON з конвексним датчиком з частотою 5,5 МГц, біопсійні автоматичні і напівавтоматичні засоби забору біопсійного матеріалу (Bard Magnum, Colt Short).
Для гістологічних досліджень біоптати фіксували в 10% розчині нейтрального формаліну, зневоднювали в спиртах висхідної концентрації і заливали в парафін. Гістологічні зрізи товщиною 3–5 мкм забарвлювали гематоксиліном і еозином за Маллорі в модифікації Слінченка [14].
Комп’ютерна морфометрія використовувалася як додатковий метод об’єктивізації морфологічного дослідження. Область паренхіми фіброзу була виділена і виміряна за допомогою програмного забезпечення ImageJ 1.45S (National Institutes of Health, USA). Комп’ютерний індекс фіброзу — це отримане на цифровому зображенні співвідношення площі колагену до загальної площі біоптату.
Для оцінки ступеня активності хронічного гепатиту використовується індекс гістологічної активності (ІГА) за Knodell (1981), що являє собою суму окремих компонентів, перший з яких — вираженість перипортального і/або мостоподібного некрозу печінкових часточок — змінюється в межах 0–10 балів. Наступні два компоненти — некроз частки печінки і портальне запалення — змінюються від 0 до 4 балів. Четвертий компонент вказує на ступінь рубцювання печінки і змінюється від 0 (рубці відсутні) до 4 балів (велике рубцювання або цироз). Ступінь активності хронічного гепатиту відображають перші три компоненти, четвертий — стадію процесу. ІГА, що дорівнює 0 балів, свідчить про відсутність запалення; 1–3 бали відповідають хронічному гепатиту з мінімальною активністю патологічного процесу; 4–8 — слабовираженому; 9–12 — помірному і 13–18 — значно вираженому хронічному гепатиту [15].
Хворим проводилось дослідження ступеня стеатозу печінки (за показниками САР на апараті FibroScan 502 (Франція)). Отримані параметри оцінювались наступним чином: показники САР до 232 dB/m відповідали ступеню стеатозу S0, 233–255 dB/m — ступеню S1, 256–289 dB/m — S2, вище за 290 dB/m — S3.
Для діагностики СНБР застосовували водневий дихальний тест (ВДТ) з глюкозою з використанням газоаналізатора Gastro Gastrolyzer компанії Bedfont Scientific Ltd (Велика Британія) [16]. До початку проведення тесту хворий знаходиться в положенні сидячи 1 хв. Починають ВДТ з виміру базального рівня водню натще. Для цього пацієнт затримує подих на 15 с, потім виконує повільний видих в апарат, тим самим реєструється перший замір дослідження. Інтервали між заборами повітря становлять 15 хвилин. Наступні заміри (II, III, IV, V) проводяться через 15 хв. Доза глюкози становить 50 г, розчинена в 250 мл води. Пацієнт випиває субстанцію по закінченні базального видиху (I заміру). Тобто показник кількості водню в повітрі, що видихнув хворий, реєструють до протоколу в 0, 15, 30, 45, 60 хвилин дослідження. Тривалість дослідження глюкозного дихального тесту становить 1,5 години. Пороговий рівень виділення водню — 10 ppm. За наявності збільшеної кількості анаеробної мікрофлори відбувається підвищення концентрації Н2 у повітрі, що видихується. Таким чином, визначалось:
1. Негативний ВДТ. За нормою концентрація водню при контрольних вимірюваннях не відхиляється від базального рівня більше ніж на 5 ppm.
2. Позитивний ВДТ. Підвищення базальної концентрації більше ніж на 10 ppm свідчить про порушення всмоктування глюкози в кишечнику та про наявність СНБР [17, 18].
Статистичну обробку проводили за допомогою дескриптивної статистики; порівняння середніх значень змінних здійснювали за допомогою параметричних методів (t-критерію Стьюдента) за нормального розподілу даних ознак, виражених в інтервальній шкалі. Відповідність виду розподілу ознак закону нормального розподілення перевіряли за допомогою методу Шапіро — Уїлка. В інших випадках використовували непараметричний метод (U-критерій Манна — Уїтні).
Результати та обговорення
Із метою визначення наявності СНБР у 27 досліджених хворих було виконано ВДТ з навантаженням глюкозою. Результати наведено у табл. 1.
Як видно з табл. 1, середній рівень виділення водню в усіх групах був вищим відносно нормальних показників та перевищував нормальний поріг, що свідчило про наявність СНБР. При проведенні порівняльного аналізу між нозологіями цей показник був вірогідно більшим у хворих ІІ групи ((34,6 ± 3,2) ppm) порівняно з хворими І групи ((15,7 ± 3,1) ppm) (р < 0,05). Різке підвищення рівня водню у хворих ІІ групи в перші 30 хвилин дослідження свідчило про порушення мікробіоти у тонкому кишечнику, тоді як наявність стабільної кривої у більшої кількості хворих І групи (58,3 %) визначала нормальний мікробіоценоз тонкого кишечника у цих хворих.
Аналіз частоти виявлення СНБР показав, що зміни у стані мікрофлори тонкої кишки спостерігались у 51,8 % усіх хворих, вірогідно майже у 1,5 раза переважали у хворих ІI групи (60,0 %) порівняно з І групою (41,7 %) (рис. 1).
Згідно з наявністю та ступенем стеатозу, що визначались за показником САР, пацієнти були розподілені на 4 групи: у групу S0 ввійшли 2 (7,4 %) пацієнти без ознак стеатозу; у S1 — 8 (29,6 %) пацієнтів з 1 ступенем стеатозу; у групу S2 — 7 (25,9 %) пацієнтів з 2 ступенем стеатозу; у групу S3 — 10 (37,1 %) пацієнтів з 3 ступенем стеатозу.
Частота виявлення СНБР була вищою й становила 63,5 % у групах хворих із S2–S3 порівняно з цим показником (37,5 %) у групах хворих без стеатозу печінки та першим ступенем стеатозу (S0–S1) (рис. 2).
Середні значення показників концентрації Н2 у видихуваному повітрі хворих залежно від ступеня стеатозу показали, що середній рівень виділення Н2 у хворих із S3 перевищував порогове значення на 30 та 45 хв дослідження ((32,00 ± 1,19) ppm, (26,7 ± 2,2) ppm відповідно), що вірогідно відрізняло хворих цієї групи від групи S0 та свідчило про наявність СНБР.
За показниками еластометрії пацієнти були розподілені на 5 груп за ступенем фіброзу: F0–1 — 6 (22,2 %) хворих; F2 — 3 (11,1 %); F3 — 7 (26,0 %) та F4 — 11 (40,7 %) хворих. За частотою різного ступеня фіброзу за групами вірогідних відмінностей не виявлялось.
Аналіз частоти виявлення СНБР залежно від ступеня фіброзу показав, що вірогідні зміни у стані мікрофлори тонкої кишки спостерігались у більшої кількості хворих із зростанням ступеня фіброзу (відповідно у 85,7 % хворих із F3 та у 63,6 хворих із F4).
Були вивчені особливості гістоструктури печінки залежно від стадії фіброзу та патогістологічних особливостей стеатозу печінки у хворих на хронічні дифузні захворювання печінки, отримані при виконанні трепанбіопсії печінки під УЗД-наведенням.
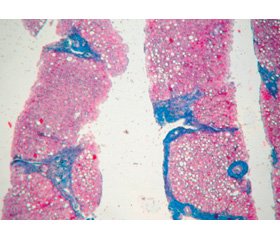
Для гістологічного дослідження було представлено 3 стовпчики тканини, що містять від 4 до 6 портальних трактів. Усі хворі були обстежені за протоколом, спеціально розробленим в лабораторії патоморфології ДУ «Інститут гастроентерології НАМН України». Були вивчені структурні зміни печінки, що найбільш точно описують прогресування фіброзу та активності гепатиту при ХДЗП. Розподіл усіх випадків за ступенем активності та стадією фіброзу (згідно з Metavir) показав для І групи септування та широкий спектр активності від незначної до вираженої (рис. 3А), для ІІ групи — багаточисленні фіброзні септи та помірну активність гепатиту (рис. 3Б).
З метою вивчення впливу запальної реакції на розвиток жирової дистрофії залежно від етіологічного фактора було проаналізовано характерні гістологічні ознаки запального процесу в досліджуваних групах. Отримані дані наведені в табл. 2.
Виходячи з даних табл. 2, помірна інфільтрація портальних трактів зустрічалася вірогідно частіше — у 41,7 % випадків при ХГС проти 26,7 % випадків при АХП, лімфоїдні фолікули зустрічались вірогідно частіше також при ХГС (25,0 % порівняно з 13,3 % відповідно).
Для групи І були характерні найбільш виражені показники запалення та активності гепатиту: інфільтрація портальних трактів від помірної до вираженої, інтрачасточкова інфільтрація, вогнища некрозу гепатоцитів (рис. 4). Треба зазначити, що збільшення кількості лімфоїдних фолікулів, що є вірогідною ознакою персистенції ХГС, вірогідно частіше зустрічалось в цій групі (порівняно з 13,3 % при АХП).
У групі ІІ спостерігалися найбільш помітні зміни гістологічної будови за рахунок запалення (виражена інфільтрація портальних трактів в цій групі переважала над помірною або незначною (33,3 %), у чверті випадків до неї приєднувалася інтрачасточкова інфільтрація). Гідропічна дистрофія гепатоцитів зустрічалася частіше, ніж при ХГС (80,0 % порівняно з 50,0 %), але її поширеність значно варіювала.
Важлива відмінність між досліджуваними групами була виявлена за характером, ступенем та локалізацією ліпідних крапель, що свідчить про розбіжність деяких механізмів накопичення ліпідів в гепатоцитах (табл. 3).
Виходячи з даних табл. 3, в групах І та ІІ переважав стеатоз 1 ступеня. За характером поширеності мікровезикулярний стеатоз вірогідно частіше спостерігався в ІІ групі (26,7 % порівняно з 8,3 % у І групі). Дрібнокрапельна жирова дистрофія вірогідно частіше спостерігалась у І групі (33,3 % порівняно з 20,0 % ІІ групи).
На відміну від цього для хворих І групи (рис. 5) була характерна жирова дистрофія, яка найчастіше супроводжувала помірне фіброзування та в більшості випадків являла собою осередки дрібнокрапельного або змішаного стеатозу, що розташовані всередині часточок і не зачіпають прикордонну пластинку. У деяких випадках дрібнокрапельну дистрофію доповнював також фокальний крупнокрапельний стеатоз (41,7 %) або мікровезикулярна жирова дистрофія (8,3 %).
Типова морфологічна картина у хворих ІІ групи характеризувалась в першу чергу значною дезорганізацією ліпідних включень (рис. 6).
Локалізація ліпідних крапель в часточці також може бути відмінною рисою перебігу ХГС з характерним розташуванням крапель по краю печінкової часточки (рис. 7А). В інших випадках ІІ групи ліпідні краплі були локалізовані групами ближче до центральної вени. На противагу цьому для АХГ найбільш характерним було хаотичне розташування крапель, особливо на тлі інтрачасточкової інфільтрації (рис. 7Б).
З метою об’єктивізації результатів було проведено послідовне морфометричне дослідження біоптатів із підрахунком індексу фіброзу, що показало у пацієнтів з ХГС його середнє значення до (0,01812 ± 0,06000), на відміну від хворих на АХП, у яких індекс фіброзу був вищим і становив (0,1266 ± 0,0130).
Аналіз отриманих результатів зареєстрував чіткий взаємозв’язок показників ВДТ та ІГА (табл. 4).
Встановлено чіткий взаємозв’язок показників ВДТ та ІГА у хворих I групи. При відсутності СНБР (рівень виділення водню менше 10 рpm) констатується мінімальний ступінь активності хронічного гепатиту, що відповідає ІГА 1–3 бали; слабовиражений ступінь ІГА (4–8 балів) був притаманний усім хворим на СНБР (з рівнем виділення водню більше 10 та 20 рpm); у 66,7 % хворих з помірним ступенем ІГА (9–12 балів) спостерігався СНБР (рpm > 20). Таким чином, можна припустити, що при ХГС рівень виділення водню адекватно відображує ступінь активності запального процесу в печінці.
З метою вивчення впливу порушення мікробіоти в тонкому кишечнику на розвиток жирової дистрофії залежно від етіологічного фактора було проаналізовано співвідношення гістологічних показників прогресування стеатозу із показниками ВДТ, що відображують дані табл. 5, 6.
Як видно з табл. 5, 6, у хворих на ХГС із прогресуванням стеатозу збільшується кількість випадків СНБР, і навпаки, у більшості хворих із АХП, які мали гістологічно підтверджений мікровезикулярний та дрібнокрапельний стеатоз печінки, виявляли при дослідженні ВДТ порушення мікробіоти у тонкому кишечнику.
Висновки
1. У хворих на ХДЗП СНБР був виявлений у 51,8 % випадків, вірогідно майже у 1,5 раза переважав у хворих на АХП (60,0 %) порівняно з хворими на ХГС, у яких тільки у 41,7 % виявлений СНБР. Відзначено переважання позитивних випадків ВДТ у групі S3 (70,0 %), що вірогідно відрізняло її від групи S1 (37,5 %). Із зростанням ступеня фіброзу зростає вдвічі кількість хворих на СНБР.
2. Для ХГС були характерні найбільш виражені показники запалення й активності гепатиту на тлі помірного фіброзування та дрібнокрапельного або змішаного стеатозу. У групі АХП типова морфологічна картина характеризувалась значною дезорганізацією ліпідних включень та помітними змінами гістологічної будови за рахунок як запалення, так і гідропічної дистрофії гепатоцитів.
3. У хворих на хронічний гепатит С виявлений чіткий взаємозв’язок між показниками водневого дихального тесту та індексом гістологічної активності, гістологічними показниками прогресування стеатозу печінки, крім того, було визначено, що із збільшенням активності запального процесу (9 балів) та ступеня стеатозу печінки (S3) зростає рівень порушень мікробіоти в тонкому кишечнику (> 20 ppm), тобто синдром надлишкового бактеріального росту негативно впливає на морфологічну картину.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Lonardo A., Bellentani S., Argo C.K. et al. Epidemiological modifiers of non-alcoholic fatty liver disease: Focus on highrisk groups. Dig. Liver Dis. 2015. Vol. 47. P. 997-1006.
2. Степанов Ю.М. Применение эссенциальных фосфолипидов для лечения жировой болезни печени. Гастроентерологія. 2016. № 4(62). С. 58-63.
3. Диденко В.И. Современные достижения в оценке стеатоза печени. Гастроентерологія. 2015. № 3(57). С. 94-100.
4. Маев И.В., Кучерявый Ю.А., Андреев Д.Н., Ивашкин Н.Ю. Синдром избыточного бактериального роста в тонкой кишке: клиническое значение, критерии диагностики и терапевтическая тактика. Инфекционные болезни: новости, мнения, обучение. 2016. № 3. С. 118-125.
5. Маевская Е.А., Черемушкин С.В., Кривобородова Н.А., Кучерявый Ю.А. Синдром избыточного бактериального роста в тонкой кишке: от последних научных данных к рутинной практике. Клинические перспективы гастроэнтерологии и гепатологии. 2015. № 5. С. 29-40.
6. Жаркова М.С., Маевская М.В., Ивашкин В.Т. Влияние синдрома избыточного бактериального роста и бактериальной транслокации на течение заболевания у больных циррозом печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2012. Т. 22, № 5. С. 56-63.
7. Compare D. et al. Gut-liver axis: the impact of gut microbiota on non alcoholic fatty liver disease. Nutr. Metab. Cardiovasc. Dis. 2012 Jun. Vol. 22, № 6. P. 471-476.
8. Еремина Е.Ю. Лекарства и печень: неизменный тандем. Архив внутренней медицины. 2012. № 2(4). С. 60-64.
9. Sachdev A.H., Pimentel М. Gastrointestinal Bacterial Overgrowth Pathogenesis and Clinical Significance. Ther. Adv. Chronic Dis. 2013 Sep. Vol. 4, № 5. P. 223-231.
10. Quigley E.M. Small Intestinal Bacterial Overgrowth: What It Is and What It Is Not. Current Opinion in Gastroenterology. 2014 Mar. Vol. 30, № 2. P. 141-146.
11. Claesson M.J. et al. Gut microbiota composition correlates with diet and health in the elderly. 2012 Aug. Vol. 488. P. 178-184.
12. Quigley E.M., Stanton С., Murphy E.F. The gut microbiota and the liver. Pathophysiological and clinical implications. Journal of Hepatology. 2013 May. Vol. 58, № 5. P. 1020-1027.
13. Сапожников А.Г., Доросевич А.Е. Гистологическая и микроскопическая техника. Смоленск: САУ, 2000. 476 с.
14. Донцов Д.В., Амбалов Ю.М., Васильева В.В. Оценка степени активности хронического гепатита С. Современные проблемы науки и образования. 2011. № 6.
15. Жданов К.В., Гусев Д.А., Захаренко С.М., Козлов К.В. и др. Синдром избыточного бактериального роста у больных хроническим гепатитом С. Журнал инфектологии. 2011. Т. 3, № 4. С. 98-101.
16. Ledochowski М. Hydrogen Breath tests. — Инсбрук: Изд-во «Akademie», 2008. 20 с.
17. Gasbarrini А., Corazza G.R., Gasbarrini G., Montalto M. 1st Rome H2 Breath Testing Consensus Conference Working Group. Methodology and indications of H2 breath testing in gastrointestinal diseases: the Rome Consensus Conference. Aliment. Pharmacol. Ther. 2009. 20 р.
18. Rana S.V., Malik А. Hydrogenbreath tests in gastrointestinal diseases. Indian J. Clin. Biochem. 2014. Vol. 29(4). Р. 398-405.
19. De Ledinghen V., Vergniol J. et al. Non-invasive diagnosis of liver steatosis using controlled attenuation parameter (CAP) and transient elastography. Liver Int. 2012. Vol. 32(6). P. 911-918.

/31-1.jpg)
/31-2.jpg)
/32-1.jpg)
/32-2.jpg)
/33-1.jpg)
/33-2.jpg)
/34-1.jpg)
/35-1.jpg)