Журнал "Гастроэнтерология" Том 53, №4, 2019
Вернуться к номеру
Значення екстрацелюлярних везикул у патогенезі та діагностиці неалкогольної жирової хвороби печінки (огляд літератури)
Авторы: Степанов Ю.М., Лук’яненко О.Ю.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Екстрацелюлярні везикули (ЕВ) — це невеликі мембранні везикули, що виділяються клітинами в позаклітинне середовище. ЕВ являють собою полікомпозиційні комунікаційні молекули й можуть впливати на низку цільових клітин в оточуючому їх клітинному середовищі, а також мати дистанційну дію. У даний час ЕВ розглядаються як високочутливі біомаркери хронічних захворювань печінки. У статті наведений огляд сучасних літературних даних щодо ролі ЕВ у патогенезі неалкогольної жирової хвороби печінки (НАЖХП), а також діагностичного значення ЕВ у розрізі НАЖХП. Розглянуті питання класифікації, будови ЕВ, описані молекули, що входять до складу ЕВ. Увага приділена особливостям ідентифікації ЕВ у сироватці крові. У статті продемонстровано, що в прогресуванні НАЖХП мають значення як ЕВ, що походять із гепатоцитів, так і екстрагепатичні та бактеріальні ЕВ. Показано, що значення ЕВ при НАЖХП не обмежується формуванням дисметаболічних змін, а включає розвиток запалення та фіброзу печінки. З іншого боку, ЕВ можуть використовуватися як транспортери екзогенних молекул РНК до клітин печінки. EВ-асоційовані ncRNA впевнено визнаються як важливі регулятори біологічних процесів як у фізіологічних, так і в патологічних умовах.
Экстрацеллюлярные везикулы (ЭВ) — это небольшие мембранные везикулы, выделяемые клетками во внеклеточную среду. ЭВ представлюют собой коммуникационные молекулы и могут влиять на целый ряд целевых клеток в окружающей их клеточной среде, а также могут оказывать дистанционное действие. ЭВ рассматриваются в качестве высокочувствительных биомаркеров хронических заболеваний печени. В статье приведен обзор современных литературных данных о роли ЭВ в патогенезе неалкогольной жировой болезни печени (НАЖБП), а также диагностическом значении ЭВ в разрезе НАЖБП. Рассмотрены вопросы классификации ЭВ, строение ЭВ, описаны молекулы, входящие в состав ЭВ. Уделено внимание особенностям идентификации ЭВ в сыворотке крови. Подробно рассмотрены вопросы роли ЭВ в формировании и развитии НАЖБП. В cтатье показано, что в прогрессировании НАЖБП имеют значение как ЭВ, происходящие из гепатоцитов, так и внепеченочные и бактериальные ЭВ. Показано, что значение ЭВ при НАЖБП не ограничивается формированием дисметаболических изменений, а включает развитие воспаления и фиброза печени. С другой стороны, ЭВ могут использоваться в качестве транспортеров экзогенных молекул РНК в клетки печени. ЭВ-ассоциированные ncRNA уверенно признаются в качестве важных регуляторов биологических процессов как в физиологических, так и в патологических условиях.
Extracellular vesicles (EVs) are small membrane vesicles that are secreted by cells into the extracellular environment. EVs are cell-produced communication molecules that can affect a range of target cells in their cellular environment and may also have a long-range effect. Currently, EVs are considered to be highly sensitive biomarkers of chronic liver diseases. The article gives an overview of the current literature on the role of EVs in the pathogenesis of non-alcoholic fatty liver disease (NAFLD), as well as the diagnostic value of EVs in the context of NAFLD. The article deals with the classification of EVs, the structure of EV, describes molecules that make up EV. Attention is paid to the issues of EV identification in the blood serum. The role of EV in the formation and progression of NAFLD is discussed in detail. The article demonstrates that progression of NAFLD is associated with EVs derived from hepatocytes, as well as extrahepatic and bacterial EVs. It is shown that the value of EV in NAFLD is not limited to the formation of dysmetabolic changes, but includes the development of inflammation and liver fibrosis. On the other hand, EVs can be used as transporters of exogenous RNA molecules to the liver cells. EV-associated ncRNAs are confidently recognized as important regulators of biological processes in both physiological and pathological conditions.
екстрацелюлярні везикули; біомаркери; хронічні захворювання печінки
экстрацеллюлярные везикулы; биомаркеры; хронические заболевания печени
extracellular vesicles; biomarkers; chronic liver disease
Вступ
Останнє десятиріччя характеризується бурхливим розвитком неінвазивних методів діагностики, проте досі біопсія печінки залишається золотим стандартом оцінки тяжкості ураження, наявності запалення та фіброзу при хронічних захворюваннях печінки. При курації пацієнтів із неалкогольною жировою хворобою печінки (НАЖХП) біопсія є вкрай важливим інструментом, на сьогодні вона найнадійніший метод диференціальної діагностики простого стеатозу та стеатогепатиту [1].
Актуальним залишається питання пошуку чутливих та специфічних біомаркерів, які могли б допомогти вдосконалити підходи до діагностики та моніторингу прогресування/регресії захворювання в клінічних умовах. Як претенденти на роль високочутливих біомаркерів у діагностиці хронічних захворювань печінки в даний час розглядаються екстрацелюлярні везикули (ЕВ).
ЕВ — це невеликі мембранні везикули, що виділяються клітинами в позаклітинне середовище. ЕВ являють собою комунікаційні молекули, що продукуються клітинами та можуть впливати на низку цільових клітин в оточуючому їх клітинному середовищі, а також можуть чинити віддалену дію [2]. Cклад ЕВ демонструє їх клітинне походження і в той же час може відображати специфічний процес у клітині, що індукував формування та вивільнення ЕВ. ЕВ транспортують різноманітні біоактивні молекули, у тому числі ДНК, мРНК, мікроРНК, білки та ліпіди, що регулюють різні клітинні реакції [3].
Історична довідка
Номенклатура, що використовується для ЕВ, ускладнюється непослідовним використанням термінів, що мають різні значення для певних груп молекул. Альберт Клод вперше зазначив вивільнення везикул, що містять РНК, у 1938 р. Інші дані щодо ЕВ були описані Вольфом як «пил» тромбоцитів у 1967 р., як «кальцифікуючі матричні везикули» — Андерсоном у 1969 р. [4]. Перше вживання терміна «екзосома» Trams et al. (1981) стосувалося везикул без обмежень за розміром. Однак надалі ним позначали везикули, звільнені від мультивезикулярних тіл, відповідно до досліджень Хардінга та співавт. (1983) [5]. Згодом обмеження розміру та біогенез зазвичай використовувалися для диференціації екзосом від інших ЕВ [4].
Класифікація
ЕВ можна загалом класифікувати за розмірами та способом біогенезу з виділенням трьох основних категорій [2].
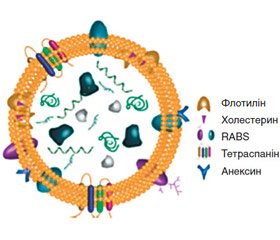
1. Екзосоми, що мають розмір приблизно 30–100 нм і походять із внутрішньоклітинних везикул [6]. При злитті ендоцитарних пухирців, що опосередковане комплексом ендосомного сортування, відповідальним за транспорт (ESCRT), утворюються мультивезикулярні тільця (MB) [8]. MB можуть деградувати під дією лізосом або вивільняти інтралюмінальні везикули шляхом злиття з плазматичною мембраною, опосередкованого Rab GTPases. Екзосоми збагачені маркерами — CD81, CD63 та CD9 [7] (рис. 1).
2. Ектосоми (мікровезикули) мають розмір приблизно 100–1000 нм і вивільняються при зовнішній бутонізації та розщепленні плазматичної мембрани й при подальшому вивільненні везикул у позаклітинний простір у процесі, залежному від активації каспази та кінази стресу. Мікровезикули можуть бути позитивними для CD81, CD63 та анексину V [8] (рис. 2).
3. Апоптотичні тіла походять від мембранного розшарування з клітин, які перебувають у запрограмованій загибелі. Вони неоднорідні за розміром, діаметром від 200 до 5000 нм, збагачені анексином V [2] (рис. 3).
Склад
Зростаюча кількість досліджень свідчить про ключову патофізіологічну роль ЕВ у різних станах печінки, включаючи запалення і фіброгенез, зокрема при таких нозологіях, як неалкогольний стеатогепатит (НАСГ) та алкогольна хвороба печінки [10].
ЕВ потрапляють у системний кровообіг і зберігають надзвичайну стабільність у цьому середовищі. Відповідно, у даний час припускають, що кількісна оцінка ЕВ може являти собою нову форму «рідинної біопсії» печінки.
До складу ЕВ входять білки (тетраспаніни — CD9, CD63, CD81, CD82; рецептори, включаючи рецептор епідермального фактора росту (EGFR), білки адгезії, транспортери та канали, білки, пов’язані з транспортом везикул, білки цитоскелета та цитозолітичні білки — Alix та Tsg101, GTPases, Flotillin та Annexins), ліпіди (сфінгомієлін, фосфатидилхолін, фосфатидилетаноламін, фосфатидилсерин) та нуклеїнові кислоти (месенджерна РНК (мРНК), мікроРНК (міРНК), рибосомальна РНК (рРНК), транспортна РНК (тРНК), мітохондріальна ДНК (мтДНК)) [2].
Білки
Анексин
ANXA1 — перший охарактеризований член родини анексинів, Ca2+-залежний фосфоліпід-зв’язуючий білок, що бере участь у численних фізіопатологічних процесах. ANXA1 відомий як один із медіаторів клітинної рухливості, оскільки він бере участь в організації мембрани й цитоскелета [11]. Цей білок відіграє важливу роль у внутрішньоклітинному транспорті екстрацелюлярних везикул, опосередковуючи взаємодію везикул з ESCRT [12]. Анексин VII був першим анексином, виявленим під час вивчення білків, що сприяють контакту та синтезу гранул хромафіну. Однак дослідження in vitro показали, що анексин VII не сприяє злиттю мембран, а лише тісному приєднанню одна до одної [13].
Анексин VI бере участь у бутонізації мембрани, тоді як анексин II бере участь як в інтерналізації холестеринових ефірів, так і в біогенезі мультивезикулярних ендосом.
Анексини можуть функціонувати як будівельні білки, забезпечуючи прикріплення інших білків до клітинної мембрани. Анексини збираються у вигляді тримерів. Утворення тримеру сприяє надходженню кальцію та ефективному формуванню, що призводить до утворення мембранозв’язаних анексинових мереж. Ці мережі можуть індукувати брунькування пухирців під час екзоцитозу [12].
Анексин А-V забезпечує стабілізацію змін форми клітин під час ендоцитозу та екзоцитозу. Крім того, показано, що анексини A-I та A-II зв’язують PIP2 (фосфатидилінозитол-4,5-бісфосфат) у клітинній мембрані та полегшують збірку актину біля мембрани [13].
Флотилін
Флотилін-1 та флотилін-2 є мембран-асоційованими білками, що мають ключове значення у функціонуванні різних сигнальних шляхів, ендоцитозі та формуванні цитоскелета. Флотиліни здатні збиратись у дискретні мікродомени плазматичної мембрани. Таким чином, флотиліни можуть фасилітувати компартменталізацію та функціональну спеціалізацію мембранних структур [14].
Тетраспанін
Тетраспаніни — білкова надродина, що відповідає за організацію мембранних мікродоменів, утворюючи кластери та взаємодіючи з великим різноманіттям трансмембранних та цитозольних сигнальних білків [15]. Серед тетраспанінів тетраспаніни CD9, CD63, CD81, CD82 та CD151 мають широкий розподіл тканин, а інші обмежуються певними тканинами, наприклад Tssc6, CD37 та CD53 у кровотворних клітинах. Дослідження за допомогою імуноелектронної мікроскопії показали, що тетраспаніни широко представлені на різних видах ендоцитарних мембран, а також використовуються як екзосомні маркери [16].
RAB
RAB GTPases контролюють ендоцитарні та секреторні шляхи, використовуючи конкретні ефекторні білки на мембранній поверхні для руху, або збирання, або стикування пухирців на мембранах.
Родина RAB малих гуанозинтрифосфатаз (GTPases) контролює внутрішньоклітинний везикулярний обіг. Кілька типів GTPases, включаючи RAB11, RAB35, RAB27A та RAB27B, відіграють важливу роль у вивільненні екзосом. Ці білки RAB допомагають приєднатися до плазматичної мембрани МВ, що необхідно для остаточного злиття двох мембран, що дозволяє вивільнити екзосоми з МВ.
Інтегрини
Інтегрини — це трансмембранні гетеродимерні клітинні рецептори, що взаємодіють із позаклітинним матриксом та передають різні міжклітинні сигнали. Від функціонування цих білків залежить форма клітини, її рухливість, регулювання клітинного циклу.
Структурно інтегринові рецептори являють собою облігатні гетеродимери — кожний складається з однієї альфа- та однієї бета-субодиниці. Альфа-субодиниці визначають специфічність інтегрину до ліганду, а бета-субодиниці пов’язані з компонентами цитоскелета та забезпечують передачу сигналу в клітині. Інтегрини постійно присутні у клітині, проте для їх зв’язування необхідна їх активація.
Ванін
Ванін-1 (VNN1) є ектоензимом з активністю пантетеїнази [19]. Основна його функція пов’язана з активністю його пантетеїнази: ванін-1 розщеплює пантетеїн на цистеамін і пантотенову кислоту, що є попередником коферменту А. Дійсно, його фізіологічна роль здається пов’язаною з метаболізмом коензиму А, метаболізмом ліпідів та виробленням енергії. Останніми роками в багатьох дослідженнях з’ясовано роль ваніну-1 у фізіологічних умовах щодо оксидативного стресу та запалення. Було виявлено, що ферментативна активність ваніну має ключове значення при певних захворюваннях. Як у мишей, так і в печінці людини ванін-1 експресується на рівні генів та білка [19, 20].
Ванін-1 експресується гепатоцитами, зокрема центролобулярними гепатоцитами в зоні 3, що прилягає до центральної вени. Ці гепатоцити беруть участь у метаболізмі ліпідів та ксенобіотиків [19]. Обидва процеси регулюються активацією PPAR-α. Зв’язок між стеатозом та експресією ваніну-1 може бути пояснений посиленою активацією PPAR-α після голодування та подальшою транскрипцією його цільових генів у печінці зі стеатозом. VNN1 бере участь в адгезії та міграції клітин, ідентифікується як поширений поверхневий білок у печінкових ЕВ, функціональні дослідження показують, що проангіогенний вплив мікрочастинок вимагає інтерналізації ендотеліальних клітин у процесі, залежному від VNN1 та ліпідів.
Некодуюча РНК
Відомо, що незахищені некодуючі РНК (ncRNA) легко руйнуються РНКазами в крові. Однак ЕВ можуть захищати ncRNA від деградації та підтримувати їх цілісність та активність. За даними ExoCarta (база даних ідентифікованих екзосом), 4563 білки, 194 ліпіди, 1639 мРНК та 764 міRNA було ідентифіковано в екзосомах, які були вивільнені з різних клітин [21] (рис. 4).
Хоча ncRNA не в змозі кодувати білок, ці молекули виконують специфічну біологічну функцію — регулювання експресії білків та мРНК генів-мішеней, ncRNA зазвичай діляться на два основні класи відповідно до їх розміру:
— довгі ncRNA (lncRNA > 200 нуклеотидів) [21];
— короткі ncRNA (< 200 нуклеотидів), наприклад міРНК, ендогенна мала інтерферуюча РНК (siRNA) і piwi-взаємодіюча РНК (piRNA) [20–22].
Довгі некодуючі види
Довгі некодуючі види (lncRNA) — це молекули РНК довжиною > 200 нуклеотидів [24].
З огляду на близкість до білок-кодуючих генів lncRNAs можуть бути поділені на 4 категорії:
— смислові lncRNAs;
— антисмислові lncRNAs;
— бінаправлені, або дивергентні, lncRNAs;
— інтергенні lncRNAs [24].
Завдяки комлексним властивостям lncRNA може взаємодіяти з ДНК, РНК і/або білком. Функція lncRNA асоційована з клітинною локалізацією. Так, ці молекули можуть впливати на архітектуру хроматину через взаємодію з хроматімуномодулюючими білками, впливаючи на транскрипційну активність [26].
У цитоплазмі lncRNAs можуть зв’язуватись із рибосомами. В одному дослідженні встановлено, що lncRNAs може виступати як молекулярна пастка для білків або miRNAs. LncRNAs працює як «губка» для miRNAs, модулюючи зв’язування однієї або кількох miRNAs [27].
LncRNAs продемонстрували важливу роль у патогенезі захворювань печінки. Дисрегуляція lncRNA-MALAT1-експресії асоційована із запаленням та фіброзом при НАСГ. MEG3-рівень був знижений при Ccl4-індукованому фіброзі в експериментальних тварин.
Більшість lncRNAs в ЕВ мають специфічний патерн експресії на різних стадіях та при різному ступені ураження печінки. У даний час перспективним напрямком є вивчення вмісту lncRNA для діагностики гепатоцелюлярної карциноми. Дослідження рівня LINC00152, XLOC014172 і RP11-160H22.5 у плазмі крові має важливе значення у диференціальній діагностиці гепатоцелюлярної карциноми, хронічного гепатиту та цирозу печінки [28].
Короткі ncRNA та mіRNA
Короткі некодуючі РНК мають довжину менше ~28 нуклеотидів, із яких мікроРНК (miRs) є найбільш вивченою категорією. MiRNA, як правило, націлені на 3’RR мРНК, індукуючи її деградацію або ж блокування трансляції. MiRs відіграють важливу роль у різноманітних біологічних процесах, у тому числі розвитку, диференціюванні, метаболізмі та загибелі клітин [21]. Некодуючі РНК вивільняються в позаклітинний простір, де вони захищені від деградації або асоціацією з різними білками, такими як родина Ago2, або у межах ЕВ [22].
МіRNA, такі як miR-145 та miR-122, є найбільш вивченими молекулами, описаними в літературі, починаючи з ncRNA lin-4 у C. elegans, що був описаний у 1993 р. MiRNA — це широкий клас ендогенних коротких ncRNA, які мають довжину приблизно 22 нуклеотиди і можуть регулювати експресію генів за допомогою сайленсингу або в результаті посттранскрипційної дії [29]. MіРНК орієнтовані на багато генів та залучені в регуляцію проліферації клітин, їх диференціацію, міграцію, апоптоз та модуляцію відповіді на вірусне навантаження.
Циркулююча ДНК
Циркулююча ДНК (cell free DNA (cfDNA)) була вперше описана в 1948 р. У даний час відомо, що cfDNA мають розмір приблизно 180 пар нуклеотидів. Джерелом cfDNA можуть бути клітини, що зазнали апоптозу. Іноді ідентифікуються фрагменти більшої або значно меншої довжини, що свідчить про внесок некрозу у формування загального пулу cfDNA.
Раніше вважалося, що високий рівень cfDNA у крові є показником пухлинного росту, проте зараз доведено, що ці молекули мають діагностичне значення при широкому спектрі патологічних станів, зокрема при автоімунних захворюваннях.
Значення cfDNA можна описувати такою епігенетичною характеристикою, як метильованість. Метилювання ДНК є дуже специфічним для різних типів клітин. При розвитку та прогресуванні патології печінки патерн метилювання ДНК змінюється. Виділення метильованої cfDNA із загиблих гепатоцитів або інших клітин печінки дає можливість відстежити ступінь фіброзу [21].
Hardy та співавт. продемонстрували, що метилювання cfDNA у промоторі гена PPARγ у плазмі пацієнта корелює зі стадією фіброзу. CpG-метилювання сягало найвищих рівнів у пацієнтів із морфологічно доведеним тяжким фіброзом печінки. Джерелом cfDNA, що виражається у вищому CpG-метилюванні промотору гена PPARγ, як вважають, є вузли гепатоцитів, а не тканини, багаті на міофібробласти. Вважається, що cfDNA може мати значення у виявленні пухлин на найбільш ранніх стадіях онкогенезу [29].
Ідентифікація
Для виявлення та кількісної оцінки складу ЕВ доступні декілька методів. Першим кроком є ретельне очищення ЕВ від інших розчинних факторів, присутніх у сироватці.
Методи очищення, що використовуються в даному випадку, включають ультрацентрифугування, центрифугування в градієнті щільності, ексклюзійну та афінну хроматографію [21].
Розмір циркулюючих ЕВ може бути охарактеризований за допомогою трансмісійної електронної мікроскопії, аналізу динамічного розсіювання світла, аналізу відстеження наночастинок (NTA) та проточної цитометрії (FC).
Більше того, NTA та FC також можуть вимірювати концентрацію ЕВ, що важливо в контексті діагностики конкретної патології [21].
ЕВ є полікомпозиційними молекулами, тому аналіз їх складу є надзвичайно важливим етапом. Відомо, що ЕВ складаються з ліпідів, РНК та білків. Ідентифікація білкового складу ЕВ доступна за допомогою імуноферментного аналізу, вестерн-блот-аналізу та таргетної протеоміки/мас-спектрометрії. Уміст РНК можна дослідити, використовуючи полімеразну ланцюгову реакцію, мРНК-секвенування та міРНК-секвенування. Уміст ліпідів ЕВ може бути досліджений за допомогою ліпідоміки/мас-спектрометрії [2, 20].
Роль ЕВ у патогенезі НАЖХП
Печінка сама по собі є джерелом ЕВ, проте також реагує на екзосоми/мікровезикули, що виділяються з інших тканин або самої печінки. Низка органів передають до печінки протизапальні/профіброзні сигнали через ЕВ. Недавні дослідження показали, що первинні та імморталізовані гепатоцити здатні продукувати й вивільняти як екзосоми, так і МВ [3]. ЕВ утворюються й вивільняються під час накопичення ліпотоксичних ліпідів у гепатоцитах, що є ключовим механізмом ураження печінки та прогресування хвороби [25]. Останні дані свідчать про те, що адипоцити вісцеральної жирової тканини формують екзосоми, які містять медіатори, здатні активувати запальні та фіброзні сигнальні шляхи [31].
Можна виділити такі шляхи впливу печінкових ЕВ на перебіг НАЖХП:
— профіброгенна сигналізація та ангіогенез;
— індукція прозапального фенотипу макрофагів;
— вплив позапечінкових ЕВ;
— вплив бактеріальних ЕВ.
Профіброгенна сигналізація та ангіогенез
Кілька досліджень повідомляли, що ЕВ також регулюють фіброз печінки за допомогою паракринного шляху. Гепатоцити зв’язуються з зірчастими клітинами печінки (HSC) за допомогою системи ЕВ, унаслідок наявності ліпотоксичності в гепатоцитах сигналювання ЕВ має профіброгенний характер [33]. Горизонтальний профіброгенний зв’язок сигналу між зірчастими клітинами та зв’язок між міофібробластами печінки й клітинами ендотелію печінки також відбувається через систему ЕВ [34].
Як відомо, фактор росту сполучної тканини (CTGF) виступає промотором фіброгенезу в печінкових зірчастих клітинах. MiR-214 може бути специфічно направленим на 30-UTR-регіон CTGF в активованих HSCs.
ЕВ, що виділені з HSCs, містять miR-214, можуть пригнічувати активність 30-UTR-регіону CTGF та інгібувати експресію CTGF. У той же час CTGF також може входити до складу ЕВ та бути перенесеним між HSCs, що призводить до збільшення вмісту гладком’язової тканини в HSCs [33]. ЕВ, виділені з гепатоцитів, регулюють функціонування HSCs також через miR-128-3p, що направлений на ген PPAR. Подальші дослідження продемонстрували, що miR-128-3p виступає як центральний регулятор ефектів ЕВ на активацію HSCs та інгібування гена PPAR, що провокує активацію зірчастих клітин та, у свою чергу, індукує фіброз печінки [34]. Також відомо, що miR-145 може гальмувати активацію HSCs, впливаючи на ZEB2 через Wnt/β-катенін-шлях.
Низький рівень let-7 у ЕВ може впливати на печінковий фіброгенез через активацію трансформуючого фактора росту бета в HSCs.
При вивченні експериментальної моделі НАЖХП виявлено, що циркулююча miR-122 збагачується ЕВ-фракцією у плазмі крові, її рівень корелює з гістологічними ознаками тяжкості захворювання [30]. Експресія miRNA-122 та miRNA-192 була збільшена в циркулюючих екзосомах при прогресуванні НАЖХП порівняно з пацієнтами з ранніми стадіями НАЖХП.
Виявлено, що у плазмі пацієнтів зі значним фіброзом печінки підвищена експресія miRNA-451a та miRNA-142-5p порівняно з пацієнтами, які не мають фіброзу або мають легкий фіброз, тоді як експресія Let-7f-5p знижена [32].
Сантангело та співавт. було ідентифіковано один із молекулярних механізмів сортування miRNA печінкових екзосом [23], що відкриває новий напрямок у терапії НАЖХП та НАСГ.
Майбутні дослідження, що стосуються зміни як концентрації, так і компартменталізації циркулюючих miRNA та можливого виникнення диференційованої композиції циркулюючої мікроРНК при різних формах захворювань печінки, можуть істотно впливати на розвиток ЕВ-асоційованих мікроРНК як біомаркерів хвороби печінки
Насичені вільні жирні кислоти можуть призводити до виділення проангіогенних ЕВ. Ангіогенез відіграє центральну роль у хронічних захворюваннях печінки та може бути залучений у прогресування стеатозу печінки. Слід зазначити, що ЕВ, які вивільняються гепатоцитами в пацієнтів із НАЖХП, збагачені ваніном-1. VNN1 відповідає за інтерналізацію печінкових ЕВ до печінкових зірчастих клітин, що, у свою чергу, стимулює профібротичні процеси [24]. Велика кількість гепатогенних ЕВ виявляється у крові експериментальних тварин при індукованому дієтою стеатогепатиті, а кількість ЕВ корелює із ступенем тяжкості захворювання [25]. Таким чином, VNN1-позитивні ЕВ є привабливою потенційною мішенню для розробки нових антиангіогенних терапевтичних стратегій у лікуванні НАСГ, а також як неінвазивний біомаркер ураження печінки.
Інтегрин β1 (ITGβ1) відіграє ключову роль у прогресуванні стеатогепатиту. ITGβ1 вивільняється з інфільтрованих жиром гепатоцитів як вантаж ЕВ й опосередковує адгезію моноцитів до клітин синусоїдального ендотелію печінки, що є важливою стадією при печінковому запаленні. В експериментальній моделі НАСГ блокування ITGβ1 зменшує запалення печінки та її фіброз [18]. Отже, інгібування ITGβ1 може послужити новою терапевтичною стратегією для НАСГ.
Аналіз вмісту ЕВ у мишей в експериментальній моделі НАСГ виявив декілька білків, присутніх лише в ЕВ та збагаченні білків, пов’язаних з НАСГ, як ті, що беруть участь у клітинному стресі, загибелі клітин та ангіогенезі, порівняно з контрольними [25].
Індукція прозапального фенотипу макрофагів
Гепатоцити, інфільтровані жиром, можуть продукувати ЕВ, збагачені CXCL10 (CXCL10 є хемоатрактантом макрофагів), що призводить до рекрутування та активації макрофагів [26].
Активація рецепторів смерті DR5 під впливом лізофосфатидилхоліну (інтрацелюлярного метаболіту насиченої пальмітинової кислоти) призводить до вивільнення ЕВ із гепатоцитів і може спричиняти активацію запального фенотипу макрофагів. Показано, що вивільнення ЕВ знижується при інактивації медіаторів сигнального шляху DR5 або інгібуванні Rho-асоційованої протеїнкінази 1 (ROCK1). Установлено, що інгібування ROCK1 у мишей із НАСГ призводить до зниження рівня циркулюючих ЕВ та зменшення ураження печінки — запалення та фіброзу [26].
Мартінес та співавт. виявили, що рівень циркулюючої інкапсульованої мітохондріальної ДНК (mtDNA) у гепатогенних ЕВ збільшується в пацієнтів із НАСГ. Продемонстровано, що капсульована мтДНК в ЕВ опосередковувала активацію макрофагів за допомогою Toll-like рецептора 9 (TLR9) [27]. Ці дані розкривають нові терапевтичні можливості щодо НАЖХП та НАСГ.
Роль ЕВ позапечінкового походження та непаренхіматозних клітин печінки
Непаренхіматозні клітини та інфільтровані запальні клітини в печінці можуть бути ще одним важливим джерелом ЕВ, що сприяють ураженню печінки [34].
Корнек та співавт. спостерігали, що ЕВ Т-клітин регулюють процеси фіброгенезу в печінці [35]. Також відомо, що ЕВ, виділені в пацієнтів, які страждають від ожиріння, викликають порушення регуляції шляху TGF-β, що пов’язаний із фіброзом печінки [36].
Лемойнн та співавт. демонструють, що EV-похідні з міофібробластів виділяють проангіогенний фактор, фактор росту судинного ендотелію A (VEGF-A), що призводить до активації ендотеліальних клітин та тубулогенезу за допомогою рецептора VEGF-A [37].
Активовані CD4+ та CD8+ T-клітини за допомогою ЕВ переносять молекули, такі як CD147, у HSCs, що призводить до підвищення рівня фібролітичних молекул [38]. Гіпертрофовані адипоцити виділяють велику кількість ЕВ, які діють як хемоатрактант для макрофагів у жировій тканині. Ці ЕВ вивільняються й можуть бути виявлені в експериментальних моделях стеатозу печінки. Цікаво, що введення ЕВ від мишей з ожирінням до здорових мишей призводило до гострого запалення в печінці. Зокрема, рівень ЕВ-похідних від адипоцитів був значно підвищений у людей з ожирінням, що показало сильну кореляцію з рівнем інсуліну та HOMA-IR [38].
Екстрацелюлярні бактеріальні везикули
Велика кількість молекул бактерій, включаючи нуклеїнові кислоти, білки, фосфоліпіди, гліколіпіди і полісахарид, присутні в ЕВ, що екскретуються представниками мікробіоти (EVs) [39]. EVs відіграють важливу біологічну роль не тільки у виживанні бактерій через передачу факторів вірулентності та знешкодження поживних речовин, а й у взаємодії між господарем і бактеріальними компонентами або метаболітами, які регулюють численні сигнальні шляхи в клітинах господаря. Бактеріальні ЕВ, які надходять до системної циркуляції, такі як нанорозмірні мембранні частинки, можуть індукувати кілька метаболічних каскадів та імунологічні відповіді в різних органах. Наприклад, дослідження Tulkens et al. [40] показало, що пацієнти з порушенням проникності кишечника демонструють підвищення системного рівня LPS-позитивних бактеріальних екстрацелюлярних везикул. Це спостереження свідчить про те, що ендотоксин здатний змінювати біологічну функцію господаря через його присутність у складі ЕВ. Бактеріальні клітини переносять LPS за допомогою EVs у цитозоль сигналізацією TLR4-TRIF GBP (білки, що зв’язують гуанілат) [42]. Інші медіатори рецепторів включають TLR2, NOD1 та NOD2. ЕВ можуть регулювати перебіг НАЖХП за допомогою комунікації з клітинами Купфера, зірчастими клітинами та гепатоцитами. Коротка РНК (сРНК) бактеріальних ЕВ може вивільнятися з метою впливу на біологічні функції господаря [41]. Отже, представники мікробіоти можуть мати потенціал для регулювання НАЖХП через епігенетичний механізм, опосередкований сРНК.
Терапевтичні можливості ЕВ
ЕВ із мезенхімальних стовбурових клітин (MSC) можуть мати значний терапевтичний потенціал у лікуванні захворювань печінки. ЕВ MSC активують проліферацію клітин, зменшують прозапальну відповідь та інгібують фіброгенез у печінці. ЕВ, виділені з MSC пуповини людини, можуть зменшувати фіброз печінки, викликаний Ccl4, також ЕВ можуть мати антиапоптичну активність. Таким чином, використання ЕВ відкриває нові перспективи для регенеративної терапії печінки [42].
Той факт, що ЕВ є стійкими до дії РНКази та протеази, робить їх потенціальними кандидатами в транспортери ліків, мікроРНК та білків тощо. Видалення ЕВ із кровообігу при захворюваннях печінки також може мати терапевтичний потенціал. Повідомлялось про два можливих підходи до видалення ЕВ із кровотоку. Першим підходом є виключення генів, що відповідають за біогенез та видалення ЕВ. Другий підхід — використання афінної платформи для плазмаферезу, для видалення ЕВ із кровообігу [43]. Проте сьогодні недостатньо даних, щоб засвідчити ефективність цього напрямку.
Підсумки та клінічні наслідки
Розвиток неінвазивних інструментів, що можуть прийти на зміну біопсії, на сьогодні стає пріоритетом у галузі гепатології.
Асоціація конкретних компонентів ЕВ із захворюваннями печінки демонструє потенціал використання ЕВ як біомаркерів захворювань печінки.
ЕВ мають великий потенціал у діагностиці НАЖХП та диференціальній діагностиці стадії хвороби, активності запалення та фіброзу, адже ЕВ супроводжують практично всі процеси прогресування хвороби. З іншого боку, ЕВ можуть використовуватися для доставки екзогенних молекул РНК до клітин печінки, що вже продемонстровано in vitro та in vivo. EВ-асоційовані ncRNA впевнено визнаються як важливі регулятори біологічних процесів як у фізіологічних, так і в патологічних умовах.
Надійні біомаркери можуть із часом замінити інвазивну біопсію печінки та матимуть вирішальне значення для адекватного підбору лікування та моніторингу ефективності терапії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Leoni S., Tovoli F. et al. Current guidelines for the management of non-alcoholic fatty liver disease: A systematic review with comparative analysis. World J. Gastroenterol. 2018. № 24(30). Р. 3361-3373. doi: 10.3748/wjg.v24.i30.3361. PMID: 30122876; PMCID: PMC6092580.
2. Akiko Eguchi, Enis Kostallari, Ariel E. Feldstein, Vijay H. Shah. Extracellular vesicles, the liquid biopsy of the future. Journal of Hepatology. 2019. Vol. 70. Р. 1292-1294.
3. Hirsova P., Ibrahim S.H., Verma V.K. et al. Extracellular vesicles in liver pathobiology: small particles with big impact. Hepatology. 2016. № 64. Р. 2219-2233.
4. Maji S., Matsuda A., Yan I.K. et al. Extracellular vesicles in liver diseases. American Journal of Physiology-Gastrointestinal and Liver Physiology. 2016. Vol. 3. G194-G200.
5. Harding C.V., Heuser J.E., Stahl P.D. Exosomes: looking back three decades and into the future. J Cell Biol. 2013. Vol. 200. P. 367-371. doi: 10.1083/jcb.201212113. [Erratum. J. Cell Biol. 2013. Vol. 485. Р. 2013. doi: 10.1083/jcb.2012121132013c].
6. Lambrecht J., Verhulst S., Mannaerts I. et al. Prospects in non-invasive assessment of liver fibrosis: Liquid biopsy as the future gold standard? Biochim. Biophys Acta. 2018. Vol. 36. P. 1864-1024.
7. Deng F., Magee N., Zhang Y. Decoding the role of extracellular vesicles in liver diseases. Liver research. 2017. Vol. 1(3). P. 147155.
8. Xu Zhang, Xuetao Ji, Qian Wang, John Zhong Li. New insight into inter-organ crosstalk contributing to the pathogenesis of nonalcoholic fatty liver disease (NAFLD). Protein Cell. 2018. Vol. 9(2). P. 164-177. DOI: 10.1007/s13238-017-0436-0.
9. Yao Z.Y., Chen W.B., Shao S.S. et al. Role of exosome-associated microRNA in diagnostic and therapeutic applications to metabolic disorders. Journal of Zhejiang University-SCIENCE. 2018. Vol. 19(3). P. 183-198.
10. Hirsova P., Ibrahim S.H., Verma V.K. et al. Extracellular vesicles in liver pathobiology: Small particles with big impact. Hepatology. 2016. Vol. 64. P. 2219-33.
11. Ban L., Shackel N., McLennan S. Extracellular vesicles: a new frontier in biomarker discovery for non-alcoholic fatty liver disease. International journal of molecular sciences. 2018. Vol. 17(3). P. 376.
12. Pessolano E., Belvedere R., Bizzarro V. Annexin A1 Contained in Extracellular Vesicles Promotes the Activation of Keratinocytes by Mesoglycan Effects: An Autocrine Loop Through FPRs. Cells. 2019. Vol. 8(7). P. 753. doi: 10.3390/cells8070753.
13. Povero D., Eguchi A., Li H. et al. Circulating extracellular vesicles with specific proteome and liver microRNAs are potential biomarkers for liver injury in experimental fatty liver disease. PloS ONE. 2014. Vol. 9(12). P. e113651.
14. Otto G.P., Nichols B.J. The roles of flotillin microdomains-endocytosis and beyond. J. Cell Sci. 2011. Vol. 124(23). P. 3933-3940.
15. Andreu Z., Mó-Yáñez M. Tetraspanins in extracellular vesicle formation and function. Frontiers in immunology. 2014. Vol. 5. P. 442.
16. Lozano-Andrés E., Libregts S.F., Toribio V. et al. Tetraspanin-decorated extracellular vesicle-mimetics as a novel adaptable reference material. Journal of Extracellular Vesicles. 2019. Vol. 8(1). P. 1573052.
17. Pfeffer S.R. Two Rabs for exosome release. Nature cell biology. 2010. Vol. 12(1). P. 3.
18. Lorenz L., Axnick J., Buschmann T. et al. Mechanosensing by β1 integrin induces angiocrine signals for liver growth and survival. Nature. 2018. Vol. 562(7725). P. 128.
19. Bartucci R., Salvati A., Olinga P., Boersma Y.L. Vanin 1: Its Physiological Function and Role in Diseases. International journal of molecular sciences. 2019. Vol. 20(16). P. 3891.
20. Parola M., Patel H.H., Feldstein A.E. Lipid-induced toxicity stimulates hepatocytes to release angiogenic microparticles that require Vanin-1 for uptake by endothelial cells. Sci Signal. 2013 Oct 8. 6(296). ra88. doi: 10.1126/scisignal.2004512. PMID: 24106341; PMCID: PMC4016801.
21. Yang J., Li C., Zhang L., Wang X. Extracellular vesicles as carriers of non-coding RNAs in liver diseases. Frontiers in pharmacology. 2018. Vol. 9. P. 415.
22. Roderburg C., Luedde T. Circulating microRNAs as markers of liver inflammation, fibrosis and cancer. J. Hepatol. 2014. Vol. 61. P. 1434-7.
23. Arrese M., Eguchi A., Feldstein A.E. Circulating microRNAs: emerging biomarkers of liver disease. Semin. Liver Dis. 2015. Vol. 35. P. 43-54.
24. Falcon-Perez J.M. Circulating RNA: looking at the liver through a frosted glass. Biomarkers. 2015. Vol. 20(6–7). P. 339-54.
25. Rodriguez-Suarez E., Gonzalez E., Hughes C. et al. Quantitative proteomic analysis of hepatocyte-secreted extracellular vesicles reveals candidate markers for liver toxicity. J. Proteomics. 2014. 103. 227-240. doi: 10.1016/j.jprot.2014.04.008.
26. Giroud M., Scheideler M. Long Non-coding RNAs in metabolic organs and energy homeostasis. Int. J. Mol. Scі. 2017. Vol. 18. P. 2578. doi: 10.3390/ijms18122578C.
27. Carlevaro C.M., Irastorza R.M., Vericat F. Quaternionic representation of the genetic code. Biosystems. 2016. Vol. 141. P. 10-19. doi: 10.1016/j.biosystems.2015.12.009.
28. Galle P.R., Forner A., Llovet J.M. et al. EASL clinical practice guidelines: management of hepatocellular carcinoma. Journal of hepatology. 2018. Vol. 69(1). P. 182-236.
29. Malizia A.P., Wang D.Z. MicroRNAs in cardiomyocyte development. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 2011. Vol. 3(2). P. 183-190.
30. Hardy Т., Zeybel M., Day C.P. et al. Plasma DNA methylation: a potential biomarker for stratification of liver fibrosis in non-alcoholic fatty liver disease. Gut. 2017. Vol. 66. P. 1321-8.
31. Eguchi A., Lazaro R.G., Wang J. et al. Extracellular vesicles released by hepatocytes from gastric infusion model of alcoholic liver disease contain a MicroRNA barcode that can be detected in blood. Hepatology. 2017. Vol. 65. P. 475-90.
32. Shadway J.R. UEG image Hub.
33. Huang-Doran I., Zhang C.Y., Vidal-Puig A. Extracellular vesicles: novel mediators of cell communication in metabolic disease. Trends Endocrinol. Metab. 2017. Vol. 28. P. 3-18.
34. Ybсez-Mу M., Siljander P.R., Andreu Z. et al. Biological properties of extracellular vesicles and their physiological functions. J. Extracell Vesicles. 2015. Vol. 4. P. 27066.
35. Royo F., Moreno L., Mleczko J. et al. Hepatocyte-secreted extracellular vesicles modify blood metabolome and endothelial function by an arginase-dependent mechanism. Scientific reports. 2017. Vol. 7. P. 42798.
36. Kornek M., Lynch M., Mehta S.H. et al. Circulating microparticles as disease-specific biomarkers of severity of inflammation in patients with hepatitis C or nonalcoholic steatohepatitis. Gastroenterology. 2012. Vol. 143. P. 448-58.
37. Eguchi A., Feldstein A.E. Extracellular vesicles in non-alcoholic and alcoholic fatty liver diseases. Liver research. 2018. Vol. 2(1). P. 30-34.
38. Kornek M., Popov Y., Libermann T.A. et al. Human T cell microparticles circulate in blood of hepatitis patients and induce fibrolytic activation of hepatic stellate cells. Hepatology. 2011. Vol. 53(2011). P. 230-242.
39. Gut Y., Yin Y., Li Z., Zhang W. Microbiota-Derived Components and Metabolites in the Progression of Non-Alcoholic Fatty Liver Disease (NAFLD). Nutrients. 2019. Vol. 11(8). P. 1712.
40. Tulkens J., Vergauwen G., Van Deun J. et al. Increased levels of systemic LPS-positive bacterial extracellular vesicles in patients with intestinal barrier dysfunction. Gut. 2018. pii: gutjnl-2018-317726.
41. Anand D., Chaudhuri A. Bacterial outer membrane vesicles: New insights and applications. Mol. Membr. Biol. 2016. Vol. 33. P. 125-137.
42. Rani S., Ryan A.E., Griffin M.D. et al. Mesenchymal stem cell-derived extracellular vesicles: toward cell-free therapeutic applications. Molecular Therapy. Vol. 23(5). P. 812-823.
43. Phinney D.G., Di Giuseppe M., Njah J. et al. Mesenchymal stem cells use extracellular vesicles to outsource mitophagy and shuttle microRNAs. Nature communications. 2015. Vol. 6. P. 8472.

/91-1.jpg)
/91-2.jpg)
/93-1.jpg)
/94-1.jpg)