Журнал "Гастроэнтерология" Том 53, №4, 2019
Вернуться к номеру
Гастроинтестинальные проявления системных васкулитов: спектр клинических симптомов, диагностика и лечение
Авторы: Головач И.Ю.(1), Егудина Е.Д.(2)
(1) — Клиническая больница «Феофания» Государственного управления делами, г. Киев, Украина
(2) — Клиника современной ревматологии, г. Киев, Украина
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Системні васкуліти є гетерогенною групою захворювань, що характеризуються запаленням стінок кровоносних судин і класифікуються залежно від типу й розміру залучених у патологічний процес судин. Гастроінтестинальна система може залучатися в патологічний процес при первинних і вторинних системних васкулітах. Ураження шлунково-кишкового тракту (ШКТ) найчастіше зустрічається при IgA-васкуліті, АНЦА-асоційованих васкулітах, вузликовому поліартеріїті та синдромі Бехчета. Наслідками залучення судин є аневризми або оклюзії в брижових, печінкових або селезінкових судинах із розвитком запалення, ерозій або виразок, що можуть призвести до перфорації, кровотечі та непрохідності кишечника, а також можуть бути важливою причиною захворюваності та смертності у пацієнтів із васкулітами. Клінічні ознаки зазвичай неспецифічні, до них належать лихоманка, біль у животі, нудота, блювання, діарея та кровотеча. Діагностика ґрунтується головним чином на візуалізації за допомогою катетерної ангіографії, комп’ютерної томографічної та/або магнітно-резонансної ангіографії й ендоскопії з проведенням гістопатологічного дослідження. Лікування ураження ШКТ залежить від типу васкуліту і зазвичай включає застосування високих доз глюкокортикоїдів, імунодепресантів, таких як циклофосфамід, азатіоприн або мікофенолату мофетил, і біологічних агентів. У даному огляді літератури надані дані щодо патофізіології, клінічних проявів, діагностики, лікування та наслідків ураження ШКТ при різних типах системних васкулітів.
Системные васкулиты представляют собой гетерогенную группу заболеваний, которые характеризуются воспалением стенок кровеносных сосудов и классифицируются в зависимости от типа и размера вовлеченных в патологический процесс сосудов. Гастроинтестинальная система может быть вовлечена в патологический процесс при первичных и вторичных васкулитах. Поражение желудочно-кишечного тракта (ЖКТ) чаще всего встречается при IgA-васкулите, АНЦА-ассоциированных васкулитах, узелковом полиартериите и синдроме Бехчета. Исходами воспалительного поражения сосудов являются аневризмы или окклюзии в брыжеечных, печеночных или селезеночных сосудах с развитием воспаления, эрозий и/или язв, которые могут привести к перфорации, кровотечению и непроходимости желудка и кишечника и быть важной причиной заболеваемости и смертности у пациентов с васкулитами. Клинические признаки поражения ЖКТ при системных васкулитах обычно неспецифичны, к ним относятся лихорадка, боль в животе, тошнота, рвота, диарея и кровотечение. Диагностика базируется главным образом на визуализации при помощи катетерной ангиографии, компьютерной томографической и/или магнитно-резонансной ангиографии, эндоскопии с проведением гистопатологического исследования. Лечение поражения ЖКТ зависит от типа васкулита и обычно включает применение высоких доз глюкокортикоидов, иммунодепрессантов, таких как циклофосфамид, азатиоприн или микофенолата мофетил, и биологических препаратов. В данном обзоре литературы представлены данные о патофизиологии, клинических данных, диагностике, лечении и исходе поражения ЖКТ при различных типах системных васкулитов.
Systemic vasculitides are a heterogeneous group of diseases that are characterized by inflammation of blood vessel walls and are classified depending on the type and size of the vessels primarily involved in the pathological process. The gastrointestinal system may be involved in the pathological process in primary and secondary vasculitis. Gastrointestinal lesion is most common with IgA vasculitis, ANCA-associated vasculitis, polyarteritis nodosa and Behcet’s syndrome. Vascular involvement results from aneurysms or occlusions in the mesenteric, hepatic, or splenic vessels with the development of inflammation, erosion, or ulcers, which can lead to perforation, bleeding, and bowel obstruction and can be an important cause of morbidity and mortality in patients with vasculitis. Clinical signs are usually non-specific, including fever, abdominal pain, nausea, vomiting, diarrhea, and bleeding. Diagnosis is mainly based on imaging using catheter angiography, computed tomography and/or magnetic resonance angiography, endoscopy with histopathological examination. Treatment for gastrointestinal lesions depends on the type of vasculitis and usually involves the use of high doses of corticosteroids, immunosuppressants such as cyclophosphamide, azathioprine or mycophenolate mofetil, and biologicals. This literature review presents the latest data on the pathophysiology, clinical data, diagnosis, treatment, and outcome of gastrointestinal lesions in various types of systemic vasculitis.
системний васкуліт; шлунково-кишковий тракт; діагностика; лікування; антинейтрофільні цитоплазматичні антитіла; хвороба Бехчета; вузликовий поліартеріїт
системный васкулит; желудочно-кишечный тракт; диагностика; лечение; антинейтрофильные цитоплазматические антитела; болезнь Бехчета; узелковый полиартериит
systemic vasculitis; gastrointestinal tract; diagnosis; treatment; antineutrophil cytoplasmic antibodies; Behcet’s disease; polyarteritis nodosa
Введение
Системные васкулиты представляют собой гетерогенную группу заболеваний, которые характеризуются воспалением стенок кровеносных сосудов и классифицируются в зависимости от типа и размера вовлеченных в патологический процесс сосудов, что, в свою очередь, определяет площадь и тип ишемического повреждения [1]. В зависимости от типа васкулита поражение желудочно-кишечного тракта (ЖКТ) варьирует от распространенных инфарктов кишечника или других органов при васкулитах крупных сосудов до очаговой, сегментарной ишемии и изъязвлений за счет поражения интрамуральных артерий при васкулитах сосудов мелкого калибра [2]. Клинически желудочно-кишечные проявления васкулитов колеблются от легкой боли в животе до серьезных и потенциально опасных для жизни осложнений, таких как перитонит и перфорация кишечника. Частота и тип этих желудочно-кишечных манифестаций зависит от типа системного васкулита. Наиболее распространенные гастроинтестинальные проявления системных васкулитов приведены в табл. 1. Клинические симптомы могут возникать при первичной диагностике или во время рецидива заболевания, но могут быть и изолированными. Среди всех желудочно-кишечных проявлений некоторые выделены как основные предикторы смертности при микроскопическом полиангиите, узелковом полиартериите и эозинофильном гранулематозе с полиангиитом наряду с тяжелым поражением центральной нервной системы (ЦНС), сердца и/или почек [3]. Относительно недавно изолированное вовлечение ЖКТ, прежде всего желчного пузыря и тонкой кишки, было классифицировано в рамках относительно новой концепции «васкулит одного органа». Несмотря на наблюдающееся улучшение выживаемости пациентов с васкулитом за последние несколько десятилетий благодаря достижениям в области медицинского и хирургического лечения, желудочно-кишечные проявления остаются серьезной проблемой ревматологии и гастроэнтерологии. В данном литературном обзоре рассматриваются желудочно-кишечные проявления системных васкулитов и основные подходы к их лечению.
Диагностика вовлечения желудочно-кишечного тракта при васкулитах
Диагностика поражения ЖКТ в рамках системных васкулитов может быть достаточно сложным испытанием для клинициста. Пациенты с поражением ЖКТ на фоне системного васкулита обычно имеют ряд неспецифических жалоб: лихорадка, боли в животе, тошнота, рвота, диарея и желудочно-кишечные кровотечения. Для постановки диагноза наиболее информативными являются определенные инструментальные методы исследования. Так, при подозрении на поражение брыжеечных сосудов катетерная ангиография является золотым стандартом диагностики и предпочтительна у пациентов, нуждающихся в эндоваскулярных терапевтических вмешательствах. Компьютерная томографическая (КТ) ангиография и магнитно-резонансная ангиография являются менее инвазивными процедурами, которые также могут быть полезны для диагностики поражения сосудов ЖКТ при васкулитах [4].
Эндоскопическое исследование также является важным, но менее информативным диагностическим методом у пациентов с подозрением на поражение ЖКТ в рамках системных васкулитов. В недавнем ретроспективном одноцентровом исследовании, изучающем частоту поражения верхних отделов ЖКТ у пациентов с васкулитом, среди 6477 больных с первичным или вторичным васкулитом 912 пациентам с симптомами поражения ЖКТ провели эндоскопию верхних отделов ЖКТ. Гастроинтестинальные изменения были выявлены всего у 148 (1,6 %) [5]. Основными клиническими манифестациями были эрозии, петехии, узелки, отек, подслизистые кровоизлияния, язвы и стриктуры [5]. Более распространенными были неспецифические воспалительные изменения (78 %): эзофагит, гастрит и дуоденит. Однако они не являются диагностическими признаками васкулитов, поскольку достаточно широко распространены в общей популяции. Исследователи отметили, что в их исследовании васкулитные язвы были, как правило, множественными, нерегулярными и неравномерными, а дуоденальный васкулит был представлен подслизистыми кровоизлияниями, гиперемией слизистой с множественными изъязвлениями в двенадцатиперстной кишке [5].
Гистопатологическое подтверждение васкулита в образцах биопсии, полученных эндоскопически, является еще более сложной задачей, поскольку обычно это образцы ткани, полученные при поверхностной биопсии слизистой оболочки. В исследовании E.J. Gong и соавт. (2016) [5] специфические для васкулитов изменения были обнаружены только у 8 из 124 (5,4 %) пациентов. Кроме того, следует учитывать, что эндоскопия должна проводиться крайне осторожно из-за повышенного риска перфорации в условиях ишемии, свойственной системным васкулитам.
Колоноскопические симптомы в остром периоде часто включают отечную рыхлую слизистую оболочку, эритему и вкрапленные бледные области. Для более тяжелого заболевания характерны цианоз слизистой оболочки, рассеянные геморрагические эрозии и/или линейные изъязвления [2]. В хронической фазе ишемического колита можно обнаружить атрофию слизистой оболочки и участки грануляционной ткани. Биопсия, взятая из пораженных областей, может визуализировать неспецифические изменения, такие как кровоизлияние, разрушенные крипты, тромбоз капилляров, грануляция ткани с абсцессами и псевдополипы [2]. Биопсия постишемической стриктуры характеризуется обширным трансмуральным фиброзом и атрофией слизистой оболочки.
Видеокапсульная эндоскопия может быть полезна для визуализации поражений тонкой кишки, участки которой не доступны обычной эндоскопии, но отсутствие возможности проведения биопсии значительно снижает информативность метода [2].
Не существует единого высокоинформативного диагностического лабораторного теста для васкулитов. Основные лабораторные исследования чаще всего используются для определения степени поражения органов и степени их вовлеченности. Начальные лабораторные исследования должны включать общий анализ крови и мочи, креатинин сыворотки крови, биохимическое исследование функции печени, серологические маркеры вирусных гепатитов, сывороточные криоглобулины. Скорость оседания эритроцитов и/или С-реактивный белок также должны быть включены в исследование, но они не чувствительны и не специфичны для системных васкулитов и должны интерпретироваться в клиническом контексте. Дополнительные, более специфические серологические исследования, в том числе антинейтрофильных цитоплазматических антител (AНЦA), также могут дополнительно помочь в диагностике системных васкулитов.
Васкулиты сосудов крупного калибра
Артериит Такаясу (неспецифический аортоартериит)
При артериите Такаясу в патологический процесс преимущественно вовлекаются аорта и/или ее основные ветви, особенно подключичные и общие сонные артерии. Стенотические поражения встречаются у > 90 %, аневризмы — у ~ 25 % [1, 6].
Гастроинтестинальные проявления. Поражение ЖКТ при артериите Такаясу встречается достаточно редко и обусловлено главным образом стенозом и окклюзией крупных или средних желудочно-кишечных артерий в тонком или толстом кишечнике, селезенке или, реже, печени. В ретроспективном исследовании 126 пациентов с артериитом Такаясу у 16 % были отмечены боли в животе, у 4 % — мезентериальная ишемия и у 14 % выслушивались сосудистые шумы [7]. При визуализации ~ 25 % пациентов имели стенотические или окклюзионные поражения в чревном стволе и/или верхних брыжеечных артериях [8]. Кроме того, при артериите Такаясу был описан казуистический случай аорто-пищеводного свища [8]. Поражение печени, обусловленное ишемией, проявлялось повышением уровня щелочной фосфатазы. Описаны клинические случаи печеночной синусоидальной дилатации при артериите Такаясу. Это патологическое состояние характеризуется поражением, подобным гепатиту, с вовлечением сосудов печени, с появлением множества кистоподобных заполненных кровью полостей в печени [9].
В научной литературе представлены данные об ассоциации артериита Такаясу с воспалительными заболеваниями кишечника (ВЗК), что предполагает возможную связь между этими двумя нозологиями. В североамериканской когорте из 160 пациентов с артериитом Такаясу у 8 больных (5 %) были диагностированы ВЗК по сравнению с 0,2% распространенностью болезни Крона в общей популяции [10]. Существуют доказательства генетического перекреста между артериитом Такаясу и язвенным колитом — это наличие HLA B52:01 в качестве общей генетической детерминанты [11]. Диагноз ВЗК обычно предшествует развитию артериита Такаясу (в среднем на 4 года) [10]. Следует отметить, что сосуществование этих двух заболеваний не предполагает худшего прогноза ни для ВЗК, ни для артериита Такаясу.
Лечение. Основным лекарственным препаратом для лечения активного артериита Такаясу являются глюкокортикоиды (ГК) (0,5–1,0 мг/кг массы тела в день, эквивалентно преднизолону для индукционной терапии с последующим постепенным снижением). Эффективность ГК достаточно высока, но отмечаются частые рецидивы при уменьшении дозы [12]. Доказательств эффективности метотрексата (15–25 мг в неделю) при артериите Такаясу относительно немного [13]. Циклофосфамид (2 мг/кг массы тела в день перорально или внутривенная пульс-терапия 7,5–15,0 мг/кг в 1, 15 и 29 дни, а затем ежемесячно в течение максимум 6 месяцев) и микофенолата мофетил (1–3 г в день) используются в рефрактерных случаях [13].
Ретроспективные исследования подтверждают эффективность использования блокаторов факторов некроза опухоли (ФНО) для лечения рефрактерного артериита Такаясу, в том числе и с гастроинтестинальными поражениями. Следует выделить инфликсимаб (5–10 мг/кг внутривенно в 1, 15 дни и затем ежемесячно) и адалимумаб (подкожная инъекция 40 мг каждые 2 недели), которые показали высокую эффективность в лечении артериита Такаясу и уменьшении количества рецидивов [13]. Также проводилась оценка эффективности тоцилизумаба (моноклональное антитело к человеческому рецептору интерлейкина 6 (ИЛ-6)) 8 мг/кг массы тела внутривенно в месяц у 49 пациентов с артериитом Такаясу. Результаты оказались многообещающими, хотя в конечном итоге 29 % пациентов был назначен другой биологический агент вследствие неэффективности тоцилизумаба [14].
Тяжелые желудочно-кишечные проявления артериита Такаясу следует лечить высокими дозами ГК и другим иммунодепрессантом, главным образом блокаторами ФНО. Может потребоваться открытое хирургическое вмешательство и эндоваскулярное лечение, особенно у пациентов с симптомным стенозом чревной или брыжеечной артерии. Основное нежелательное явление после сосудистой хирургии — высокая частота рестенозов: 15–30 % через 5–20 лет для открытой хирургической операции и 30–70 % через 5–10 лет после ангиопластики [6]. Частота осложнений через пять лет увеличивается в 7 раз для пациентов с активным воспалением после реваскуляризации и/или лиц, не принимавших ГК во время хирургического лечения [6].
Гигантоклеточный артериит (болезнь Хортона)
Гигантоклеточный артериит (ГКА) поражает аорту и/или ее основные ветви с преимущественным вовлечением сонной, позвоночной артерий и часто височной артерии [1]. Это наиболее распространенный системный васкулит, поражающий крупные сосуды у лиц старше 50 лет. Основные клинические проявления ГКА объединяются в четыре группы симптомов: 1) краниального артериита; 2) экстракраниального артериита; 3) системного воспаления; 4) ревматической полимиалгии.
Гастроинтестинальные проявления. Мезентериальные сосуды редко поражаются при ГКА. Систематический обзор литературы выявил только 12 случаев ГКА (75 % — с положительным результатом биопсии височной артерии) с вовлечением сосудов брыжейки, приводящим к инфаркту тонкой кишки [15]. Более 50 % этих пациентов имели как краниальные, так и абдоминальные симптомы, причем последние часто преобладали над первыми. Описаны единичные случаи инфаркта толстой кишки, которые могут сопровождаться неспецифической лихорадкой, болью в животе или симптомами острого живота [16].
Значимый симптом заболевания — перемежающаяся «хромота» нижней челюсти («жевательная хромота»). Боль и преходящее затруднение или ослабление движений нижней челюсти возникают при продолжительном жевании, особенно твердой пищи, или при длительном разговоре и прекращаются после расслабления жевательных мышц. Этот симптом позволяет с высокой вероятностью предположить диагноз ГКА. При поражении артерий, кровоснабжающих мышцы языка, может появиться аналогичный симптом — перемежающаяся «хромота» языка, сопровождающийся болью в языке, его слабостью. Крайне редким клиническим проявлением поражения ЖКТ при ГКА является некроз языка, который клинически проявляется дисфагией, болью в языке, отеком и/или гангреной [16].
Боль в животе у пациентов с ГКА также может быть результатом аневризмы и расслоения брюшной аорты. Среднее время от постановки диагноза ГКА до развития аневризмы или расслоения брюшной аорты составляет 6–7 лет [17]. Все пациенты с ГКА должны быть регулярно обследованы на предмет возможного появления аневризмы аорты при постановке диагноза и в течение минимального периода наблюдения 5 лет после [18].
У одной трети — половины пациентов с ГКА можно обнаружить бессимптомное повышение уровня ферментов печени, особенно щелочной фосфатазы, без какого-либо прогностического значения [19]. Это нарушение может быть вызвано повреждением эпителиальных клеток желчного протока вследствие артериита прилегающих сосудов [19]. Артериит печеночных сосудов портального тракта или гранулематозное воспаление печени встречаются крайне редко, но могут вызывать лихорадку и желудочно-кишечные симптомы, предшествуя появлению краниальных симптомов, свидетельствующих о ГКА [20].
Лечение. Как и при артериите Такаясу, ГК являются краеугольным камнем лечения ГКА. В случае тяжелых желудочно-кишечных проявлений следует расширить лечение путем добавления иммунодепрессантов, а также хирургических и/или эндоваскулярных процедур. Пациенты с ГКА, как правило, старше, чем пациенты с артериитом Такаясу, поэтому заболеваемость и смертность у них более высоки [16]. Дополнительное лечение метотрексатом может снизить частоту рецидивов и кумулятивную дозу преднизолона [21]. На основе нескольких открытых и рандомизированных контролируемых исследований тоцилизумаб показал эффективность у пациентов с впервые диагностированным или рецидивирующим ГКА с поражением ЖКТ [22, 23]. В этих исследованиях 56–85 % пациентов достигли устойчивой ремиссии через 1 год, а 80 % смогли прекратить лечение ГК [22, 23]. Абатацепт также был исследован у пациентов с ГКА и продемонстрировал интересные результаты. Согласно предварительному анализу, при использовании абатацепта по сравнению с плацебо было обнаружено небольшое, но достоверно (р < 0,049) более низкое безрецидивное течение заболевания через 12 месяцев, в том числе и среди пациентов с поражением ЖКТ [24].
Васкулиты сосудов среднего калибра
Узелковый полиартериит
Узелковый полиартериит (УПА) представляет собой васкулит мышечных артерий среднего калибра. Одним из отличительных признаков УПА является наличие суженных конусообразных артерий наряду с саккулярными или веретенообразными микроаневризмами, которые можно выявить при абдоминальной артериографии, КТ или магнитно-резонансной ангиографии [25]. Эти характерные поражения артерий встречаются у 85 % пациентов с УПА с преимущественной локализацией в брыжеечных, почечных и/или печеночных артериях, часто в местах разветвления этих сосудов [25]. УПА часто ассоциируется с вирусом гепатита В (ВГВ). Согласно классификации васкулитов 2012 г., ВГВ-ассоциированный УПА относят к ВГВ-ассоциированным васкулитам или васкулитам, ассоциированным с какими-либо известными инфекционными агентами [1]. Пациенты с ВГВ-ассоциированным васкулитом обязательно должны быть исследованы на предмет криоглобулинемии, учитывая высокую распространенность ВГВ-ассоциированного криоглобулинемического васкулита [26].
Гастроинтестинальные проявления. УПА представляет собой один из васкулитов, при котором вовлечение ЖКТ является наиболее распространенным клиническим проявлением.
В недавнем проспективном исследовании 27 пациентам с УПА была проведена КТ органов брюшной полости. Были обнаружены аневризмы, неровный контур, окклюзии и стеноз печеночных, верхних брыжеечных и селезеночных артерий, а также инфаркты и утолщение стенки кишечника [27]. Поражение ЖКТ чаще встречается при ВГВ-ассоциированном васкулите [28]. Тяжелое поражение ЖКТ (кровотечение, перфорация, инфаркт и/или панкреатит) в течение первого года после начала заболевания васкулитом, ассоциированным с ВГВ, связано с более высокой смертностью, чем в не ассоциированных с ВГВ случаях [29].
Боль в животе неспецифична и вариабельна по интенсивности и присутствует у 35–95 % пациентов с УПА [30]. Считается, что эта боль является вторичной по отношению к трансмуральному некротическому воспалению мезентериальных сосудов, приводящему к ишемии кишечника, чаще тонкого [31]. Другие гастроинтестинальные симптомы включают тошноту, рвоту, диарею, гематохезию (кровь в кале), мелену и кровотечение. Желудочно-кишечные или внутрибрюшные кровотечения могут быть результатом слизистых ишемических изъязвлений, инфарктов кишечника, перфораций или внутрибрюшинного разрыва микроаневризм печеночной, селезеночной и/или почечной артерий [31]. Язвы кишечника встречаются у 5–6 % пациентов с УПА, главным образом в тощей кишке [28, 30].
Интересно отметить, что острый гепатит, ассоциированный с ВГВ, характеризуется легким течением у пациентов с УПА с медленно прогрессирующим развитием фиброза [28, 30]. Также сообщалось о сегментарных инфарктах печени или селезенки и окклюзии печеночных вен (синдром Бадда — Киари) вследствие поражения гепатолиенальных сосудов при УПА [32].
Лечение. Пятилетняя выживаемость для пациентов с УПА превышает 80 % [25]. Пятифакторная шкала (Five-Factor Score-FFS) может использоваться для лечения УПА, не ассоциированного с ВГВ-инфекцией [31]. При тяжелых (FFS ≥ 1) и рефрактерных формах УПА, включая тяжелые желудочно-кишечные проявления, для индукции ремиссии в лечении используют циклофосфамид (2 мг/кг массы тела в день перорально или пульс-терапия 7,5–15,0 мг/кг массы тела внутривенно в 1, 15 и 29 дни, затем каждые 3–4 недели в течение максимум 6 месяцев) и высокие дозы ГК (1 мг/кг преднизолона с возможным предшествующим проведением пульс-терапии 7,5–15,0 мг/кг массы тела в течение 1–3 дней с постепенным снижением дозы) [31]. В последующем назначают азатиоприн (2 мг/кг массы тела в день) или метотрексат (20–25 мг в неделю) для поддержания ремиссии [25]. У пациентов с легкими формами (FFS = 0) удается достичь устойчивой ремиссии в 50 % случаев при помощи изолированного назначения ГК [33]. Добавление азатиоприна к ГК в качестве терапии первой линии не привело к повышению эффективности лечения или снижению частоты рецидивов УПА [34].
Лечение ВГВ-ассоциированного васкулита основывается на применении противовирусных препаратов (ламивудин) или более новых, таких как энтекавир, тенофовир, адефовир дипивоксил или тельбивудин. При тяжелом течении заболевания или с целью более быстрого контроля клинических проявлений противовирусные препараты комбинируют с коротким курсом ГК (0,5–1,0 мг/кг преднизолона в день с быстрым режимом снижения и отмены в течение 1–2 месяцев) и плазмаферезом [28, 30].
Болезнь Кавасаки
Синдром (болезнь) Кавасаки (слизисто-кожный лимфонодулярный синдром) — остро протекающее заболевание (системный васкулит), морфологически характеризующееся деструктивно-пролиферативным поражением преимущественно мелких и средних артерий (в том числе коронарных сосудов) и проявляющееся наряду с этим лихорадкой, изменениями слизистых оболочек, кожи, лимфатических узлов [1]. Примерно 85–90 % случаев болезни Кавасаки регистрируется у детей младше 5 лет.
Гастроинтестинальные проявления. В исследовании, проведенном A.L. Baker с соавт. (2009), у 61 % детей (из 198) с диагнозом «болезнь Кавасаки» были отмечены желудочно-кишечные проявления в остром лихорадочном периоде [35]. В другой группе из 219 детей с болезнью Кавасаки у 10 (4,6 %) были более тяжелые абдоминальные симптомы: у 9 пациентов установлен острый живот вследствие мукоцеле — водянки желчного пузыря, паралитической кишечной непроходимости подвздошной кишки, аппендикулярного васкулита и геморрагического дуоденита [36]. Интересно, что аневризмы коронарных артерий развились у половины детей с поражением ЖКТ (по сравнению с 20–25 % среди пациентов с болезнью Кавасаки в целом), несмотря на раннее введение внутривенных иммуноглобулинов [36]. Ранние клинические гастроинтестинальные манифестации наблюдаются в течение первых 2 недель после постановки диагноза. Чаще всего это мукоцеле желчного пузыря, возможно, вследствие васкулита стенки желчного пузыря [37].
В исследовании, включающем 43 взрослых пациента с болезнью Кавасаки, у 56 % были верифицированы желудочно-кишечные симптомы, причем наиболее частыми проявлениями были боль в животе и желтуха [38].
Лечение. Стандартное лечение болезни Кавасаки с поражением ЖКТ включает применение ацетилсалициловой кислоты и высоких доз внутривенного иммуноглобулина (2 г/кг массы тела). Эти лекарственные препараты снижают риск развития как аневризм коронарных артерий, так и водянки желчного пузыря с 20–25 до 2–4 % [39]. Пациентам, не отвечающим на инициальную терапию (~ 10 %), необходимо назначить повторную внутривенную инфузию иммуноглобулина [40]. Назначение ГК рекомендуется пациентам с рефрактерным течением болезни [40]. К другим препаратам спасения, доказавшим свою эффективность в сложных, инкурабельных случаях, относят инфликсимаб, антагонисты интерлейкина 1 (анакинра), плазмаферез и циклофосфамид [40, 41].
AНЦА-ассоциированные васкулиты сосудов малого калибра
С антинейтрофильными цитоплазматическими антителами ассоциированные васкулиты сосудов малого калибра (ААВ) представляют собой некротизирующие васкулиты, которые преимущественно поражают мелкие сосуды (капилляры, венулы, артериолы и мелкие артерии), с небольшим количеством или отсутствием образования иммунных депозитов [1, 42]. AAВ могут также вовлекать артерии среднего калибра. На сегодня опубликовано очень мало клинических случаев ангиографической визуализации висцеральных сосудов при AAВ. В опубликованных работах клиницисты не выявили таких больших и многочисленных микроаневризм, как при УПА [42].
Аббревиатура АНЦА (ANCA) характеризует аутоантитела к белкам цитоплазматических гранул нейтрофилов (гранулоцитов) и лизосом моноцитов, которые классифицируются по типу свечения при реакции непрямой иммунофлуоресценции. Влияние типа AНЦA на проявления болезни и реакцию на лечение привлекло значительное внимание исследователей в последние годы. Группа японских ученых показала, что частота желудочно-кишечного и гепатобилиарного поражения была одинаковой среди пациентов, позитивных по протеиназе 3-AНЦA (ПР3-AНЦA) и миелопероксидазе АНЦА (MПO-AНЦA) [43].
Гранулематоз с полиангиитом
Гранулематоз с полиангиитом (ГПА) является наиболее распространенным первичным системным васкулитом. Это аутоиммунное гранулематозное воспаление стенок сосудов (васкулит), захватывающее мелкие и средние кровеносные сосуды: капилляры, венулы, артериолы и артерии, с вовлечением верхних дыхательных путей, глаз, почек, легких и других органов [1]. ГПА обычно ассоциируется с ПР3-AНЦA.
Гастроинтестинальные проявления. Желудочно-кишечные симптомы наблюдаются у 5–11 % пациентов с ГПА [28, 44]. Аутопсические исследования выявили гистопатологические признаки желудочно-кишечного васкулита в 24 % случаев ГПА [45].
В патологический процесс может быть вовлечена любая часть ЖКТ, но наиболее распространенными являются поражения тонкой и толстой кишки. Симптомы варьируют от преходящих болей в животе и язв (пероральные, пищеводные и пептические) до кровавой диареи и перфорации кишечника [46]. Результаты визуализации ЖКТ, как правило, неспецифичны: от мультифокального или диффузного утолщения стенки кишки до стаза в сосудах брыжейки и асцита [42]. При эндоскопическом исследовании можно выявить изъязвления, иногда описанные как гранулематозные и ишемические изменения. По сравнению с болезнью Крона язвы, наблюдаемые при ГПА, чаще бывают неглубокими и поперечно ориентированными, но провести дифференциальный диагноз достаточно сложно, поскольку описаны случаи сопутствующей болезни Крона (или язвенного колита) при ГПА (или других AAВ) [10, 45, 47].
Эндоскопическая биопсия пищевода или желудка редко способствует диагностике. Как уже упоминалось, биопсия язв толстой кишки имеет низкую чувствительность (~ 30–40 %), но при условии, если материал взят из глубоких и подслизистых слоев, специфичность исследования возрастает [2]. Следует отметить, что проведение биопсии имеет высокий риск перфорации у пациентов с васкулитом.
Гранулематозный холецистит, гранулематоз печени и поджелудочной железы, которые можно выявить у пациентов с ГПА, могут вызвать подозрения по поводу злокачественного образования при визуализации [46]. Также при ГПА были обнаружены инфаркты селезенки и печени или кровоизлияния [48].
Микроскопический полиангиит
Микроскопический полиангиит (МПА) в 50 % случаев проявляется в виде тяжелого легочно-почечного синдрома [1]. При МПА наблюдают острое начало и более агрессивное течение, чем при ГПА. МПА имеет много общих черт с ГПА, отличаясь отсутствием гранулематозного воспаления и серологическими особенностями — более частым обнаружением МПО-AНЦA [1].
Гастроинтестинальные проявления. Поражение ЖКТ было зарегистрировано у 5–30 % пациентов с МПА с симптомами, варьирующими от боли в животе, тошноты, рвоты и диареи до более редких манифестаций: ишемических язв толстой кишки, перитонита и перфорации кишечника [28, 49].
Эозинофильный гранулематоз с полиангиитом
Основными клиническими проявлениями у большинства пациентов с эозинофильным гранулематозом с полиангиитом (ЭГПА) являются астма с поздним началом, эозинофилия, кожный васкулит (пурпура) и/или множественный мононеврит [1, 50]. У 30–40 % пациентов с ЭГПА обнаруживают сывороточные МПО-AНЦA [1, 50]. Вовлечение сердца, более распространенное у AНЦA-отрицательных пациентов, является основным фактором риска смертности [51].
В исследовании N. Tsurikisawa и соавт. (2015) изучалась патология ЖКТ и роль T-хелперов 17 (Th17) в патогенезе гастроинтестинальных проявлений у пациентов с ЭГПА. У них наблюдались повышенные уровни Th17 и сывороточной молекулы межклеточной адгезии 1 (ICAM-1), эозинофилия ободочной кишки и отечные изменения подслизистого слоя, которые уменьшались в фазе ремиссии [52].
Гастроинтестинальные проявления. Желудочно-кишечные симптомы наблюдаются у 30–50 % пациентов с ЭГПА, они неспецифичны и включают боль в животе (91 %), диарею (45 %), мелену или гематохезию (19–36 %), тошноту и рвоту (18 %) и острый живот (6–36 %) [28, 51, 53]. Васкулит брыжеечной артерии является наиболее распространенным объяснением этих проявлений и может привести к инфаркту кишечника и перфорации, особенно в тонкой кишке. Инфильтрация слизистой оболочки желудочно-кишечного тракта эозинофилами также может вызывать боль, нарушения моторики, обструктивные симптомы и диарею с развитием эозинофильного эзофагита, гастрита или колита [53]. Гранулематозные и эозинофильные язвы на слизистой оболочке были описаны как потенциальные источники кровотечений в желудке, двенадцатиперстной кишке, тощей кишке и/или, реже, в толстой кишке [28]. В научной литературе также есть указания на частое сосуществование ЭГПА и ВЗК [10].
Лечение ААВ
Тяжелое поражение ЖКТ при МПА и ЭГПА (кровотечение, перфорация, панкреатит, лапаротомия) всегда свидетельствует о плохом прогнозе [3]. Пациентам с тяжелыми желудочно-кишечными проявлениями должны быть незамедлительно назначены ГК в сочетании с иммунодепрессантом, например таким, как циклофосфамид (2 мг/кг перорально или пульс-терапия). Пациентам с ГПА комбинация ГК и иммуносупрессанта показана независимо от тяжести желудочно-кишечных проявлений. В настоящее время при лечении циклофосфамидом и ГК 5-летняя выживаемость таких пациентов возросла до 80 % [54, 55]. У AНЦA-позитивных пациентов, рефрактерных к лечению циклофосфамидом, рекомендуется применение ритуксимаба — химерного антитела против антигена CD20, обнаруженного на поверхности В-лимфоцитов (375 мг/м2 площади тела еженедельно в течение 4 последовательных недель). Это альтернативный и весьма эффективный метод лечения ААВ [56].
У пациентов с ЭГПА и поражением ЖКТ среди биологических агентов следует выделить меполизумаб. Препарат приводил к значительно большему количеству недель ремиссии и более высокой доле участников, находящихся в ремиссии, чем плацебо, что позволило снизить использование ГК [57]. Как только устойчивая ремиссия достигнута, для ее поддержания используются разные подходы к лечению, поскольку частота рецидивов при ААВ высока [58]. К препаратам для поддержания ремиссии ААВ относят азатиоприн, метотрексат, микофенолата мофетил [58]. В дополнение к неотложной медикаментозной терапии иногда требуется хирургическое вмешательство.
Другие васкулиты сосудов малого калибра
Иммунокомплексные васкулиты сосудов малого калибра характеризуются воспалением сосудистой стенки с отложениями иммуноглобулинов и/или комплемента [1].
IgA-васкулит
IgA-васкулит (также известный как пурпура Шенлейна — Геноха) может развиться в любом возрасте, но чаще всего встречается у детей в возрасте от 3 до 10 лет [59]. Это васкулит, поражающий главным образом мелкие сосуды. Характерные проявления включают пальпируемую пурпуру, артралгии, желудочно-кишечные проявления и гломерулонефрит [1].
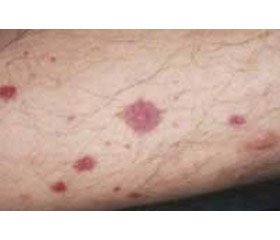
Гастроинтестинальные проявления. В целом до 75 % пациентов с IgA-васкулитом имеют желудочно-кишечные проявления [60]. Наиболее частым клиническим проявлением является боль в животе, она встречается у 20 % пациентов. Боль имеет спастический характер, часто локализуется в околопупочной области и усиливается после еды. Желудочно-кишечные кровотечения, обусловленные васкулитом сосудов слизистой и подслизистой оболочек, встречаются у 18–52 % пациентов [60]. Чаще всего поражается двенадцатиперстная и нисходящая ободочная кишка. При эндоскопическом исследовании можно обнаружить петехии, диффузную гиперемию слизистой оболочки и геморрагические эрозии [61]. Поражение пищевода встречается редко и может проявляться язвенным поражением, стриктурой или тяжелым эзофагитом [31]. Систематический обзор литературы, в котором было проанализировано поражение ЖКТ у пациентов с IgA-васкулитом, продемонстрировал частый терминальный илеит с лейкоцитокластическим васкулитом с депозицией IgA при проведении биопсии кишечника, что позволяло отличить IgA-васкулит от болезни Крона [62]. Интересным является клиническое наблюдение, что выраженность кожной пурпуры ассоциирована с риском развития желудочно-кишечных кровотечений [63].
Большинство желудочно-кишечных проявлений самопроизвольно разрешаются и не требуют лечения, но у 3–5 % пациентов наблюдаются отек стенки кишечника (видимый на КТ брюшной полости), инфаркты, некроз, перфорация или инвагинация [31, 60]. К другим редким проявлениям относятся тяжелая энтеропатия с потерей белка, панкреатит, холецистит и аппендицит [60]. В исследовании H.C. Chao с соавт. (2000) было отмечено вовлечение гепатобилиарной системы у 1,85 % детей с IgA-васкулитом, у которых наблюдались боль в правом верхнем квадранте (80 %), повышенные уровни трансаминаз (75 %), гепатомегалия при ультразвуковом иссоедовании (75 %) и утолщение стенки желчного пузыря (25 %) [64].
Недавнее исследование показало, что фекальный кальпротектин может быть перспективным маркером желудочно-кишечного поражения у пациентов с IgA-васкулитом [65]. Уровни фекального кальпротектина у детей с IgA-васкулитом, у которых было выявлено поражение ЖКТ по клиническим данным, были значительно выше, чем у лиц без поражения ЖКТ (124 против 16,57 мг/г). Чувствительность фекального кальпротектина составляла 87 %, а специфичность — 64 % с пороговым уровнем для позитивности более 50 мг/г, что указывает, что этот биомаркер полезен в качестве инструмента для скрининга пациентов [65].
Лечение. IgA-васкулит, как правило, имеет доброкачественное течение и может самостоятельно разрешиться через несколько недель [66]. Рецидивы заболевания чаще встречаются при поражении почек. Пациентам с IgA-васкулитом и ЖКТ-проявлениями следует назначать ГК; добавление циклофосфамида может привести к большему количеству неблагоприятных эффектов и не имеет явных преимуществ [67]. Микофенолата мофетил или ритуксимаб являются препаратами выбора в достижении ремиссии у некоторых пациентов, которые плохо реагируют на ГК на фоне поражения ЖКТ [68]. В исследовании L. Fotis с соавт. (2016) у шести пациентов с рецидивирующим IgA-васкулитом с поражением ЖКТ и без поражения почек использовался азатиоприн 1 мг/кг в течение 7–21 месяца. Терапия была успешной, пациенты прекратили прием ГК без рецидивов или каких-либо нежелательных явлений [69]. В другой серии случаев сообщалось, что плазмаферез был эффективен при поражении ЖКТ, рефрактерном к другим методам лечения [70]. В целом 5–12 % пациентов с IgA-васкулитом нуждаются в лапаротомии из-за инвагинации, перфорации кишечника и/или сильного кровотечения [2].
Криоглобулинемический васкулит
Криоглобулины — это циркулирующие иммуноглобулины, которые преципитируют и осаждаются при температуре ниже 37 °С и растворяются при повторном нагревании. Было описано три подтипа криоглобулинемии: криоглобулинемия I типа представляет собой отдельные моноклональные иммуноглобулины (Ig) (чаще всего — IgM, редко — IgG или IgA), II типа — комбинацию моноклональных (чаще — IgMκ) и поликлональных Ig (IgGκ и IgGλ), и III тип представлен поликлональными IgM или IgG [71]. Криоглобулины трудно обнаружить из-за технических температурных ограничений. У пациентов с характерными клиническими признаками следует заподозрить криоглобулинемический васкулит в случаях низкой концентрации комплемента C4 (с нормальным уровнем C3) и положительным ревматоидным фактором и провести повторный тест на криоглобулины даже при отрицательном первом [71]. Криоглобулинемический васкулит (КВ) в основном развивается при криоглобулинемии II и III типа и характеризуется поражением кожи, почек и/или периферической нервной системы [1].
Гастроинтестинальные проявления. Поражение ЖКТ при КВ встречается редко, но наличие такового является катастрофическим [72]. Желудочно-кишечные симптомы варьируют от боли в животе и кровянистого стула до перфорации кишечника, кишечной ишемии, острого холецистита и панкреатита [71]. Поражение печени наблюдается у 60 % пациентов с вирусом гепатита С (ВГС) ассоциированным КВ, у 25 % наблюдается прогрессирование до цирроза [73]. Гепатоцеллюлярная карцинома реже встречается у пациентов с ВГС-ассоциированным КВ, чем у лиц без такового [73]. Тяжелые желудочно-кишечные проявления ассоциированы с плохим прогнозом как для ВГС-, так и для не-ВГС-ассоциированного КВ [74, 75].
Лечение. Лечение зависит от основного заболевания (например, ВГС-инфекции или лимфомы) и степени тяжести КВ. Новые противовирусные методы лечения являются краеугольным камнем терапии ВГС-ассоциированного КВ [76]. Ритуксимаб также используется в терапии наряду с противовирусными средствами для индукции ремиссии у пациентов с тяжелыми желудочно-кишечными проявлениями [77]. ГК эффективны при КВ, не ассоциированном с ВГС, также их назначают короткими курсами при рефрактерном течении КВ, ассоциированного с ВГС.
Васкулиты сосудов разного калибра
Для васкулитов сосудов разного калибра характерно поражение артериальных и венозных сосудов различных размеров. Они включают болезнь Бехчета и синдром Когана (у пациентов с последним сообщалось только о редких случаях брыжеечного васкулита) [78].
Болезнь Бехчета
Болезнь Бехчета характеризуется рецидивирующими оральными и/или генитальными афтозными язвами и может осложняться тромботическими и/или воспалительными поражениями кожи, глаз, суставов, ЖКТ и/или ЦНС [1].
Гастроинтестинальные проявления. Частота поражения ЖКТ при болезни Бехчета различна и составляет 2,8 % у пациентов в Турции, 32 % в Тайване, 37–43 % в США и 50–60 % в Японии [79]. Клинические симптомы варьируют от анорексии, рвоты, диспепсии, диареи, мелены и болей в животе до перфораций, требующих неотложного хирургического вмешательства.
Можно выделить две формы кишечных проявлений болезни Бехчета: язвы слизистой оболочки в результате нейтрофильных инфильтратов, которые могут имитировать ВЗК [80], и кишечная ишемия и инфаркты вследствие васкулита крупных сосудов, особенно брыжеечных [81]. В патологический процесс может быть вовлечена любая часть ЖКТ, чаще всего терминальный отдел подвздошной кишки и илеоцекальный отдел кишечника [82]. Язвы пищевода чаще всего обнаруживаются в его нижней части. Поражение желудка включает язвы и стеноз привратника [82]. В толстой кишке были описаны три типа язв: вулканическая, географическая и афтозная [31]. Вулканические язвы имеют самый высокий риск перфорации, особенно у пациентов младше 25 лет [83]. Ректальное и/или анальное вовлечение встречается редко [79].
Синдром Бадда — Киари регистрируется у 1,3–3,2 % пациентов с болезнью Бехчета, наиболее часто — у молодых мужчин [79, 84]. Размер тромба в нижней полой вене является основным фактором выживаемости (полная диффузная окклюзия связана со средней продолжительностью жизни 10 месяцев) [84].
Лечение. Колхицин является краеугольным камнем лечения язв в полости рта и половых органов, но для желудочно-кишечных проявлений требуются другие препараты: ГК, сульфасалазин, азатиоприн или, в более тяжелых случаях, циклофосфамид или анти-ФНО агенты, такие как инфликсимаб или адалимумаб [79, 85, 86].
Оперативное лечение может потребоваться в случаях перфорации, свищей или обструкции [87]. Отмечалась высокая частота рецидивов заболевания в месте хирургических анастомозов [88].
Использование антикоагулянтной терапии в случаях венозного тромбоза, связанного с болезнью Бехчета, остается дискутабельным, но мощное иммуносупрессивное лечение в этом случае является обязательным [86].
Васкулиты при системных заболеваниях
Системная красная волчанка
Желудочно-кишечные проявления отличаются высокой распространенностью у пациентов с системной красной волчанкой (СКВ). Большинство проявлений связано с побочными реакциями на лекарственные препараты и сопутствующими инфекциями [89]. Желудочно-кишечные манифестации, непосредственно связанные с СКВ, установлены у 1,3–27,5 % пациентов [90].
Распространенность васкулита при СКВ составляет 11–36 %, и в основном заболевание проявляется поражением кожи [90]. Вовлечение мезентериальных сосудов составляет всего 0,2–9,7 % с преимущественным поражением верхней брыжеечной артерии [91], приводя к ишемии подвздошной и тощей кишки с высоким риском перфораций и кровоизлияний.
На КТ можно обнаружить локальное усиление кровотока в сосудах брыжейки — симптом гребенки, которое прежде всего свидетельствует об экстрамуральном характере повреждения, очаговом или диффузном расширении петель кишечника, асците и утолщении стенки кишки с появлением двойного контура [92]. Тромбоз брыжеечных сосудов может протекать без васкулита, обычно вызывая ограниченную ишемию [92].
Лечение СКВ-ассоциированного брыжеечного васкулита включает высокие дозы ГК и полный покой кишечника. Циклофосфамид добавляют при вовлечении других органов-мишеней (например, ЦНС или почек), а также в случае некроза кишечника или постоянной боли в животе, несмотря на прием ГК. Ремиссия достигается у 85 % пациентов, а частота рецидивов составляет 23 % в течение года [92]. Оперативное хирургическое вмешательство требуется у пациентов с некрозом или перфорацией толстой кишки. У пациентов с перфорацией смертность достигает 50 % [93].
Ревматоидный васкулит
Ревматоидный васкулит может развиться у пациентов с длительным (обычно 10–15 лет) эрозивным ревматоидным артритом [94]. Однако с использованием биологических агентов его распространенность существенно снизилась: с 30–50 % в 1990–2000 гг. до 1–5 % в настоящее время [95].
При ревматоидном васкулите в патологический процесс вовлекаются сосуды малого и среднего калибра, и это проявление связано с плохим прогнозом: смертность составляет ~ 25 % в течение 5 лет [96]. Кожный васкулит и васкулитная невропатия являются наиболее распространенными клиническими проявлениями [95]. В целом 10–38 % пациентов с ревматоидным васкулитом имеют поражение ЖКТ [94], что может привести к ишемическим язвам, перфорациям и сегментарному или обширному инфаркту кишечника. ГК и циклофосфамид являются препаратами выбора для лечения тяжелого ревматоидного васкулита.
Васкулит одного органа
Васкулит с изолированным поражением ЖКТ характеризуется поражением пищевода, желудка, сальника, тонкого и толстого кишечника, червеобразного отростка, желчного пузыря и поджелудочной железы [97]. У пациентов с изолированным васкулитом ЖКТ часто имеет место острый живот, что может привести к диагностическим ошибкам, поскольку в большинстве случаев диагноз изолированного васкулита ЖКТ устанавливается ретроспективно на основе данных гистологического исследования после проведенной операции [97].
За исключением васкулитов тонкой и толстой кишки большинство изолированных васкулитов ЖКТ разрешаются после хирургического вмешательства и не требуют назначения иммуносупрессивной терапии [98]. Прогрессирование или последующее развитие системного васкулита является редкостью [98]. Необходимо проведение системного диагностического обследования у таких пациентов для поиска внегастроинтестинальных проявлений, свидетельствующих в пользу системного васкулита. Обязательны исследование сывороточных маркеров воспалительного процесса, креатинина, общий анализ крови и мочи, AНЦA и антиядерных антител, фракций комплемента, серологических маркеров ВГВ и ВГС и рентгенография грудной клетки.
Заболевания, имитирующие гастроинтестинальный васкулит
Помимо желудочно-кишечных инфекций имеются состояния, которые могут имитировать васкулит с поражением желудочно-кишечного тракта:
1) инфекционный процесс;
2) атеросклероз;
3) тромбоэмболические состояния (миксома сердца, сердечный тромб, эндокардит, микотическая аневризма и др.);
4) антифосфолипидный синдром;
5) фибромышечная дисплазия;
6) синдром верхней брыжеечной артерии;
7) IgG4-связанное заболевание;
8) гиперэозинофильный синдром;
9) облитерирующий тромбангиит;
10) внутрисосудистая крупная В-клеточная лимфома;
11) синдром Марфана;
12) синдром Элерса — Данло IV типа;
13) злокачественный атрофический папулез.
Ишемия мезентериальных сосудов обусловлена множеством возможных этиологических факторов, наиболее частым из которых является атеросклероз. ВЗК также могут имитировать ААВ или болезнь Бехчета, однако следует помнить, что ВЗК могут ассоциироваться с этими васкулитами [10]. Остается неясным, находятся ли эозинофильный эзофагит, гастрит и колит в патогенном спектре гиперэозинофильного синдрома или ЭГПА [50]. IgG4-связанное заболевание также может вызывать различные желудочно-кишечные проявления вследствие аортита и периаортита, с возможным поражением желудочно-кишечных артериальных ветвей аорты или энтероколическим лимфоцитарным флебитом [99].
Облитерирующий тромбангиит поражает мелкие и средние артерии и вены конечностей. При этой патологии могут наблюдаться воспалительные тромбозы, но поражение стенок кровеносных сосудов менее выражено по сравнению с теми, которые наблюдаются у пациентов с системными васкулитами [100]. Облитерирующий тромбоангиит наиболее часто встречается у молодых курящих мужчин [100]. У пациентов чаще всего наблюдается подострая ишемическая перемежающаяся хромота с частым развитием изъязвлений. Поражение ЖКТ встречается редко, но имеет плохой прогноз [101]. Вовлечение брыжейки с ишемией тонкой кишки может произойти в любое время, а в некоторых случаях даже может быть единственным проявлением заболевания [102]. Также могут быть вовлечены чревные, желудочные или другие висцеральные артерии [101]. На ангиографии, как правило, можно увидеть множественные сосудистые окклюзии с извилистой коллатерализацией [101]. Лечение обычно включает вазодилататоры, в том числе инфузии аналога простациклина, и обязательное прекращение курения. Иммунодепрессанты не проявили эффективности при этом заболевании, поэтому их применение является бесполезным [103]. Иногда хирургическое вмешательство неизбежно, при облитерирующем желудочно-кишечном тромбангиите часто требуется экстренная лапаротомия для резекции сегментов ишемии кишечника, пациентам присуща высокая периоперационная смертность (~ 30 %) [101]. В хронических случаях может потребоваться шунтирование.
У пациентов с подтвержденным васкулитом диагностика и лечение самостоятельных заболеваний ЖКТ, осложняющих течение основного заболевания, может быть сложной и трудной задачей, их трудно отличить от обострения васкулита. Эти осложнения включают стресс и/или ГК-индуцированный гастрит, эзофагит, язвы и/или инфекции, такие как вирус герпеса, цитомегаловирус, кандида, паразитарные агенты или бактерии. Эндоскопическое исследование, ангиография и/или биопсия необходимы для постановки правильного диагноза и назначения лечения.
Выводы
1. Желудочно-кишечные проявления редко являются преобладающими признаками системных васкулитов, но часто представляют собой угрожающие жизни состояния. Заболеваемость и смертность, связанные с тяжелыми желудочно-кишечными проявлениями, остаются высокими.
2. Поражение ЖКТ достаточно редко встречается при васкулитах крупных сосудов и обусловлено стенозом или окклюзией крупных сосудов с ишемическими проявлениями.
3. Васкулиты сосудов мелкого калибра могут вызывать различные желудочно-кишечные проявления, включая пурпуру слизистой оболочки, которая значительно повышает риск кровотечений, а также гранулематозные или ишемические язвенные поражения, которые могут вызывать перфорацию кишечника или имитировать ВЗК.
4. Вовлечение печени редко является клинически значимым симптомом при системных васкулитах, за исключением инфаркта вследствие окклюзий артерий при васкулитах сосудов большого или среднего калибра и синдрома Бадда — Киари у пациентов с болезнью Бехчета.
5. Лечение желудочно-кишечных проявлений должно быть незамедлительным, адаптированным к тяжести болезни и проводиться в сотрудничестве с ревматологами, гастроэнтерологами и хирургами.
6. Пациенты с васкулитом одного органа (ЖКТ) должны быть подвергнуты тщательному дообследованию для исключения развития системного васкулита, хотя такая прогрессия наблюдается максимум у одной четверти больных в течение последующих 5 лет.
7. Боль в животе может быть ранним признаком ишемической перфорации. Врачи должны всегда быть настороже и внимательно наблюдать за своими пациентами с известными системными заболеваниями при появлении жалоб на необычные и особенно впервые проявившиеся желудочно-кишечные симптомы.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Jennette J.C., Falk R.J., Bacon P.A., et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis. Rheum. 2013. Vol. 65, № 1. P. 1-11. doi: 10.1002/art.37715.
2. Hatemi I., Hatemi G., Çelik A.F. Systemic vasculitis and the gut. Curr. Opin. Rheumatol. 2017. Vol. 29, № 1. P. 33. DOI: 10.1097/BOR.0000000000000344.
3. Guillevin L., Lhote F., Gayraud M., et al. Prognostic factors in polyarteritis nodosa and Churg-Strauss syndrome. A prospective study in 342 patients. Medicine (Baltimore). 1996. Vol. 75, № 1. P. 17-28. DOI: 10.1097/00005792-199601000-00003.
4. Stone J.R., Wilkins L.R. Acute mesenteric ischemia. Tech. Vasc. Interv. Radiol. 2015. Vol. 18, № 1. P. 24-30. doi: 10.1053/j.tvir.2014.12.004.
5. Gong E.J., Kim do H., Chun J.H., et al. Endoscopic findings of upper gastrointestinal involvement in primary vasculitis. Gut Liver. 2016. Vol. 10, № 4. P. 542-548. doi: 10.5009/gnl15198.
6. Mason J.C. Takayasu arteritis: surgical interventions. Curr. Opin. Rheumatol. 2015. Vol. 27, № 1. P. 45-52. DOI: 10.1097/BOR.0000000000000127.
7. Schmidt J., Kermani T.A., Bacani A.K., et al. Diagnostic features, treatment, and outcomes of Takayasu arteritis in a US cohort of 126 patients. Mayo Clin. Proc. 2013. Vol. 88, № 8. P. 822-830. doi: 10.1016/j.mayocp.2013.04.025.
8. Reddi A., Chetty R. Primary aorto-esophageal fistula due to Takayasu’s aortitis. Cardiovasc. Pathol. 2003. Vol. 12, № 2. P. 112-114.
9. Durant C., Martin J., Hervier B., Gournay J., Hamidou M. Takayasu arteritis associated with hepatic sinusoidal dilatation. Ann. Hepatol. 2011. Vol. 10, № 4. P. 559-61.
10. Sy A., Khalidi N., Dehghan N., et al. Vasculitis in patients with inflammatory bowel diseases: a study of 32 patients and systematic review of the literature. Semin. Arthritis. Rheum. 2016. Vol. 45, № 4. P. 475-482. doi: 10.1016/j.semarthrit.2015.07.006.
11. Terao C., Matsumura T., Yoshifuji H., et al. Takayasu arteritis and ulcerative colitis: high rate of co-occurrence ratio and genetic overlap. Arthritis. Rheumatol. 2015. Vol. 67, № 8. P. 2226-2232. doi: 10.1002/art.39157.
12. Drigo I., Saccari A., Bacchin C., et al. Glucocorticoid resistance in a girl with Takayasu’s arteritis. Ann. Rheum. Dis. 2006. Vol. 65, № 5. P. 689-691. doi: 10.1136/ard.2005.040162.
13. Koster M.J., Matteson E.L., Warrington K.J. Recent advances in the clinical management of giant cell arteritis and Takayasu arteritis. Curr. Opin. Rheumatol. 2016. Vol. 28, № 3. P. 211-217. doi: 10.1097/BOR. 0000000000000265.
14. Mekinian A., Comarmond C., Resche-Rigon M., et al. Efficacy of biological-targeted treatments in Takayasu arteritis: multicenter, retrospective study of 49 patients. Circulation. 2015. Vol. 132, № 18. P. 1693-1700. doi: 10.1161/CIRCULATIONAHA.114.014321.
15. Scola C.J., Li C., Upchurch K.S. Mesenteric involvement in giant cell arteritis. An underrecognized complication? Analysis of a case series with clinicoanatomic correlation. Medicine (Baltimore). 2008. Vol. 87, № 1. P. 45-51. doi: 10.1097/MD. 0b013e3181646118.
16. Gonzalez-Gay M.A., Pina T. Giant cell arteritis and polymyalgia rheumatica: an update. Curr. Rheumatol. Rep. 2015. Vol. 17, № 2. P. 6. doi: 10.1007/s11926-014-0480-1.
17. Nayar A.K., Casciello M., Slim J.N., Slim A.M. Fatal Aortic Dissection in a Patient with Giant Cell Arteritis: A Case Report and Review of the Literature. Case Rep. Vasc. Med. 2013. Vol. 2013. P. 590-721. doi: 10.1155/2013/590721.
18. Bienvenu B., Ly K.H., Lambert M., et al. Management of giant cell arteritis: recommendations of the French Study Group for Large Vessel Vasculitis (GEFA). Rev. Med. Interne. 2016. 37 (3). 154-165. doi: 10.1016/j.revmed.2015.12.015.
19. Xu J., Bjornsson E.S., Sundaram V. Severe cholestatic hepatitis due to large vessel vasculitis: report of two cases. Gastroenterol. Rep. 2018. Vol. 6, № 1. P. 68-71. http://dx.doi.org/10.1093/gastro/gov061.
20. Lee S., Childerhouse A., Moss K. Gastrointestinal symptoms and granulomatous vasculitis involving the liver in giant cell arteritis: a case report and review of the literature. Rheumatology. 2011. Vol. 50, № 12. P. 2316-2317. https://doi.org/10.1093/rheumatology/ker278.
21. Mahr A.D., Jover J.A., Spiera R.F., et al. Adjunctive methotrexate for treatment of giant cell arteritis: an individual patient data meta-analysis. Arthritis. Rheum. 2007. 56 (8). Р. 2789-2797. DOI: 10.1002/art.22754.
22. Villiger P.M., Adler S., Kuchen S., et al. Tocilizumab for induction and maintenance of remission in giant cell arteritis: a phase 2, randomised, double-blind, placebo-controlled trial. Lancet. 2016. Vol. 387, № 10031. P. 1921-1927. doi: 10.1016/S0140-6736(16)00560-2.
23. Stone J.H., Tuckwell K., Dimonaco S., et al. Trial of Tocilizumab in Giant-Cell Arteritis. N. Engl. J. Med. 2017. Vol. 377, № 4. P. 317-328. doi: 10.1056/NEJMoa1613849.
24. Langford C.A., Cuthbertson D., Ytterberg S.R., et al. A Randomized, Double-Blind Trial of Abatacept (CTLA-4Ig) for the Treatment of Giant Cell Arteritis. Arthritis. Rheum. 2017. Vol. 69, № 4. P. 837-845. doi: 10.1002/art.40044.
25. De Virgilio A., Greco A., Magliulo G., et al. Polyarteritis nodosa: A contemporary overview. Autoimmun Rev. 2016. Vol. 15, № 6. P. 564-70. doi: 10.1016/j.autrev.2016.02.015.
26. Li S.J., Xu S.T., Chen H.P., et al. Clinical and morphologic spectrum of renal involvement in patients with HBV-associated cryoglobulinemia. Nephrology. 2016. Vol. 22, № 6. P. 449-455. http://dx.doi.org/10.1111/nep.12795.
27. Singhal M., Gupta P., Sharma A., et al. Role of multidetector abdominal CT in the evaluation of abnormalities in polyarteritis nodosa. Clin. Radiol. 2016. Vol. 71, № 3. P. 222-227. doi: 10.1016/j.crad.2015.11.004.
28. Pagnoux C., Mahr A., Cohen P., Guillevin L. Presentation and outcome of gastrointestinal involvement in systemic necrotizing vasculitides: analysis of 62 patients with polyarteritis nodosa, microscopic polyangiitis, Wegener granulomatosis, Churg-Strauss syndrome, or rheumatoid arthritis-associated vasculitis. Medicine (Baltimore). 2005. Vol. 84, № 2. P. 115-128. DOI: 10.1097/01.md.0000158825.87055.0b.
29. Bourgarit A., Le Toumelin P., Pagnoux C., et al. Deaths occurring during the first year after treatment onset for polyarteritis nodosa, microscopic polyangiitis, and Churg-Strauss syndrome: a retrospective analysis of causes and factors predictive of mortality based on 595 patients. Medicine (Baltimore). 2005. Vol. 84, № 5. P. 323-330. DOI: 10.1097/01.md.0000180793.80212.17.
30. Pagnoux C., Seror R., Henegar C., et al. Clinical features and outcomes in 348 patients with polyarteritis nodosa: a systematic retrospective study of patients diagnosed between 1963 and 2005 and entered into the French Vasculitis Study Group Database. Arthritis. Rheum. 2010. Vol. 62, № 6. P. 616-626. doi: 10.1002/art.27240.
31. Soowamber M., Weizman A.V., Pagnoux C. Gastrointestinal aspects of vasculitides. Nat. Rev. Gastroenterol. Hepatol. 2017. Vol. 14, № 3. P. 185-194. doi: 10.1038/nrgastro.2016.179.
32. Sharma A., Gopalakrishan D., Nada R., et al. Uncommon presentations of primary systemic necrotizing vasculitides: the Great Masquerades. Int. J. Rheum. Dis. 2014. Vol. 17, № 5. P. 562-572. doi: 10.1111/1756-185X.12223.
33. Samson M., Puéchal X., Devilliers H., et al. Long-term follow-up of a randomized trial on 118 patients with polyarteritis nodosa or microscopic polyangiitis without poor-prognosis factors. Autoimmun. Rev. 2014. Vol. 13, № 2. P. 197-205. doi: 10.1016/j.autrev.2013.10.001.
34. Puechal X., Baron G., Quémeneur T., et al. Does adding azathioprine to glucocorticoid induction increase the remission rate and prevent relapses in patients with systemic necrotizing vasculitides without poor-prognosis factors? A multicenter, double-blind randomized controlled trial [abstract]. Arthritis. Rheum. 2015. Vol. 67, № 10. P. 1086. http://dx.doi.org/10.1136/annrheumdis-2016-eular.6204.
35. Baker A.L., Lu M., Minich L.L., et al. Associated symptoms in the ten days before diagnosis of Kawasaki disease. J. Pediatr. 2009. Vol. 154, № 4. P. 592-595.e2. doi: 10.1016/j.jpeds.2008.10.006.
36. Zulian F., Falcini F., Zancan L., et al. Acute surgical abdomen as presenting manifestation of Kawasaki disease. J. Pediatr. 2003. Vol. 142, № 6. P. 731-735. DOI: 10.1067/mpd.2003.232.
37. Singh R., Ward C., Walton M., Persad R. Atypical Kawasaki disease and gastrointestinal manifestations. Paediatr. Child Health. 2007. Vol. 12, № 3. P. 235-237. DOI: 10.1093/pch/12.3.235.
38. Fraison J.B., Sève P., Dauphin C., et al. Kawasaki disease in adults: observations in France and literature review. Autoimmun. Rev. 2016. Vol. 15, № 3. P. 242-249. doi: 10.1016/j.autrev.2015.11.010.
39. Yim D., Curtis N., Cheung M., Burgner D. An update on Kawasaki disease II: clinical features, diagnosis, treatment and outcomes. J. Paediatr. Child Health. 2013. Vol. 49, № 8. P. 614-623. doi: 10.1111/jpc.12221.
40. Newburger J.W., Takahashi M., Gerber M.A. et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Pediatrics. 2004. Vol. 114, № 6. P. 1708-1733. DOI: 10.1542/peds.2004-2182.
41. Shulman S.T., Rowley A.H. Kawasaki disease: insights into pathogenesis and approaches to treatment. Nat. Rev. Rheumatol. 2015. Vol. 11, № 8. P. 475-482. doi: 10.1038/nrrheum.2015.54.
42. Ha H.K., Lee S.H., Rha S.E., et al. Radiologic features of vasculitis involving the gastrointestinal tract. Radiographics. 2000. Vol. 20, № 3. P. 779-794. DOI: 10.1148/radiographics.20.3.g00mc02779.
43. Murosaki T., Sato T., Akiyama Y., Nagatani K., Minota S. Difference in relapse-rate and clinical phenotype by autoantibody-subtype in Japanese patients with anti-neutrophil cytoplasmic antibody-associated vasculitis. Mod. Rheumatol. 2017. Vol. 27, № 1. P. 95-101. doi: 10.1080/14397595.2016.1192760.
44. Nay J., Menias C.O., Mellnick V.M., Balfe D.M. Gastrointestinal manifestations of systemic disease: a multimodality review. Abdom. Imaging. 2015. Vol. 40, № 6. P. 1926-1943. doi: 10.1007/s00261-014-0334-3.
45. Akbulut S. Multiple ileal perforations in a patient with Wegener’s granulomatosis: a case report and literature review. J. Gastrointest. Surg. 2012. Vol. 16, № 4. P. 857-862. doi: 10.1007/s11605-011-1735-z.
46. Nay J., Menias C.O., Mellnick V.M., Balfe D.M. Gastrointestinal manifestations of systemic disease: a multimodality review. Abdom. Imaging. 2015. Vol. 40, № 6. P. 1926-1943. doi: 10.1007/s00261-014-0334-3.
47. Humbert S., Guilpain P., Puéchal X., et al. Inflammatory bowel diseases in anti-neutrophil cytoplasmic antibody-associated vasculitides: 11 retrospective cases from the French Vasculitis Study Group. Rheumatology. 2015. Vol. 54, № 11. P. 1970-1975. doi: 10.1093/rheumatology/kev199.
48. Valerieva Y., Golemanov B., Tzolova N., Mitova, R. Pancreatic mass as an initial presentation of severe Wegener’s granulomatosis. Ann. Gastroenterol. 2013. Vol. 26, № 3. P. 267-269.
49. Schirmer J.H., Wright M.N., Vonthein R., et al. Clinical presentation and long-term outcome of 144 patients with microscopic polyangiitis in a monocentric German cohort. Rheumatology. 2016. Vol. 55, № 1. P. 71-9. doi: 10.1093/rheumatology/kev286.
50. Groh M., Pagnoux C., Baldini C., et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur. J. Intern. Med. 2015. Vol. 26, № 7. P. 545-53. doi: 10.1016/j.ejim.2015.04.022.
51. Comarmond C., Pagnoux C., Khellaf M., et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss): clinical characteristics and long-term followup of the 383 patients enrolled in the French Vasculitis Study Group cohort. Arthritis. Rheum. 2013. Vol. 65, № 1. P. 270-81. doi: 10.1002/art.37721.
52. Tsurikisawa N., Oshikata C., Tsuburai T., et al. Th17 cells reflect colon submucosal pathologic changes in active eosinophilic granulomatosis with polyangiitis. BMC Immunol. 2015. Vol. 16. P. 75. doi: 10.1186/s12865-015-0138-4.
53. Moosig F., Bremer J.P., Hellmich B., et al. A vasculitis centre based management strategy leads to improved outcome in eosinophilic granulomatosis and polyangiitis (Churg-Strauss, EGPA): monocentric experiences in 150 patients. Ann. Rheum. Dis. 2013. Vol. 72, № 6. P. 1011-7. doi: 10.1136/annrheumdis-2012-201531.
54. Flossmann O., Berden A., de Groot K., et al. Long-term patient survival in ANCA-associated vasculitis. Ann. Rheum. Dis. 2011. Vol. 70, № 3. P. 488-94. doi: 10.1136/ard.2010.137778.
55. Синяченко О.В., Ермолаева М.В., Седая Л.В., Бевзенко Т.Б., Егудина ЕД. Эффективность лечения ANCA-ассоциированных системных васкулитов. Український терапевтичний журнал. 2016. № 1. С. 36-43.
56. Stone J.H., Merkel P.A., Spiera R., et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N. Engl. J. Med. 2010. Vol. 363, № 3. P. 221-32. doi: 10.1056/NEJMoa0909905.
57. Wechsler M.E., Akuthota P., Jayne D., et al. Mepolizumab or Placebo for Eosinophilic Granulomatosis with Polyangiitis. N. Engl. J. Med. 2017. Vol. 376, № 20. P. 1921-1932. doi: 10.1056/NEJMoa1702079.
58. McGeoch L., Twilt M., Famorca L., et al. CanVasc recommendations for the management of antineutrophil cytoplasm antibody-associated vasculitides. J. Rheumatol. 2016. Vol. 43, № 1. P. 97-120. doi: 10.3899/jrheum.150376.
59. Чернышова О.Е., Герасименко В.В., Егудина Е.Д., Синяченко О.В., Ермолаева М.В. Эволюция ювенильной пурпуры Шенлайна-Геноха. Здоровье ребенка. 2016. T. 7, № 75. С. 85-89. DOI: 10.22141/2224-0551.7.75.2016.86730.
60. Ebert E.C. Gastrointestinal manifestations of Henoch-Schönlein purpura. Dig. Dis. Sci. 2008. Vol. 53, № 8. P. 2011-9. doi: 10.1007/s10620-007-0147-0.
61. Esaki M., Matsumoto T., Nakamura S., et al. Gastrointestinal involvement in Henoch-Schönlein purpura. Gastrointest. Endosc. 2002. Vol. 56, № 6. P. 920-923. DOI: 10.1067/mge.2002.129592.
62. Sampat H.N., McAllister B.P., Gaines D.D., Ostrov B. Terminal ileitis as a feature of Henoch-Schönlein purpura masquerading as Crohn disease in adults. J. Clin. Rheumatol. 2016. Vol. 22, № 2. P. 82-5. doi: 10.1097/RHU.0000000000000361.
63. Nam E.J., Kim G.W., Kang J.W., et al. Gastrointestinal bleeding in adult patients with Henoch-Schönlein purpura. Endoscopy. 2014. Vol. 46, № 11. P. 981-6. doi: 10.1055/s-0034-1377757.
64. Chao H.C., Kong M.S., Lin S.J. Hepatobiliary involvement of Henoch-Schönlein purpura in children. Acta Paediatr. Taiwan. 2000. Vol. 41. P. 63-68.
65. Kanik A., Baran M., Ince F.D., et al. Faecal calprotectin levels in children with Henoch- Schönlein purpura: is this a new marker for gastrointestinal involvement? Eur. J. Gastroenterol. Hepatol. 2015. Vol. 27. P. 254-258. DOI: 10.1097/MEG.0000000000000284.
66. Audemard-Verger A., Pillebout E., Guillevin L., Thervet E., Terrier B. IgA vasculitis (Henoch-Shönlein purpura) in adults: diagnostic and therapeutic aspects. Autoimmun. Rev. 2015. Vol. 14, № 7. P. 579-85. doi: 10.1016/j.autrev.2015.02.003.
67. Pillebout E., Alberti C., Guillevin L., et al. Addition of cyclophosphamide to steroids provides no benefit compared with steroids alone in treating adult patients with severe Henoch Schönlein purpura. Kidney Int. 2010. Vol. 78, № 5. P. 495-502. doi: 10.1038/ki.2010.150.
68. Chou T., Louissant V.R., Adams A., et al. Successful treatment of Henoch-Schönlein purpura with recurrent gastrointestinal involvement with mycophenolate mofetil: a brief report. Clin. Pediatr. 2015. Vol. 54, № 9. P. 900-3. doi: 10.1177/0009922814568288.
69. Fotis L., Tuttle P.V. 4th, Baszis K.W., Pepmueller P.H., Moore T.L., White A.J. Azathioprine therapy for steroidresistant Henoch-Schönlein purpura: a report of 6 cases. Pediatr. Rheumatol. Online J. 2016. Vol. 14, № 1. P. 37. doi: 10.1186/s12969-016-0100-x.
70. Başaran Ö., Cakar N., Uncu N., et al. Plasma exchange therapy for severe gastrointestinal involvement of Henoch Schönlein purpura in children. Clin. Exp. Rheumatol. 2015. Vol. 33, № 2. P. 176-80.
71. Cacoub P., Comarmond C., Domont F., Savey L., Saadoun D. Cryoglobulinemia vasculitis. Am. J. Med. 2015. Vol. 128, № 9. P. 950-5. doi: 10.1016/j.amjmed.2015.02.017.
72. Retamozo S., Díaz-Lagares C., Bosch X., et al. Life-threatening cryoglobulinemic patients with hepatitis C: clinical description and outcome of 279 patients. Medicine (Baltimore). 2013. Vol. 92, № 5. P. 273-284. http:// dx.doi.org/10.1097/MD.0b013e3182a5cf71.
73. Ferri C., Sebastiani M., Giuggioli D., et al. Mixed cryoglobulinemia: demographic, clinical, and serologic features and survival in 231 patients. Semin. Arthritis. Rheum. 2004. Vol. 33, № 6. P. 355-374.
74. Terrier B., Semoun O., Saadoun D., et al. Prognostic factors in patients with hepatitis C virus infection and systemic vasculitis. Arthritis. Rheum. 2011. Vol. 63, № 6. P. 1748-57. doi: 10.1002/art.30319.
75. Terrier B., Carrat F., Krastinova E., et al. Prognostic factors of survival in patients with non-infectious mixed cryoglobulinaemia vasculitis: data from 242 cases included in the CryoVas survey. Ann. Rheum. Dis. 2013. Vol. 72, № 3. P. 374-80. doi: 10.1136/annrheumdis-2012-201405.
76. Sise M.E., Bloom A.K., Wisocky J., et al. Treatment of hepatitis C virus-associated mixed cryoglobulinemia with direct-acting antiviral agents. Hepatology. 2016. Vol. 63, № 2. P. 408-17. doi: 10.1002/hep.28297.
77. Saadoun D., Rigon M.R., Thibault V., et al. Peg-IFNα/ribavirin/protease inhibitor combination in hepatitis C virus associated mixed cryoglobulinemia vasculitis: results at week 24. Ann. Rheum. Dis. 2014. Vol. 73, № 5. P. 831-837. doi: 10.1136/annrheumdis-2012-202770.
78. Ho A.C., Roat M.I., Venbrux A., Hellmann D.B. Cogan’s syndrome with refractory abdominal aortitis and mesenteric vasculitis. J. Rheumatol. 1999. Vol. 26, № 6. P. 1404-7.
79. Skef W., Hamilton M.J., Arayssi T. Gastrointestinal Behçet’s disease: a review. World J. Gastroenterol. 2015. Vol. 21, № 13. P. 3801-12. doi: 10.3748/wjg.v21.i13.3801.
80. Lee S.K., Kim B.K., Kim T.I., Kim W.H. Differential diagnosis of intestinal Behçet’s disease and Crohn’s disease by colonoscopic findings. Endoscopy. 2009. Vol. 41, № 1. P. 9-16. doi: 10.1055/s-0028-1103481.
81. Vaiopoulos A.G., Sfikakis P.P., Kanakis M.A., Vaiopoulos G., Kaklamanis P.G. Gastrointestinal manifestations of Behçet’s disease: advances in evaluation and management. Clin. Exp. Rheumatol. 2014. Vol. 32, № 4. P. 140-8.
82. Zeidan M.J., Saadoun D., Garrido M., et al. Behçet’s disease physiopathology: a contemporary review. Auto Immun. Highlights. 2016. Vol. 7, № 1. P. 4. doi: 10.1007/s13317-016-0074-1.
83. Moon C.M., Cheon J.H., Shin J.K., et al. Prediction of free bowel perforation in patients with intestinal Behçet’s disease using clinical and colonoscopic findings. Dig. Dis. Sci. 2010. Vol. 55, № 10. P. 2904-11. doi: 10.1007/s10620-009-1095-7.
84. Desbois A.C., Rautou P.E., Biard L., et al. Behcet’s disease in Budd-Сhiari syndrome. Orphanet. J. Rare Dis. 2014. Vol. 9. P. 104. doi: 10.1186/s13023-014-0153-1.
85. Tanida S., Inoue N., Kobayashi K., et al. Adalimumab for the treatment of Japanese patients with intestinal Behçet’s disease. Clin. Gastroenterol. Hepatol. 2015. Vol. 13, № 5. P. 940-8.e3. doi: 10.1016/j.cgh.2014.08.042.
86. Hatemi G., Silman A., Bang D., et al. EULAR recommendations for the management of Behçet disease. Ann. Rheum. Dis. 2008. Vol. 67, № 12. P. 1656-62. doi: 10.1136/ard.2007.080432.
87. Han S.W., Kim G.W., Lee J., Kim Y.J., Kang Y.M. Successful treatment with stent angioplasty for Budd-Chiari syndrome in Behçet’s disease. Rheumatol. Int. 2005. Vol. 25, № 3. P. 234-237. DOI: 10.1007/s00296-004-0495-4.
88. Naganuma M., Iwao Y., Inoue N., et al. Analysis of clinical course and long-term prognosis of surgical and nonsurgical patients with intestinal Behçet’s disease. Am. J. Gastroenterol. 2000. Vol. 95, № 10. P. 2848-2851. DOI: 10.1111/j.1572-0241.2000.03198.x.
89. Fawzy M., Edrees A., Okasha H., El Ashmaui A., Ragab G. Gastrointestinal manifestations in systemic lupus erythematosus. Lupus. 2016. Vol. 25, № 13. P. 1456-1462. doi: 10.1177/0961203316642308.
90. Barile-Fabris L., Hernandez-Cabrera M.F., Barragan-Garfias J.A. Vasculitis in systemic lupus erythematosus. Curr. Rheumatol. Rep. 2014. Vol. 16, № 9. P. 440. doi: 10.1007/s11926-014-0440-9.
91. Janssens P., Arnaud L., Galicier L., et al. Lupus enteritis: from clinical findings to therapeutic management. Orphanet. J. Rare Dis. 2013. Vol. 8. P. 67. doi: 10.1186/1750-1172-8-67.
92. Yuan S., Ye Y., Chen D., et al. Lupus mesenteric vasculitis: clinical features and associated factors for the recurrence and prognosis of disease. Semin. Arthritis. Rheum. 2014. Vol. 43, № 6. P. 759-66. doi: 10.1016/j.semarthrit.2013.11 .005.
93. Ju J.H., Min J.K., Jung C.K., et al. Lupus mesenteric vasculitis can cause acute abdominal pain in patients with SLE. Nat. Rev. Rheumatol. 2009. Vol. 5, № 5. P. 273-81. doi: 10.1038/nrrheum.2009.53.
94. Makol A., Crowson C.S., Wetter D.A., et al. Vasculitis associated with rheumatoid arthritis: a case-control study. Rheumatology. 2014. Vol. 53, № 5. P. 890-9. doi: 10.1093/rheumatology/ket475.
95. Ntatsaki E., Mooney J., Scott D.G., Watts R.A. Systemic rheumatoid vasculitis in the era of modern immunosuppressive therapy. Rheumatology. 2014. Vol. 53, № 1. P. 145-152. https://doi.org/10.1093/rheumatology/ket326.
96. Ebert E.C., Hagspiel K.D. Gastrointestinal and hepatic manifestations of rheumatoid arthritis. Dig. Dis. Sci. 2011. Vol. 56, № 2. P. 295-302. doi: 10.1007/s10620-010-1508-7.
97. Hernandez-Rodriguez J., Tan C.D., Rodriguez E.R., Hoffman G.S. Single-organ gallbladder vasculitis: characterization and distinction from systemic vasculitis involving the gallbladder. An analysis of 61 patients. Medicine (Baltimore). 2014. Vol. 93, № 24. P. 405-413. doi: 10.1097/MD.0000000000000205.
98. Salvarani C., Calamia K.T., Crowson C.S., et al. Localized vasculitis of the gastrointestinal tract: a case series. Rheumatology. 2010. Vol. 49, № 7. P. 1326-35. doi: 10.1093/rheumatology/keq093.
99. Kamisawa T., Zen Y., Pillai S., Stone J.H. IgG4-related disease. Lancet. 2015. Vol. 385, № 9976. P. 1460-71. doi: 10.1016/S0140-6736(14)60720-0.
100. Olin J.W., Shih A. Thromboangiitis obliterans (Buerger’s disease). Curr. Opin. Rheumatol. 2006. Vol. 18, № 1. P. 18-24.
101. Lee K.S., Paik C.N., Chung W.C., et al. Colon ischemia associated with Buerger’s disease: case report and review of the literature. Gut Liver. 2010. Vol. 4, № 2. P. 287-291. doi: 10.5009/gnl.2010.4.2.287.
102. Hassoun Z., Lacrosse M., De Ronde T. Intestinal involvement in Buerger’s disease. J. Clin. Gastroenterol. 2001. Vol. 32, № 1. P. 85-89. DOI: 10.1097/00004836-200101000-00020.
103. Cacione D.G., Macedo C.R., Baptista-Silva J.C. Pharmacological treatment for Buerger’s disease. Cochrane Database Syst. Rev. 2016. Vol. 2. CD011033. doi: 10.1002/14651858.CD011033.pub2.

/103-1.jpg)