Журнал «Здоровье ребенка» Том 14, №7, 2019
Вернуться к номеру
Характеристика сенсибілізації і досвід використання дезлоратадину в лікуванні сезонного алергічного риніту в дітей
Авторы: Марушко Ю.В., Московенко О.Д.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Останніми роками відмічається значне зростання кількості алергічних захворювань, у тому числі алергічного риніту, серед дітей і дорослих, що негативно впливає на стан загального благополуччя населення. Мета дослідження: узагальнити дані літератури та власний досвід визначення причинно-значимих алергенів і використання дезлоратадину в терапії алергічних сезонних ринітів у дітей. Матеріали та методи. Під спостереженням перебувало 28 дітей із гострими проявами сезонного алергічного риніту віком від 5 до 14 років. У всіх дітей мали місце клінічні симптоми гострого риніту. Діагноз підтверджувався імунологічними методами. Усім пацієнтам на початку лікування проводили мультикомпонентний алерготест АLEX, що визначає антитіла до 282 екстрактів і молекул алергенів, включно з рівнем загального IgE. Як базисну терапію використовували блокатор Н1-гістамінових рецепторів дезлоратадин (Едем). Результати. Серед обстежених 28 дітей із проявами алергічного риніту основною причиною сезонної сенсибілізації був мажорний алерген амброзії (у 16 (54,1 %) дітей). Сенсибілізація до весняних дерев також була досить високою. Так, до мажорного алергену берези й вільхи сенсибілізація була виявлена в 35,7 і 29,3 % дітей відповідно. Сенсибілізація до трав тимофіївки й плевелу багаторічного посідала третє місце за поширеністю. Позитивна динаміка в лікуванні дезлоратадином дітей з алергічним ринітом відмічалася в усіх пацієнтів. Уже на 3-й день лікування діти відмічали зменшення інтенсивності більшості симптомів алергічного риніту, на 10-й день лікування практично зникали всі симптоми риніту. Побічних дій при застосуванні дезлоратадину не спостерігалося.
Актуальность. В последние годы отмечается значительный рост аллергических заболеваний, в том числе аллергического ринита, среди детей и взрослых, что негативно влияет на состояние общего благополучия населения. Цель исследования: обобщить данные литературы и собственный опыт определения причинно-значимых аллергенов и использования дезлоратадина в терапии аллергических сезонных ринитов у детей. Материалы и методы. Под наблюдением находилось 28 детей с проявлениями сезонного аллергического ринита в возрасте от 5 до 14 лет. У всех детей отмечали клинические симптомы острого ринита. Диагноз подтверждался иммунологическими методами. Всем пациентам в начале лечения проводили мультикомпонентный аллерготест ALEX, который определяет антитела к 282 экстрактам и молекулам аллергенов, включая уровень общего IgE. В качестве базисной терапии использовали блокатор Н1-гистаминовых рецепторов дезлоратадин (Эдем). Результаты. Среди обследованных 28 детей с явлениями аллергического ринита основной причиной сезонной сенсибилизации являлся мажорный аллерген амброзии (у 16 детей (54,1 %)). Сенсибилизация к весенним деревьям также была достаточно высокой. Так, к мажорному аллергену березы и ольхи сенсибилизация была выявлена у 35,7 и 29,3 % детей соответственно. Сенсибилизация к травам тимофеевке и плевелу многолетнему занимала третье место по распространенности. Позитивная динамика в лечении дезлоратадином детей с аллергическим ринитом отмечалась у всех пациентов. Уже на 3-й день лечения дети отмечали уменьшение интенсивности большинства симптомов аллергического ринита, на 10-й день лечения практически исчезали все симптомы ринита. Побочных реакций при использовании дезлоратадина не наблюдалoсь.
Background. In recent years, there has been a significant increase in allergic diseases, including allergic rhinitis, among children and adults. It negatively affects overall health. The purpose of this work is to summarize the literature data and our own experience in the identification of cause-significant allergens and the use of desloratadine in the treatment of allergic seasonal rhinitis in children. Materials and methods. We have examined 28 children with manifestations of seasonal allergic rhinitis aged 5 to 14 years. All children noted clinical symptoms of acute rhinitis. The diagnosis was confirmed by immunological methods. At the beginning of treatment, all patients used ALEX multi-component allergy test, which determines antibodies to 282 extracts and allergen molecules, including the level of total IgE. Desloratadine (Edem), a histamine H1-receptor antagonist, was used as basic therapy. Results. Among the examined 28 children with allergic rhinitis, the main cause of seasonal sensitization is the major allergen of ragweed (in 16 (54.1 %) patients). Sensitization to spring trees was also quite high. So, sensitization to the major allergens of birch and alder was detected in 35.7 and 29.3 % of children, respectively. Sensitization to timothy grass and rye grass was the third most common. Positive dynamics with desloratadine treatment of children with allergic rhinitis was observed in all patients. Already on day 3 of treatment, children noted a decrease in the severity of most allergic rhinitis symptoms, on day 10, all the symptoms of rhinitis almost disappeared. Adverse reactions were not observed when using desloratadine.
алергічний риніт; діти; діагностика; лікування; дезлоратадин
аллергический ринит; дети; диагностика; лечение; дезлоратадин
allergic rhinitis; children; diagnosis; treatment; desloratadine
Вступ
Останніми роками відзначається значне зростання кількості алергічних захворювань серед дітей і дорослих, що негативно впливає на стан загального благополуччя населення [2, 3]. На жаль, на сьогодні відсутні об’єктивні статистичні дані, які б реально відображали поширеність алергічних захворювань серед жителів України. За даними літератури відомо, що більшість населення має ті чи інші прояви алергії. Алергічний риніт (АР) посідає перші місця в структурі алергічних захворювань дитячого й дорослого населення і на сьогодні є найбільш поширеним хронічним алергічним захворюванням. За даними P.J. Turner, A.S. Kemp, АР вражає до 40 % дітей, близько 20 % дорослого населення, але частіше не діагностується. Від АР у світі страждає близько 615 млн людей [13]. Середній вік дебюту захворювання припадає на 10 років життя, а найбільше число пацієнтів, що захворіли на АР, фіксується у віці між 13 і 19 роками життя [12].
Алергічний риніт може призводити до розвитку бронхіальної астми, ускладнювати її перебіг і сприяти інвалідності в зрілому віці, особливо в пацієнтів, які мають генетичну схильність до алергії [1]. Доказом взаємозв’язку АР і БА є паралельне зростання рівня захворюваності на АР і БА, бо ці захворювання мають подібні патогенетичні механізми розвитку. Симптоми риніту присутні у 88 % хворих на БА, вони можуть суттєво погіршувати перебіг БА і в 32–49 % випадків передують її розвитку [8]. АР часто перебігає з явищами алергічного кон’юнктивіту. Клінічні прояви АР погіршують якість життя, у тому числі за рахунок втрати працездатності, перешкоджання відвідуванню дитячих навчальних закладів, погіршення сну. За статистичними даними, алергічний риніт більш поширений в економічно розвинених країнах. Так, у США АР діагностується у кожного шостого американця, що спричиняє прямі витрати на лікування цього захворювання від 2 до 5 мільярдів доларів щорічно [10].
Згідно із сучасними рекомендаціями з алергічного риніту ARIA 2017 [4], за тривалістю симптомів (періодичні чи постійні) виділяють цілорічний персистуючий і сезонний АР.
Сезонний АР частіше зустрічається в дітей шкільного віку, підлітків і молодих людей. Для нього характерний чіткий зв’язок із сезонним впливом інгаляційних алергенів — пилку трав, дерев, бур’янів, і, як правило, уникнути алергенів на практиці часто дуже складно. Сімейний алергологічний анамнез у переважній більшості випадків обтяжений.
АР являє собою хронічне алергічне запалення слизової оболонки носа, для якого в період загострення характерні такі симптоми: чхання, свербіж у носі, закладеність носа, поява слизових виділень з носа. Крім цього, хворі можуть скаржитися на загальну слабкість, підвищену дратівливість, головний біль, підвищену втомлюваність, порушення сну. При сезонному АР під час контакту з причинними алергенами в носі утворюється значна кількість слизу, що може ставати густим. Витікаючи з носових пазух по задній стінці глотки, цей слиз може бути причиною нападів кашлю.
Патогенетичним механізмом розвитку сезонного АР є IgE-обумовлена алергічна реакція термінового типу. У ранній фазі розвитку алергічної реакції головна роль належить гістаміну, що підвищує проникність судинної стінки й вазодилатацію, викликає набряк, ринорею, закладеність носа. Ці симптоми виникають у результаті взаємодії між медіаторами й нервовими, судинними й залозистими структурами в носі. Носовий свербіж, чихання й ринорея мають переважно зв’язок з нервовою іннервацією, на той час як носова обструкція обумовлена переважно судинним компонентом. Дослідження біопсії слизової носових ходів показує накопичення еозинофілів в епітелії, збільшення кількості базофілів на тканинній і клітинній поверхні й збільшення числа опасистих клітин. Це сприяє активації Т-клітин. Накопичення цих клітин пов’язують з індукцією хемокінів і цитокінів самими епітеліальними клітинами.
Через декілька годин після контакту з алергеном розвивається пізня фаза алергічної реакції, під час якої активується клітинна відповідь: адгезія циркулюючих нейтрофілів та інфільтрація тканин. Активовані запальні клітини також вивільняють прозапальні медіатори (цитокіни, лейкотрієни й простагландини), пролонгуючи й підсилюючи алергічний каскад. Ці клітинні прояви в першу чергу опосередковані Н1-рецепторами, тому антагоністи Н1-рецепторів мають виражений терапевтичний ефект [10]. Це пояснює необхідність широкого використання антигістамінних препаратів (АГП) як основних протиалергічних лікарських засобів при клінічних проявах сезонного алергічного риніту.
Ефективність лікування АР залежить від правильного діагнозу. Перш за все у хворих на сезонний АР в анамнезі клінічні прояви виникають у певний період року, причому з кожним роком ці прояви без лікування посилюються. Для підтвердження алергічної природи захворювання необхідно провести дообстеження, що включає специфічне тестування на наявність IgE-залежної сенсибілізації до сезонних інгаляційних алергенів. Шкірні прик-тести на причинні алергени в період загострення протипоказані. Часто хворі на АР не можуть чітко визначити, коли і скільки триває загострення. Тому для визначення алергічних тригерів і планування курсу лікування рекомендоване проведення молекулярної компонентної алергодіагностики.
Враховуючи, що АР — це хронічне алергічне запалення слизової оболонки верхніх дихальних шляхів, виділяють курс лікування в період загострення й у період ремісії. За останні 10 років було прийнято низку міжнародних узгоджуючих документів: ARIA — Allergic Rhinitis and its Impact on Asthma (Алергічний риніт і його вплив на астму), 2008; EAACI/EDF — European Academy of Allergology and Clinical Immunology/European Dermatology Forum, 2016 [6]. У цих документах при лікуванні гострого періоду АР рекомендований принцип ступінчастої терапії залежно від ступеня тяжкості захворювання. У дітей і дорослих при легкому перебігу АР рекомендована монотерапія неседативними Н1-блокаторами гістамінових рецепторів, при середньотяжкому перебігу АР до лікування додають топічні (назальні) глюкокортикоїди [4, 7, 9].
У численних мультицентрових подвійних сліпих плацебо-контрольованих дослідженнях, проведених останніми роками, було вірогідно показано, що АГП ІІ покоління і їх метаболіти суттєво підвищують ефективність і безпеку лікування в дітей і дорослих. Через побічні реакції АГП І покоління не рекомендовані для лікування АР у дітей і дорослих, що чітко визначено в міжнародних протоколах лікування.
До антигістамінних препаратів ІІ покоління відносять АГП, що мають виражену ефективність у блокуванні Н1-рецепторів за відсутності блокади інших видів рецепторів. У цих препаратів відсутній седативний ефект. АГП ІІ покоління здатні швидко викликати клінічний ефект з тривалим його збереженням (упродовж 24 годин) і, як правило, не викликають звикання (тахіфілаксії), вони в більшості випадків сумісні з іншими лікарськими препаратами. З огляду на їх високий профіль безпеки АГП ІІ покоління рекомендовані для лікування АР дітям і людям похилого віку.
Усім цим вимогам відповідає антигістамінний препарат ІІ покоління — первинний активний метаболіт лоратадину дезлоратадин. Він відрізняється від інших препаратів високою селективністю до Н1-рецепторів порівняно з іншими АГП — у 200 разів більше порівняно з фексофенадином, у 50 разів більше порівняно з лоратадином [5, 11]. Багатьма дослідженнями доведено, що дезлоратадин на відміну від інших АГП не викликає холіноблокуючого ефекту (сухість у роті, порушення зору, затримка сечі, запор, тахікардія). Протиалергічна дія дезлоратадину проявляється його можливістю значно пригнічувати каскад реакцій алергічного запалення, вивільняючи протизапальні цитокіни (інтерлейкін (ІЛ) 4, ІЛ-6, ІЛ-8, ІЛ-13), та IgE-опосередковане вивільнення гістаміну, простагландину D2 і лейкотрієну С4. Це запобігає алергічним реакціям чи значно полегшує їх перебіг. Клінічний ефект після прийому per os середньої терапевтичної дози дезлоратадину проявляється вже через 30 хв і триває 24 години. Препарат не викликає подовження інтервалу QT на електрокардіограмі. Вживання їжі не впливає на фармакологічні властивості препарату [14]. Для вивчення безпечності використання дезлоратадину в лікуванні АР було проведено великомасштабне дослідження його ефективності на 6 тисячах хворих, яке показало, що частота виникнення небажаних реакцій була порівнянною з такою в плацебо [15]. Багатьма дослідженнями показана висока ефективність і безпечність використання дезлоратадину в дітей [16].
Метою нашого дослідження було узагальнення даних літератури і власного досвіду визначення причинно-значимих алергенів і використання дезлоратадину в терапії алергічних сезонних ринітів у дітей.
Матеріали та методи
Під нашим спостереженням перебувало 28 дітей — 16 хлопчиків і 12 дівчаток із гострими проявами сезонного алергічного риніту віком від 5 до 14 років, які звернулися по допомогу в лікувальні заклади (в медичний центр FxMed і соматичне відділення Дитячої клінічної лікарні № 8 м. Києва) упродовж весняно-літнього періоду 2019 р. Розподіл дітей із сезонним АР за віком поданий у табл. 1. У групу спостереження відбирали хворих із клінічними проявами гострого риніту: закладеність носа, ринорея, свербіж носа й піднебіння, чхання, явища кон’юнктивіту, кашель поверхневого характеру. Головним критерієм відбору в групу спостереження була відсутність в обстежуваних клінічних проявів гострої респіраторної вірусної інфекції (ГРВІ), загострення хронічного аденоїдиту, тонзиліту, гіпертермії, контакту з хворими на ГРВІ, посилення скарг у динаміці за останні два-три роки. Усі пацієнти були оглянуті лор-лікарем для оцінки стану слизової оболонки верхніх дихальних шляхів і виключення пацієнтів із запаленням слизової оболонки бактеріальної чи вірусної природи.
При вивченні анамнезу захворювання у 22 (78,6 %) обстежуваних виявлено обтяжений сімейний алергологічний анамнез. З них у 12 (42,9 %) дітей відмічали наявність полінозу в родичів. Тривалість перебігу клінічних проявів сезонного АР в обстежуваних була різною. Так, у 9 дітей (32,1 %) прояви сезонного АР батьки відмічали останні 4–5 років, 12 дітей (42,9 %) страждали від сезонного АР останні 2–3 роки, лише 7 (25 %) дітей з групи обстежених відмічали сезонні прояви АР уперше. У 8 (28,6 %) обстежених в анамнезі були проведені різні алерготести, що констатували наявність сезонної алергії на пилок дерев, бур’янів, злаків. Алергенспецифічну імунотерапію діти з групи спостереження не отримували.
Обстежувані пацієнти після огляду й визначення діагнозу сезонного АР отримували лікування згідно з міжнародними протоколами (ARIA, 2016). Оскільки в усіх дітей спостерігали сезонний АР середнього ступеня тяжкості, як базисну терапію використовували блокатор Н1-гістамінових рецепторів дезлоратадин виробництва АТ «Фармак» (Едем). Для обстежених віком до 12 років препарат Едем використовували у вигляді сиропу з розрахунку 2,5 мг (5 мл сиропу) один раз на добу впродовж 1 міс. Для дітей віком понад 12 років рекомендували Едем у вигляді таблеток по 1 табл. (5 мг) 1 раз на добу. Препарат діти отримували незалежно від прийому їжі, не розжовуючи, запиваючи невеликою кількістю води, переважно в першій половині дня. Вісім дітей (28,6 %) із групи обстеження згідно з призначеннями алерголога отримували паралельно як базисну терапію АР монтелукаст у віковій дозі. Це були діти, у яких прояви сезонного АР відмічали протягом декількох років.
Для об’єктивної оцінки ефективність лікування сезонного АР у дітей і динаміку клінічних симптомів і їх тяжкості оцінювали в балах на 1, 3, 5, 10, 15-й день лікування. Діагностичними критеріями були: оцінка ступеня вираженості закладеності носа, інтенсивність і характер виділень з носа, свербіж носа й піднебіння, почервоніння очей і сльозотеча. Також оцінювали загальний стан пацієнтів (млявість, слабкість, загальне самопочуття) в динаміці лікування. У всіх дітей вираженість клінічних симптомів оцінювали в балах від 0 до 3. Критерії бальної оцінки основних симптомів АР наведені в табл. 2.
При кожному огляді лікар крім терапевтичної ефективності дезлоратадину в обстежуваних оцінював побічні дії, пов’язані з прийомом препарату. Безпечність дезлоратадину оцінювали на основі суб’єктивних скарг пацієнтів на слабкість, млявість, сонливість
Для підтвердження алергічної природи захворювання й визначення причинних алергенів усім пацієнтам на початку лікування проводили мультикомпонентний алерготест АLEX, що містить алергопанель на 282 екстракти й молекули алергенів, включно з рівнем загального IgE. Цей діагностичний метод на сьогодні є високоточним, надає повну картину сенсибілізації пацієнта. У плані нашого обстеження використання саме цього діагностичного дослідження було вирішальним, оскільки проведення провокаційних шкірних тестів було неможливе в умовах наявності клінічних проявів в обстежуваних для підтвердження сезонного характеру алергії. Також суттєвим було те, що на результати дослідження не впливав прийом Н1-блокаторів гістамінових рецепторів і монтелукасту. Виявлення сенсибілізації та її деталізація в плані молекулярної діагностики дає можливість спрогнозувати подальший план лікування алергічного захворювання в обстежуваних. Статистична обробка отриманих даних проводилась методом варіаційної статистики за допомогою програми Microsoft Excel 7.0; оцінювалась вірогідність показників за критерієм Стьюдента.
Результати та обговорення
Усім дітям на початку лікування було проведено дообстеження з метою виявлення етіології алергічних проявів — сенсибілізації до інгаляційних алергенів. Був застосований мультикомпонентний алерготест ALEX, що містить алергопанель на 282 екстракти й молекули алергенів, включно з рівнем загального IgE. У результаті дослідження була підтверджена алергічна природа клінічних проявів у всіх пацієнтів. Загальний рівень IgE у більшості хворих перевищував референтні значення (25 дітей, 89,3 %). Дані щодо сенсибілізації дітей до аероалергенів подані в табл. 3 і на рис. 1.
У результаті проведеного дообстеження було встановлено сенсибілізацію тільки до сезонних інгаляційних алергенів у 17 дітей (60,7 %), а в решти обстежуваних була констатована сенсибілізація як до сезонних алергенів, так і до цілорічних. Серед обстежених 28 дітей із проявами АР основною причиною сезонної сенсибілізації був мажорний алерген амброзії (16 дітей, 57,1 %). Сенсибілізація до весняних дерев також була досить високою. Так, до мажорного алергену берези й вільхи сенсибілізація була виявлена в 35,7 і 29,3 % дітей відповідно. Сенсибілізація до трав тимофіївки й плевелу багаторічного посідала третє місце за поширеністю (Phl h 1 — 32,1 % випадків, Lol p1 — 25,0 % дітей). Сенсибілізацію до мажорного алергену полину виявили лише в 6 дітей (21,4 %). Серед супутньої цілорічної сенсибілізації клінічне значення мала сенсибілізація до кліщів домашнього пилу. Істинна сенсибілізація до епідермальних алергенів кота порівняно з іншими причинними факторами зустрічалась рідко (Fel d1 — у 6 дітей, 21,43 %). Тільки в трьох дітей була виявлена сенсибілізація до мажорного алергену пліснявки альтернарії Alt a 1 (10,7 %). Рівень сенсибілізації в обстежених дітей не перевищував 2-й клас активності за шкалою алерготесту ALEX.
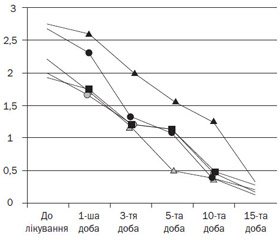
Нами вивчена динаміка клінічних проявів під впливом лікування в обстежених пацієнтів. У всіх дітей, включених у групу спостереження, до терапії відмічали закладеність носа, виділення з носа різного характеру, що супроводжувалися свербежем, сльозотечею й чханням. Динаміка клінічних проявів алергічного риніту в обстежуваних дітей на фоні лікування антигістамінним препаратом з діючою речовиною дезлоратадин (Едем) подана в табл. 4.
При порівняльному аналізі динаміки клінічних проявів АР у процесі лікування відмічалося регресування клінічних проявів уже з першої доби терапії. На третю добу лікування відмічалась позитивна динаміка в усіх хворих у вигляді вірогідного зменшення вираженості симптомів алергічного риніту — закладеності носа, зменшення виділень з носових ходів, свербежу носа, сльозотечі, почервоніння очей і чхання. Терапевтичний ефект зменшення закладеності носа був суттєвим починаючи з 5-ї доби лікування (1,57 ± 0,12 бала), на 15-й день лікування незначна закладеність носа відмічалась лише в 5 хворих (17,9 %).
Покращення характеру виділень з носа було вірогідним уже на 3-тю добу лікування (1,21 ± 0,18 бала, р < 0,05), а на 10-ту добу лікування незначні виділення з носа відмічалися лише в 4 хворих (14,3 %).
На свербіж очей до лікування скаржились усі пацієнти. Уже на 3-тю добу після початку лікування інтенсивність цього симптому почала вірогідно зменшуватися (1,32 ± 0,11 бала, р < 0,05), на 10-ту добу симптом зберігався у вигляді незначного свербежу лише в 4 хворих (14,3 %).
Почервоніння очей і сльозотеча зустрічалися на початку лікування в усіх пацієнтів, але вираженість цього симптому була середнього ступеня тяжкості, частіше він зустрічався вдень при контакті з інгаляційними сезонними алергенами. Вірогідне покращення відмічали на 3-тю й 10-ту добу лікування (1,21 ± 0,08 бала і 0,46 ± 0,10 бала відповідно, р < 0,05).
На чихання в перші три дні лікування скаржилися більшість дітей, але вже починаючи з третьої доби цей симптом відмічався рідко, поодиноко упродовж дня (1,18 ± 0,16 бала, р < 0,05), а вже після 10-го дня лікування зустрічався лише в 3 пацієнтів (10,7 %).
Лише у 2 пацієнтів (5,6 %) на 15-й день лікування залишалися всі визначені симптоми, але з мінімальним ступенем прояву. Це були діти із сімейним алергологічним анамнезом і тривалістю захворювання понад 3 роки.
Переносимість дезлоратадину (Едем) протягом 15 днів терапії була задовільною. Небажаних побічних дій на тлі його використання не було виявлено. Жодний пацієнт не відмічав сонливості, млявості, головного болю, сухості в роті.
Динаміка клінічних симптомів алергічного риніту в дітей під впливом дезлоратадину (Едем) подана на рис. 1.
Отже, проведене дослідження підтвердило алергічний генез риніту в дітей завдяки визначенню анамнезу, клініки й проведенню молекулярної алергодіагностики. Терапія дітей із сезонним АР показала високу ефективність застосування згідно з рекомендаціями ARIA антигістамінного препарату дезлоратадину Едем у терапії сезонного алергічного риніту. Такі дані дозволяють рекомендувати цей препарат для широкого використання в клінічній практиці.
Висновки
1. Алергічний риніт — актуальна проблема клінічної медицини, він суттєво погіршує якість життя пацієнтів. Встановлені причинно-значимі алергени в дітей з АР.
2. Позитивна динаміка в лікуванні АР із використанням дезлоратадину (Едем) відмічалася в усіх обстежуваних.
3. При порівняльному аналізі динаміки клінічних проявів АР у процесі лікування відмічалося регресування клінічних проявів уже з першої доби терапії. Під впливом терапії дезлоратадином (Едем) уже на 3-й день лікування в усіх пацієнтів відмічено вірогідне зменшення проявів та інтенсивності всіх симптомів алергічного риніту.
Конфлікт інтересів. Не заявлений.
1. Беш Л.В. Алергічний риніт у дітей. Здоровье ребенка. 2012. № 5(40). С. 35-37.
2. Кривопустов С.П. Острые риниты у детей. Дитячий лікар. 2009. № 1. С. 15-18.
3. Марушко Ю.В., Московенко О.Д. Комплексні препарати в терапії гострого риніту у дітей. Современная педиатрия. 2016. № 2(74). С. 84-88.
4. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines-2016 revision. J. Allergy Clin. Immunol. 2017 Oct. 140(4). 950-958. Doi10.1016/j.jaci.2017.03.050. Epub 2017 Jun 8.
5. Anthes J.C., Gilchrest H., Richard C. et al. Biochemical characterization of desloratadine, a potent antagonist of the human histamine H1 receptor. Eur. J. Pharmacol. 2002. 449. 229-37.
6. ARIA — Allergic Rhinitis and its Impact on Asthma — Allergic Rhinitis and Yoga for Asthma, 2008; EAACI/EDF — European Academy of Allergology and Clinical Immunology/European Dermatology Forum, 2016.
7. Church M.K., Maurer M., Simons F.E.R. et al. Risk of first-generation H1-antihistamines: a GA2 LEN position paper. Allergy. 2010. 65(4). 459-466.
8. Dykewicz M.S., Hamilos D.L. Rhinitis and sinusitis. J. Allergy Clin. Immunol. 2010. 125 (Suppl. 2).
9. EAACI/GA2 LEN/EDF guideline: management of urticaria. Allergy. 2006. 61. 321-331.
10. Howarth P.H., Salagean M., Dokic D. Allergic rhinitis: not only a disease associated with histamine. J. Allergy Clin. Immunol. 2012. 129 (Suppl. 4).
11. Kreutner W., Hey J.A., Anthes J. et al. Preclinical pharmacology of desloratadine, a selective and nonsedating histamine H1 receptor antagonist. 1st communication: receptor selectivity, antihistaminic activity, and antiallergenic effects. Arzneimittelforschung. 2000. 50. 345-52.
12. Meltzer E.O. et al. Sleep, quality of life, and productivity impact of nasal symptoms in the United States: findings from the Burden of Rhinitis in American survey. Allergy Asthma Proc. 2009. 30(3). 244-54.
13. Turner P.J., Kemp A.S. Allergic rhinitis in children. J. Paediatr. Children’s Health. 2012 Apr. 48(4). 302-10. Doi: 10.1111 / j.1440-1754.2010.01779.x. Epub 2010 June 27.
14. Tachert C., Maurer M. Safety and efficacy of desloratadine in subjects with seasonal allergic rhinitis or chronic urticaria results of four postmarketing surveillance studies. Clin. Drug Investig. 2010. 30(2).
109-22.
15. DuBuske L.M. Review of desloratadine for the treatment of allergic rhinitis, chronic idiopatic urticaria and allergic inflammatory disorders. Expert Opin. Pharmacother. 2005. 6(14). 2511-23.
16. Вousquet J., Bachert C., Canonica G.W., Mullol J., Van Cauwenberge P., Jensen C.B., Fokkens W.J., Ring J., Keith P., Gopalan G., Lorber R., Zuberbier T.; ACCEPT-2 Study Group. Efficacy of desloratadine in persistent allergic rhinitis — a GA2LEN study. Int. Arch. Allergy Immunol. 2010. 153(4). 395-402. doi: 10.1159/000316351. Epub 2010 Jun 18.

/23-1.jpg)
/24-1.jpg)
/25-1.jpg)
/25-2.jpg)