Журнал «Травма» Том 20, №5, 2019
Вернуться к номеру
Гістологічні зміни ентезису підошовного апоневрозу при підошовному фасціїті
Авторы: Турчин О.А., Григоровська А.В., Коструб О.О., Лябах А.П.
ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Мета роботи: аналіз результатів гістологічного дослідження проксимального ентезису підошовного апоневрозу у пацієнтів із підошовним фасціїтом. Матеріал та методи. Досліджено 4 зразки тканини підошовного апоневрозу в ділянці проксимального ентезису, які були взяті у 3 пацієнтів із хронічним підошовним фасціїтом під час апоневротомії. Середній вік пацієнтів становив 34,6 ± 12,6 (21–57) року, усі пацієнти були чоловіками. Для гістологічного дослідження відбирали фрагменти сухожильно-кісткового з’єднання, що проходили звичайну гістологічну обробку. Препарати досліджували на мікроскопі Olympus CX-41. Градації вираженості морфологічних показників оцінювали згідно з візуально-аналоговою шкалою від низького до високого ступеня при збільшенні × 100. Результати. Матеріал наведено фрагментами патологічно зміненої сполучної тканини підошовного апоневрозу з мілкими ділянками інтерстиціальних тендонекрозів, дезорганізацією колагенових пучків. Наявна велика кількість гіперцелюлярних проліфератів фіброзно-жирової тканини, поява судин та ділянки нечітко обмежених фібронекрозів. Ознак гострого або хронічного запалення не виявили, лише прояви неспецифічної ентезопатії фіброзно-хрящового ентезису. Висновки. Описані гістологічні зміни тканини ентезису підошовного апоневрозу у хворих із підошовним фасціїтом відповідають хронічним неспецифічним дистрофічно-дегенеративним змінам фіброзно-хрящової структури ентезису, тендиніту — фасціїту вторинного генезу.
Цель работы: анализ результатов гистологического исследования проксимального энтезиса подошвенного апоневроза у пациентов с подошвенным фасциитом. Материалы и методы. Исследовано 4 образца ткани подошвенного апоневроза в области проксимального энтезиса, которые были взяты у 3 пациентов с хроническим подошвенным фасциитом во время апоневротомии. Средний возраст пациентов составил 34,6 ± 12,6 (21–57) года, все пациенты были мужчины. Для гистологического исследования отбирали фрагменты сухожильно-костного соединения, которые проходили обычную гистологическую обработку. Препараты исследовали на микроскопе Olympus CX-41. Градации выраженности морфологических показателей оценивали согласно визуально-аналоговой шкале от низкой до высокой степени при увеличении × 100. Результаты. Материал представлен фрагментами патологически измененной соединительной ткани подошвенного апоневроза с мелкими участками интерстициальных тендонекрозов, дезорганизацией коллагеновых пучков. Присутствует большое количество гиперцеллюлярных пролифератов фиброзно-жировой ткани, появление сосудов и участки ограниченных фибронекрозов. Проявлений острого или хронического воспаления не было, только признаки неспецифической энтезопатии фиброзно-хрящевого энтезиса. Выводы. Описанные гистологические изменения ткани энтезиса подошвенного апоневроза у больных с подошвенным фасциитом соответствуют хронической неспецифической дистрофически-дегенеративной энтезопатии, тендиниту — фасцииту вторичного генеза.
Background. We have made the analysis of the plantar aponeurosis enthesis histology results in patients with plantar fasciitis. Materials and methods. Four samples of the plantar aponeurosis enthesis were obtained for histology assessment from 3 patients with chronic plantar fasciitis during aponeurotomy. All patients were males with average age of 34.6 ± 12.6 (range 21–57) years. Fragments of the tendon-bone junction were selected for histologic examination. Paraffin sections (5 micron) were analyzed with bright-field microscopy (Olympus CX-41). Grades of severity of morphological signs were evaluated by visual analogue scale from low to high at 100× magnification. Results. The material in plantar aponeurosis biopsies was represented by fragments of pathologically altered connective tissue with small areas of interstitial tendonecrosis, changes in the regularity and density of collagen fibers. There is a large amount of hypercellular proliferations of fibroadipose tissue, the appearance of vessels and areas of indistinctly restricted fibronecrosis. No signs of acute or chronic inflammation were found, there were only manifestations of non-specific enthesopathy of fibrocartilaginous enthesis. Conclusions. The histological changes in the tissue of the plantar aponeurosis enthesis in patients with plantar fasciitis correspond to the chronic non-specific dystrophic degenerative changes in the fibrocartilaginous structure of the enthesis, tendinitis-fasciitis of secondary origin.
ентезис; підошовний фасціїт; підошовний апоневроз; стопа; гістологічне дослідження
энтезис; подошвенный фасциит; подошвенный апоневроз; стопа; гистологическое исследование
enthesis; plantar fasciitis; plantar aponeurosis; foot; histologic examination
Вступ
Ентезопатії є актуальною проблемою сьогодення через значну поширеність, тенденцію до зростання, особливо серед урбанізованого населення. Серед інших особливе місце займає ентезопатія підошовного апоневрозу (ПА) — підошовний фасціїт (ПФ). Сукупність біомеханічних та метаболічних факторів поряд із стереотипами сучасного життя в умовах індустріального суспільства обумовлюють значну частоту ПФ. Так, за даними D. Inrving et al., від ПФ страждають 7–10 % дорослого населення у будь-якій популяції [1].
Лікування ПФ представлене широкою гамою консервативних, ін’єкційних, навіть хірургічних методик, сукупність яких виглядає достатньо безсистемною та контроверсійною. Однією з причин такого стану є відсутність єдиної думки щодо причин виникнення ПФ, більшість літературних джерел не систематизовані та містять різноманітні дані [2].
Частина авторів вбачають причину захворювання у гіаліновій дегенерації ПА, інші вважають ПФ запальним захворюванням [3, 4]. Однак переконливих морфологічних даних, характерних для гострої або хронічної запальної реакції, не було встановлено [5, 6].
Крім того, літературних даних щодо морфологічних змін ентезису ПА при ПФ достатньо мало [7–9]. Через це вивчення патологічної гістології ентезису ПА сприятиме уточненню природи ПФ та розв’язанню низки дискутабельних практичних питань щодо його лікування.
Мета роботи — аналіз результатів гістологічного дослідження проксимального ентезису підошовного апоневрозу у пацієнтів із підошовним фасціїтом.
Матеріали та методи
Матеріалом для дослідження стали 4 зразки тканини ПА в ділянці проксимального ентезису, які були взяті у 3 пацієнтів із хронічним підошовним фасціїтом під час апоневротомії ПА. Усі пацієнти проходили стаціонарне лікування в ДУ «Інститут травматології та ортопедії НАМН України». Середній вік пацієнтів становив 34,6 ± 12,6 (21–57) року, всі пацієнти були чоловіками. Використання даних з історій хвороби проведене з урахуванням вимог комітету з біоетики ДУ «Інститут травматології та ортопедії НАМН України».
Критерії включення до дослідження: відсутність цукрового діабету, системних захворювань та травматичного анамнезу в ділянці стопи.
Діагноз ПФ був встановлений за даними клініко-інструментального обстеження. В усіх випадках захворювання мало хронічний перебіг, тривалість больового синдрому в одного пацієнта із двобічним ураженням становила 15 місяців, в іншого — 18 місяців. Прогресування больового синдрому та відсутність ефекту від проведеної комплексної консервативної терапії стали показанням для підошовної апоневротомії.
Для гістологічного дослідження відбирали фрагменти сухожильно-кісткового з’єднання. Проводили звичайну гістологічну обробку, зразки тканин фіксували в 10% розчині нейтрального формаліну (рН 7,4) протягом 24 годин. Після фіксації у формаліні зразки промивали у проточній воді, вирізали відповідні ділянки. Препарати зневоднювали шляхом проводки через спирти зростаючої міцності та заливали в парафін; з парафінових блоків на ротаційному мікротомі виготовляли серійні гістологічні зрізи завтовшки 5 мкм, які потім забарвлювали гематоксиліном і еозином. Препарати досліджували на мікроскопі Olympus CX-41. Градації вираженості морфологічних показників оцінювали за візуально-аналоговою шкалою від низького до високого ступеня при збільшенні × 100.
Результати
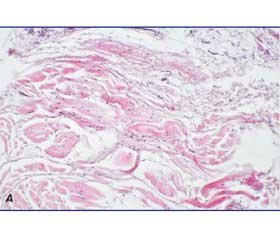
Матеріал наведено фрагментами патологічно зміненої тканини апоневрозу з мілкими ділянками інтерстиціальних тендонекрозів та дезорганізацією колагенових пучків (рис. 1А). Поряд з товстими сухожильними колагеновими пучками в перитендинії наявна велика кількість гіперцелюлярних проліфератів фіброзно-жирової тканини зі скупченням мілких судин (рис. 1Б, 2А).
У склерозованій фіброзно-жировій тканині визначається значна кількість дрібних судин капілярного і венулярного типу. Тканина апоневрозу побудована з фіброзної тканини довгопучкового характеру, в деяких ділянках пучки хаотично переплетені. Матрикс колагеноволокнистий, з переважанням тонких звивистих фуксинофільних волокон, іноді зустрічаються ділянки міксоїдно-зміненого матриксу. Клітинні форми представлені юними фібробластами і фіброцитами, також міофібробластами, з незначною мононуклеарною інфільтрацією.
Також зустрічаються більш великі зони дезорганізації структури щільної оформленої сполучної тканини з ознаками набряку та мукоїдного набухання міжклітинної речовини, ділянки нечітко обмежених фібронекрозів. Інтерстиціальна мононуклеарна інфільтрація виражена мінімально (рис. 2Б).
У фіброзній тканині різного ступеня зрілості з дрібними інтерстиціальними фібронекрозами та ознаками дистрофії міжклітинної речовини спостерігаються незначно виражені проліферативні зміни та гіперемія мікроциркуляторного русла: фіброзування стінок судин дрібного калібру, деякі з них — облітеровані, зі значною кількістю периваскулярних острівцевих мононуклеарних інфільтратів. Описані дистрофічні зміни фіброзної тканини супроводжуються серозно-фібринозним запаленням та продуктивним запаленням низької активності вторинного генезу у вигляді нечисленних нещільних інфільтратів. Жоден досліджуваний фрагмент ентезису ПА не виявив гістологічних ознак гострого або хронічного запалення.
У досліджуваних фрагментах ентезису ПА виявлено гістологічні ознаки дегенеративно-дистрофічних та ішемічних змін щільної сполучної тканини, що супроводжуються ознаками реактивного низькоактивного продуктивного запалення у вигляді нещільних лімфоцитарно-плазмацитарних інфільтратів. Узагальнення отриманих даних дозволяє стверджувати, що виявлені зміни відповідають таким при неспецифічній ентезопатії фіброзно-хрящового ентезису.
Обговорення
Проксимально ПА представлений фіброзно-хрящовим ентезисом [10–12]. Перенавантаження та явища асептичного запалення завжди починаються з ділянки ентезису як найбільш уразливого місця ПА [2, 13]. Тому існує думка, що в цій ділянці ПА реагує подібно до ентезопатії [7–9].
За даними небагатьох дослідників, основними гістологічними змінами ПА при ПФ є надлишок дезорганізованого колагену, гіпертрофія фібробластів, судинна гіперплазія з аваскулярними фасцикулами ПА. Кровопостачання через уражений ПА зменшується, в результаті зменшується регенерація та ремоделювання екстрацелюлярного матриксу, який потрібен для загоєння [9, 14, 15]. Гістологічними знахідками також є потовщення і фіброз ПА уздовж, втрата ходу та некроз колагенових волокон, збільшення основної речовини, збільшення фібробластів та міофібробластів, хрящова метаплазія та кальцифікація [16, 17].
Отримані нами результати демонструють потовщення колагенових пучків з інтерстиціальними тендонекрозами та дезорганізацією колагенових пучків. Характерних гістологічних ознак гострого (скупчення лейкоцитів) та хронічного (інфільтрація макрофагів, лімфоцитів і плазматичних клітин; деструкція тканини з наступним відновленням) запалення ми не виявили.
Результати нашого дослідження збігаються з даними інших авторів, які також не виявили ознак класичного запалення [6]. Натомість мікроскопічними знахідками є потоншення та порушення структури колагенових волокон, наявність грануляційної тканини, дегенерація теноцитів, накопичення ліпідів. З цього робимо висновок, що зміни ПА є більш дегенеративними, ніж запальними [13]. Виявлені гістологічні зміни описують як «невдалу репаративну реакцію», з безсистемною проліферацією теноцитів та їх внутрішньоклітинними аномаліями, порушенням ходу колагенових волокон, подальшим збільшенням неколагенового матриксу [18, 19].
Schepsis et al. проводили біопсію під час резекції кісткового екзостозу, виявили потовщення та фіброз ПА в ділянці ентезису [20]. Tountas і Fornasier також виявили дегенеративні ознаки без клітин запалення [21]. Snider et al. описали некроз колагенових волокон, ангіофіброзну гіперплазію, хрящову метаплазію [22].
Мікророзриви, міксоїдна дегенерація, ангіофібробластна гіперплазія, некроз колагенових волокон свідчать про незапальний дегенеративний фасціоз.
Запальний процес виникає вторинно [13]. Розуміння цього є важливим для розробки ефективних методів лікування, бо підходи в лікуванні дегенеративних і запальних процесів різняться.
У проведеному нами дослідженні гістологічна картина патологічних змін ПА ілюструє дегенеративно-дистрофічні зміни ділянки ентезису у вигляді потовщення та фіброзування. Характерними є набряк та дезорганізація пучків колагенових волокон, дифузна мононуклеарна інфільтрація середнього та низького ступенів вираженості. Також виявлені осередкові гіперпластичні розростання синовіальної оболонки у вигляді серозно-фібринозного запалення, що виникає вторинно. Узагальнення отриманих даних дозволяє стверджувати, що зміни ПА відповідають таким при неспецифічній ентезопатії фіброзно-хрящового ентезису.
Незаперечною перевагою нашого дослідження є дослідження ПА при ПФ на операційному матеріалі, що дозволило верифікувати доопераційний клініко-інструментальний діагноз.
Недоліком нашого дослідження є невелика кількість досліджених зразків.
Висновки
Описані гістологічні зміни тканини ПА у хворих із ПФ характеризуються хронічними неспецифічними дистрофічно-дегенеративними змінами фіброзно-хрящової структури ентезису, тендиніту — фасціїту, які морфологічно відповідають неспецифічній ентезопатії. Описані зміни можуть бути наслідком хронічного травматичного впливу. Присутні осередкові гіперпластичні розростання синовіальної оболонки у вигляді серозно-фібринозного запалення, що виникає вторинно. Також характерні дегенеративно-дистрофічні зміни сухожильної тканини у вигляді набряку та дезорганізації пучків колагенових волокон, дифузної мононуклеарної інфільтрації середнього та низького ступенів вираженості.
Етичний аспект. Усі процедури, що проводилися в дослідженні за участю пацієнтів, відповідали етичним стандартам інституційного та/або національного дослідницького комітету, а також Гельсінської декларації 1964 року і її більш пізнім змінам або порівнянним етичним стандартам.
Конфлікт інтересів. Дана публікація не викликає будь-якого конфлікту між авторами, не була і не буде предметом комерційної зацікавленості чи винагороди в жодній формі.
1. Inrving D.B., Cook J.L., Young M.A., Menz H.B. Impact of chronic plantar heel pain on health-related quality of life. J. Am. Podiatr. Med. Assoc. 2008. 98(4). 283-289. PMID: 18685048.
2. Wackawski E.R., Beach J., Milne A., Yacyshyn E., Dryden D.M. Systematic review: plantar fasciitis and prolonged weight bearing. Occup. Med. (Lond.). 2015. 65. 97-106. DOI: 10.1093/occmed/kqu177.
3. Yucel I., Yazici B., Degirmenci E., Erdogmus B. et al. Comparison of ultrasound-, palpation-, and scintigraphy-gui–ded steroid injections in the treatment of plantar fasciitis. Arch. Orthop. Trauma Surg. 2009. 129(5). 695-701. DOI: 10.1007/s00402-008-0760-1.
4. Thomas J.L., Christensen J.C., Kravitz S.R. et al. The diagnosis and treatment of heel pain: A clinical practice guideline — revision 2010. J. Foot Ankle Surg. 2010. 49. S1-S19. DOI: 10.1053/j.jfas.2010.01.001.
5. Ahmad J., Karim A., Daniel J.N. Relationship and classification of plantar heel spurs in patients with plantar fasciitis. Foot Ankle Int. 2016. 37. 994-1000. DOI: 10.1177/1071100716649925.
6. Tae Im Yi, Ga Eun Lee, In Seok Seo, Won Seok Huh et al. Clinical Characteristics of the Causes of Plantar Heel Pain. Ann. Rehabil. Med. 2011. 35. 507-513. DOI: https://doi.org/10.5535/arm.2011.35.4.507.
7. Benjamin М., McGonagle D. Entheses: tendon and ligament attachment sites. Scand. J. Med. Sci. Sports. 2009. 19. 520-527. doi: 10.1111/j.1600-0838.2009.00906.x.
8. Apostolakos J., Durant Т., Dwyer С., Russell R. et al. The enthesis: a review of the tendon-to-bone insertion. Muscles Ligaments Tendons J. 2014. 4(3). 333-342. PMID: 25489552.
9. Buono A. Del, Battery L., Denaro V., Maccauro G., Maffulli N. Tendinopathy and inflammation: some truths. International Journal of Immunopathology and Pharmacology. 2011. 24(1). 45-50. DOI: 10.1177/03946320110241S209.
10. Rufai A., Ralph J.R., Benjamin M. Structure and histopathology of the insertional region of the Achilles tendon. J. Orthop. Res. 1995. 13. 585-93. DOI: 10.1002/jor.1100130414.
11. Benjamin M., Evans E.J., Copp L. The histology of tendon attachments to bone in man. J. Anat. 1986. 149. 89-100. PMCID: PMC1261636.
12. Lemont Н., Ammirati K.M., Usen N. Plantar Fasciitis. A Degenerative Process (Fasciosis) Without Inflammation. Journal of the Am. Pod. Med. Assoc. 2003. 93(3). 234-237. PMID: 12756315.
13. Wearing S.C., Smeathers J.E., Urry S.R., Hennig E.M. et al. The Pathomechanics of Plantar Fasciitis. Sports Med. 2006. 36(7). 585-611. DOI: 10.2165/00007256-200636070-00004.
14. Buono A. Del, Papalia R., Denaro V., Maccauro G. et al. Platelet rich plasma and tendinopathy: state of the art. International Journal of Immunopathology and Pharmacology. 2011. 24(1). 79-83. Doi: 10.1177/03946320110241S215.
15. Murrell G.A. Understanding tendinopathies. British Journal of Sports Medicine. 2002. 36(6). 392-393. DOI: 10.1136/bjsm.36.6.392.
16. Khan K.M., Cook J.L., Taunton J.E., Bonar F. Overuse tendinosis, not tendinitis. part 1: A new paradigm for a difficult clinical problem. Physician Sportsmed. 2000. 28. 38-8. DOI: 10.3810/psm.2000.05.890.
17. Sharma P., Maffulli N. Tendon injury and tendinopathy: Healing and repair. J. Bone Joint Surg. Am. 2005. 87. 187-202. DOI: 10.2106/JBJS.D.01850.
18. Cook J.L., Purdam C.R. Is tendon pathology a continuum? A pathology model to explain the clinical presentation of load-induced tendinopathy. Br. J. Sports Med. 2009. 43(6). 409-416. doi: 10.1136/bjsm.2008.051193.
19. Thomopoulos S., Genin G.M., Galatz L.M. The development and morphogenesis of the tendon-to-bone insertion — what development can teach us about healing. J. Musculoskelet Neuronal Interact. 2010. 10(1). 35-45. PMCID: PMC3605736.
20. Schepsis A.A., Leach R.E., Gorzyca J. Plantar fasciitis: etiology, treatment, surgical results, and review of the literature. Clin. Orthop. 1991. 266. 185-196. PMID: 2019049.
21. Tountas A.A., Fornasier V.L. Operative treatment of subcalcaneal pain. Clin. Orthop. 1996. 332. 170-178. DOI: 10.1097/00003086-199611000-00023.
22. Snider M.P., Clancy W.G., McBeath A.A. Plantar fascia release for chronic plantar fasciitis in runners. Am. J. Sports Med. 1983. 11. 215-219. DOI: 10.1177/036354658301100406.
23. Forman W.M., Green M.A. The role of intrinsic musculature in the formation of inferior calcaneal exostoses. Clin. Podiatr. Med. Surg. 1990. 7(2). 217-223. PMID: 2189534.

/42-1.jpg)
/43-1.jpg)