Журнал «Травма» Том 20, №5, 2019
Вернуться к номеру
Изменения метаболизма пуринов при костно-суставной форме рака легкого
Авторы: Синяченко О.В., Алиев Р.Ф., Ермолаева М.В., Бондарь В.Г.
Донецкий национальный медицинский университет, г. Лиман, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Актуальність проблеми набуває особливої значущості у зв’язку з почастішанням випадків метастазування раку легені (РЛ) у скелет, що істотно погіршує показники виживаності хворих. Ця так звана кістково-суглобова форма РЛ спостерігається в 30–40 % випадків захворювання. Пуринові основи належать до біомаркерів кісткових метастазів при РЛ, але їх діагностична та прогностична роль не вивчена. Мета: визначити стан пуринового метаболізму при кістково-суглобовій формі РЛ з оцінкою клініко-патогенетичної значущості виявлених змін. Матеріали та методи. Обстежено 123 хворих (усі чоловіки) віком від 24 до 79 років. Співвідношення периферичної і центральної форм раку становило 1 : 4, дрібноклітинного та недрібноклітинного гістологічного варіанта — 1 : 4, а IВ, IIА, IIВ, IIIА, IIIВ та IV стадій захворювання — 1 : 2 : 4 : 6 : 5 : 6. Кількість хворих із метастазами в лімфатичні вузли та віддалені органи становила 89 і 62 % відповідно. У сироватці крові вивчали рівні продуктів пуринового метаболізму — сечової кислоти, оксипуринолу, аденіну, гуаніну, ксантину, гіпоксантину, активності ксантиноксидази, ксантиндезамінази, аденозиндезамінази та 5-нуклеотидази. Результати. Дисметаболізм пуринів спостерігається у 98 % від числа хворих на РЛ, що проявляється підвищенням концентрації у крові сечової кислоти й оксипуринолу, активності ксантиноксидази й аденозиндезамінази. Показники пуринового обміну при РЛ відбивають ступінь тяжкості перебігу захворювання, пов’язані з локалізацією та морфологічною формою пухлинного процесу, проростанням у грудну стінку, трахею та стравохід, наявністю компресійного синдрому й обтураційного ателектазу. Кістково-суглобову форму РЛ встановлено у 32 % від числа хворих на РЛ, що супроводжується збільшенням показників урикемії, оксипуринолемії й аденінемії, що беруть участь в патогенетичних побудовах пухлинного процесу. Рівень аденіну (6-амінопурину) щодо метастазів РЛ у скелет має прогнознегативну значущість. Виживаність хворих з кістково-суглобовою формою РЛ гірша, ніж у інших пацієнтів.
Актуальность. Актуальность проблемы приобретает особую значимость в связи с учащением случаев метастазирования рака легкого (РЛ) в скелет, что существенно ухудшает показатели выживаемости больных. Эта так называемая костно-суставная форма РЛ наблюдается в 30–40 % случаев заболевания. Пуриновые основания относятся к биомаркерам костных метастазов при РЛ, но их диагностическая и прогностическая роль не изучена. Цель: определить состояние пуринового метаболизма при костно-суставной форме РЛ с оценкой клинико-патогенетической значимости выявленных изменений. Материалы и методы. Обследованы 123 больных (все мужчины) в возрасте от 24 до 79 лет. Соотношение периферической и центральной форм рака составило 1 : 4, мелкоклеточного и немелкоклеточного гистологического варианта — 1 : 4, а IВ, IIА, IIВ, IIIА, IIIВ и IV стадий заболевания — 1 : 2 : 4 : 6 : 5 : 6. Количество больных с метастазами в лимфатические узлы и отдаленные органы составило 89 и 62 % соответственно. В сыворотке крови изучали уровни продуктов пуринового метаболизма — мочевой кислоты, оксипуринола, аденина, гуанина, ксантина, гипоксантина, активности ксантиноксидазы, ксантиндезаминазы, аденозиндезаминазы и 5-нуклеотидазы. Результаты. Дисметаболизм пуринов наблюдается у 98 % от числа больных РЛ, что проявляется повышением концентраций в крови мочевой кислоты и оксипуринола, активности ксантиноксидазы и аденозиндезаминазы. Показатели пуринового обмена при РЛ отражают степень тяжести течения заболевания, связаны с локализацией и морфологической формой опухолевого процесса, прорастанием в грудную стенку, трахею и пищевод, наличием компрессионного синдрома и обтурационного ателектаза. Костно-суставная форма РЛ установлена у 32 % от числа больных РЛ и сопровождается увеличением показателей урикемии, оксипуринолемии и аденинемии, которые участвуют в патогенетических построениях опухолевого процесса. Уровень аденина (6-аминопуринa) в отношении метастазов РЛ в скелет обладает прогнознегативной значимостью. Выживаемость больных с костно-суставной формой РЛ хуже, чем у остальных пациентов.
Background. The urgency of the problem is of particular importance due to the increased incidence of lung cancer (LC) metastasis into the skeleton, which significantly worsens the survival rate of patients. This so-called “osteoarticular form” of LC is observed in 30–40 % cases of the disease. Purine bases belong to the biomarkers of bone metastases in LC, but their diagnostic and prognostic role has not been studied. The purpose was to determine the state of purine metabolism in the “osteoarticular form” of LC with the assessment of the clinical and pathogenetic significance of the identified changes. Materials and methods. The study enrolled 123 patients (all men) aged from 24 to 79 years. The ratio of the peripheral and central forms of cancer was 1 : 4, small-cell to non-small-cell histological variant — 1 : 4, and IB, IIA, IIB, IIIA, IIIB and IV stages of the disease — 1 : 2 : 4 : 6 : 5 : 6. The number of patients with metastases to the lymph nodes and distant organs was 89 and 62 %, respectively. The blood serum levels of products of purine metabolism (uric acid, oxypurinol, adenine, guanine, xanthine, hypoxanthine, xanthine oxidase, xanthine deaminase, adenosine deaminase, and 5'-nucleotidase activities) were studied. Results. Purine dysmetabolism is observed in 98 % of the patients with LC, which manifested by increased concentrations of uric acid and oxypurinol in the blood, xanthine oxidase and adenosine deaminase activities. The parameters of purine metabolism in LC reflect the severity of the disease, associated with the localization and morphological form of the tumor process, invasion in the breast, trachea, and esophagus, the presence of nerve root syndrome and obstructive atelectasis. Thirty-two per cent of the patients with LC were found to have the “osteoarticular form” of LC accompanying by an increase in the indices of uricemia, oxypurinemia, and adeninemia, involved in the pathogenetic constructs of the tumor process. The level of adenine (6-aminopurine) relating to the LC metastases in the skeleton has a predictive negative value. The survival of patients with “osteoarticular form” of LC is worse than in other patients.
рак; легеня; скелет; пурин; метаболізм
рак; легкое; скелет; пурины; метаболизм
cancer; lung; skeleton; purines; metabolism
Введение
Рак легкого (РЛ) занимает первое место в структуре онкологической заболеваемости [1, 2] и является одной из ведущих причин смерти [3, 4]. В настоящее время актуальность проблемы РЛ стала приобретать особую значимость в контексте учащения случаев метастазирования опухолевого процесса в скелет, что существенно ухудшило общие показатели выживаемости больных [5]. Эта так называемая костно-суставная форма РЛ наблюдается в 30–40 % случаев заболевания [6]. У каждого третьего такого больного констатируется одновременное поражение метастатическим опухолевым процессом разных регионов скелета [7].
Остается недостаточно изученной роль нарушений метаболизма пуринов в процессах канцерогенеза, а их клиническое значение требует уточнения [8]. Было установлено, что гиперурикемия является фактором риска развития и последующего тяжелого течения РЛ [9, 10]. Считается, что пуриновые основания относятся к биомаркерам костных метастазов при РЛ, но их диагностическая и прогностическая значимость пока еще не определена [11].
Целью работы стало изучение состояния пуринового метаболизма при костно-суставной форме РЛ с оценкой клинико-патогенетической значимости выявленных изменений.
Материалы и методы
Под наблюдением находились 123 больных РЛ (все мужчины) в возрасте от 24 до 79 лет (в среднем 59,40 ± 0,83 года). Правосторонний РЛ установлен в 48,8 % случаев, левосторонний — в 48,0 %, двусторонний — в 3,3 %. Верхне-нижнедолевая локализация слева констатирована в 31,7 % наблюдений, средне-верхнедолевая справа — в 17,9 %, верхнедолевая — в 16,2 %, медиастинальная — в 13,0 %, нижнедолевая — в 12,2 %, среднедолевая справа — в 4,9 %, верхушечная Панкоста — Тобиаса — в 4,1 %. Соотношение центральной и периферической форм РЛ составило 4 : 1, а мелкоклеточного и немелкоклеточного вариантов — 1 : 4. Среди немелкоклеточного гистологического варианта РЛ аденокарцинома имела место в 44,3 % случаев, плоскоклеточная карцинома — в 41,2 % случаев, крупноклеточная — в 14,4 %.
РЛ осложнился экссудативным плевритом в 16,2 % наблюдений, компрессионным синдромом — в 9,8 %, прорастанием в трахею — в 10,6 %, грудную стенку — в 4,9 %, пищевод — в 3,3 % и перикард — в 0,8 %, обтурационным ателектазом и сдавлением возвратного нерва — в 2,4 % случаев, сдавлением верхней полой вены — в 1,6 %. Количество больных с метастазами в лимфатические узлы и отдаленные органы составило 88,6 и 61,8 % соответственно. Индекс тяжести течения РЛ (IWT) был равен 3,5 ± 0,08 о.е. и определялся по формуле:
IWT = ln[T + N2 + (ΣM)2],
где ln — натуральный логарифм, Т — международный показатель характера первичной опухоли, N — международный показатель метастатического поражения региональных лимфатических узлов, ΣМ — сумма отдаленных органов с метастазами.
Диагностика РЛ и его метастазов базировалась на рентгенологическом, компьютерном томографическом, магнитно-резонансном, сонографическом и эндоскопическом методах исследования (использовали аппараты Multix-Compact-Siеmens (Германия), Somazom-Emotion-6-Siemens (Германия), Gygoscan-Intera-Philips (Нидерланды), сонограф Envisor-Philips (Нидерланды), фиброскопы Olympus-GIF-Q20 (Япония), EXERA-II-Olympus (Япония), Fujinon-FG-1Z (Япония)). Используя биохимические анализаторы Olympus-AU640 (Япония) и BS200 (Китай), спектрофотометры SPECORD-S600 (Германия), «Искролайн-100» (Россия) и «СФ-46» (Россия), в сыворотке крови изучали уровни продуктов пуринового метаболизма: UA, оксипуринола (ОР), аденина (Ad), гуанина (Gu), ксантина (Xa), гипоксантина (Hx), активности ксантиноксидазы (ХO), ксантиндезаминазы (XD), аденозиндезаминазы (AD) и 5-нуклеотидазы (5N). Интегральную степень изменения показателей пуринового метаболизма (IPM) высчитывали по формуле:
где М1 — показатель у больного, М2 — средний показатель у здоровых людей контрольной группы, SD — стандартное отклонение показателя у здоровых. Измененным значением считали IPM > 3 о.е. Подсчитывали (в процентах) число измененных показателей пуринового обмена (> M + SD здоровых). В качестве контроля были обследованы 30 практически здоровых мужчин в возрасте от 20 до 68 лет (в среднем 39,7 ± 1,9 года).
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного непараметрического корреляционного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica, StatSoft (США)). Оценивали средние значения (M), их стандартные ошибки (SE) и отклонения (SD), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии дисперсии (D), однородности дисперсии Брауна — Форсайта (BF), Уилкоксона — Рао (WR), различий Стьюдента (t) и Мак-Немара — Фишера (χ2), а также достоверность статистических показателей (р). Подсчитывали степень прогнозирования предлагаемого результата модели (PPV) и трехлетнюю выживаемость больных.
Результаты и обсуждение
У больных РЛ содержание в крови UA составляет 480,20 ± 13,87 мкмоль/л, OP — 94,00 ± 6,21 мкмоль/л, Ad — 135,00 ± 3,42 е.э., Gu — 183,40 ± 4,10 е.э., Xa — 148,10 ± 2,50 е.э., Hx — 165,70 ± 3,63 е.э., активность XO — 6,60 ± 0,37 нмоль/мл • мин, XD — 7,40 ± ± 0,39 нмоль/мл • мин, AD — 12,90 ± 1,79 нмоль/мл • мин и 5N — 6,00 ± 0,09 нмоль/мл • мин. По сравнению с аналогичными показателями у здоровых людей контрольной группы установлено достоверное повышение уровня UA на 77 % (t = 7,42, p < 0,001), OP — в 3,8 раза (t = 5,50, p < 0,001), XO — на 89 % (t = 4,09, p < 0,001) и AD — в 8,1 раза (t = 3,14, p = 0,002). Повышение концентрации (> M + SD здоровых) в сыворотке крови UA обнаружено у 87,8 % от числа больных РЛ, AD — у 84,6 %, XO — у 75,6 %, ОР — у 72,4 %, XD — у 46,3 %, 5N — у 35,8 %, Ad — у 32,5 %, Hx — у 28,5 %, Gu — у 22,8 %, Xa — у 17,1 %. В целом интегральные изменения показателей пуринового метаболизма обнаружены в 98,4 % случаев заболевания, а гиперурикемия (UA > 420 мкмоль/л здоровых) — в 56,1 %. При этом IPM составил 3,30 ± 0,09 о.е.
Костно-суставная форма диагностирована в 31,7 % случаев РЛ. Прорастание опухоли в ребра обнаружено у 4,1 % от общего числа больных, на что влияли интегральные показатели клинического течения РЛ (WR = 2,27, p = 0,019). Как показал многофакторный дисперсионный анализ Уилкоксона — Рао, метастазы РЛ в скелет воздействуют на интегральное состояние пуринового обмена (WR = 2,25, p < 0,001). В случаях гиперурикемии установлено достоверное — на 47 % — повышение содержания OP (t = 2,90, p = 0,004), на 29 % — Ad (t = 5,48, p < 0,001), на 11 % — Gu (t = = 2,33, p = 0,022) и на 39 % — активности XO (t = 2,89, p = 0,005). Необходимо отметить, что параметры урикемии у больных РЛ прямо соотносятся со значениями в крови Ad (r = +0,603, p < 0,001), Gu (r = +0,354, p < 0,001), XO (r = +0,179, p = 0,049) и XD (r = +0,295, p = 0,001).
Как свидетельствует однофакторный дисперсионный анализ, на уровень в крови UA влияют IWT (D = = 200,62, p < 0,001), наличие обтурационного ателектаза легкого (D = 1,95, p = 0,014), прорастания опухоли в грудную стенку (D = 4,19, p < 0,001) и сдавление возвратного нерва (D = 1,66, p = 0,047), на содержание ОР — IWT (D = 3,52, p < 0,001), морфологическая форма РЛ (D = 1,87, p = 0,010) и развитие экссудативного плеврита (D = 1,75, p = 0,018), на показатель Ad — сдавление верхней полой вены (D = 2,25, p = 0,001), на Gu — степень дифференциации опухоли (D = 1,60, p = 0,047), на Xa — прорастание неоплазмы в трахею (D = 2,04, p = 0,031), на Hx — локализация рака (D = = 1,67, p = 0,029), на ХO — прорастание опухоли в пищевод (D = 3,76, p < 0,001), на ХD и 5N — наличие компрессионного синдрома (D = 1,88, p = 0,045 и D = 2,48, p = 0,027 соответственно), на активность AD — мелкоклеточный морфологический вариант патологического процесса (D = 2,14, p = 0,007).
Метастазы в позвоночник обнаружены у 17,1 % от общего числа больных и у 53,9 % от числа обследованных с метастазами в скелет, метастазы в ребра — в 13,0 и 41,0 % случаев, в подвздошную и крестцовую кость — соответственно в 8,1 и 25,6 %, в плечевой сустав — в 5,7 и 18,0 %, в плечевую и бедренную кость — соответственно в 4,9 и 15,4 %, в крестцово-подвздошное со-членение — в 4,1 и 12,8 %, в тазобедренный сустав — в 3,3 и 10,3 %, в грудину и ключицу — соответственно в 2,4 и 7,7 %, в челюсть и лопатку — в 1,6 и 5,1 %, в локтевой и коленный сустав, лобковую и большеберцовую кость — соответственно в 0,8 и 2,6 % (рис. 1). Соотношение поражений грудного, крестцового, поясничного и шейного отделов позвоночника составило 6 : 4 : 2 : 1. Если у больных РЛ без метастазов в скелет показатели в крови UA, OP и Ad составили 429,50 ± 14,74 мкмоль/л, 85,80 ± 6,85 мкмоль/л и 126,20 ± 3,56 е.э., то метастазы в скелет сопровождались достоверным повышением этих параметров пуринового метаболизма на 37, 30 и 22 % соответственно, что представлено в табл. 1 и на рис. 2.
По данным литературы, самым агрессивным гистологическим вариантом опухоли в отношении развития костного метастазирования является мелкоклеточный РЛ [12], а для немелкоклеточного варианта заболевания соотношение числа аденокарциномы, плоскоклеточной и крупноклеточной карцином легкого как причин метастазирования в ребра составляет 7 : 4 : 1 [13]. Среди больных немелкоклеточным РЛ с костными метастазами 3/4 приходится на лиц, страдающих аденокарциномой, а остальная 1/4 — плоско- и крупноклеточной карциномой [14]. Необходимо отметить, что однолетняя выживаемость больных РЛ с костными метастазами в 3–4 раза меньше, чем в остальных случаях [15]. При этом средняя продолжительность жизни пациентов, страдающих РЛ с метастазами в позвоночник, обычно не превышает 4 месяцев [16]. В целом позвоночный ствол считается наиболее излюбленной локализацией костных метастазов при РЛ [17]. Хорошо известно также при РЛ метастатическое поражение периферических суставов, протекающее в виде стойкого синовита [18].
По данным однофакторного дисперсионного анализа, метастатическое поражение костно-суставного аппарата зависит от локализации патологического процесса (D = 2,22, p = 0,039), формы опухоли (D = 4,69, p < 0,001), наличия аденокарциномы (D = 3,04, p = 0,006), плоскоклеточной карциномы (D = 2,25, p = 0,037) и компрессионного синдрома (D = 3,08, p = 0,005). От формы заболевания (центральная, периферическая) и некоторых гистологических вариантов РЛ (аденокарцинома, плоскоклеточная карцинома) зависит метастазирование в позвоночник (соответственно D = 26,33, p < 0,001 и D = 7,37, p = 0,007), от дифференциации опухолевого процесса и прорастания его в трахею — поражение периферических костей (D = = 5,47, p = 0,020 и D = 5,38, p = 0,021), от локализации РЛ — периферических суставов (D = 9,75, p = 0,002).
В основной группе больных (костно-суставная форма РЛ) была большей (на 1/4) частота верхнедолевого РЛ (χ2 = 3,90, p = 0,048) и на 1/2 — частота периферической формы болезни при поражении позвоночника (χ2 = 21,29, p < 0,001). Среди всех больных РЛ параметры IWA в основной группе были выше на 30 %, а в случаях метастатической спондилопатии — на 25 %. Согласно результатам выполненного многофакторного дисперсионного анализа Уилкоксона — Рао, на интегральные клинические проявления РЛ оказывают воздействие метастазы в позвоночник (WR = 2,30, p = 0,017), челюсти (WR = 3,01, p < 0,001) и подвздошную кость (WR = 1,61, p = 0,012), с которыми, как демонстрирует ANOVA, тесно связано прорастание опухоли в трахею (D = 4,16, p = 0,028).
Мы отобрали те показатели пуринового обмена, которые одновременно имели достоверные значения теста однородности дисперсии Брауна — Форсайта и непараметрической корреляции Кендалла. Оказалось, что в отношении метастазов в скелет к таковым относятся UA (BF = 2,79, p = 0,001; τ = +0,516, p < 0,001), OP (BF = 2,29, p = 0,001; τ = +0,209, p = 0,021) и Ad (BF = 2,74, p < 0,001; τ = +0,418, p < 0,001). У этих больных продемонстрирована связь IWT с UA (BF = = 195,89, p < 0,001; τ = +0,981, p < 0,001), Ad (BF = 2,04, p = 0,004; τ = +0,372, p < 0,001), Gu (BF = 2,27, p = 0,002; τ = +0,200, p = 0,001), XO (BF = 6,02, p < 0,001; τ = +0,266, p < 0,001), XD (BF = 2,71, p = 0,003; τ = +0,124, p = 0,042). Установлено, что прорастание опухоли в ребра прямо связано с концентрациями в крови UA (BF = 8,88, p = 0,004; τ = +0,129, p = 0,043), OP (BF = 7,58, p = 0,007; τ = +0,126, p = 0,038) и 5N (BF = 60,39, p < 0,001; τ = +0,138, p = 0,024), а метастазирование в костно-суставную систему — с UA (BF = 9,52, p < 0,001; τ = +0,433, p < 0,001) и 5N (BF = 15,69, p < 0,001; τ = +0,159, p = 0,009). С IPM существует дисперсионная связь у IWT (D = 4,75, p = 0,004) и числа метастазов в скелет (D = 9,76, p < 0,001).
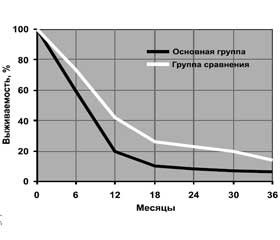
96,8 % больных РЛ после обследования получали лучевую терапию, а 71,6 % — параллельную либо изолированную химиотерапию. 67,5 % от общего числа пациентов и 94,3 % от числа лиц с химиотерапией назначали препараты платины, 39,0 и 54,6 % — подофиллотоксины, 30,9 и 43,2 % — алкиланты, 28,5 и 39,8 % — антрациклины, 20,3 и 28,4 % — алкалоиды барвинка, 16,3 и 22,7 % — антиметаболиты пуринового и пиримидинового ряда, 8,1 и 11,4 % — таксаны, 6,5 и 9,1 % — камптотецины. Выживаемость больных основной группы (с опухолевым поражением скелета) на фоне лечения оказалась хуже, чем в остальных случаях (группа сравнения), что представлено на рис. 3. После статистической обработки выполненных исследований сделано следующее заключение, имеющее практическую направленность: показатель Ad > 170 е.э. (> M + SD больных) свидетельствует о наличии метастазов РЛ в скелет (PPV = 79,5 %).
Необходимо отметить, что пуриновые нуклеотиды играют важную роль в метаболизме и опухолевых клеток, и остеобластов [8, 19]. Считается, что метастазирование РЛ в кости связано с экспрессией у больных экзосомных интегринов a6b1 и a6b4, которые также тесно связаны с пуриновым метаболизмом [20]. Как известно, метастатические клетки РЛ угнетают в костях формирование остеобластов и способствуют быстрому увеличению остеокластов, что стимулируется UA [21].
Выводы
1. Дисметаболизм пуринов наблюдается у 98 % от числа больных РЛ, что проявляется повышением уровней в крови UA, ОР, ХО и AD.
2. Показатели пуринового обмена при РЛ отражают степень тяжести течения заболевания, связаны с локализацией и морфологической формой опухолевого процесса, прорастанием в грудную стенку, трахею и пищевод, наличием компрессионного синдрома и обтурационного ателектаза.
3. Костно-суставная форма РЛ наблюдается у 32 % от числа больных РЛ и сопровождается увеличением показателей урикемии, оксипуринолемии и аденинемии, которые участвуют в патогенетических построениях опухолевого процесса.
4. Уровень Ad (6-аминопуринa) в отношении метастазов РЛ в скелет обладает прогнознегативной значимостью.
5. Выживаемость больных с костно-суставной формой РЛ хуже, чем у остальных пациентов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Muzamil J., Bashir S., Guru F.R., Nabi F., Bhat G.M. Squamous cell carcinoma lung with skeletal muscle involvement: a 8-year study of a tertiary care hospital in Kashmir. Indian J. Med. Paediatr. Oncol. 2017. 38(4). 456-60. doi: 10.4103/ijmpo.ijmpo_169_16.
2. Latimer K.M. Lung cancer: clinical presentation and diagnosis. FP Essent. 2018. 464(1). 23-6.
3. Ceniceros L., Aristu J., Castanon E., Rolfo C., Legaspi J., Olarte A. et al. Stereotactic body radiotherapy (SBRT) for the treatment of inoperable stage I non-small cell lung cancer patients. Clin. Transl. Oncol. 2015. 55(8). 213-9. doi: 10.1007/s12094-015-1361-4.
4. Wilkins C.M., Johnson V.L., Fargason R.E., Birur B. Psychosis as a sequelae of paraneoplastic syndrome in small-cell lung carcinoma: A psycho-neuroendocrine interface. Clin. Schizophr. Relat. Psychoses. 2017. 22(11). 153-8. doi: 10.3371/CSRP.CWVJ.111717.
5. Deberne M., Ropert S., Billemont B., Daniel C., Chapron J., Goldwasser F. Inaugural bone metastases in non-small cell lung cancer: a specific prognostic entity? BMC Cancer. 2014. 14(10). 416-26. doi: 10.1186/1471-2407-14-416.
6. Ulas A., Bilici A., Durnali A., Tokluoglu S., Akinci S., Silay K. et al. Risk factors for skeletal-related events (SREs) and factors affecting SRE-free survival for nonsmall cell lung cancer patients with bone metastases. Tumour. Biol. 2016. 15(8). 161-6. doi: 10.1007/s13277-015-3907-z.
7. Da Silva G.T., Bergmann A., Thuler L.C. Skeletal related events in patients with bone metastasis arising from non-small cell lung cancer. Support. Care Cancer. 2018. 5(7). 143-9. doi: 10.1007/s00520-015-2835-1.
8. Garcia-Gil M., Camici M., Allegrini S., Pesi R., Petrotto E., Tozzi M.G. Emerging role of purine metabolizing enzymes in brain function and tumors. Int. J. Mol. Sci. 2018. 19(11). 3598. doi: 10.3390/ijms19113598.
9. Yiu A., Van Hemelrijck M., Garmo H., Holmberg L., Malmström H., Lambe M. et al. Circulating uric acid levels and subsequent development of cancer in 493,281 individuals: findings from the AMORIS Study. Oncotarget. 2017. 26(8). 42332-42. doi: 10.18632/oncotarget.16198.
10. Dovell F., Boffetta P. Serum uric acid and cancer mortality and incidence: a systematic review and meta-analysis. Eur. J. Cancer. Prev. 2018. 27(4). 399-405. doi: 10.1097/CEJ.0000000000000440.
11. Sun Q., Zhao W., Wang L., Guo F., Song D., Zhang Q. et al. Integration of metabolomic and transcriptomic profiles to identify biomarkers in serum of lung cancer. J. Cell. Biochem. 2019. 25(2). 28482. doi: 10.1002/jcb.28482.
12. Meder L., König K., Fassunke J., Ozretić L., Wolf J., Merkelbach-Bruse S. et al. Implementing amplicon-based next generation sequencing in the diagnosis of small cell lung carcinoma metastases. Exp. Mol. Pathol. 2015. 99(3). 682-6. doi: 10.1016/j.yexmp.2015.11.002.
13. Hu M., Zhi X., Zhang J. Radiofrequency ablation (RFA) for palliative treatment of painful non-small cell lung cancer (NSCLC) rib metastasis: Experience in 12 patients. Thorac. Cancer. 2015. 6(6). 761-4. doi: 10.1111/1759-7714.12258.
14. He Y.F., Luo H.Q., Wang W., Chen J., Yao Y.W., Cai S.B. et al. Clinical features and prognosis-associated factors of non-small cell lung cancer exhibiting symptoms of bone metastasis at the time of diagnosis. Oncol. Lett. 2015. 9(6).2706-12.
15. Cetin K., Christiansen C.F., Jacobsen J.B., Nørgaard M., Sørensen H.T. Bone metastasis, skeletal-related events, and mortality in lung cancer patients: a Danish population-based cohort study. Lung. Cancer. 2014. 86(2). 247-54. doi: 10.1016/j.lungcan.2014.08.022.
16. Goodwin C.R., Khattab M.H., Sankey E.W., Elder B.D., Kosztowski T.A., Sarabia-Estrada R. et al. Factors associated with life expectancy in patients with metastatic spine disease from adenocarcinoma of the lung. Global. Spine J. 2015. 5(5). 417-24. doi: 10.1055/s-0035-1554778.
17. Oliveira M.F., Rotta J.M., Botelho R.V. Survival analysis in patients with metastatic spinal disease: the influence of surgery, histology, clinical and neurologic status. Arq. Neuropsiquiatr. 2015. 73(4). 330-5. doi: 10.1590/0004-282X20150003.
18. Avenel G., Rousseau T., Abramovici-Roels O., Paillotin D., Lequerré T., Vittecoq O. Arthritis due to metastasis. Joint Bone Spine. 2015. 82(1). 66-7. doi: 10.1016/j.jbspin.2014.07.004.
19. Pedley A.M., Benkovic S.J. A new view into the regulation of purine metabolism: the purinosome. Trends. Biochem. Sci. 2017. 42(1). 141-54. doi: 10.1016/j.tibs.2016.09.009.
20. Hoshino A., Costa-Silva B., Shen T.L., Rodrigues G., Hashimoto A., Tesic Mark M. Tumour exosome integrins determine organotropic metastasis. Nature. 2015. 527(7578). 329-35. doi: 10.1038/nature15756.
21. Yamaguchi S., Kageyama S., Miura K., Kato S. Pharmacological treatment for bone metastasis. Gan To Kagaku Ryoho. 2015. 42(11). 1342-5.

/47-1.jpg)
/48-1.jpg)
/48-2.jpg)
/49-1.jpg)
/50-1.jpg)