Журнал «Здоровье ребенка» Том 14, №8, 2019
Вернуться к номеру
Застосування бета-2-агоністів у лікуванні бронхіальної астми в дітей: спірні питання та власний досвід
Авторы: Ткаченко О.Я.
Українська медична стоматологічна академія, м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Історія використання бета-2-агоністів при респіраторних захворюваннях є багатогранною, адже ці світові досягнення медицини не тільки вплинули на лікування, але й змінили погляд на патогенетичні механізми розвитку бронхіальної астми. Активна дискусія щодо безпечного застосування тривалодіючих бета-2-агоністів триває не один десяток років. Цьому питанню присвячено багато наукових метааналізів, а найгостріше ця проблема постає, коли йдеться про пацієнтів дитячого віку. Проте, незважаючи на значний прогрес у діагностиці та лікуванні бронхіальної астми, усе ще залишається чимала частина пацієнтів, у яких захворювання з різних причин не повністю контролюється. Саме тому метою нашого дослідження стало вивчення ефективності й безпечності комбінованої терапії в пацієнтів з астмою за допомогою роздільного застосування інгаляційних кортикостероїдів і тривалодіючих бета-2-агоністів на тлі часткового контролю над симптомами астми. Під нашим спостереженням перебували 36 дітей віком від 11 до 17 років із діагнозом «бронхіальна астма», яким до базисного лікування інгаляційними кортикостероїдами був доданий β2-агоніст тривалої дії — формотеролу фумарат (Зафірон) 12 мкг через інгалятор «Циклохалер» двічі на день протягом двох тижнів. Під час лікування спостерігалось стрімке динамічне покращання, що характеризувалось зменшенням показника ACQ-5, пропорційним підвищенням пікової швидкості видиху з максимальним його приростом наприкінці 2-го тижня лікування. Важливо зауважити, що стійка кореляційна залежність була виявлена між рівнем контролю над симптомами астми й показниками функції зовнішнього дихання (ОФВ1), що додатково вказувало на ефективність комбінованої терапії. Отримані результати дозволяють рекомендувати використання формотеролу фумарату (Зафірон) через інгалятор «Циклохалер» у режимі роздільної комбінації з інгаляційними кортикостероїдами та як нетривалу монотерапію для запобігання бронхоспазму, індукованого фізичним навантаженням, у дітей з бронхіальною астмою.
История использования бета-2-агонистов при респираторных заболеваниях многогранна, поскольку данные мировые достижения медицины не только повлияли на лечение, но и изменили взгляд на патогенетические механизмы развития бронхиальной астмы. Активная дискуссия относительно безопасного использования длительно действующих бета-2-агонистов продолжается не одно десятилетие. Этому вопросу посвящено много научных метаанализов, но наиболее остро эта проблема стоит, когда речь идет о пациентах детского возраста. Однако, несмотря на значительный прогресс в диагностике и лечении бронхиальной астмы, все еще остается существенная часть пациентов, у которых заболевание по разным причинам не полностью контролируется. Именно поэтому целью нашего исследования стало изучение эффективности и безопасности комбинированной терапии у пациентов с астмой с помощью раздельного применения ингаляционных кортикостеродов и длительно действующих бета-2-агонистов на фоне частичного контроля над симптомами астмы. Под нашим наблюдением находились 36 детей в возрасте от 11 до 17 лет с диагнозом «бронхиальная астма», которым к базисному лечению ингаляционными кортикостероидами был добавлен β2-агонист длительного действия — формотерола фумарат (Зафирон) 12 мкг через ингалятор «Циклохалер» дважды в сутки на протяжении двух недель. Во время лечения наблюдалось стремительное динамическое улучшение, что характеризовалось уменьшением показателя ACQ-5, пропорциональным повышением пиковой скорости выдоха с максимальным его приростом в конце 2-й недели лечения. Важно отметить, что стойкая корреляционная зависимость была выявлена между уровнем контроля над симптомами астмы и показателями функции внешнего дыхания (ОФВ1), что дополнительно указывало на эффективность комбинированной терапии. Полученные результаты позволяют рекомендовать использовать формотерола фумарат (Зафирон) через ингалятор «Циклохалер» в режиме раздельной комбинации с ингаляционными кортикостероидами и в качестве непродолжительной монотерапии для предупреждения бронхоспазма, индуцированного физической нагрузкой, у детей с бронхиальной астмой.
The history of the use of beta-2 agonists in respiratory diseases is multifaceted since these world achievements of medicine not only influenced the treatment but also changed the view on the pathogenetic mechanisms of bronchial asthma. An active discussion regarding the safe use of long-acting beta-2 agonists has been going on for decades. Many scientific meta-analyses have been devoted to this issue, but the problem is most acute when it comes to paediatric patients. However, despite significant progress in the diagnosis and treatment of asthma, there is still a significant proportion of patients in whom the disease for various reasons is not fully controlled. That is why our study aimed to study the efficacy and safety of combination therapy in patients with asthma by using a separate combination of inhaled corticosteroids and long-acting beta-2 agonists against the background of partial control of asthma symptoms. The study involved 36 children aged 11 to 17 years with a diagnosis of bronchial asthma, who received β2-agonist long-acting formoterol fumarate (Zafiron) 12 mc via Cyclohaler inhaler twice a day for two weeks along with the basic treatment with inhaled corticosteroids. During the treatment, rapid dynamic improvement was observed, which was characterized by a decrease in the ACQ-5 index, a proportional increase in the peak exhalation rate with its maximum increase at the end of the 2nd week of treatment. It is important to note that a persistent correlation was found between the level of control over asthma symptoms and indicators of pulmonary function test, which further indicated the effectiveness of combination therapy. The results obtained allow us to recommend the use of formoterol fumarate (Zafiron) via Cyclohaler inhaler in separate combination with inhaled corticosteroids and as a short-term monotherapy for the prevention of exercise-induced bronchospasm in children with bronchial asthma.
бронхіальна астма; діти; бета-2-агоністи тривалої дії
бронхиальная астма; дети; бета-2-агонисты длительного действия
asthma; children; long-acting beta-2 agonists
Вступ
Бета-2-агоністи відносяться до чималої групи препаратів, які найчастіше використовують для лікування бронхіальної астми (БА). За останні 20 років немає жодного великого узагальнюючого метааналізу щодо фармакотерапії бронхіальної астми, де б не підкреслювали, що інгаляційні бета-2-агоністи є засобами вибору при лікуванні загострень бронхіальної астми. Обґрунтовуючи механізми впливу бета-агоністів, першочергову увагу фокусують на бета-2-адренорецепторах дихальних шляхів, які безпосередньо відповідають за бронходилатаційний ефект. Проте останнім часом інтенсивно ведеться дискусія щодо доцільності, раціонального застосування та безпеки бета-2-агоністів пролонгованої дії, зокрема в педіатричній практиці [1].
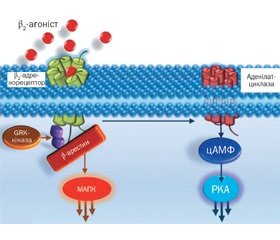
Адренергічні рецептори є членами великої родини G-білок-зв’язуючих рецепторів, функціонування яких здійснюється за допомогою аденілатциклазної системи. Бета-2-адренергічний рецептор містить сім гідрофобних трансмембранних ділянок. Його функція залежить від зв’язування з Gs-білком, який стимулюється аденілатциклазою, що веде до збільшення рівня циклічного аденозинмонофосфату (цАМФ) у клітині й діє як вторинний месенджер, викликаючи активацію функції рецептора. Вплив бета-2-адренергічного рецептора на гладку мускулатуру полягає у відкритті через цАМФ або безпосередньо через Gs-білок Са2+-залежних калієвих каналів. Підвищення концентрації цАМФ, окрім розслаблення гладких м’язів бронхів, сприяє пригніченню вивільнення медіаторів реакції гіперчутливості негайного типу, здебільшого із тучних клітин (Liggett S.В., Raymond J.R., 1993). Після зв’язування рецептора або передачі сигналу знижується чутливість бета-2-адренергічних рецепторів до подальшої стимуляції, тобто відбувається десенситизація, яка має дві фази (рис. 1) [2].
Спочатку, протягом декількох секунд чи хвилин, шляхом фосфорилювання цитоплазматичних ділянок від Gs-білка відщеплюється бета-2-адренергічний рецептор, а після інактивації тригерного стимулу можливе швидке відновлення цього зв’язку. Наступна фаза десенситизації пов’язана з тривалою (протягом декількох годин) експозицією агоніста і проявляється або зниженням афінності рецептора до нього, або порушенням взаємодії між аденілатциклазною системою і рецептором. Цей процес може відбуватися за участю цАМФ або незалежно від неї.
Бета-2-адренергічні рецептори широко представлені в дихальних шляхах і присутні на клітинах гладких м’язів, епітелії, в підслизовому шарі, альвеолах, пресинаптичних нервах, також на різних клітинах, що беруть участь в алергічному запаленні (Johnson М., 1998). Максимальна щільність бета-адренорецепторів визначається на рівні дрібних і середніх бронхів. Принципова дія бета-2-агоністів полягає в стимуляції відповідних рецепторів гладкої мускулатури, що призводить до бронходилатації, проте вони також можуть збільшувати мукоциліарний кліренс, секрецію слизових залоз, продукцію сурфактанту і навіть модулювати холінергічну нейротрансмісію (Barnes P.J., 1993).
За механізмом дії b2-агоністи поділяються на три групи (табл. 1): короткодіючі (КДБА), тривало діючі (ТДБА) та ультратривалі (ультра-ТДБА). Короткодіючі b2-агоністи, як свідчить назва, мають короткий період напіврозпаду й використовуються як засоби для швидкого зняття бронхіальної обструкції, тоді як ТДБА і ультра-ТДБА забезпечують більш тривале та стійке полегшення клінічної симптоматики (Tamm et al., 2012).
Історія використання b-агоністів при респіраторних захворюваннях є різносторонньою і, можна навіть сказати, захоплюючою, адже це світові досягнення медицини не тільки вплинули на лікування, але й змінили погляд на патогенетичні механізми розвитку бронхіальної астми (Chu і Drazen, 2005; Barnes, 2006; Jackson, 2009).
Вважається, що b-агоніст-опосередкована релаксація дихальних шляхів була вперше застосована близько 5000 років тому в китайській медицині, коли для полегшення симптомів респіраторних захворювань була використана ефедринвмісна рослина ma huang. Ефедрин активує b2AР альтернативним шляхом через підвищення активності норадреналіну. Дослідження XX століття призвели до збільшення використання b-агоністів при респіраторних захворюваннях, особливо після впровадження в 1940-х роках першого неселективного b-агоніста — ізопреналіну. Протягом наступних двадцяти років ізопреналін став інгаляційним препаратом, який найчастіше використовували для лікування бронхіальної астми (Jackson, 2009). Проте в 1960-х роках епідемія смертей у шести країнах, ймовірно, через перевищення дози ізопреналіну, дала зрозуміти, що потрібно більш прискіпливо ставитися до призначення бронхолітичної терапії. Перший b2-селективний агоніст AР — сальбутамол був синтезований 1968 року. І це був ще один сплеск у фарміндустрії, адже окрім зменшення побічних ефектів, пов’язаних із неселективністю ізопреналіну, він також перевершив свого попередника за тривалістю ефекту (Brittain et al., 1968; Cullum et al., 1969). При подальшій модифікації сальбутамолу ця ж команда дослідників створила сальметерол, здатний утримувати бронходилатаційний ефект до 12 годин, тому цей клас лікарських засобів був названий бета-агоністами тривалої дії. Згодом був створений ще один ТДБА — формотерол, а не так давно відкриті агоністи b2AР (індакатерол), одноразове використання яких у пацієнтів із хронічним обструктивним захворюванням легень (ХОЗЛ) дозволяє утримувати бронходилатаційний ефект протягом доби, — так звані ультра-ТДБА. Незважаючи на те, що b2-агоністи є основою лікування бронхіальної астми та ХОЗЛ, рекомендації щодо їх застосування в різних категоріях пацієнтів різко відрізняються. У 2011 році Управління з контролю за продуктами і лікарськими засобами США (FDA) опублікувало попередження про те, що при лікуванні астми тривало діючі b2-агоністи рекомендується використовувати в поєднанні з інгаляційними кортикостероїдами (ІКС) [3].
Незважаючи на те, що b-агоністи більше ніж півстоліття широко застосовуються для лікування астми, вони мають майже таку ж довгу історію вивчення побічних «нецільових» ефектів. І навіть на сьогодні побоювання щодо безпеки використання b-агоністів через ризик смертності/захворюваності залишаються суперечливими, оскільки ще досить погано вивчені факти, які формують це підґрунтя до сумніву.
Смертність і захворюваність є несприятливими наслідками, які домінували в обговоренні безпеки b-агоністів за останні кілька десятиліть. Огляд Ortega і Peters, 2010, демонструє чудову історію різних «епідемій», пов’язаних із використанням бронхолітиків як препаратів для лікування астми. У Новій Зеландії 1976 року смертність, пов’язана з астмою, збільшилася після випуску фенотеролу (КДБА), але згодом, 1989 року, після видалення препарату з ринку пішла на спад. 1990 року в одному з перших проспективних досліджень із безпеки b-агоністів повідомлялося, що регулярне планове застосування фенотеролу призвело до погіршення контролю над астмою (Sears et al., 1990).
Після появи на фармацевтичному ринку ТДБА їх безпека також була поставлена під сумнів, зокрема широкомасштабне дослідження (SNS) припускає тенденцію до збільшення смертності від астми в зв’язку з використанням сальметеролу (Castle et al., 1993). Ці результати виявилися достатніми для того, щоб викликати проведення численних ретроспективних та перспективних досліджень. Критичним виявилось дослідження SMART (Salmeterol Multicenter Asthma Research Trial), ініційоване компанією «GlaxoSmithKline» 1996 року, яке посилило обговорення безпеки ТДБА. 2002 року проміжний аналіз даних показав чотирикратне збільшення смертності пацієнтів, які отримують сальметерол, порівняно з тими, які отримували плацебо (Nelson et al., 2006). Із моменту оприлюднення результатів дослідження SMART почалась гаряча дискусія щодо методів статистичного аналізу, інтерпретації отриманих даних та самого дизайну [4].
Результати наукових оглядів останніх років теж неоднозначні. Групою дослідників з Японії було проведене відкрите рандомізоване багатоцентрове дослідження трансдермального застосування тулобутеролу в дітей 4–12 років на тлі антилейкотрієнової терапії [5]. Під спостереженням знаходились 33 дитини основної групи, у яких протягом чотирьох тижнів вивчали ефективність даного лікування, досліджуючи пікову швидкість видиху (ПШВ), рівень оксиду азоту у видихуваному повітрі (FeNO), клінічні симптоми та побічні явища. Висновки, які зробили автори, свідчать про те, що тулобутерол, будучи агоністом b2 короткої дії, демонструє тривалість ефекту протягом 24 годин, схожий за активністю на ТДБА (особливо за даними ПШВ), за відсутності побічних ефектів порівняно з іншими групами.
Літературний огляд B.F. Chauhan et al., 2015, щодо застосування тривало діючих b2-агоністів разом з ІКС у дітей з бронхіальною астмою включав 39 досліджень за участю 6381 дитини [6]. Результати метааналізу свідчать, що в дітей з персистуючою астмою додавання ТДБА до ІКС не сприяло значному зниженню частоти загострень, але значно покращувало функцію легень порівняно з групою дітей, які отримували низькі або більш високі дози ІКС. Не було також виявлено вірогідних відмінностей у побічних ефектах, але автори підкреслюють необхідність подальшого моніторингу та вивчення безпеки застосування ТДБА.
Дані, отримані завдяки метааналізу 45 подвійних сліпих плацебо-контрольованих рандомізованих досліджень, демонструють, що інгаляційні b2-агоністи короткої та тривалої дії є безпечними для запобігання бронхоспазму, індукованому фізичним навантаженням [7]. В огляді проаналізована ефективність b2-агоністів, молекули яких найчастіше досліджуються (сальбутамол, сальметерол та формотерол), що доставлялися через дозовані інгалятори чи небулайзери. Оцінювали ефективність разового введення та тривале застосування. В одному з досліджень, яке очолив Stelmach і в якому порівнювали ефективність формотеролу в дозі 9 мкг на день і плацебо у двох групах, обидві з яких отримували паралельно ІКС (будесонід у дозі 100 мкг щодня), наприкінці чотиритижневого періоду лікування індукований фізичним навантаженням бронхоспазм в основній групі був значно меншим порівняно з групою плацебо. Загалом аналіз педіатричних досліджень у даному огляді демонструє виражений профілактичний ефект застосування b2-агоністів, хоча він є досить неоднорідним, а тривале регулярне їх введення формує толерантність і не дає можливості сформувати кінцеві висновки про безпеку. Повідомляється також, що регулярне профілактичне використання b2-агоністів для запобігання бронхоспазму, індукованому фізичним навантаженням, потребує подальшого вивчення, перш за все з позиції застосування монотерапії ТДБА при лікуванні астми, у тому числі з урахуванням різних генотипів, супутньої терапії та генетичних поліморфізмів.
2016 року робоча група Американської академії алергології, астми та імунології (AAAAI), яку очолив J. Weiler, опублікувала практикум щодо ведення пацієнтів із фізично індукованою бронхообструкцією (ФІБ) [8]. Висновки експертів, які стосуються можливості призначення інгаляційних агоністів b2-адренергічних рецепторів для попередження ФІБ з метою відновлення легеневої функції, мають високий рівень доказовості (А). Вони рекомендують дозоване застосування КДБA, ТДБA або обох періодично перед фізичними навантаженнями (< 4 разів на тиждень), оскільки це може попередити чи зменшити ФІБ (рівень доказовості А), при цьому застерігають від безконтрольного застосування b2-адренергічних препаратів не тільки як монотерапії, але також у комбінації з ІКС. Експерти підкреслюють, що наразі застосовуються декілька ТДБА і відрізняються вони за механізмом дії, наприклад, формотерол, на відміну від сальметеролу, має більш швидкий початок бронхолітичної та бронхопротективної дії (15–30 хв). Середня тривалість бронхолітичної дії сягає 12 годин, однак у деяких пацієнтів оптимальний інтервал бронхопротекції для ФІБ може тривати до 6 годин. Щоденне використання ТДБА (та КДБА) сприяє певній втраті бронхопротективного ефекту (толерантності) із перехресною чутливістю до інших b2-агоністів. Важливо зауважити, що толерантність виникає навіть тоді, коли пацієнти паралельно отримують ІКС. Деякі особи можуть мати більшу схильність до виникнення резистентності, хоча не було отримано вірогідних даних, що в пацієнтів із поліморфізмом b2-рецепторів Arg16Gly вона розвивається частіше й швидше. Тому не рекомендується тривале застосування агоністів адренергічних речовин.
Найчастіше ТДБА використовують як один із трьох варіантів корекції лікування в дітей, які не мають належного контролю над симптомами астми при застосуванні ІКС [9]: додавання ТДБА; додавання антагоніста рецептора лейкотрієну; збільшення дози інгаляційних кортикостероїдів.
2015 року з’явився системний тематичний огляд із застосування ТДБА у дітей, де були проаналізовані 43 наукові публікації (28 досліджень) і зроблені висновки, що на даний час немає рандомізованих випробувань, які можуть стверджувати про необхідність припинення застосування ТДБА у дітей після досягнення контролю над астмою за допомогою ІКС плюс ТДБА [10]. Для того щоб адекватно судити про те, коли доцільно та безпечно відмінити ТДБА у дітей, необхідно провести масштабне подвійне сліпе рандомізоване дослідження з оцінки ефективності та безпечності, яке повинно включати дітей різного віку й тривати принаймні шість місяців.
Активна дискусія щодо безпечного застосування ТДБА триває не один десяток років. Цьому питанню присвячений не один науковий метааналіз, а найгостріше ця проблема постає, коли йдеться про пацієнтів дитячого віку. В електронній базі даних Кокранівської бібліотеки висвітлено чимало якісних досліджень, які стосуються безпечності бронхолітичної терапії в дітей. В одному з них [11], незважаючи на ґрунтовно проведений аналіз безпечності регулярного прийому формотеролу та сальметеролу в дітей з астмою, автори не змогли зробити однозначних висновків. Вони підкреслили, що немає переконливих даних, що тривала комбінована терапія формотеролом або сальметеролом у дітей збільшує ризик летальності від астми і водночас не можна сказати, що вона є безпечною. Проте поєднання ІКС та ТДБА є менш ризикованим, ніж тривала монотерапія бронхолітиком. Великі сподівання покладені на FDA, яка ініціювала низку аналогічних досліджень, які ще тривають.
Проте, незважаючи на значний прогрес у діагностиці та лікуванні БА, все ще залишається чимала частина пацієнтів, у яких захворювання з різних причин не повністю контролюється. Особливу категорію становлять діти, у яких тригером часто виступає гостра респіраторно-вірусна інфекція, що сприяє порушенню функції зовнішнього дихання та зниженню показників якості життя. Такі діти не завжди демонструють загострення БА, але перебіг захворювання може погіршуватись, що потребує зваженої та неагресивної корекції лікування.
Метою нашого дослідження стало вивчення ефективності й безпечності комбінованої терапії пацієнтів з БА за допомогою роздільного застосування ІКС і ТДБА на тлі часткового контролю над симптомами астми.
Матеріали та методи
Під нашим спостереженням в амбулаторних умовах перебували 36 дітей віком від 11 до 17 років (середній вік 14,0 ± 0,4 року) із діагнозом «бронхіальна астма персистуюча», встановленим згідно з міжнародним уніфікованим клінічним протоколом (https://ginasthma.org/wp-content/uploads/2019/06/GINA-2019-main-report-June-2019-wms.pdf), які мали частковий (неповний) контроль через супутню гостру респіраторну вірусну інфекцію (ГРВІ) із неускладненим перебігом (табл. 2).
Усі пацієнти на момент першого візиту отримували базисну терапію виключно інгаляційними кортикостероїдами згідно з протоколом лікування у відповідній дозі двічі на день. Після включення в дослідження до базисного лікування був доданий b2-агоніст тривалої дії — формотеролу фумарат (Зафірон) у дозі 12 мкг у вигляді сухого порошку, який діти застосовували через інгалятор «Циклохалер» перед прийомом ІКС також двічі на день протягом двох тижнів (спочатку b2-агоніст тривалої дії, а після 15-хвилинної перерви — ІКС). У подальшому, після його відміни, пацієнти продовжували використовувати ІКС у сталій дозі та знаходились під спостереженням ще два тижні. Зазначені препарати застосовувалися пацієнтами в режимі роздільної комбінації, що дозволило з легкістю відмінити b2-агоніст тривалої дії після досягнення контролю.
Дослідження тривало 4 тижні (28,06 ± 1,25 дня), із них два тижні (13,30 ± 0,15 дня) склав період прийому препарату. Процедура візиту включала оцінку ефективності та безпечності лікування, а саме: симптомів захворювання за допомогою опитувальника Asthma Control Questionnaire (ACQ-5), результатів фізикального обстеження, даних щоденної пікфлоуметрії та показників функції зовнішнього дихання, зокрема об’єму форсованого видиху за 1 секунду (ОФВ1) на першому та останньому візитах.
Критеріями включення пацієнтів у дослідження були:
— згода пацієнта та батьків на участь у дослідженні;
— вік 11–17 років;
— встановлений діагноз БА;
— відсутність повного контролю над БА (ACQ-5);
— об’єм форсованого видиху за 1 с (ОФВ1) < 80 % від належного, оборотність бронхообструкції в пробі з 200–400 мкг сальбутамолу > 12 %.
Критеріями виключення був прийом інших препаратів базисного лікування (антагоністи лейкотрієнових рецепторів, комбіновані препарати, до складу яких входять ТДБА, теофіліни, пероральні кортикостероїди, антитіла до IgE). У разі необхідності пацієнти могли користуватися симптоматичними засобами (антигістамінні препарати, b2-агоністи короткої дії, емолієнти, жарознижуючі та засоби для промивання і зрошення порожнини носа).
Для оцінки ефективності проведеної терапії використовували скорочений варіант опитувальника контролю над астмою ACQ-5 (https://www.qoltech.co.uk/acq.html), який дозволяє не тільки оцінити рівень поточного контролю над симптомами астми, але й прогнозувати ризик майбутнього загострення [12]. На сьогодні скорочена версія ACQ-5 є обґрунтованим, адекватним та об’єктивним інструментом оцінки, який найчастіше використовується в клінічних дослідженнях, де мінімальний діапазон балів допомагає виявити клінічно значущі зміни контролю над астмою у тих хворих, у яких згідно з критеріями GINA вона залишається неконтрольованою. Універсальність даного опитувальника обумовлена можливістю застосовувати в дорослих та пацієнтів із 6 років (лише діти до 10 років під час заповнення потребують допомоги медичного персоналу, для цього розроблена інтерв’ю-версія). Пацієнти нашої групи спостереження відповідали на питання самостійно.
Для оцінки ефективності проведеної терапії застосовували щоденну пікфлоуметрію як метод функціональної діагностики, який дозволяє визначити ПШВ. Пацієнти самостійно або під контролем батьків проводили щоденне вимірювання в один і той самий час (вранці після пробудження та ввечері перед сном) двічі на день і отримані показники заносили в щоденник. Норми показників пікфлоуметрії розраховувалися індивідуально для кожного пацієнта, залежно від статі, віку та зросту (для дітей до 15 років враховувався лише вік).
Результати
Динаміка результатів опитувальника ACQ-5 наведена в табл. 3. Наведені дані демонструють, що повного контролю над симптомами астми на першому візиті не було в жодного пацієнта, оскільки середня кількість балів, отриманих при опитуванні, становила більше 1,50 (2,08 ± 0,16). Під час лікування спостерігалось стрімке динамічне покращання, що характеризувалось зменшенням показника за ACQ-5: через тиждень прийому препарату він уже становив менше від порогового значення (1,50), що відповідає досягненню контролю за останній тиждень. Період контрольованого перебігу продовжував прогресивно збільшуватися до кінця дослідження. Слід підкреслити, що різниця у вираженості симптомів між 1-м, 2-м та 4-м тижнем лікування (1–3-й візити) була вірогідною за всіма симптомами (p < 0,05). На кінець дослідження, за даними опитувальника ACQ-5, серед обстежених не було жодної особи з неконтрольованим перебігом БА, оскільки в усіх пацієнтів показник був меншим за 0,75, що свідчить про низький ризик майбутнього загострення [13].
Із наведених у табл. 3 даних видно, що знижений показник ОФВ1 на початку дослідження також указує на частковий контроль над симптомами астми. Так, на 1-му візиті (до зміни режиму терапії пацієнтів) середній показник ОФВ1 становив 68,46 ± 6,23 % від належного, що відповідало 2,08 ± 0,16 бала згідно з опитувальником ACQ-5 та частоті застосування КДБА в середньому понад 3 рази на день. Протягом лікування спостерігалась чітка тенденція до збільшення показника ОФВ1 та, відповідно, зменшення необхідності в додатковій бронхолітичній терапії. Важливо відзначити, що стійка кореляційна залежність була виявлена між рівнем контролю над симптомами БА (дані опитувальника ACQ-5) і показниками функції зовнішнього дихання (ОФВ1), що додатково вказувало на ефективність комбінованої терапії із призначенням формотеролу фумарату (Зафірон).
Зниження ПШВ під час щоденної пікфлоуметрії є також вагомою діагностичною ознакою поганого контролю астми. Цей показник є надзвичайно динамічним, а величина його відхилення прямо пропорційна ступеню бронхіальної гіперреактивності. Аналізуючи результати, наведені в табл. 4, слід відзначити пропорційне підвищення ПШВ під час лікування, з максимальним його приростом наприкінці 2-го тижня лікування.
Слід зауважити, що всі пацієнти відмітили хорошу і дуже хорошу переносимість препарату Зафірон, а також високо оцінили зручність, надійність та простоту користування інгалятором «Циклохалер». Під час дослідження не було зафіксовано жодних негативних побічних явищ; усі пацієнти дотримувалися правильного дозування препаратів та завершили дослідження згідно з протоколом. Високий комплаєнс під час лікування, а також позитивна суб’єктивна оцінка з боку пацієнтів відобразилася у зменшенні клінічних симптомів астми та зниженні потреби в симптоматичних засобах.
Обговорення
Проведене дослідження продемонструвало високу ефективність та безпечність запропонованої схеми лікування, яка перш за все була покликана максимально якісно внести корективи в базисну терапію дітей з поганим контролем над БА. Гнучкість фармакотерапії тут є дуже важливою складовою, адже для практикуючих лікарів підбір оптимальних доз препаратів часто стає досить непростим алгоритмом, оскільки стан пацієнта може змінюватися не настільки критично, щоб говорити про перехід на наступну сходинку фармакотерапії. Проте з метою підвищення ефективності лікування хворі все-таки потребують корекції в призначенні лікарських засобів та їх дозуванні.
Вибір препарату Зафірон здійснювався на підставі його фармакологічної ефективності та переваг щодо застосування самого інгалятора «Циклохалер» [14]. Формотерол поєднує цілу низку унікальних фармакологічних властивостей: висока ефективність і b2-селективність, що забезпечують високий профіль безпеки, швидкий початок дії і водночас тривалий ефект за відсутності кумуляції препарату в терапевтичних дозах. Добре відомі також протизапальні властивості формотеролу, які досліджувались in vitro. Шляхом зниження активності металопротеїнеази-9, макрофагів, еозинофілів він проявляє свою активність при гострому запальному процесі [15]. За рахунок стимулювання b2-рецепторів на клітинах ендотелію формотерол може не тільки ефективно блокувати виникнення локального набряку, але також зменшувати нейтрофільне запалення в дихальних шляхах через пригнічення продукції IL-8, що демонструє додаткову перевагу прийому Зафірону під час загострення, індукованого вірусними чи бактеріальними агентами. Важливо також відзначити, що формотерол шляхом активації протеїнфосфатази 2А в рецепторах підвищує чутливість до кортикостероїдів, що пояснює перевагу його над іншими ТДБА у базисному лікуванні БА, зокрема у дітей (GINA, 2019) [16]. Власне ці додаткові небронхолітичні ефекти Зафірону відіграють чималу роль під час лікування загострень.
Аналізуючи результати дослідження, варто зауважити, що позитивна динаміка симптомів астми почалась одразу після застосування призначеної схеми лікування, і це ще раз підкреслює можливість призначення незначних і нетривалих корекцій у лікуванні БА без переходу на більш агресивну терапію. Окрім того, планова інгаляція Зафірону дає змогу не тільки покрити період фізичної активності дитини протягом дня (10–12 годин), але також попередити безконтрольний самостійний прийом бронхолітиків короткої дії, адже інколи ознаки бронхіальної обструкції зберігаються досить тривало, з явищами прихованого бронхоспазму та проявами бронхіальної гіперреактивності.
Відсутність небажаних явищ під час нашого дослідження ще раз дозволяє акцентувати увагу на безпечності застосування формотеролу, що підтверджена у великій кількості рандомізованих досліджень, у яких препарат призначався не тільки як базисна терапія, але також за потребою [17]. Проведений аналіз понад 40 випробувань за участю 11 419 дітей (4–11 років) та підлітків (12–17 років), у яких формотерол у 82 % випадків застосовували разом із ІКС, свідчить про відсутність будь-якого ризику госпіталізації, пов’язаної з астмою, на тлі застосування ТДБА. На ці результати не впливала ні доза препарату, ні етнічна приналежність.
Багатогранний механізм реалізації фармакологічних ефектів доповнюється якісною доставкою препарату в дихальні шляхи, яка забезпечується інгалятором «Циклохалер» нового покоління «Fantasmino». Середній діаметр частинок під час інгалювання становить лише 2,4 мкм, що дозволяє досягти 40% легеневої депозиції препарату. Пристрій активується вдихом пацієнта, повітряний потік обертає капсулу і сприяє попаданню порошку з капсули в дихальні шляхи. При цьому витримується принцип контролю за дозою; завдяки солодкому присмаку лактози в роті після інгаляції та візуальному контролю через прозору стінку капсули пацієнти та батьки з легкістю могли контролювати правильність застосування препарату, а відсутність потреби координувати вдих із натисканням на клапан інгалятора додавала зручності при користуванні. Важливо підкреслити, що для ефективної інгаляції достатньо невеликого інспіраторного потоку навіть у дітей, старших від 5 років, за умови загострення астми.
Отримані позитивні результати роздільного застосування двох засобів базисної терапії відкривають можливість більш гнучкого використання ІКС та ТДБА. Така схема дозволяє змінити дозу ІКС без збільшення дози бронхолітика чи взагалі відмінити його за необхідності. Вагомою перевагою є також можливість інгалювання препаратів у правильній послідовності, що не лише покращує депозицію препаратів, а й дозволяє зменшити медикаментозне навантаження на пацієнта та знизити ризик розвитку можливих побічних ефектів. Отже, призначення формотеролу фумарату (Зафірон) разом з адекватними дозами ІКС дозволило пацієнтам досягти необхідного рівня контролю над захворюванням навіть на тлі ГРВІ.
Висновки
Таким чином, отримані результати дослідження дозволяють рекомендувати використання формотеролу фумарату (Зафірон) через інгалятор «Циклохалер» у режимі роздільної комбінації з інгаляційними кортикостероїдами та як нетривалу монотерапію для запобігання бронхоспазму, індукованому фізичним навантаженням, у дітей з бронхіальною астмою.
Конфлікт інтересів. Не заявлений.
1. Kim So-H., Sun-Ju Yi, Lee H. et al. b2-Adrenergic receptor (b2-AR) agonist formoterol suppresses differentiation of L6 myogenic cells by blocking PI3K-AKT pathway. Anim. Cells Syst. (Seoul). 2019 Feb. 23(1). 18-25. doi: 10.1080/19768354.2018.1561516.
2. Charlotte K.В., Penn R.B., Ian P. Hall b2-agonists. Handb. Exp. Pharmacol. 2017. 237. 23-40. doi: 10.1007/164_2016_64.
3. Płoszczuk A., Bosheva M., Spooner K. et al. Efficacy and safety of fluticasone propionate/formoterol fumarate in pediatric asthma patients: a randomized controlled trial. Ther. Adv. Respir. Dis. 2018 Jan-Dec. 12. doi: 10.1177/1753466618777924.
4. Bisgaard H., Le Roux P., Bjåmer D. et al. Budesonide/formoterol maintenance plus reliever therapy: a new strategy in pediatric asthma. Chest. 2006 Dec. 130(6). 1733-43. doi: 10.1378/chest.130.6.1733.
5. Katsunuma T., Fujisawa T., Nagao M. et al. Effects of transdermal tulobuterol in pediatric asthma patients on long-term leukotriene receptor antagonist therapy: results of a randomized, open-label, multicenter clinical trial in Japanese children aged 4-12 years. Allergol. Int. 2013 Mar. 62(1). 37-43. doi: 10.2332/allergolint.12-OA-0437.
6. Chauhan B.F., Chartrand C., Ni Chroinin M. et al. Addition of long-acting beta2-agonists to inhaled corticosteroids for chronic asthma in children. Cochrane Database of Systematic Reviews. 2015, Issue 11. Art. No.: CD007949. doi: 10.1002/14651858.CD007949.pub2.
7. Bonini M. Beta-2 agonists for exercise-induced bronchoconstriction in children. Paediatric respiratory reviews. 2014. Vol. 15. № 1. P. 42-44. doi: 10.1016/j.prrv.2013.11.009.
8. Weiler J.M., Brannan J.D., Randolph C.C. et al. Exercise-induced bronchoconstriction update — 2016. J. Allergy Clin. Immunol. 2016 Nov. 138(5). 1292-1295. e36. doi: 10.1016/j.jaci.2016.05.029.
9. Van Asperen P. Long-acting beta2 agonists for childhood asthma. Aust. Prescr. 2012 Aug. 35. 111-31. doi: 10.18773/austprescr.2012.049.
10. Kew K.M., Beggs S., Ahmad S. Stopping long-acting beta2-agonists (LABA) for children with asthma well controlled on LABA and inhaled corticosteroids. Cochrane Database of Systematic Reviews. 2015. Issue 5. Art. No.: CD011316. doi: 10.1002/14651858.CD011316.pub2.
11. Cates C.J., Oleszczuk M., Stovold E., Wieland L.S. Safety of regular formoterol or salmeterol in children with asthma: an overview of Cochrane reviews. Cochrane Database Syst. Rev. 2012 Oct 17. 10. CD010005. doi: 10.1002/14651858.CD010005.pub2.
12. Juniper E.F., Gruffydd-Jones K., Ward S., Svensson K. Asthma Control Questionnaire in children: validation, measurement properties, interpretation. Eur. Respir. J. 2010 Dec. 36(6). 1410-6. doi: 10.1183/09031936.00117509.
13. Bateman E.D., Reddel H.K., Ericksson G. et al. Overall asthma control: the relationship between current control and future risk. J. Allergy Clin. Immunol. 2010. 125. 600-608.
14. Kuprys’-Lipin’ska I., Tworek D., Vanderbist F., Bochen’ska-Marciniak M. Эффективность и безопасность 12-недельного курса терапии новой лекарственной формой флутиказона пропионата в дозировке 125 и 250 мкг дважды в сутки с использованием Циклохалера нового поколения. Астма та алергія. 2013. № 4. С. 88-97.
15. Zhang W., Fiévez L., Cheu E. et al. Anti-inflammatory effects of formoterol and ipratropium bromide against acute cadmium-induced pulmonary inflammation in rats. European journal of pharmacology. 2009. 628(1–3). 171-8. doi: 10.1016/j.ejphar.2009.11.015.
16. Helen K., FitzGerald J.M., Eric D. Bateman et al. GINA 2019: a fundamental change in asthma management. European Respiratory Journal. 2019. 53. 1901046. doi: 10.1183/13993003.
01046-2019.
17. Price J.F., Radner F., Lenney W., Lindberg B. Safety of formoterol in children and adolescents: experience from asthma clinical trials. Arch. Dis. Child. 2010 Dec. 95(12). 1047-53. doi: 10.1136/adc.2010.183814.

/28-1.jpg)
/29-1.jpg)
/31-1.jpg)
/32-1.jpg)