Журнал «Боль. Суставы. Позвоночник» Том 9, №4, 2019
Вернуться к номеру
Дискуссионные вопросы определения порога вмешательства при глюкокортикоидиндуцированном остеопорозе: кого лечить?
Авторы: Головач И.Ю.
Клиническая больница «Феофания» Государственного управления делами, г. Киев, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Глюкокортикоїдіндукований остеопороз є найпоширенішою причиною вторинного остеопорозу. Після початку перорального прийому глюкокортикоїдів протягом декількох місяців відзначається швидка втрата кісткової маси й зростання ризику переломів. Важливість глюкокортикоїдіндукованого остеопорозу як проблеми охорони здоров’я асоційована з частим застосуванням глюкокортикоїдів пацієнтами з різними хронічними захворюваннями та високим рівнем остеопорозу, виявленого в цих груп пацієнтів. Розвиток глюкокортикоїдіндукованого остеопорозу обумовлений пригніченням процесу утворення кістки, що супроводжується раннім, але короткочасним збільшенням резорбції кістки. Серед численних механізмів, що лежать в основі порушення кісткового метаболізму при тривалому прийомі глюкокортикоїдів, необхідно відзначити збільшення співвідношення RANKL/OPG, підвищення експресії склеростину, активацію PPARγR2, а також гіпогонадизм, порушення всмоктування кальцію в кишечнику й зниження вироблення інсуліноподібного фактора росту 1. Незважаючи на доступні й ефективні профілактичні заходи, багато пацієнтів, які починають або отримують глюкокортикоїдну терапію, недостатнім чином оцінені в плані стану кісткової тканини й ризику переломів. Установлено порогові значення добових доз глюкокортикоїдів (≥ 2,5 мг/добу) і тривалість їх прийому (≥ 3 місяців), при яких пацієнти повинні бути обов’язково піддані оцінці ризику переломів і необхідності проведення лікування антиостеопоротичними препаратами. Національні керівництва з менеджменту глюкокортикоїдіндукованого остеопорозу пропонують різні підходи до визначення порогу втручань, базуючись на використанні різних критеріїв. Алгоритм FRAX® розраховує 10-річну ймовірність переломів за клінічними факторами ризику з тестуванням мінеральної щільності кістки або без нього і калібрується для регіональної частоти переломів і смертності. Незважаючи на обмеження, цей інструмент є найдієвішим у визначенні порога втручань. У рекомендаціях ACR — 2017 вказується, що початковий абсолютний ризик переломів слід оцінювати з використанням алгоритму FRAX® з урахуванням доз глюкокортикоїдів і тестування мінеральної щільності кістки якомога швидше (до 6 місяців від початку прийому глюкокортикоїдів).
Глюкокортикоидиндуцированный остеопороз является наиболее распространенной причиной вторичного остеопороза. После начала перорального приема глюкокортикоидов в течение нескольких месяцев отмечаются быстрая потеря костной массы и увеличение риска переломов. Важность глюкокортикоидиндуцированного остеопороза как проблемы здравоохранения ассоциирована с частым применением глюкокортикоидов пациентами с различными хроническими заболеваниями и высоким уровнем остеопороза, обнаруженного у этих групп пациентов. Развитие глюкокортикоидиндуцированного остеопороза обусловлено ингибированием процесса образования кости, сопровождаемым ранним, но кратковременным увеличением резорбции кости. Среди многочисленных механизмов, лежащих в основе нарушения костного метаболизма при длительном приеме глюкокортикоидов, необходимо отметить увеличение соотношения RANKL/OPG, повышение экспрессии склеростина, активацию PPARγR2, а также гипогонадизм, нарушение всасывания кальция в кишечнике и снижение выработки инсулиноподобного фактора роста 1. Несмотря на доступные и эффективные профилактические меры, многие пациенты, начинающие или получающие глюкокортикоидную терапию, недостаточным образом оценены в плане состояния костной ткани и риска переломов. Установлены пороговые значения суточных доз глюкокортикоидов (≥ 2,5 мг/сутки) и длительность их приема (≥ 3 мес.), при которых пациенты должны быть обязательно подвергнуты оценке риска переломов и необходимости проведения лечения антиостеопоротическими препаратами. Национальные руководства по менеджменту глюкокортикоидиндуцированного остеопороза предлагают различные подходы к определению порога вмешательств, базируясь на использовании различных критериев. Алгоритм FRAX® рассчитывает 10-летнюю вероятность переломов по клиническим факторам риска с тестированием минеральной плотности кости или без него и калибруется для региональной частоты переломов и смертности. Несмотря на ограничения, этот инструмент является наиболее действенным в определении порога вмешательств. В рекомендациях ACR — 2017 указывается, что начальный абсолютный риск переломов следует оценивать с использованием алгоритма FRAX® с учетом доз глюкокортикоидов и тестирования минеральной плотности кости как можно быстрее (до 6 мес. от начала приема глюкокортикоидов).
Glucocorticoid-induced osteoporosis is the most common cause of secondary osteoporosis. The research demonstrates that oral administration of glucocorticoids often result in rapid bone loss and an increased risk of fractures during several months. The urgency of glucocorticoid-induced osteoporosis as a public health problem is caused by the frequent use of glucocorticoids by patients with various chronic diseases resulting in high level of osteoporosis. The glucocorticoid-induced osteoporosis develops due to the inhibition of bone formation, accompanied by an early but short-term bone resorption increase. An increase in the RANKL/OPG ratio, sclerostin expression growth, activation of PPARγR2, as well as hypogonadism, impaired absorption of calcium in the intestine, and a decrease of the insulin-like growth factor 1 production are among many mechanisms underlying the bone metabolism disorders caused by the long-term use of glucocorticoids. Despite available and effective preventive measures, the bone condition and risk of fractures for many patients who start or continue glucocorticoid therapy are not adequately assessed. The threshold values of daily doses of glucocorticoids (≥ 2.5 mg/day) and the duration of their administration (≥ 3 months) at which patients’ risk of fractures and the necessity of treatment with antiosteoporotic drugs should be assessed were identified. National guidelines for the management of glucocorticoid-induced osteoporosis offer different approaches to determination of the interventions threshold based on the use of various criteria. The 10-year probability of fractures based on the clinical risk factors, with or without bone mineral density assessment, is calculated and adjusted for regional fracture rate and mortality with the Fracture Risk Assessment Tool (FRAX). Despite limitations, this algorithm is the most effective in defining the interventions thresholds. The 2017 American College of Rheumatology guidelines indicate that the initial absolute risk of fractures should be assessed using the FRAX and taking into account the doses of glucocorticoids and bone mineral density test results no later than 6 months from the start of glucocorticoids therapy.
глюкокортикоїдіндукований остеопороз; глюкокортикоїди; добова доза; патогенез; поріг втручання; ризик переломів; FRAX®; лікування; огляд
глюкокортикоидиндуцированный остеопороз; глюкокортикоиды; суточная доза; патогенез; порог вмешательства; риск переломов; FRAX®; лечение; обзор
glucocorticoid-induced osteoporosis; glucocorticoids; daily dose; pathogenesis; intervention threshold; fracture risk; FRAX; treatment; review
Введение
Глюкокортикоиды (ГК) являются единственными лекарственными средствами, сочетающими яркие и быстрые противовоспалительные и иммуносупрессивные свойства и, таким образом, осуществляющими разностороннее влияние на иммунопатологические процессы при ревматических заболеваниях и многих других состояниях. ГК широко используют в лечении ревматических и других заболеваний. В сентябре 2018 года исполнилось 70 лет со дня первого успешного применения кортизона в клинической практике. Несмотря на более чем полувековой период после внедрения ГК в терапевтическую практику, они до сих пор занимают ведущее место в противовоспалительной терапии [1].
В последние годы расширилось понимание механизмов действия ГК. Они реализуют свое влияние через геномные и негеномные пути. Большинство терапевтических эффектов ГК проявляются через геномные механизмы путем связывания ГК с цитозольными рецепторами ГК (ГКР). После образования комплекс ГК/ГКР транслоцируется в ядро, где связывается со специфическими факторами транскрипции и приводит к индукции или ингибированию специфических генов, так называемых трансактивирующих и транс–репрессионных генов соответственно [2]. ГК/ГКР взаимодействует непосредственно с двумя факторами транскрипции: белком-активатором-1 (AP-1) и ядерным фактором kB, которые играют ведущую роль в регуляции нескольких воспалительных генов [3, 4]. Наиболее сильные терапевтические воздействия ГК индуцированы трансрепрессией; трансактивация, наоборот, может быть ответственна за некоторые из известных побочных эффектов ГК.
Негеномные эффекты ГК предопределены мембраносвязывающими рецепторами и/или инициированными физико-химическими взаимодействиями с клеточными мембранами и могут оказывать быстрые клинические эффекты, которые опосредуются тремя различными механизмами [5]. Во-первых, связывание ГК с цитозольным ГКР способствует высвобождению сигнальных молекул, которые вызывают быстрые ядерные ответы. Во-вторых, ГК оказывают влияние, опосредованное через недавно открытый мембрано–связывающий рецептор ГК. Связывание ГК с данным рецептором способно изменить пути трансдукции в течение нескольких минут, приводя к апоптозу клетки. В-третьих, при использовании очень высоких доз ГК (пульс-терапия) происходят физико-химические взаимодействия между ГК и клеточной мембраной, индуцируя неспецифические эффекты. Прямой контакт с мембраной клетки влияет на транспорт ионов, а прямой контакт с мембраной митохондрий вызывает утечку протонов [2].
Многочисленные наблюдения за пациентами, находящимися на терапии ГК, показывают, что их использование, особенно в больших дозах и/или в течение длительного периода, в большинстве случаев сопровождается существенным риском появления серьезных побочных эффектов, в частности вторичного глюкокортикоидиндуцированного остеопороза (ОП) и ассоциированных с ним патологических переломов [1, 6–9].
Глюкокортикоиды используются при лечении широкого спектра болезней, и, по экспертным оценкам, 1–2 % населения планеты получают длительную терапию ГК [10–12]. Неблагоприятные скелетные эффекты ГК были впервые описаны более 80 лет назад, и в настоящее время костные изменения, вызванные ГК, являются наиболее частой вторичной причиной остеопороза [8, 13].
Эпидемиологические данные касаются главным образом пероральной терапии ГК, проводимой непрерывно в течение 3–6 мес. и дольше. Так, в исследовании, проведенном в Исландии, продемонстрировано, что у 26 % пациентов, принимавших ГК-терапию > 6 мес., развивается остеопороз [14]. Главной отличительной чертой ГК-индуцированного остеопороза является ранняя и быстрая потеря костной массы после начала ГК-терапии [9]. Потеря минеральной плотности кости (МПК) коррелирует с кумулятивной дозой ГК, также установлена связь между суточной дозой ГК и риском переломов [15]. Риск переломов костей с возрастом увеличивается и у мужчин, и у женщин, однако он возрастает в большей степени при приеме (или анамнезе приема) ГК. Количественная оценка этого риска осложняется значительными различиями между пациентами, фоновыми заболеваниями, дозами и схемами применения ГК. В настоящее время утверждается, что нет абсолютно безопасной дозы ГК, тем не менее описывается определенная зависимость между риском переломов и дозой ГК. К примеру, относительный риск компрессионных переломов тел позвонков повышается в 1,5 раза при приеме ГК в суточной дозе менее 2,5 мг/сут, в 2,59 раза — при дозе от 2,5 до 7,5 мг/сут,
в 5,18 раза — при дозе 7,5 мг/сут и более [16]. Даже минимальная доза ГК — 2,5 мг/сутки — ассоциируется с повышением риска переломов. Было показано, что ежедневный прием преднизолона в дозе < 5 мг/сут
повышает риск переломов на 20 %, а доза 20 мг в день — на 60 % [9]. Проведенный метаанализ, который обобщил данные 42 000 пациентов из 7 когортных исследований, установил, что текущее и предшествующее применение ГК является независимым фактором риска вне связи с предшествующими переломами и текущей МПК [15]. Относительный риск (ОР) любого перелома при приеме ГК (по сравнению с лицами, никогда не получавшими ГК) варьировал от 1,98 в возрасте 50 лет до 1,66 в возрасте 85 лет. Для остеопоротических переломов позвонков ОР переломов колебался от 2,63 до 1,71, а для шейки бедренной кости — от 4,42 до 2,48 [15]. Еще один метаанализ продемонстрировал, что риск переломов стремительно возрастает в течение 3–6 мес. от начала пероральной терапии ГК независимо от основного заболевания, возраста и пола пациентов [9].
M.A. Amiche и соавт. (2016) провели байесовский метаанализ риска переломов при пероральном использовании ГК, опираясь на данные контрольных групп клинических испытаний [17]. У лиц, которым проводилось лечение ГК в последние 6 мес., годовая частота переломов позвонков составила 5,1 % (95% доверительный интервал (ДИ) 2,8–8,2) и внепозвоночных переломов — 2,5 % (95% ДИ 1,2–4,2). Для пациентов с продолжительностью применения ГК более 6 мес. соответствующие показатели составляли 3,2 % (95% ДИ 1,8–5,0) и 3,0 % (95% ДИ 0,8–5,0).
Используя большую административную базу данных, А. Balasubramanian и соавт. (2016) исследовали эффекты инициации системного (перорального или инъекционного) применения ГК на риск переломов у пациентов с ревматоидным артритом (средний возраст — 49 лет) [18]. Частота переломов колебалась от 5 до 9 на 1000 человек при дозе < 15 мг/сут, 16 (11–22,6) — при дозе ≥ 15 мг/сут и 13,4 (10,7–16,7) — при кумулятивной дозе ≥ 5400 мг (в перерасчете на преднизон). Через 60–182 дня после прекращения терапии ГК риск переломов был на 29 % ниже, чем у тех, кто продолжал ГК-терапию, а через 12 мес. он был таким же, как и у больных, которые не получали ГК.
Пациенты, принимающие ингаляционные ГК, также подвержены более высокому риску переломов позвонков, однако это влияние менее выражено, чем при системной ГК-терапии [19], а также хуже задокументировано. Существуют некоторые доказательства, что высокие дозы ингаляционных ГК ассоциируются с повышенным риском переломов [20–22]. Показатели ОР переломов позвонков, бедренной кости во время ингаляционного лечения ГК по сравнению с конт–ролем составили 1,15 (95% ДИ 1,10–1,20), 1,22 (95% ДИ 1,04–1,43) и 1,51 (95% ДИ 1,22–1,85) соответственно. Частота переломов позвонков среди лиц, принимавших будесонид (ОР 0,95; 95% ДИ 0,85–1,07) и флутиказона пропионат (ОР 1,03; 95% ДИ 0,71–1,49), была сходна с частотой, определенной для лиц, принимавших беклометазона дипропионат [21]. Интересно, что длительное использование топических форм ГК не приводило к повышению риска переломов [23]. Переломы костей скелета при приеме ГК могут иметь различную локализацию: позвонки, проксимальный отдел бедренной кости, кости предплечья, ребра, диафизы длинных трубчатых костей, однако наиболее высок риск остеопоротических переломов позвонков, которые чаще всего протекают бессимптомно и выявляются только при целенаправленном рентгенографическом поиске [8].
Более ранние исследования демонстрировали, что костный метаболизм не подвержен серьезным изменениям во время прерывистых курсов ГК-терапии, включая высокодозовую пульс-терапию. Указывалось только на транзиторное снижение маркеров костного формирования и их восстановление через 7–10 дней после завершения пульс-терапии, а также отмечалась гиперкальциурия [24–26]. В некоторых исследованиях также фиксировалось повышение уровня паратиреоидного гормона и 1,25-гидроксивитамина D после первого сеанса высокодозовой ГК-пульс-терапии, однако эти показатели довольно быстро возвращались к базовым уровням. На сегодняшний день считается, что риск переломов связан с интермиттирующим приемом ГК, с высокими дозами и высокой частотой повторных курсов терапии [27]. Пероральная ГК-терапия значимо повышает риск переломов позвонков, так же как и ингаляционная терапия, однако при постоянном приеме риск переломов значительно выше [28].
Отмена или прекращение приема ГК приводит к существенному снижению риска переломов, однако остается неясным, насколько уровень риска возвращается к исходным значениям [28–30]. В одном из исследований «случай — контроль» риск перелома не вернулся к первоначальному значению через 1 год после прекращения лечения ГК [31]. Еще ряд исследований указывает на неполное восстановление костной ткани после отмены ГК [16]. Эти данные поднимают вопрос о сроках прекращения антиостеопоротического лечения после отмены ГК. Примечательно, что алгоритм FRAX при оценке риска переломов включает в себя любое использование ГК в прошлом, даже если в настоящее время прием ГК приостановлен [32].
Различия в выраженности побочных эффектов ГК, включая скорость потери костной массы и скорость ее восстановления, хорошо известны, но малопонятны. Пререцепторная модуляция глюкокортикоидной активности 11-b-гидроксистероиддегидрогеназой (11-b-HSD) — ферментом, который преобразуют неактивные и активные кортизон/кортизол, может способствовать этой изменчивости через эффекты провоспалительных цитокинов [33, 34] и генетический полиморфизм глюкокортикоидных рецепторов [35].
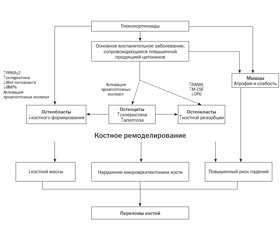
ГК-индуцированный остеопороз характеризуется снижением костеобразования с дополнительным ранним, но кратковременным увеличением резорбции кости (рис. 1). Снижение формирования новой кости является решающим процессом и центральным звеном ГК-индуцированного остеопороза, а также главной отличительной особенностью между ним и постменопаузальным остеопорозом, которому присуще увеличение скорости костного оборота [36].
Начальное увеличение скорости ремоделирования сопровождается уменьшением формирования костной ткани на уровне отдельной базовой многоклеточной единицы (BMU), и эта комбинация увеличенного костного оборота и отрицательного ремоделирующего баланса приводит к быстрой потере костной массы [37–39]. Вследствие снижения костеобразования как на уровне ткани, так и на уровне BMU формируется, а затем преобладает низкий уровень костного оборота. Прямое воздействие ГК на формирование кости опосредуется в основном через гамма-рецептор-2, активируемый пролифератором пероксисомы (PPAR-g-2) [40] и через влияние на сигнальный путь Wnt/b-катенин [41]. Первый механизм способствует преимущественной дифференцировке плюрипотентных клеток-предшественников в адипоциты, а не в остеобласты, что приводит к уменьшению количества последних. Повышенная экспрессия склеростина, который связывается с корецепторами Frizzled, Lrp4 и Lrp5, приводит к ингибированию сигнального пути Wnt, а далее — к снижению дифференцировки предшественников остеобластов в зрелые остеобласты и усилению апоптоза остеобластов и остеоцитов. Общеизвестно, что склеростин (SOST) является эндогенным ингибитором канонического Wnt/b-катенин-сигнального пути. При его наличии предшественники остеобластов не подвергаются воздействию Wnt-сигнала, в результате процесс дифференциации остеобластов приостанавливается [42]. Помимо ингибирования дифференцировки остео–бластов путем подавления сигнального пути Wnt/b-катенин, ГК нарушают функцию остеобластов и другими путями, например через снижение выработки костных морфогенетических белков (BMPs), что также приводит к ингибированию дифференцировки остеобластов [43].
ГК также оказывают непосредственное влияние на резорбцию кости, увеличивая выработку макрофагального колониестимулирующего фактора (M-CSF) и активатора рецептора нуклеарного фактора kВ (RANKL) и снижая производство остеопротегерина (OPG) остео–бластами и остеоцитами, что приводит к увеличению как числа, так и активности остеокластов [44]. Этот эффект уменьшается со временем, возможно, в результате сокращения числа остеобластов и остеоцитов.
В течение последних лет были проведены фундаментальные исследования, которые способствовали большему пониманию молекулярных механизмов, участвующих в патогенезе ГК-индуцированного остеопороза. Эти механизмы включают в себя повышенный апоптоз зрелых остеобластов и остеоцитов, нарушение дифференцировки остеобластов и увеличение продолжительности жизни остеокластов [1].
Помимо прямого воздействия на костные клетки, ГК оказывают косвенное влияние на мышцы, обмен кальция, минерализацию кости, индуцируя гипогонадизм, а также снижение выработки гормона роста, инсулиноподобного фактора роста 1 (IGF1) и IGF1-связывающого белка (IGF-BP) [45]. Было продемонстрировано неблагоприятное влияние использования ГК на мышечную массу и мышечную силу. Эта так называемая стероидная миопатия может косвенно увеличивать риск переломов за счет повышения риска падений. Кроме того, хорошо известно, что ГК нарушают метаболизм кости путем торможения кишечной абсорбции кальция и ингибирования его реабсорбции в почечных канальцах, приводя к гипокальциемии и вторичному гиперпаратиреозу [8]. Кроме того, было продемонстрировано, что ГК нарушают минерализацию костей путем транспрессии двух важных матричных белков — остеокальцина и коллагена I типа [46]. Необходимо отметить, что назначение ГК связано с воспалительными/аутоиммуными заболеваниями, патогенез которых сопряжен с продукцией провоспалительных, прорезорбтивных цитокинов, что способствует дополнительной потере костной массы. Контролируя воспаление, ГК способны смягчить негативное влияние воспаления на кость, однако рецидивы основного заболевания приводят к повышению костной резорбции и прогрессирующей потере костной массы.
Таким образом, применение ГК способствует быстрой потере костной массы и повышенному риску переломов костей. Ранние терапевтические вмешательства с остеопротекторной целью являются важным аспектом терапии пациентов, принимающих ГК.
Кого лечить?
Несмотря на то, что ГК являются известной и хорошо изученной причиной развития вторичного остео–пороза, большая часть пациентов, получающая ГК или начинающая их прием, остается недостаточно обследованной и оцененной в плане возможной потери костной массы и развития переломов [47]. При ГК-индуцированном остеопорозе используемые термины «профилактика» и «лечение» должны трактоваться по-разному: о профилактике можно говорить, если пациент, ранее не принимавший ГК, начинает эту терапию; лечение же предполагает ситуацию, когда пациент принимает ГК более 3 мес. Также, несмотря на некоторое улучшение профилактики ГК-индуцированного остеопороза, его менеджмент все-таки остается субоптимальным: только 1/4 пациентов, длительно принимающих ГК, получает противоостеопоротическое лечение и планово проходит контрольные денситометрические обследования [47]. В этом плане чрезвычайно важно выделить группы пациентов, имеющих наибольший риск развития переломов, и установить порог вмешательства, требующий назначения противоостеопоротического лечения и тщательного мониторинга.
Различные рекомендации по ведению пациентов с ГК-индуцированным остеопорозом, принятые в разных странах и регионах, базируются на эпидемиологических данных и представлены в табл. 1. Тем не менее различные интерпретации этих данных, а также локальные различия медико-экономических условий способствовали созданию рекомендаций с разным порогом вмешательств. Критерии для определения этих порогов эволюционировали параллельно с прогрессом в оценке риска переломов и созданием алгоритма FRAX®.
До внедрения алгоритма FRAX® порог вмешательств базировался на оценке применяемой дозы ГК и длительности лечения, а также на определении МПК. Что касается дозы ГК, то долгое время такой пороговой дозой считались 7,5 мг/сут в течение 3 мес. В 2000 году появились результаты широкомасштабного когортного исследования, которые продемонстрировали увеличение риска переломов костей на фоне использования дозы ГК < 5 мг/сут. Эти исследования прежде всего указали на отсутствие безопасных доз ГК и необходимость лечебно-профилактических мероприятий у всех пациентов, которым проводится или планируется проведение длительной пероральной ГК-терапии. После пересмотра рекомендаций Американской коллегии ревматологов (ACR) 2001 года была снижена пороговая суточная доза ГК до 5 мг [60]. В отношении Т-критерия предлагался диапазон от –1,0 до –1,5 SD. Многие национальные сообщества последовали рекомендациям ACR и также снизили пороговую дозу ГК. Согласно последним руководствам [61] развитие ГК-индуцированного остеопороза рассматривается в условиях применения ГК в дозе ≥ 2,5 мг/сут (в преднизоновом эквиваленте) в течение 3 мес. и более. Эти пациенты имеют высокий риск развития остеопороза. Одновременно выявление пациентов с повышенным риском переломов, базируясь только на показателях МПК, имеет ряд недостатков, прежде всего возможную неточность при измерении качества кости и зависимость от возраста [62].
Со временем показания к антиостеопоротическим вмешательствам при ГК-индуцированном остеопорозе сместились в сторону оценки абсолютного риска переломов. С этой целью предлагалось использовать инструмент FRAX®. Он рассчитывает 10-летнюю вероятность переломов по клиническим факторам риска с тестированием МПК или без него и калибруется для региональной частоты переломов и смертности. На основании алгоритма FRAX® все пациенты, получающие ГК в дозе ≥ 2,5 мг/сут (в преднизоновом эквиваленте) в течение 3 мес. и более, стратифицируются на группы в зависимости от риска переломов (табл. 2).
При расчете вероятности переломов учитывается прием ГК в дозе 2,5–7,5 мг/сут и выше в настоящее время или в прошлом. В этом состоит одно из ограничений FRAX®, поскольку использование пероральных ГК вводится в алгоритм как дихотомический фактор риска (да/нет) и при этом не учитывается ни суточная доза ГК, ни длительность приема (за исключением того, что длительность приема менее 3 мес. не учитывается вообще) [27, 63]. Для длительного применения ГК (от 3 мес.) FRAX® подсчитывает риск средней дозы (2,5–7,5 мг/сут) и средней продолжительности терапии ГК [15]. Однако следует учитывать, что дозы выше средней (≥ 7,5 мг/сут) ассоциируются с более высоким риском переломов и, наоборот, суточные дозы ниже < 2,5 мг — с меньшим риском [12, 16, 27]. По данным популяционных исследований, проведенных в Великобритании, определены поправочные коэффициенты, которые могут быть использованы при расчете 10-летней вероятности остеопоротических переломов в зависимости от суточной дозы ГК (табл. 3) [32]. При этом для суточной дозы ≥ 2,5–< 7,5 мг абсолютный риск переломов соответствует рассчитанному по алгоритму FRAX®.
Позже авторы FRAX® предприняли попытку количественно выразить эффект ГК на величину риска переломов [32]. Они пришли к выводу, что для пациентов, которые используют низкие дозы ГК (менее 2,5 мг/сут в преднизоновом эквиваленте), риск перелома проксимального отдела бедра должен быть уменьшен в среднем на 35 %, а основные остеопоротические переломы — на 20 % с колебаниями в зависимости от возраста. Для пациентов, принимающих ГК в дозе выше 7,5 мг в сутки, риск переломов при подсчете по FRAX® необходимо увеличить на 10–25 %, в зависимости от локализации перелома и возраста пациентов [27]. Поскольку сразу после завершения приема ГК риск переломов существенно снижается, при подсчете по FRAX® не рекомендуется учитывать короткие курсы ГК, проводимые ранее. В то же время часто повторяющиеся даже короткие курсы ГК, а также их ингаляционное применение могут оказать негативное влияние на МПК и увеличивать риск переломов, хотя при подсчете по FRAX® выразить эту зависимость количественно оказалось невозможным. Еще одним недостатком FRAX® является то, что этот инструмент не предназначен для расчета риска переломов у пациентов, которые уже получают активное противоостео–поротическое лечение. В инструменте FRAX® также отсутствует возможность расчета риска переломов позвонков — наиболее часто встречающихся переломов при ГК-индуцированном остеопорозе, что является еще одним важным недостатком данной модели [2]. Еще одним ограничением FRAX® является возраст. FRAX® рекомендовано применять только людям в возрасте 40 лет и более; у детей и молодых лиц оценка риска переломов должна проводиться с использованием измерения МПК вместе с учетом других факторов риска, в частности предыдущего перелома. Это ограничение может быть критичным для ревматологических пациентов, среди которых большая часть больных являются лицами молодого возраста.
В последнее десятилетие было предложено несколько алгоритмов для расчета абсолютного риска переломов для отдельного пациента, что основывается на Т-критерии измерения МПК позвоночника и бедренной кости и на ежедневной дозе ГК (в пересчете на эквивалент преднизона). Так был разработан Fracture in GIOP Score, который рассчитывает 5- и 10-летний риск развития остеопороза, переломов бедренной кости, позвонков и предплечья [64]. И хотя использование данной модели несколько сложнее, чем FRAX®, этот алгоритм имеет преимущество, поскольку учитывает основное заболевание, частоту госпитализаций по поводу основного заболевания, риск падений и дозу ГК — факторы, которые не учитываются в модели FRAX®. Подсчет риска проводился по балльной системе. Так, баллы 30, 40 и 50 соответствовали абсолютным 5-летним рискам переломов в 6,2, 15,3 и 35,2 % соответственно. У женщины в возрасте 65 лет с ревматоидным артритом, низким индексом массы тела, а также с переломами и падениями в анамнезе, которая ежедневно принимала 15 мг ГК (общий показатель риска — 54), риск переломов в течение 5 лет составляет 47 % (у мужчины с аналогичной историей — 30,1 %). Кратковременное применение высокодозовой терапии ГХ (≥ 30 мг) было связано лишь с небольшим повышенным риском развития остеопоротического перелома (ОР 1,21; 95% ДИ 1,04–1,42) у пациентов с ГК в анамнезе.
Результаты когортного исследования в рамках общенациональной программы скрининга остеопороза, которое проводилось на Тайване с 2008 по 2011 год, были опубликованы в 2017 году [65]. Целью исследования были разработка и внедрение порогового значения вмешательства на основе алгоритма FRAX® у пациентов, принимающих ГК. Порог индивидуального вмешательства (Individual intervention threshold — IIT) был установлен по индивидуально-специфической вероятности FRAX® крупного остеопоротического перелома по сравнению с субъектами с предшествующими переломами. Всего было зарегистрировано 8704 участника, включая принимающих ГК лиц (n = 807) и лиц группы контроля (n = 7897). Клинические риски переломов, включая предшествующий перелом бедренной кости, перелом бедра у родителей, ревматоидный артрит и вторичный остеопороз, были выше у больных, принимавших ГК, чем в контрольной группе. Пациенты, которые принимали ГК, имели более высокую 10-летнюю вероятность перелома бедренной кости, чем пациенты контрольной группы. Доля лиц, принимавших ГК, с 10-летней вероятностью крупного остеопоротического перелома выше IIT была более высокой, чем в конт–рольной группе (75,0 против 10,6 %; P < 0,001). При этом только 20,3 % принимавших ГК лиц и 30,5 % лиц группы контроля, у которых риск переломов был выше IIT, сообщили об использовании антиостеопоротической терапии. Исследователи делают заключение о том, что принимавшие ГК лица должны получать активное лечение на основе IIT независимо от МПК [65].
В исследовании особо акцентируется внимание на том, что пациенты, принимающие ГК, являются недостаточно оцененными в плане риска переломов и не проводят необходимое антиостеопоротическое лечение, несмотря на превышение индивидуального порога вмешательства. Этот факт был также отмечен в предыдущих исследованиях [66]. Потенциальные факторы низкого соблюдения руководящих принципов для ГК-индуцированного остеопороза включали молодой возраст, мужской пол, более низкую дозу ГК, назначение их специалистами по хирургии и отоларингологии, а также небольшие клинические учреждения [67].
На сегодняшний день оценка риска переломов с использованием модели FRAX® рекомендуется в нескольких руководствах по управлению ГК-индуцированным остеопорозом, в том числе Национальным руководством группы по остеопорозу (NOGG) [68], обновленными рекомендациями ACR [61] и руководствами, опубликованными Международным фондом остеопороза (IOF) и Европейским обществом кальцинированных тканей (ECTS) [56, 57].
Большинство рекомендаций по менеджменту ГК-индуцированного остеопороза касается женщин в постменопаузе и мужчин старше 50 лет, которым проводится или планируется длительная (3 мес. и более) терапия ГК. Лечение противоостеопоротическими препаратами следует назначать всем пациентам с низкоэнергетическими переломами в анамнезе. В этих случаях диагноз остеопороза устанавливается клинически, показатели Т-критерия (норма или более –1,5 SD) не влияют на установление диагноза и принятие решения о назначении лечения [63]. Также показанием для назначения противоостеопоротической терапии является возраст пациентов 70 лет и старше, поскольку большинство пациентов данной возрастной категории при приеме пероральных ГК имеют порог вмешательства по FRAX® в «красной зоне». В терапии также нуждаются пациенты в возрастном периоде 50–70 лет при приеме высоких доз ГК (≥ 7,5 мг/сут). В остальных случаях рекомендуется провести двухфотонную рентгеновскую абсорбциометрию; при показателях Т-критерия –1,5 SD и ниже устанавливается диагноз остеопороза и назначается противоостеопоротическое лечение. При отсутствии вышеперечисленных критериев назначения терапии, а также при недоступности двухфотонной рентгеновской абсорбциометрии проводится расчет 10-летней вероятности переломов по FRAX®. На рис. 2 представлены инициальная оценка риска переломов и стратификация по группам риска пациентов, которым планируется проведение длительной терапии ГК.
Необходимо отметить, что до сих пор стратификация рисков при применении ГК касалась только женщин и мужчин старше 50 лет; для пациентов моложе 40 лет и для детей не были разработаны подобные критерии. В Рекомендациях Американской коллегии ревматологов 2017 года по менеджменту ГК-индуцированного остеопороза [61] впервые предложили критерии для определения среднего и низкого риска развития остеопоротических переломов у взрослых пациентов моложе 40 лет. Это очень важно для ревматологических пациентов, поскольку дебют основных системных заболеваний соединительной ткани происходит именно в молодом возрасте, к 40-летнему возрасту такие пациенты подходят с длительным анамнезом приема ГК и, собственно, со значительными потерями МПК [1, 69]. Безусловным показанием к назначению противоостео–поротического лечения у женщин в пременопаузе и мужчин моложе 50 лет, которым проводится или планируется длительная (3 мес. и более) терапия ГК, является наличие низкоэнергетических переломов в анамнезе. У остальных пациентов решение о назначении терапии должно приниматься индивидуально, доказательной базы о необходимости назначения лечения в этих случаях в настоящее время нет.
В рекомендациях ACR 2017 четко указывается, что для взрослых в возрасте до 40 лет начальный абсолютный риск переломов следует оценивать с использованием FRAX® с учетом доз ГК и тестирования МПК как можно раньше (до 6 мес. от начала приема ГК). Для пациентов старше 40 лет определение МПК следует проводить также как можно скорее. Это касается прежде всего пациентов с анамнезом переломов или наличием других важных факторов остеопороза. Рекомендациями четко установлен срок проведения первичной оценки риска переломов — период до 6 мес. от начала ГК-терапии или как можно быстрее. Повторная оценка риска переломов должна проводиться всем пациентам каждые 12 мес. в условиях продолжающейся ГК-терапии. Для пациентов ≥ 40 лет, которые продолжают прием ГК и не получают противоостеопоротических препаратов, кроме кальция и витамина D, переоценка риска переломов с помощью FRAX® и определение МПК должны выполняться каждые 1–3 года. Пациентам, получающим очень высокие дозы ГК (≥ 30 мг/сут в преднизоновом эквиваленте или кумулятивную дозу ГК 5 г в предыдущем году) или имеющим в анамнезе остеопоротические переломы, повторную оценку необходимо проводить раньше указанного срока. Тестирование в данном диапазоне лет приемлемо только для пациентов, получающих более низкие дозы ГК без каких-либо других факторов остеопороза [1, 61].
Недостаточное лечение ГК-индуцированного остео–пороза в связи с высоким процентом недооцененных рисков возможных переломов является общепризнанным фактом [70, 71]. В популяционном исследовании взрослых пациентов в возрасте ≥ 20 лет определен разрыв в проведении тестирования МПК и назначении противоостеопоротического лечения пациентам, длительно принимающим ГК, в 90 дней и более [72]. В целом за первые 6 мес. после начала терапии ГК только 6 % пациентов было проведено денситометрическое исследование, 22 % получали противоостеопоротическую терапию и 25 % имели оба вмешательства. Недостаточное обследование и отсутствие лечения отмечались преимущественно у молодых пациентов, мужчин и пациентов, которых наблюдали семейные врачи (по сравнению с ревматологами). Подобные результаты с использованием информации из Национальной базы данных государственного медицинского страхования во Франции были недавно сообщены: только 8 % пациентов, длительно принимающих ГК, проходят тестирование для определения МПК, 18 % получают комбинированную терапию препаратами кальция и витамина D, 12 % — терапию бисфосфонатами [73]. При анализе канадской когорты пациентов в возрасте 66 лет и старше, которые начинали длительно принимать ГК, только 13 % получали остеопротекторную терапию [74]. Проблема недооцененности рисков развития остеопороза и переломов при длительной терапии ГК усугубляется недостаточной настойчивостью врачей при назначении терапии бисфосфонатами, недостаточным контролем и недостаточной приверженностью к лечению. В этом плане стратификация и определение группы пациентов, несомненно подлежащих терапии, имеют первостепенное значение.
Выводы
ГК-индуцированный остеопороз в настоящее время признается наиболее распространенной причиной вторичного остеопороза и ассоциируется с повышенным риском переломов. ГК-терапия вызывает повышенный апоптоз остеобластов и остеоцитов наряду с увеличением продолжительности жизни остеокластов, что приводит к снижению плотности кости и нарушению ее микроархитектоники. В последние годы также расшифрованы глубинные механизмы развития ГК-индуцированного остеопороза, в котором система RANKL/OPG и Wnt-сигнальный путь играют ведущую роль. Новые рекомендации по менеджменту ГК-индуцированного остеопороза и новые инструменты для оценки абсолютного риска переломов у отдельного пациента могут улучшить идентификацию пациентов с повышенным риском переломов, способствовать более качественному и своевременному лечению.
1. Головач І.Ю. Глюкокортикоїд-індукований остеопороз. К.: Медкнига, 2019. 240 с.
2. Bultink I.E., Baden M., Lems W.F. Glucocorticoid-induced osteoporosis: an update on current pharmacotherapy and future directions. Expert Opin. Pharmacother. 2013. 14(2). Р. 185-97. doi: 10.1517/14656566.2013.761975.
3. McKay L.I., Cidlowski J.A. Cross-talk between nuclear factor-kappa B and the steroid hormone receptors: mechanisms of mutual antagonism. Mol. Endocrinol. 1998. 12. Р. 45-56. doi: 10.1210/mend.12.1.0044.
4. Vayssaire B.M., Dupont S., Choquart A. et al. Synthe–tic glucocorticoids that dissociate transactivation and AP-1 transrepression exhibit antiiflammatory activity in vivo. Mol. Endocrinol. 1997. 11. Р. 1245-1255. doi: 10.1210/mend.11.9.9979.
5. Buttgereit F., Straub R.H., Wehling M. et al. Glucocorticoids in the treatment of rheumatic diseases: an update on the mechanisms of action. Arthritis Rheum. 2004. 50. Р. 3408-3417. doi: 10.1002/art.20583.
6. Башкова И.Б., Мадянов И.В. Принципы ведения пациентов с глюкокортикоидным остеопорозом. РМЖ. 2018. 12(II). С. 99-102.
7. Головач И.Ю. Глюкокортикоид-индуцированный остеопороз: исторические аспекты и современные подходы к профилактике и лечению. Фарматека. 2015. S. 4. С. 50-55.
8. Поворознюк В.В., Нейко Є.М., Головач І.Ю. Глюкокортикоїд-індукований остеопороз. К.: ТМК, 2000. С. 208.
9. Van Staa T.P., Leufkens H.G., Cooper C. The epidemiology of corticosteroid-induced osteoporosis: a meta-ana–lysis. Osteoporos. Int. 2002. 10. Р. 777-787. doi: 10.1007/s001980200108.
10. Fardet L., Petersen I., Nazareth I. Prevalence of long-term oral glucocorticoid prescriptions in the UK over the past 20 years. Rheumatology. 2011. 50(11). Р. 1982-1990. doi: 10.1093/rheumatology/ker017.
11. Overman R.A., Yeh J.Y., Deal C.L. Prevalence of oral glucocorticoid usage in the United States: a general population perspective. Arthritis Care Res. 2013. 65(2). Р. 294-298. doi: 10.1002/acr.21796.
12. van Staa T.P., Leufkens H.G., Abenhaim L. et al. Use of oral corticosteroids in the United Kingdom. Q. Med. J. 2000. 93. Р. 105-111. doi: 10.1093/qjmed/93.2.105
13. Compston J. Glucocorticoid-induced osteoporosis: an update. Endocrine. 2018. 61. Р. 7-16. doi: 10.1007/s12020-018-1588-2.
14. Gudbjornsson B., Juliusson U.I., Gudjonsson F.V. Prevalence of long term steroid treatment and the frequency of decision making to prevent steroid induced osteoporosis in daily clinical practice. Ann. Rheum. Dis. 2002. 61(1). Р. 32-36. doi: 10.1136/ard.61.1.32.
15. Kanis J.A., Johansson H., Oden A. et al. A meta-analysis of prior corticosteroid use and fracture risk. J. Bone Miner. Res. 2004. 19(6). Р. 893-899. doi: 10.1359/JBMR.040134.
16. Van Staa T.P., Leufkens H.G., Abenhaim L. et al. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses. Rheumatology (Oxford). 2000. 39(12). P. 1383-1389. doi: 10.1093/rheumatology/39.12.1383.
17. Amiche M.A., Albaum J.M., Tadrous M. et al. Fracture risk in oral glucocorticoid users: a Bayesian meta-regression leveraging control arms of osteoporosis clinical trials. Osteoporos. Int. 2016. 27(5). Р. 1709-1718. doi: 10.1007/s00198-015-3455-9.
18. Balasubramanian A., Wade S.W., Adler R.A. et al. Glucocorticoid exposure and fracture risk in patients with new-onset rheumatoid arthritis. Osteoporos. Int. 2016. 27(11). Р. 3239-3249. doi: 10.1007/s00198-016-3646-z.
19. Etminan M., Sadatsafavi M., Ganjizadeh Zavareh S. et al. Inhaled corticosteroids and the risk of fractures in ol–der adults: a systematic review and meta-analysis. Drug. Saf. 2008. 31(5). Р. 409-414. doi: 10.2165/00002018-200831050-00005.
20. Toogood J.H., Baskerville J.C., Markov A.E. et al. Bone mineral density and the risk of fractures in patients receiving long-term inhaled steroid therapy for asthma. J. Allergy Clin. Immunol. 1995. 96. Р. 157-166.
21. Van Staa T.P., Leufkens H.G., Cooper C. Use of inhaled corticosteroids and risk of fractures. J. Bone Miner. Res. 2001. 16. Р. 581-588. doi: 10.1359/jbmr.2001.16.3.581.
22. Wong C.A., Walsh L.J., Smith C.J. et al. Inhaled corticosteroid use and bone mineral density in patients with asthma. Lancet. 2000. 355. Р. 1399-1403. doi: 10.1016/S0140-6736(00)02138-3.
23. Vestergaard P., Rejnmark L., Mosekilde L. Fracture risk associated with systemic and topical corticosteroids. J. Intern. Med. 2005. 257(4). Р. 374-384. doi: 10.1111/j.1365-2796.2005.01467.x.
24. Bijlsma J.W., Duursma S.A., Bosch R. et al. Acute changes in calcium and bone metabolism during methylprednisolone pulse therapy in rheumatoid arthritis. Br. J. Rheumatol. 1988. 27(3). Р. 215-219.
25. Lems W.F., Gerrits M.I., Jacobs J.W. et al. Changes in (markers of) bone metabolism during high dose corticosteroid pulse treatment in patients with rheumatoid arthritis. Ann. Rheum. Dis. 1996. 55(5). Р. 288-293.
26. van der Veen M.J., Bijlsma J.W. Effects of different regimes of corticosteroid treatment on calcium and bone metabolism in rheumatoid arthritis. Clin. Rheumatol. 1992. 11(3). Р. 388-392.
27. Leib E.S., Saag K.G., Adachi J.D. et al. Official Positions for FRAX® clinical regarding glucocorticoids: the impact of the use of glucocorticoids on the estimate by FRAX® of the 10 year risk of fracture from Joint Official Positions Development Conference of the International Society for Clinical Densitometry and International Osteoporosis Foundation on FRAX®. J. Clin. Densitom. 2011. 14(3). Р. 212-9. doi: 10.1016/j.jocd.2011.05.014.
28. De Vries F., Bracke M., Leufkens H.G. et al. Fracture risk with intermittent high-dose oral glucocorticoid therapy. Arthritis Rheum. 2007. 56(1). Р. 208-14. doi: 10.1002/art.22294.
29. Compston J. Management of glucocorticoid-induced osteoporosis. Nat. Rev. Rheumatol. 2010. 6(2). Р. 82-88. doi: 10.1038/nrrheum.2009.259.
30. Kanis J.A., Stevenson M., McCloskey E.V. et al. Glucocorticoid-induced osteoporosis: a systematic review and cost-utility analysis. Health Technol. Assess. 2007. 11(7). III–IV, IX–XI. Р. 1-231.
31. Vestergaard P., Rejnmark L., Mosekilde L. Fracture risk associated with different types of oral corticosteroids and effect of termination of corticosteroids on the risk of fractures. Calcif. Tissue Int. 2008. 82(4). Р. 249-257. doi: 10.1007/s00223-008-9124-7.
32. Kanis J.A., Johansson H., Oden A., McCloskey E.V. Guidance for the adjustment of FRAX according to the dose of glucocorticoids. Osteoporos. Int. 2011. 22(3). Р. 809-16. doi: 10.1007/s00198-010-1524-7.
33. Cooper M.S., Bujalska I., Rabbitt E. et al. Modulation of 11-beta hydroxysteroid dehydrogenase enzymes by proinflammatory cytokines in osteoblasts: an autocrine switch from glucocorticoid inactivation to activation. J. Bone Miner. Res. 2001. 16. Р. 1037-1044. doi: 10.1359/jbmr.2001.16.6.1037.
34. Cooper M.S., Blumsohn A., Goddard P.E. et al. 11 betahydroxysteroid dehydrogenase type 1 activity predicts the effects of glucocorticoids on bone. J. Clin. Endocrinol. Metab. 2003. 83. Р. 3874-3877.
35. Головач І.Ю. Проблеми резистентності до глюкокортикоїдів: механізми розвитку та важливість для клінічної практики. Рацiональна фармакотерапія. 2012. 1(22). С. 29-32.
36. Rizzoli R., Biver E. Glucocorticoid-induced osteoporosis: who to treat with what agent? Nat. Rev. Rheumatol. 2015. 11(2). Р. 98-109. doi: 10.1038/nrrheum.2014.188.
37. Bressot C., Meunier P.J., Chapuy M.C. et al. Histomorphometric profile, pathophysiology and reversibility of corticosteroid-induced osteoporosis. Metab. Bone Dis. Rel. Res. 1979. 1. Р. 303-311.
38. Dalle Carbonare L., Arlot M.E., Chavassieux P.M. et al. Comparison of trabecular bone architecture and remodeling in glucocorticoid-induced and postmenopausal osteoporosis. J. Bone Miner. Res. 2001. 16. Р. 97-103. doi: 10.1359/jbmr.2001.16.1.97.
39. Dempster D.W. Bone histomorphometry in glucocorticoidinduced osteoporosis. J. Bone Miner. Res. 1989. 4. Р. 137-147. doi: 10.1002/jbmr.5650040202.
40. Wu Z., Bucher N.L.R., Farmer S.R. Induction of peroxisome proliferator-activated receptor g during the conversion of 3T3 fibroblasts into adipocytes is mediated by C/EBPh, C/EBPy, and glucocorticoids. Mol. Cell. Biol. 1996. 16. Р. 4128-4136. doi: 10.1128/mcb.16.8.4128.
41. Ohnaka K., Tanabe M., Kawate H. et al. Glucocorticoid suppresses the canonical Wnt signal in cultured human osteoblasts. Biochem. Biophys. Res. Commun. 2005. 329. Р. 177-181. doi: 10.1016/j.bbrc.2005.01.117.
42. Delgado-Calle J., Sato A.Y., Bellido T. Role and mechanism of action of sclerostin in bone. Bone. 2017. 96. Р. 29-37. doi: 10.1016/j.bone.2016.10.007.
43. Pereira R.C., Delany A.M., Canalis E. Effects of cortisol and bone morphogenetic protein-2 on stromal cell differentiation: correlation with CCAAT-enhancer binding protein expression. Bone. 2002. 30. Р. 685-691.
44. Swanson C., Lorentzon M., Conaway H.H., Lerner U.H. Glucocorticoid regulation of osteoclast diffe–rentiation and expression of receptor activator of nuclear factor-kappaB (NF-kappaB) ligand, osteoprotegerin, and receptor activator of NF-kappaB in mouse calvarial bones. Endocrinology. 2006. 147(7). Р. 3613-3622. doi: 10.1210/en.2005-0717.
45. Mazziotti G., Formenti A.M., Adler R.A. et al. Glucocorticoidinduced osteoporosis: pathophysiological role of GH/IGF-I and PTH/VITAMIN D axes, treatment options and guidelines. Endocrine. 2016. 54(3). Р. 603-611. doi: 10.1007/s12020-016-1146-8.
46. Canalis E., Mazziotti G., Giustina A. et al. Glucocorticoid-induced osteoporosis: pathophysiology and the–rapy. Osteoporos. Int. 2007. 18. Р. 1319-1328. doi: 10.1007/s00198-007-0394-0.
47. Majumdar S.R., Lix L.M., Yogendran M. et al. Po–pulation-based trends in osteoporosis management after new initiations of long-term systemic glucocorticoids (1998–2008). J. Clin. Endocrinol. Metab. 2012. 97(4). Р. 1236-1242. doi: 10.1210/jc.2011-2645.
48. Bone and Tooth Society of Great Britain, National Osteoporosis Society, Royal College of Physicians. Glucocorticoid-induced osteoporosis: guidelines for prevention and treatment. London: RCP, 2002.
49. Geusens P.P., de Nijs R.N., Lems W.F. et al. Prevention of glucocorticoid osteoporosis: a consensusdocument of the Dutch Society for Rheumatology. Ann. Rheum. Dis. 2004. 63(3). Р. 324-325. doi: 10.1136/ard.2003.008060.
50. Nawata H., Soen S., Takayanagi R. et al. Guidelines on the management and treatment of glucocorticoid-induced osteoporosis of the Japanese Society for Bone and Mineral Research (2004). J. Bone Miner. Metab. 2005. 23(2). Р. 105-109. doi: 10.1007/s00774-004-0596-x.
51. Devogelaer J.P., Goemaere S., Boonen S. et al. Evidence-based guidelines for the prevention and treatment of glucocorticoid-induced osteoporosis: a consensus document of the Belgian Bone Club. Osteoporos. Int. 2006. 17(1). Р. 8-19. doi: 10.1007/s00198-005-2032-z.
52. Dachverband osteologie. DVO guidelines 2009 for prevention, diagnosis and therapy of osteoporosis in adults. Osteologie. 2011. 20. Р. 55-74.
53. Grossman J.M., Gordon R., Ranganath V.K. et al. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res. 2010. 62. Р. 1515-1526. doi: 10.1002/acr.20295.
54. Papaioannou A., Morin S., Cheung A.M. et al. 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary. CMAJ. 2010. 182(17). Р. 1864-1873. doi: 10.1503/cmaj.100771.
55. Pereira R.M., Carvalho J.F., Paula A.P. et al. Guidelines for the prevention and treatment of glucocorticoid-induced osteoporosis. Rev. Bras. Reumatol. 2012. 52(4) Р. 580-593.
56. Lekamwasam S., Adachi J.D., Agnusdei D. et al. An appendix to the 2012 IOF-ECTS guidelines for the management of glucocorticoid-induced osteoporosis. Arch. Osteoporos. 2012. 7. Р. 25-30. doi: 10.1007/s11657-012-0070-7.
57. Lekamwasam S., Adachi J.D., Agnusdei D. et al. A framework for the development of guidelines for the ma–nagement of glucocorticoid-induced osteoporosis. Osteoporos. Int. 2012. 23(9). Р. 2257-2276. doi: 10.1007/s00198-012-1958-1.
58. Briot K., Cortet B., Roux C. et al. 2014update of re–commendations on the prevention and treatment of glucocorticoid-induced osteoporosis. Joint Bone Spine. 2014. 81. Р. 493-501. doi: 10.1016/j.jbspin.2014.10.001.
59. National Osteoporosis Foundation. Clinician’s guide to prevention and treatment of osteoporosis. National Osteoporosis Foundation, Washington DC, 2014.
60. Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis: 2001 update. Ameri–can College of Rheumatology Ad Hoc Committee on Glucocorticoid-Induced Osteoporosis. Arthritis Rheum. 2001. 44. Р. 1496-1503. doi: 10.1002/1529-0131(200107)
44:7<1496:AID-ART271>3.0.CO;2-5.
61. Buckley L., Guyatt G., Fink H.A. et al. 2017 American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. Arthritis Rheum. 2017. 69(8). Р. 1521-1537. doi: 10.1002/art.40137.
62. den Uyl D., Bultink I.E.M., Lems W.F. Advances in glucocorticoid-induced osteoporosis. Curr. Rheumatol. Rep. 2011. 13. Р. 233-240. doi: 10.1007/s11926-011-0173-y.
63. Лесняк О.М., Баранова И.А., Торопцова Н.В. Диагностика, профилактика и лечение глюкокортикоидного остеопороза у мужчин и женщин 18 лет и старше. Клинические рекомендации. Ярославль: ИПК «Литера», 2013. 48 с.
64. van Staa T.P., Geuzens P., Pols H.A. et al. A simple score for estimating the long-term risk of fracture in patients using oral glucocorticoids. QJM. 2005. 98. Р. 191-198. doi: 10.1093/qjmed/hci029.
65. Yu S.F., Chen J.F., Chen Y.C. et al. Beyond bone mi–neral density, FRAX-based tailor-made intervention thre–sholds for therapeutic decision in subjects on glucocorticoid: A nationwide osteoporosis survey. Medicine (Baltimore). 2017. 96(5). e5959. doi: 10.1097/MD.0000000000005959.
66. Overman R.A., Toliver J.C., Yeh J.Y. et al. United States adults meeting 2010 American College of Rheumatology criteria for treatment and prevention of glucocorticoid-induced osteoporosis. Arthritis Care Res. (Hoboken). 2014. 66. Р. 1644-1652. doi: 10.1002/acr.22346.
67. Kirigaya D., Nakayama T., Ishizaki T. et al. Ma–nagement and treatment of osteoporosis in patients recei–ving long-term glucocorticoid treatment: current status of adherence to clinical guidelines and related factors. Intern. Med. 2011. 50. Р. 2793-2800. doi: 10.2169/internalmedicine.50.5266.
68. Compston J., Cooper A., Cooper C. National Osteoporosis Guideline Group (NOGG), UK clinical guideline for the prevention and treatment of osteoporosis. Arch. Osteoporos. 2017. 12(1). Р. 43. doi: 10.1007/s11657-017-0324-5.
69. Головач І.Ю. Менеджмент глюкокортикоїд-індукованого остеопорозу у світлі останніх рекомендацій Американського коледжу ревматологів (ACR’2017). Практикуючий лікар. 2017. 3(23). С. 5-14.
70. Curtis J.R., Westfall A.O., Allison J.J. et al. Longitudinal patterns in the prevention of osteoporosis in glucocorticoid-treated patients. Arthritis Rheum. 2005. 52. Р. 2485-2494. DOI: 10.1002/art.21194.
71. Feldstein A.C., Elmer P.J., Nichols G.A., Herson M. Practice patterns in patients at risk for glucocorticoid-induced osteoporosis. Osteoporos. Int. 2005. 16. Р. 2168-2174. doi: 10.1007/s00198-005-2016-z.
72. Majumdar S.R., Lix L.M., Morin S.N. et al. The disconnect between better quality of glucocorticoid-induced osteoporosis preventive care and better outcomes: a population-based cohort study. J. Rheumatol. 2013. 40(10). Р. 1736-1741. doi: 10.3899/jrheum.130041.
73. Trijau S., de Lamotte G., Pradel V. et al. Osteoporosis prevention among chronic glucocorticoid users: results from a public health insurance database. RMD Open. 2016. 2(2). e000249. doi: 10.1136/rmdopen-2016-000249.
74. Amiche M.A., Lévesque L.E., Gomes T. et al. Effectiveness of oral bisphosphonates in reducing fracture risk among oral glucocorticoid users: three matched cohort analyses. J. Bone Miner. Res. 2017. 33. Р. 419-429. doi.org/10.1002/jbmr.3318.

/242-2.jpg)
/241-1.jpg)
/242-1.jpg)
/243-1.jpg)
/244-1.jpg)
/243-2.jpg)
/244-2.jpg)