Журнал «Здоровье ребенка» Том 15, №1, 2020
Вернуться к номеру
Медикаментозное управление диспергированием биопленки за счет регуляции активности бактериального циклического дигуанозинмонофосфата (часть 1)
Авторы: Абатуров А.Е.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Інфекційний процес, викликаний патогенними бактеріями, може супроводжуватися формуванням біоплівки, що зумовлює збереження бактерій і зниження ефективності дії антибактеріальних засобів. Розробка препаратів, які сприяють диспергуванню бактеріальної біоплівки, є одним із найважливіших терапевтичних напрямків, що сприяють вирішенню проблеми лікування бактеріальних інфекцій, викликаних мікроорганізмами, резистентними до дії антибактеріальних засобів. Однією з цільових бактеріальних молекул, що бере участь у формуванні біоплівок та може бути піддана медикаментозній регуляції, є вторинна месенджерна нуклеозидна молекула — циклічний дігуанозинмонофосфат (ц-ді-ГМФ). Медикаментозне пригнічення рівня внутрішньобактеріальної концентрації месенджерної молекули ц-ді-ГМФ або блокування її активності дозволяє запобігти формуванню та викликати руйнування бактеріальної біоплівки, що супроводжується збільшенням ефективності лікування бактеріальних інфекцій. Зниження внутрішньобактеріальної концентрації ц-ді-ГМФ може бути досягнуто шляхом інгібування процесів синтезу за рахунок: 1) пригнічення активності DGC; 2) обмеження доступності субстратів, необхідних для синтезу ц-ді-ГМФ; 3) посилення деградації молекули ц-ді-ГМФ за рахунок активації PDE. Терапія інфекційних захворювань, які супроводжуються формуванням біоплівок, вимагає медикаментозної індукції диспергування бактерій із біоплівок і застосування цілеспрямованих антибіотичних лікарських засобів, що викликають загибель вивільнених із біоплівок бактерій. Використання аналогів ц-ді-ГМФ, що порушують функціонування нативного ц-ді-ГМФ, і блокування таргетних рецепторів та інших молекулярних структур також може призводити до диспергування бактеріальної біоплівки. Лікарські засоби, що модулюють активність ц-ді-ГМФ, дозволять підвищити ефективність лікування бактеріальних інфекцій, які супроводжуються формуванням біоплівок.
Инфекционный процесс, вызванный патогенными бактериями, может сопровождаться формированием биопленки, что предопределяет сохранность бактерий и снижение эффективности действия антибактериальных средств. Разработка препаратов, которые способствуют диспергированию бактериальной биопленки, является одним из важнейших терапевтических направлений, способствующих решению проблемы лечения бактериальных инфекций, вызванных микроорганизмами, резистентными к действию антибактериальных средств. Одной из целевых, участвующих в формировании биопленок бактериальных молекул, которая может быть подвергнута медикаментозной регуляции, является вторичная мессенджерная нуклеозидная молекула — циклический дигуанозинмонофосфат (ц-ди-ГМФ). Медикаментозное подавление уровня внутрибактериальной концентрации мессенджерной молекулы ц-ди-ГМФ или блокирование ее активности позволяет предотвратить формирование и вызвать разрушение бактериальной биопленки, что сопровождается увеличением эффективности лечения бактериальных инфекций. Снижение внутрибактериальной концентрации ц-ди-ГМФ может быть достигнуто ингибированием процессов синтеза за счет: 1) подавления активности DGC; 2) ограничения доступности субстратов, необходимых для синтеза ц-ди-ГМФ; 3) усиления деградации молекулы ц-ди-ГМФ за счет активации PDE. Терапия инфекционных заболеваний, которые сопровождаются формированием биопленок, требует медикаментозной индукции диспергирования бактерий из биопленок и применения целенаправленных антибиотических лекарственных средств, вызывающих гибель высвобожденных из биопленок бактерий. Использование аналогов ц-ди-ГМФ, нарушающих функционирование нативного ц-ди-ГМФ, и блокирование таргетных рецепторов и других молекулярных структур также может приводить к диспергированию бактериальной биопленки. Лекарственные средства, модулирующие активность ц-ди-ГМФ, позволят повысить эффективность лечения бактериальных инфекций, которые сопровождаются формированием биопленок.
The infectious process caused by pathogenic bacteria can be accompanied by the formation of a biofilm, which determines the safety of bacteria and a decrease in the effectiveness of antibacterial agents. The development of drugs that contribute to the dispersion of bacterial biofilms is one of the most important therapeutic areas, which help solve the problem of treating bacterial infections caused by microorganisms that are resistant to antibacterial agents. One of the target bacterial molecules involved in biofilm formation, which can be subjected to drug regulation, is a nucleotide secondary messenger molecule — cyclic dinucleotide guanosine monophosphate (c-di-GMP). Drug suppression of the level of intra-bacterial concentration of the messenger molecule of c-di-GMP or blocking its activity helps prevent the formation of bacterial biofilm and leads to its destruction, which is accompanied by an increase in the level of effectiveness of treatment of bacterial infections. A decrease in the level of intra-bacterial concentration of c-di-GMP can be achieved by inhibiting the synthesis processes due to: 1) suppression of diguanylate cyclase activity; 2) restriction on the availability of substrates required for the synthesis of c-di-GMP; 3) increased degradation of c-di-GMP molecule due to activation of phosphodiesterase activity. The treatment of infectious diseases, which are accompanied by the formation of biofilms, requires the medical induction of the dispersion of bacteria from biofilms and the use of targeted antibiotic drugs that cause the death of bacteria released from biofilms. The use of c-di-GMP analogues, which disrupt the functioning of native c-di-GMP, and the blocking of targeted receptors and other molecular structures can also lead to the dispersion of bacterial biofilm. Medicines that modulate the activity of c-di-GMP will increase the effectiveness of the antibacterial treatment of bacterial infections, which are accompanied by the formation of biofilms.
бактеріальні біоплівки; диспергування; ц-ді-ГМФ; антибіоплівкова терапія; огляд
бактериальные биопленки; диспергирование; ц-ди-ГМФ; антибиопленочная терапия; обзор
bacterial biofilms; dispersion; c-di-GMP; antibiofilm therapy; review
Введение
1. Циклический дигуанозинмонофосфат — фактор, определяющий форму жизнедеятельности бактерий
1. Абатуров А.Е., Крючко Т.А. Диспергирование бактериальной биопленки и хронизация инфекционного процесса респираторного тракта. Здоровье ребенка. 2019. № 5(14). С. 94-98. doi: 10.22141/2224-0551.14.5.2019.177411.
2. Абатуров А.Е., Крючко Т.А. Медикаментозное влияние на диспергирование биопленки. Доноры оксида азота. Здоровье ребенка. 2019. № 7(14). С. 79-86. doi: 10.22141/2224-0551.14.7.2019.184626.
3. Абатуров А.Е., Юлиш Е.И. Роль интерферонов в защите респираторного тракта. 1. Каскад возбуждения системы интерферонов. Здоровье ребенка. 2007. № 5. С. 136-144.
4. AbdelKhalek A., Abutaleb N.S., Mohammad H., Seleem M.N. Repurposing ebselen for decolonization of vancomycin-resistant enterococci (VRE). PLoS One. 2018 Jun 28. 13(6). e0199710. doi: 10.1371/journal.pone.0199710.
5. Ahonen M.J.R., Dorrier J.M., Schoenfisch M.H. Antibiofilm Efficacy of Nitric Oxide-Releasing Alginates against Cystic Fibrosis Bacterial Pathogens. ACS Infect Dis. 2019 Aug 9. 5(8). 1327-1335. doi: 10.1021/acsinfecdis.9b00016.
6. Ahonen M.J.R., Suchyta D.J., Zhu H., Schoenfisch M.H. Nitric Oxide-Releasing Alginates. Biomacromolecules. 2018 Apr 9. 19(4). 1189-1197. doi: 10.1021/acs.biomac.8b00063.
7. Allan R.N., Kelso M.J., Rineh A. et al. Cephalosporin-NO-donor prodrug PYRRO-C3D shows β-lactam-mediated activity against Streptococcus pneumoniae biofilms. Nitric. Oxide. 2017 May 1. 65. 43-49. doi: 10.1016/j.niox.2017.02.006.
8. Almblad H., Harrison J.J., Rybtke M. et al. The Cyclic AMP-Vfr Signaling Pathway in Pseudomonas aeruginosa Is Inhibited by Cyclic Di-GMP. J. Bacteriol. 2015 Jul. 197(13). 2190-200. doi: 10.1128/JB.00193-15.
9. Antoniani D., Bocci P., Maciag A., Raffaelli N., Landini P. Monitoring of diguanylate cyclase activity and of cyclic-di-GMP biosynthesis by whole-cell assays suitable for high-throughput screening of biofilm inhibitors. Appl. Microbiol. Biotechnol. 2010 Jan. 85(4). 1095-104. doi: 10.1007/s00253-009-2199-x.
10. Antoniani D., Rossi E., Rinaldo S. et al. The immunosuppressive drug azathioprine inhibits biosynthesis of the bacterial signal molecule cyclic-di-GMP by interfering with intracellular nucleotide pool availability. Appl. Microbiol. Biotechnol. 2013 Aug. 97(16). 7325-36. doi: 10.1007/s00253-013-4875-0.
11. Barraud N., Kardak B.G., Yepuri N.R. et al. Cephalosporin-3'-diazeniumdiolates: targeted NO-donor prodrugs for dispersing bacterial biofilms. Angew Chem. Int. Ed. Engl. 2012 Sep 3. 51(36). 9057-60. doi: 10.1002/anie.201202414.
12. Chou S.H., Galperin M.Y. Diversity of Cyclic Di-GMP-Binding Proteins and Mechanisms. J. Bacteriol. 2016 Jan 1. 198(1). 32-46. PMID: 26055114.
13. Collins S.A., Kelso M.J., Rineh A. et al. Cephalosporin-3'- Diazeniumdiolate NO Donor Prodrug PYRRO-C3D Enhances Azithromycin Susceptibility of Nontypeable Haemophilus influenzae Biofilms. Antimicrob. Agents Chemother. 2017 Jan 24. 61(2). pii: e02086-16. doi: 10.1128/AAC.02086-16.
14. Cutruzzolà F., Frankenberg-Dinkel N. Origin and Impact of Nitric Oxide in Pseudomonas aeruginosa Biofilms. J. Bacteriol. 2016 Jan 1. 198(1). 55-65.
15. De la Fuente-Núñez C., Reffuveille F., Fairfull-Smith K.E., Hancock R.E. Effect of nitroxides on swarming motility and biofilm formation, multicellular behaviors in Pseudomonas aeruginosa. Antimicrob. Agents Chemother. 2013 Oct. 57(10). 4877-81. doi: 10.1128/AAC.01381-13.
16. Düvel J., Bense S., Möller S. et al. Application of Synthetic Peptide Arrays To Uncover Cyclic Di-GMP Binding Motifs. J. Bacteriol. 2015 Aug 31. 198(1). 138-46. doi: 10.1128/JB.00377-15.
17. Fernicola S., Paiardini A., Giardina G. et al. In Silico Discovery and In Vitro Validation of Catechol-Containing Sulfonohydrazide Compounds as Potent Inhibitors of the Diguanylate Cyclase PleD. J. Bacteriol. 2015 Sep 28. 198(1). 147-56. doi: 10.1128/JB.00742-15.
18. Fernicola S., Torquati I., Paiardini A. et al. Synthesis of Triazole-Linked Analogues of c-di-GMP and Their Interactions with Diguanylate Cyclase. J. Med. Chem. 2015 Oct 22. 58(20). 8269-84. doi: 10.1021/acs.jmedchem.5b01184.
19. Hasan N., Cao J., Lee J. et al. PEI/NONOates-doped PLGA nanoparticles for eradicating methicillin-resistant Staphylococcus aureus biofilm in diabetic wounds via binding to the biofilm matrix. Mater. Sci Eng. C Mater. Biol. Appl. 2019 Oct. 103. 109741. doi: 10.1016/j.msec.2019.109741.
20. Hengge R. Trigger phosphodiesterases as a novel class of c-di-GMP effector proteins. Philos. Trans. R Soc. Lond. B Biol. Sci. 2016 Nov 5. 371(1707). pii: 20150498. doi: 10.1098/rstb.2015.0498.
21. Jenal U., Reinders A., Lori C. Cyclic di-GMP: second messenger extraordinaire. Nat. Rev. Microbiol. 2017 May. 15(5). 271-284. doi: 10.1038/nrmicro.2016.190.
22. Kalia D., Merey G., Nakayama S. et al. Nucleotide, c-di-GMP, c-di-AMP, cGMP, cAMP, (p)ppGpp signaling in bacteria and implications in pathogenesis. Chem. Soc. Rev. 2013 Jan 7. 42(1). 305-41. doi: 10.1039/c2cs35206k.
23. Kang D., Kirienko N.V. High-Throughput Genetic Screen Reveals that Early Attachment and Biofilm Formation Are Necessary for Full Pyoverdine Production by Pseudomonas aeruginosa. Front. Microbiol. 2017 Sep 5. 8. 1707. doi: 10.3389/fmicb.2017.01707.
24. Kang D., Turner K.E., Kirienko N.V. PqsA Promotes Pyoverdine Production via Biofilm Formation. Pathogens. 2017 Dec 25. 7(1). pii: E3. doi: 10.3390/pathogens7010003.
25. Karaolis D.K., Means T.K., Yang D. et al. Bacterial c-di-GMP is an immunostimulatory molecule. J. Immunol. 2007 Feb 15. 178(4). 2171-81. PMID: 17277122.
26. Koo H., Allan R.N., Howlin R.P., Stoodley P., Hall-Stoodley L. Targeting microbial biofilms: current and prospective therapeutic strategies. Nat. Rev. Microbiol. 2017 Dec. 15(12). 740-755. doi: 10.1038/nrmicro.2017.99.
27. Lieberman O.J., Orr M.W., Wang Y., Lee V.T. High-throughput screening using the differential radial capillary action of ligand assay identifies ebselen as an inhibitor of diguanylate cyclases. ACS Chem. Biol. 2014 Jan 17. 9(1). 183-92. doi: 10.1021/cb400485k.
28. Mann E.E., Wozniak D.J. Pseudomonas biofilm matrix composition and niche biology. FEMS Microbiol Rev. 2012 Jul. 36(4). 893-916. doi: 10.1111/j.1574-6976.2011.00322.x.
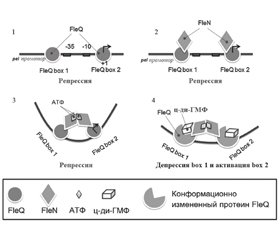
29. Matsuyama B.Y., Krasteva P.V., Baraquet C. et al. Mechanistic insights into c-di-GMP-dependent control of the biofilm regulator FleQ from Pseudomonas aeruginosa. Proc. Natl. Acad. Sci U S A. 2016 Jan 12. 113(2). E209-18. doi: 10.1073/pnas.1523148113.
30. McCarthy R.R., Valentini M., Filloux A. Contribution of Cyclic di-GMP in the Control of Type III and Type VI Secretion in Pseudomonas aeruginosa. Methods Mol. Biol. 2017. 1657. 213-224. doi: 10.1007/978-1-4939-7240-1_17.
31. Moradali M.F., Ghods S., Rehm B.H.A. Activation Mechanism and Cellular Localization of Membrane-Anchored Alginate Polymerase in Pseudomonas aeruginosa. Appl. Environ. Microbiol. 2017 Apr 17. 83(9). pii: e03499-16. doi: 10.1128/AEM.03499-16.
32. O’Connor J.R., Kuwada N.J., Huangyutitham V. et al. Surface sensing and lateral subcellular localization of WspA, the receptor in a chemosensory-like system leading to c-di-GMP production. Mol. Microbiol. 2012 Nov. 86(3). 720-9. doi: 10.1111/mmi.12013.
33. Oliveira C., Benfeito S., Fernandes C., Cagide F., Silva T., Borges F. NO and HNO donors, nitrones, and nitroxides: Past, present, and future. Med. Res. Rev. 2018 Jul. 38(4). 1159-1187. doi: 10.1002/med.21461.
34. Opoku-Temeng C., Sintim H.O. Targeting c-di-GMP Signaling, Biofilm Formation, and Bacterial Motility with Small Molecules. Methods Mol. Biol. 2017. 1657. 419-430. doi: 10.1007/978-1-4939-7240-1_31.
35. Orr M.W., Lee V.T. A PilZ domain protein for chemotaxis adds another layer to c-di-GMP-mediated regulation of flagellar motility. Sci Signal. 2016 Oct 18. 9(450). fs16. PMID: 27811181.
36. Qvortrup K., Hultqvist L.D., Nilsson M. et al. Small Molecule Anti-biofilm Agents Developed on the Basis of Mechanistic Understanding of Biofilm Formation. Front. Chem. 2019 Nov 1. 7. 742. doi: 10.3389/fchem.2019.00742.
37. Ravichandran A., Ramachandran M., Suriyanarayanan T. et al Global Regulator MorA Affects Virulence-Associated Protease Secretion in Pseudomonas aeruginosa PAO1. PLoS One. 2015 Apr 20. 10(4). e0123805. doi: 10.1371/journal.pone.0123805. e.
38. Römling U., Galperin M.Y. Discovery of the Second Messenger Cyclic di-GMP. Methods Mol. Biol. 2017. 1657. 1-8. doi: 10.1007/978-1-4939-7240-1_1.
39. Römling U., Galperin M.Y., Gomelsky M. Cyclic di-GMP: the first 25 years of a universal bacterial second messenger. Microbiol. Mol. Biol. Rev. 2013 Mar. 77(1). 1-52. doi: 10.1128/MMBR.00043-12.
40. Rong F., Tang Y., Wang T., Feng T., Song J., Li P., Huang W. Nitric Oxide-Releasing Polymeric Materials for Antimicrobial Applications: A Review. Antioxidants (Basel). 2019 Nov 15. 8(11). pii: E556. doi: 10.3390/antiox8110556.
41. Ross P., Weinhouse H., Aloni Y. et al. Regulation of cellulose synthesis in Acetobacter xylinum by cyclic diguanylic acid. Nature. 1987 Jan 15–21. 325(6101). 279-81. PMID: 18990795.
42. Sambanthamoorthy K., Luo C., Pattabiraman N., Feng X., Koestler B., Waters C.M., Palys T.J. Identification of small molecules inhibiting diguanylate cyclases to control bacterial biofilm development. Biofouling. 2014 Jan. 30(1). 17-28. doi: 10.1080/08927014.2013.832224.
43. Sambanthamoorthy K., Sloup R.E., Parashar V. et al. Identification of small molecules that antagonize diguanylate cyclase enzymes to inhibit biofilm formation. Antimicrob. Agents Chemother. 2012 Oct. 56(10). 5202-11. doi: 10.1128/AAC.01396-12.
44. Schirmer T. C-di-GMP Synthesis: Structural Aspects of Evolution, Catalysis and Regulation. J. Mol. Biol. 2016 Sep 25. 428(19). 3683-701. doi: 10.1016/j.jmb.2016.07.023.
45. Skariyachan S., Sridhar V.S., Packirisamy S. et al. Recent perspectives on the molecular basis of biofilm formation by Pseudomonas aeruginosa and approaches for treatment and biofilm dispersal. Folia Microbiol (Praha). 2018 Jul. 63(4). 413-432. doi: 10.1007/s12223-018-0585-4.
46. Soren O., Rineh A., Silva D.G. et al. Cephalosporin nitric oxide-donor prodrug DEA-C3D disperses biofilms formed by clinical cystic fibrosis isolates of Pseudomonas aeruginosa. J. Antimicrob. Chemother. 2019 Sep 17. pii: dkz378. doi: 10.1093/jac/dkz378.
47. Sortino S. Light-controlled nitric oxide delivering molecular assemblies. Chem. Soc. Rev. 2010 Aug. 39(8). 2903-13. doi: 10.1039/b908663n.
48. Thangamani S., Younis W., Seleem M.N. Repurposing ebselen for treatment of multidrug-resistant staphylococcal infections. Sci Rep. 2015 Jun 26. 5. 11596. doi: 10.1038/srep11596.
49. Valentini M., Filloux A. Biofilms and Cyclic di-GMP (c-di-GMP) Signaling: Lessons from Pseudomonas aeruginosa and Other Bacteria. J. Biol. Chem. 2016 Jun 10. 291(24). 12547-55. doi: 10.1074/jbc.R115.711507.
50. Wang J., Zhou J., Donaldson G.P. et al. Conservative change to the phosphate moiety of cyclic diguanylic monophosphate remarkably affects its polymorphism and ability to bind DGC, PDE, and PilZ proteins. J. Am. Chem. Soc. 2011 Jun 22. 133(24). 9320-30. doi: 10.1021/ja1112029.
51. Wang T., Cai Z., Shao X. et al. Pleiotropic Effects of c-di-GMP Content in Pseudomonas syringae. Appl. Environ. Microbiol. 2019 May 2. 85(10). pii: e00152-19. doi: 10.1128/AEM.00152-19.
52. Wei Q., Leclercq S., Bhasme P. et al. Diguanylate Cyclases and Phosphodiesterases Required for Basal-Level c-di-GMP in Pseudomonas aeruginosa as Revealed by Systematic Phylogenetic and Transcriptomic Analyses. Appl. Environ. Microbiol. 2019 Oct 16. 85(21). pii: e01194-19. doi: 10.1128/AEM.01194-19.
53. Wo Y., Li Z., Brisbois E.J. et al. Origin of Long-Term Storage Stability and Nitric Oxide Release Behavior of CarboSil Polymer Doped with S-Nitroso-N-acetyl-D-penicillamine. ACS Appl. Mater. Interfaces. 2015 Oct 14. 7(40). 22218-27. doi: 10.1021/acsami.5b07501.
54. Yan J., Deforet M., Boyle K.E. et al. Bow-tie signaling in c-di-GMP: Machine learning in a simple biochemical network. PLoS Comput Biol. 2017 Aug 2. 13(8). e1005677. doi: 10.1371/journal.pcbi.1005677.
55. Yang L., Feura E.S., Ahonen M.J.R., Schoenfisch M.H. Nitric Oxide-Releasing Macromolecular Scaffolds for Antibacterial Applications. Adv. Healthc Mater. 2018 Jul. 7(13). e1800155. doi: 10.1002/adhm.201800155.
56. Yin W., Wang Y., Liu L., He J. Biofilms: The Microbial “Protective Clothing” in Extreme Environments. Int. J. Mol. Sci. 2019 Jul 12. 20(14). pii: E3423. doi: 10.3390/ijms20143423.
57. Zheng Y., Tsuji G., Opoku-Temeng C., Sintim H.O. Inhibition of P. aeruginosa c-di-GMP phosphodiesterase RocR and swarming motility by a benzoisothiazolinone derivative. Chem. Sci. 2016 Sep 1. 7(9). 6238-6244. doi: 10.1039/c6sc02103d.
58. Zhou E., Seminara A.B., Kim S.K., Hall C.L., Wang Y., Lee V.T. Thiol-benzo-triazolo-quinazolinone Inhibits Alg44 Binding to c-di-GMP and Reduces Alginate Production by Pseudomonas aeruginosa. ACS Chem Biol. 2017 Dec 15. 12(12). 3076-3085. doi: 10.1021/acschembio.7b00826.
Продолжение в следующем номере

/100.jpg)
/101.jpg)
/102.jpg)
/103.jpg)