Резюме
Метою дослідження є визначення рівня N-термінального пропептиду проколагену I типу (PINP) у сироватці крові здорових чоловіків та жінок різного віку. Матеріали та методи. У дослідження були включені 1568 осіб (1422 особи жіночої та 146 — чоловічої статі) віком 20–89 років (середній вік — 60,36 ± 13,68 року). Усіх обстежених осіб розподілили на 7 груп відповідно до десятиріччя та геронтологічної класифікації віку: молодий вік — 20–44 роки, середній — 45–59 років, літній — 60–74 роки та старечий вік — 75–89 років. Під час дослідження вивчали вплив демографічних характеристик: віку і статі на рівень PINP у сироватці крові методом електрохемілюмінесцентного імуноаналізу ECLIA на аналізаторі cobas e 411. Результати. У результаті дослідження в жінок не встановлено вірогідного впливу віку на варіабельність рівня PINP у сироватці крові (F = 1,453, р = 0,19). Виявлено вірогідне зниження рівня PINP у жінок вікових груп: 40–49 років (47,74 ± 21,31, р = 0,02), 60–69 років (49,76 ± 25,75, р = 0,03), 70–79 років (50,49 ± 26,71, р = 0,04), порівняно з групою 20–29 років (58,67 ± 27,46). За результатами регресійного аналізу визначено вірогідне зниження рівня PINP із віком у молодих жінок та чоловіків (20–44 роки). При порівнянні рівня PINP у сироватці крові в представників найстаршої вікової групи (80–89 років) виявлено його підвищення в жінок (55,20 ± 28,38 нг/мл) порівняно з групою 70–79 років (50,49 ± 26,71 нг/мл) та зниження в чоловіків (54,87 ± 28,24 нг/мл та 39,16 ± 12,46 нг/мл відповідно). У чоловіків доведено вірогідний вплив віку на варіабельність рівня PINP у сироватці крові (F = 3,08, р = 0,007). Висновки. За результатами регресійного аналізу доведено вірогідне зниження рівня PINP із віком у чоловіків та жінок 20–44 років. Виявлено вірогідний вплив віку на варіабельність рівня PINP у сироватці крові у чоловіків. При порівнянні рівня PINP у сироватці крові в представників найстаршої вікової групи (80–89 років) визначено його підвищення в жінок порівняно з групою 70–79 років та зниження в чоловіків. Отримані нами результати можуть бути використані як референтні дані рівня PINP у сироватці крові в представників української популяції різного віку та статі.
Целью исследования является определение уровня N-терминального пропептида проколлагена І типа (PINP) в сыворотке крови у здоровых мужчин и женщин всех возрастов. Материалы и методы. В исследование были включены 1568 человек (1422 лица женского и 146 — мужского пола) в возрасте 20–89 лет (средний возраст — 60,36 ± 13,68 года). Всех пациентов разделили на 7 групп, в соответствии с десятилетиями и геронтологической классификацией возраста: молодой возраст — 20–44 года, средний — 45–59 лет, пожилой — 60–74 года и старческий возраст — 75–89 лет. Во время исследования изучали влияние демографических характеристик (возраста и пола) на уровень PINP в сыворотке крови методом электрохемилюминесцентного иммуноанализа ECLIA на анализаторе cobas e 411. Результаты. В результате исследования у женщин не выявлено достоверного влияния возраста на вариабельность PINP в сыворотке крови (F = 1,453, р = 0,19). Выявлено достоверное снижение уровня PINP в возрастных группах: 40–49 лет (47,74 ± 21,31, р = 0,02), 60–69 лет (49,76 ± 25,75, р = 0,03), 70–79 лет (50,49 ± 26,71, р = 0,04), по сравнению с возрастной группой 20–29 лет (58,67 ± 27,46). По результатам регрессионного анализа выявлено достоверное снижение уровня PINP с возрастом у молодых женщин и мужчин (20–44 лет). При сравнении уровня PINP в сыворотке крови у представителей старшей возрастной группы (80–89 лет) обнаружено его повышение у женщин (55,20 ± 28,38 нг/мл) по сравнению с группой 70–79 лет (50,49 ± 26,71 нг/мл) и снижение у мужчин (54,87 ± 28,24 нг/мл и 39,16 ± 12,46 нг/мл соответственно). У мужчин обнаружено вероятное влияние возраста на вариабельность PINP в сыворотке крови (F = 3,08, р = 0,007). Выводы. По результатам регрессионного анализа установлено достоверное снижение уровня PINP с возрастом у мужчин и женщин 20–44 лет. Доказано вероятное влияние возраста на вариабельность PINP в сыворотке крови у мужчин. При сравнении уровня PINP в сыворотке крови у представителей старшей возрастной группы (80–89 лет) выявлено его повышение у женщин по сравнению с группой 70–79 лет и снижение у мужчин. Полученные нами результаты могут быть использованы как референтные данные уровня PINP в сыворотке крови у представителей украинской популяции разного возраста и пола.
Background. The purpose of the study is to determine the serum level of N-terminal propeptide of type I procollagen (PINP) in healthy men and women of various ages. Materials and methods. The study included 1,568 individuals (1,422 females and 146 males, aged 20-89 years (mean age 60.36 ± 13.68 yrs). All patients were divided into 7 groups, by decades and according to the gerontological age classification: young age – 20–44 yrs, middle age 45–59 yrs, elderly 60–74 yrs, and old 75-89 yrs. During the study, we examined the effect of such demographic characteristics, as age and gender, on serum PINP level, using the electrochemiluminescence immunoassay ECLIA on the cobas e 411 analyzer. Results. We have detected no significant effect of age on the serum variability of PINP in females (F = 1.453, p = 0.19). However, we observed a significant decrease of PINP level in the female age groups of 40–49 yrs (47.74 ± 21.31, p = 0.02), 60–69 yrs (49.76 ± 25.75, p = 0.03), 70–79 yrs (50.49 ± 26.71, p = 0.04), compared with the age group of 20–29 yrs (58.67 ± 27.46). The regression analysis revealed a significant decrease of PINP level with age in young women and men (20–44 years). When comparing serum PINP level in the oldest age group (80-89 years), we detected its increase in women (55.20 ± 28.38 ng/ml), compared with the 70–79 years group (50.49 ± 26.71 ng/ml), and its decrease in men (54.87 ± 28.24 and 39.16 ± 12.46 ng/ml, respectively). In men, we revealed significant effect of age on the serum variability of PINP (F = 3,077, p = 0.007). Conclusions. The regression analysis showed a significant decrease in PINP level with age in men and women of 20-44 years. In men, we detected a significant effect of age on the variability of serum PINP level. A comparison of serum PINP levels in the oldest age group of 80-89 revealed its increase in women, compared to the 70–79 age group, and decrease in men. The obtained results may be used as reference values for PINP level in serum among representatives of the Ukrainian population of various ages and sexes.
Вступ
Кісткова тканина (КТ) — це метаболічно активна структура, що шляхом ремоделювання (резорбції та формування) бере участь у мінеральному обміні організму, адаптації до механічних навантажень, реагує на зміни зовнішнього та внутрішнього середовища, відновлюється після травматичних ушкоджень [1]. На зміну кісткового метаболізму впливають процеси соматичного росту в дитячому та юнацькому віці, збалансоване харчування та погрішності в дієті, старіння та настання менопаузи, метаболічні захворювання кісток, фізична активність, терапевтичні та хірургічні втручання, наявність супутньої патології та інші стани [2]. Традиційно перебіг процесу формування та резорбції КТ здійснюють за допомогою гістологічної оцінки — біопсії з використанням морфометричних методів. Однак останнім часом із розвитком методів імуноферментного аналізу можливе визначення молекулярних маркерів метаболізму КТ у крові або сечі [3].
Міжнародна фундація остеопорозу (International Osteoporosis Foundation — IOF) та робоча група стандартів маркерів кісткової тканини Міжнародної федерації клінічної хімії (Іnternational Federation of Clinical Chemistry Bone Marker Standards Working Group — IOF–IFCC) запропонували рутинне визначення в сироватці крові рівня N-термінального пропептиду проколагену I типу (PINP) та β-термінального телопептиду колагену I типу (β-CTx) із метою запобігання переломам, прогнозування ризику їх виникнення та моніторингу ефективності застосування остеотропної терапії у хворих на остеопороз (ОП) [4]. На сьогодні PINP і β-CTx є основними доступними, економічно ефективними та високочутливими [1] маркерами формування та резорбції КТ, які використовують у повсякденній лікарській практиці.
Активне вивчення вченими всього світу маркерів ремоделювання КТ та визначення найбільш інформативних серед них тривають упродовж останніх 30 років [4]. Вагомим поштовхом для їх відкриття були впровадження в медичну практику антиостеопоротичної терапії в 90-х роках минулого століття та необхідність контролю ефективності лікування ОП [3]. Раніше широко використовували як маркер кісткоутворення загальну лужну фосфатазу, що була відкрита ще на початку минулого століття, близько 90 років тому. Проте сьогодні вона вважається недостатньо чутливим лабораторним показником формування КТ [3, 5, 6].
Маркери ремоделювання КТ поділяють на дві групи: ті, що визначають формування та резорбцію КТ. Маркери формування є продуктами активності остеобластів, які визначають у сироватці або плазмі крові [2]: PINP, C-термінальний пропептид проколаген I типу (PICP), остеокальцин, кістковий ізофермент лужної фосфатази. Маркери резорбції КТ — в основному продукти деструкції колагену: β-CTx, N-кінцевий телопептид колагену I типу (NTX-I), дезоксипіридинолін, гідроксипролін, тартрат-резистентна кисла фосфатаза (TRACP), катепсин К (CatK), рецептор-активатор ліганду ядерного фактора κB (RANKL), остеопротегерин (OPG) [4, 6, 7].
Метою нашого дослідження було визначення рівня PINP у сироватці крові в здорових чоловіків та жінок різного віку.
Матеріали та методи
Дослідження проводилось на базі ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України» та Українського науково-медичного центру проблем остеопорозу НАМН України.
У дослідження були включені 1568 пацієнтів, серед яких 1422 особи жіночої та 146 — чоловічої статі віком 20–89 років (середній вік жінок — 61,24 ± 12,99 року, чоловіків — 51,73 ± 16,91 року). Усіх обстежених осіб поділили на 7 груп відповідно до десятиріч від 20 до 89 років та геронтологічної класифікації віку: молодий вік — 20–44 роки, середній — 45–59 років, літній — 60–74 роки та старечий вік — 75–89 років.
Критеріями включення в дослідження були пацієнти, які звернулись за медичною допомогою в зазначені вище медичні установи вперше, та наявність підписаної ними інформованої згоди на участь у дослідженні. Критерії виключення: супутня патологія, що впливає на метаболізм кісткової тканини, повторне визначення рівня PINP (показники в динаміці), прийом остеотропних препаратів (за виключенням кальцію та вітаміну D) в анамнезі, перелом кісток будь-якої локалізації протягом останнього року.
Під час дослідження вивчали вплив демографічних характеристик: віку й статі на рівень PINP. Його визначали в сироватці крові методом електрохемілюмінесцентного імуноаналізу ECLIA на аналізаторі cobas e 411. Дослідження сироватки крові проводили згідно з рекомендаціями (2017 року) щодо стандартизованої обробки зразків та підготовки пацієнтів до вимірювання PINP [4]: забір проводили натще, у проміжку часу між 7:30 та 10:00 [8]. Упродовж 2 годин після забору кров центрифугували в спеціальних вакуумних пробірках із розподільчим гелем. Зазвичай аналіз зразків проводився в день забору або в межах 3 діб після нього (зберігали центрифуговану сироватку при температурі –20 °С). За добу до забору крові пацієнти повинні були уникати тяжких фізичних навантажень.
Статистичний аналіз проводили з використанням програми Statistica 6.0. Отримані результати подані у вигляді середнього значення (M) ± стандартне відхилення (SD). Різницю показників вважали вірогідною за умови р < 0,05. Вплив віку на варіабельність показника PINP встановлювали за допомогою однофакторного дисперсійного аналізу ANOVA. Міжгрупові відмінності оцінювали за допомогою тесту Шеффе. Взаємозв’язок між статтю, віком та рівнем PINP у сироватці крові визначали за методом лінійної регресії.
Результати
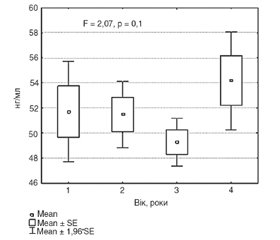
Відповідно до розподілу обстежених осіб на 7 груп за десятиріччями (рис. 1) у дослідженні брали участь: 66 осіб (47 жінок та 19 чоловіків) віком 20–29 років, 101 особа (80 жінок та 21 чоловік) 30–39 років, 105 осіб (79 жінок та 26 чоловіків) 40–49 років), 358 осіб (334 жінок та 24 чоловіки) 50–59 років, 526 осіб (496 жінок та 30 чоловіків) 60–69 років, 344 особи (322 жінки та 22 чоловіки) 70–79 років та 68 осіб (64 жінки та 4 чоловіки) 80–89 років. Розподіл пацієнтів відповідно до геронтологічної класифікації віку був таким: 212 осіб (158 жінок та 54 чоловіки) молодого віку, 418 (382 жінки та 36 чоловіків) — середнього віку, 714 (673 жінки та 41 чоловік) — літнього та 224 особи (209 жінок та 15 чоловіків) старечого віку.
/10.jpg)
У результаті дослідження в жінок не виявлено вірогідного впливу віку на варіабельність PINP у сироватці крові (F = 1,45, р = 0,19 (табл. 1; рис. 1)). При оцінюванні міжгрупових відмінностей виявили вірогідне зниження рівня рівня PINP у вікових групах: 40–49 років (47,74 ± 21,31 нг/мл, р = 0,02), 60–69 років (49,76 ± 25,75 нг/мл, р = 0,03), 70–79 років (50,49 ± 26,71 нг/мл, р = 0,04) порівняно з віковою групою 20–29 років (58,67 ± 27,46 нг/мл) (рис. 2А).
Однак у чоловіків виявлено вірогідний вплив віку на –варіабельність показника PINP у сироватці крові (F = 3,08, р = 0,007 (табл. 1)). При оцінюванні міжгрупових відмінностей (рис. 2Б) виявили вірогідне зниження рівня PINP у вікових групах: 30–39 років (50,44 ± 20,10 нг/мл, р = 0,02), 40–49 років (42,93 ± 14,87 нг/мл, р < 0,001, 50–59 років (49,57 ± 25,03 нг/мл, р = 0,01), 60–69 років (42,31 ± 27,95 нг/мл, р < 0,001) та 80–89 років (39,16 ± 12,46 нг/мл, р = 0,03), порівняно з віковою групою 20–29 років (69,18 ± 27,92 нг/мл).
При проведенні регресійного аналізу між рівнем PINP та віком (рис. 3) не виявлено вірогідних відмінностей у жінок (r = –0,012, t = –0,44, p = 0,66) та чоловіків (r = –0,15, t = –1,87, p = 0,06).
Відповідно до розподілу жінок за геронтологічною класифікацією віку (рис. 4А) показники PINP у сироватці крові були вірогідно вищими у віковій групі 75–89 років (54,17 ± 28,84 нг/мл, р < 0,05) порівняно з пацієнтами вікової групи 60–74 роки (49,26 ± 25,38 нг/мл, табл. 2).
У чоловіків віком 60–74 роки рівень PINP становив 43,85 ± 28,08 нг/мл (р < 0,05), тобто є вірогідно нижчим, ніж в осіб молодого віку, — 33,30 ± 6,88 нг/мл (рис. 4Б).
За результатами регресійного аналізу виявлено вірогідне зниження рівня PINP із віком у молодих жінок (р < 0,05) та чоловіків (р < 0,05) (рис. 5A, В). Серед жінок найстаршої вікової групи (75–89 років) спостерігалося підвищення його рівня в крові з віком (рис. 5Б). Проте в чоловіків цього ж віку відмічали негативний кореляційний зв’язок між PINP та віком (р > 0,05) (рис. 5Г).
Обговорення
Органічний матрикс кісткової тканини складається на 90 % із колагену I типу. Він забезпечує міцність кісток і синтезується остеобластами у вигляді його попередника — проколагену. Проколаген I типу містить С-карбокси- і N-аміно-термінальні фрагменти, які відщеплюються завдяки ферментам — протеїназам із подальшим утворенням колагену та його об’єднанням із кістковим матриксом, із надходженням С- і N-термінальних фрагментів у міжклітинну рідину та кровотік. N-термінальний пропептид проколагену I типу (PІNP) є найбільш чутливим маркером формування КТ і відображає темпи кісткоутворення, маючи більшу стабільність та діагностичну цінність, ніж С-термінальний фрагмент (PІСP), який розпадається в крові через 6–8 хвилин. Вміст PІNP у крові прямо пропорційний кількості продукованого остеобластами й вбудованого в кісткову тканину колагену [2, 3, 12].
Під час інтерпретації результатів необхідно враховувати всі наявні в пацієнта модифіковані та немодифіковані фактори: вік, стать, нещодавній перелом в анамнезі, тривала іммобілізація, вагітність, супутні захворювання та попередній прийом антиостеопоротичних препаратів та деяких інших лікуючих засобів.
Для більшості маркерів метаболізму кісткової тканини акрофаза або піковий час найвищого рівня в крові є подібним в обох статей [13]. Рівень маркерів формування кісткової тканини в новонароджених дітей та немовлят є максимально високий порівняно з іншими віковими групами. До настання пубертатного віку їх рівень знижується. На початку статевого дозрівання (за класифікацією Tanner — I–III) рівень маркерів вищий, а потім знижується раніше в дівчат, ніж у хлопців [4, 14]. За даними літератури, серед осіб молодого віку рівень PІNP вищий у чоловіків, ніж у жінок. Це пояснюється більшим обсягом та масою КТ у чоловіків (з урахуванням росту та конституції) і, відповідно, швидшими процесами формування та резорбції в кістках більших розмірів [14, 15]. За результатами нашого дослідження виявлено невірогідне підвищення рівня PINP у чоловіків порівняно з жінками (чоловіки — 69,18 ± 27,92 нг/мл, жінки — 58,67 ± 27,46 нг/мл). Відсутність вірогідних відмінностей, на нашу думку, обумовлена низьким числом обстежених чоловіків молодого віку (n = 19).
Під час старіння підвищення в крові рівня маркерів метаболізму КТ у чоловіків є менш вираженим, ніж у жінок [14]. За результатами нашого дослідження, серед жінок найстаршої вікової групи (75–89 років) спостерігалося підвищення рівня PINP у крові з віком, проте в чоловіків цього ж віку відмічали його зниження. Такі результати можна пояснити малою вибіркою в групі чоловіків старечого віку (n = 15 осіб) та, імовірно, низькою середньою тривалістю життя чоловічого населення в Україні. За інформацією державної служби статистики України за 2018 рік, середня тривалість життя чоловіків становить 66,69 року, тоді як у жінок — 76,72 року [10], що є нижчим порівняно з європейськими даними, за якими тривалість життя чоловіків становить 78,3 року, а жінок — 83,5 року [11]. У дослідженні J.E. Aaron та співавт. описані гістоморфометричні зміни КТ у жінок та чоловіків. Втрата трабекулярного об’єму КТ була однаковою в обох статей, проте гістологічно відрізнялася. У чоловіків головним фактором втрати КТ було зниження її формування, а в жінок цей процес залишався незмінним. Такі результати дозволили припустити, що причиною змін КТ у жінок є посилення резорбції. У жінок втрата КТ в основному пояснюється руйнуванням окремих трабекул на відміну від чоловіків, у яких спостерігалося генералізоване трабекулярне стоншення кістки, яке менше впливає на мінеральну щільність та якість КТ [16]. Таким чином, високі маркери метаболізму КТ вказують на деградацію кісткової мікроархітектури та втрату КТ меншою мірою в чоловіків, ніж у жінок. Тому можна припустити, що зміни маркерів метаболізму КТ не є предикторами переломів у чоловіків [14].
В осіб жіночої статі рівень сироваткового PINP зростає в період менопаузи, проте його внутрішньоіндивідуальні варіації в жінок в пері- та постменопаузальному періоді становлять менше 10 %. За результатами нашого дослідження виявлено підвищення рівня сироваткового PINP у віковій групі 50–59 років (51,91 ± 26,82 нг/мл, р = 0,03), що збігається з пізнім постменопаузальним періодом серед жіночого населення України, адже середній вік менопаузи в нашій країні становить 48,7 року [9]. Тоді як у чоловіків старшого віку його рівень залишається стабільним або незначно підвищується, як правило, після 70 років [4, 14, 17]. Жінки в постменопаузальному періоді мають більш високий рівень PINP, ніж чоловіки аналогічного віку.
За даними літератури, на рівень маркерів формування КТ частково впливає сезонність. Вважається, що взимку їх рівень є підвищеним, що пов’язане з дефіцитом вітаміну D та вторинним гіперпаратиреозом. Важливо враховувати це при інтерпретації результатів, особливо в осіб літнього віку, які мають більшу імовірність наявності дефіциту вітаміну D [13].
Рівень PINP є вищим у лютеїновій фазі менструального циклу порівняно з фолікулярною. P. Szulc та співавт. (2017) рекомендують жінкам репродуктивного віку проводити забір крові під час фолікулярної фази, яка в середньому триває з 1-го до 14-го дня менструального циклу [4].
Під час вагітності рівень маркерів кісткового формування є незмінним протягом перших двох триметрів і швидко збільшується в третьому. Після пологів їх концентрація в крові швидко знижується, але все ж залишається підвищеною в післяпологовому періоді порівняно з невагітними жінками того ж віку. У жінок, які годують груддю, рівень PINP є вищим порівняно з жінками, які не годують [4, 18].
Рівень PINP у сироватці різко зростає протягом перших тижнів після перелому (до 150 % від базисного рівня). Він досягає максимального рівня через 12 тижнів після перелому з подальшим зниженням. Підвищення концентрації PINP у сироватці крові зберігається впродовж більше ніж 1 року. Переломи з більшою площею руйнування та консолідації (наприклад, черезвертлюговий перелом) пов’язані з більш високим рівнем маркерів як формування, так і резорбції КТ. Іммобілізація також призводить до підвищення рівня PINP у сироватці крові [4, 14].
Вплив фізичних навантажень на рівень PINP залежить від виду спорту, його тривалості й інтенсивності. У жінок, які займаються плаванням, не виявлено впливу на концентрацію маркерів метаболізму КТ [14], що свідчить про те, що фізичні вправи не мають суттєвого впливу на рівень PINP [19].
Рівень маркерів метаболізму КТ залежить від маси тіла пацієнта. Дослідження показали, що маркери формування КТ є нижчими в осіб, які страждають від ожиріння, порівняно з особами з нормальним індексом маси тіла [14].
Порушення балансу формування та резорбції КТ спостерігають при деяких ендокринних захворюваннях (гіпотиреоз, гіпопаратиреоз, гіпопітуїтаризм, дефіцит гормона росту) та ВІЛ-інфекції. Рівень PINP є обернено пропорційним до швидкості клубочкової фільтрації у хворих із хронічною нирковою недостатністю. Пероральні та парентеральні кортикостероїди залежно від дози пригнічують формування кісткової тканини на відміну від інгаляційних, які не впливають на рівень метаболізму КТ [4].
Жінки, які вживали пероральні контрацептиви, що містять естрогени, мали на 15–25 % нижчий рівень маркерів формування КТ, проте препарати медроксипрогестерону ацетату незначно підвищували рівень PINP [4].
Перевагами PINP над іншими маркерами формування КТ є те, що він має мінімальну циркадну варіабельність і на відміну від інших на нього практично не впливає прийом їжі, що дозволяє проводити пацієнтам випадковий забір крові протягом дня з метою визначення його рівня [4].
Певними обмеженнями нашого дослідження є незначна кількість чоловіків у вікових групах 20–29 (n = 19) і 80–89 років (n = 4), що затрудняє інтерпретацію отриманих результатів.
Висновки
За результатами регресійного аналізу доведено вірогідне зниження рівня PINP із віком у чоловіків та жінок 20–44 років. Виявлений вірогідний вплив віку на варіабельність рівня PINP у сироватці крові в чоловіків. При порівнянні рівня PINP у сироватці крові в представників найстаршої вікової групи (80–89 років) виявлено його підвищення в жінок порівняно з групою 70–79 років та зниження у чоловіків. Отримані нами результати можуть бути використані як референтні дані рівня PINP у сироватці крові в представників української популяції різного віку та статі.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Shetty S., Kapoor N., Bondu J.D. et al. Bone turnover markers: Emerging tool in the management of osteoporosis. Indian J. Endocrinol. Metab. 2016 Nov – Dec. 20(6). P. 846-852. doi: 10.4103/2230-8210.192914.
2. Markus J. Seibel. Biochemical Markers of Bone Turnover Part I: Biochemistry and Variability. Clin. Biochem. Rev. 2005 Nov. 26(4). P. 97-122.
3. Roodman G.D., Guise T.A. Bone and Cancer in Basic and Applied Bone Biology. 2nd ed. 2019. P. 411-423.
4. Szulc P., Naylor K., Hoyle N.R. et al. National Bone Health Alliance Bone Turnover Marker Project. Use of CTX-I and PINP as bone turnover markers: National Bone Health Alliance recommendations to standardize sample handling and patient preparation to reduce pre-analytical variability. Osteoporos Int. 2017. 28(9). P. 2541-2556. doi: 10.1007/s00198-017-4082-4.
5. Coates P. Bone turnover markers. 2013. 42(5). P. 285-287.
6. Povoroznyuk V.V., Balats’ka N.I. Role of bone tissue turnover markers in diagnosis of osteoporosis. ML. 2013. 2–3. P. 98-99.
7. Povoroznyuk V.V. Osteoporosis and biochemical bone turnover markers. Laboratory diagnosis. 2002. 1. P. 53-61.
8. Redmond J., Fulford A.J., Jarjou L. et al. Rhythms of bone turnover markers in three ethnic groups. J. Clin. Endocrinol. Metab. 2016. 101(8). P. 3222-3230. doi: 10.1210/jc.2016-1183.
9. Povoroznyuk V.V., Hryhor’yeva N.V. Menopausa and osteoporosis. Mystetstvo likuvannya. 2005.
10. State Statistics Service of Ukraine. Fertility, mortality, and average life expectancy tables for 2018. Режим доступу: http://ukrstat.gov.ua/druk/publicat/kat_u/2019/zb/08/zb_tabl_nar_2018.pdf.
11. Eurostat. Life expectancy at birth in the EU: men vs. women. 2017. Режим доступу: https://ec.europa.eu/eurostat/web/products-eurostat-news/-/DDN-20190725-1.
12. Vasikaran S., Eastell R., Bruyère O. et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards. Osteoporos. Int. 2011. 22. P. 391-420. doi: 10.1007/s00198-010-1501-1.
13. Garnero P., Szulc P. Assessment of Bone Turnover in Men Using Biochemical Markers. Osteoporosis in Men. 2nd ed. 2010. doi: 10.1016/B978-0-12-374602-3.00003-1.
14. Eastell R., Szulc P. Use of bone turnover markers in postmenopausal osteoporosis. Lancet Diabetes Endocrinol. 2017. July 5(11). P. 908-923. doi:10.1016/s2213-8587(17)30184-5.
15. Kitareewan W., Boonhong J., Janchai S. et al. Effects of the treadmill walking exercise on the biochemical bone markers. J. Med. Assoc. Thail. 2011. 5(94). P. 10-16.
16. Aaron J.E., Makins N.B., Sagreiya K. The Microanatomy of Trabecular Bone Loss in Normal Aging Men and Women. Clin. Orthop. Relat. Res. 1987. 215. P. 260-71.
17. Van den Berghe G., Van Roosbroeck D., Vanhove P. et al. Bone turnover in prolonged critical illness: effect of vitamin D. J. Clin. Endocrinol. Metab. 2003. 88. P. 4623-4632. doi: 10.1210/jc.2003-030358.
18. Ferreira A., Alho I., Casimiro S. et al. Bone remodeling markers and bone metastases: from cancer research to clinical implications. Bonekey Rep. 2015. 4. P. 668. doi: 10.1038/bonekey.2015.35.
19. Weiler R., Keen R., Wolman R. Changes in bone turnover markers during the close season in elite football (soccer) players. J. Sci. Med. Sport. 2012. 15. P. 255-258. doi: 10.1016/j.jsams.2011.09.004
/10.jpg)

/11.jpg)
/11_2.jpg)
/12.jpg)
/12_2.jpg)
/12_3.jpg)
/13.jpg)