Резюме
Актуальність. Цукровий діабет (ЦД) як хвороба цивілізації є однією з головних причин смертності в більшості розвинених країн. Мета дослідження: визначити фактори ризику неконтрольованого перебігу автоімунного ЦД 1-го типу в дітей. Матеріали та методи. Для визначення типу вперше виявленого ЦД було обстежено 100 дітей віком від 1 до 18 років за допомогою дослідження рівнів автоантитіл до глутаматдекарбоксилази, тирозинфосфатази, транспортерів цинку імуноферментним методом (Euroimmun) та виявлення генетичних дефектів функції β-клітин за допомогою полімеразно-ланцюгової реакції та геномного секвенування (Illumina). Для прогнозування перебігу автоімунного ЦД 1-го типу за допомогою послідовного аналізу Вальда було проаналізовано 100 клініко-імунологічних, молекулярно-генетичних, інструментально-діагностичних параметрів із визначенням відносного ризику та діагностичного коефіцієнта після катамнестичного спостереження 53 дітей із неконтрольованим (основна група, n = 22) та контрольованим перебігом (контрольна група, n = 31). Результати. Автоімунний ЦД 1-го типу діагностовано в 98 %, генетичні дефекти функції β-клітин (MODY 5-го типу та синдром Вольфрама 1-го типу) — у 2 % обстежених дітей від 1 до 18 років. Предикторами розвитку неконтрольованого перебігу автоімунного ЦД 1-го типу в дітей було обрано 17 факторів із достатньою інформативною прогностичною значимістю (І ≥ 0,5): наявність грипу в анамнезі за 1 рік до дебюту ЦД (І = 1,73), підвищення аланінамінотрансферази (І = 1,27), наявність антитіл до глутаматдекарбоксилази (І = 1,14), маніфестація ЦД 1-го типу у віці 1–4 роки або понад 6 років (І = 0,98), підвищення сечовини крові (І = 0,86), макросомія при народженні (І = 0,71), підвищення глікованого гемоглобіну понад 8 % при дебюті захворювання (І = 0,7), зниження лужної фосфатази (І = 0,66), обтяжена спадковість за автоімунними захворюваннями (І = 0,62), супутні захворювання серцево-судинної системи (І = 0,61), гіперглікемія понад 23 ммоль/л (І = 0,56), затримка госпіталізації дитини понад 1 місяць від маніфестації ЦД 1-го типу (І = 0,54), відсутність режиму вигодовування на 1-му році життя (І = 0,52), глюкозурія (І = 0,52), часті гострі респіраторні інфекції в анамнезі (І = 0,52), гіпопротеїнемія (І = 0,51), наявність хронічних вогнищ інфекції (І = 0,5). Висновки. Для поліпшення якості діагностики, прогнозу перебігу та персоніфікованого лікування ЦД, особливо у хворих із вперше діагностованим захворюванням, необхідне визначення специфічних автоантитіл проти острівцевого апарату підшлункової залози. У випадках із негативним результатом рекомендоване подальше направлення для молекулярно-генетичного обстеження з метою виключення неавтоімунних типів ЦД. При лабораторно верифікованому автоімунному ЦД 1-го типу для прогнозу подальшого перебігу захворювання в дітей запропоновано просту у використанні математичну модель із високими валідними ознаками.
Актуальность. Сахарный диабет (СД) как болезнь цивилизации является одной из главных причин смертности в большинстве развитых стран. Цель исследования: определить факторы риска неконтролируемого течения аутоиммунного СД 1-го типа у детей. Материалы и методы. Для определения типа впервые выявленного СД были обследованы 100 детей в возрасте от 1 до 18 лет с помощью исследования уровней аутоантител к глутаматдекарбоксилазе, тирозинфосфатазе, транспортерам цинка иммуноферментным методом (Euroimmun) и выявления генетических дефектов функции β-клеток с помощью полимеразной цепной реакции и секвенирования с использованием технологии Illumina. Для прогнозирования течения аутоиммунного СД 1-го типа с помощью последовательного анализа Вальда были проанализированы 100 клинико-иммунологических, молекулярно-генетических, инструментально-диагностических параметров с определением относительного риска и диагностического коэффициента после катамнестического наблюдения 53 детей с неконтролируемым (основная группа, n = 22) и контролируемым течением (контрольная группа, n = 31). Результаты. Аутоиммунный СД 1-го типа диагностирован у 98 %, генетические дефекты функции β-клеток (MODY 5-го типа и синдром Вольфрама 1-го типа) — у 2 % обследованных детей от 1 до 18 лет. Предикторами развития неконтролируемого течения аутоиммунного СД 1-го типа у детей были выделены 17 факторов с достаточной информативной прогностической значимостью (I ≥ 0,5), которые являются удобными для применения в клинической практике: наличие гриппа в анамнезе за 1 год до дебюта СД 1-го типа (I = 1,73), повышение аланинаминотрансферазы (I = 1,27), наличие антител к глутаматдекарбоксилазы (I = 1,14), манифестация СД 1-го типа в возрасте 1–4 года или более 6 лет (I = 0,98), повышение мочевины в крови (I = 0,86), макросомия при рождении (I = 0,71), повышение гликированного гемоглобина более 8 % при дебюте заболевания (I = 0,7), снижение щелочной фосфатазы (I = 0,66), наследственная отягощенность по аутоиммунным заболеваниям (I = 0,62), сопутствующие заболевания сердечно-сосудистой системы (I = 0,61), гипергликемия более 23 ммоль/л (I = 0,56), задержка госпитализации ребенка более 1 месяца от манифестации СД 1-го типа (I = 0,54), отсутствие режима вскармливания на 1-м году жизни (I = 0,52), глюкозурия (I = 0,52), частые острые респираторные инфекции в анамнезе (I = 0,52), гипопротеинемия (I = 0,51), наличие хронических очагов инфекции (I = 0,5). Выводы. Для улучшения качества диагностики, прогноза течения и персонифицированного лечения СД, особенно у больных с впервые диагностированным заболеванием, необходимо определение специфических аутоантител против островкового аппарата поджелудочной железы. В случаях с отрицательным результатом рекомендовано дальнейшее направление пациентов для молекулярно-генетического обследования с целью исключения неаутоиммунных типов СД. При лабораторно верифицированном аутоиммунном СД 1-го типа для прогноза дальнейшего течения заболевания у детей предложена простая в использовании математическая модель с высокими валидными признаками.
Background. Diabetes mellitus as a disease of civilization is one of the main causes of death in most developed countries. Purpose of the study: to determine the risk factors for the uncontrolled course of autoimmune type 1 diabetes in children. Materials and methods. To determine the type of a newly diagnosed diabetes, 100 children aged 1 to 18 years were examined by evaluating the levels of autoantibodies to glutamic acid decarboxylase, tyrosine phosphatase, zinc transporters using the enzyme immunoassay method (Euroimmun) and detecting genetic defects in β-cell function by polymerase chain reaction and Illumina sequencing technology. To predict the course of autoimmune type 1 diabetes with the help of Wald sequential analysis, 100 clinical, immunological, molecular genetic, instrumental diagnostic parameters were analyzed with relative risk and diagnostic coefficient determination after follow-up observation of 53 children with uncontrolled (main group, n = 22) and controlled course (control group, n = 31). Results. Autoimmune type 1 diabetes was diagnosed in 98 %, genetic defects in β-cell function (maturity-onset diabetes of the young type 5 and Wolfram syndrome type 1) — in 2 % of the examined children aged 1 to 18 years. Seventeen factors with sufficient informative prognostic significance (I ≥ 0.5), which are convenient for use in clinical practice, were identified as predictors for the development of an uncontrolled course of autoimmune type 1 diabetes in children: history of influenza one year before the onset of type 1 diabetes (I = 1.73), increased alanine aminotransferase level (I = 1.27), presence of antibodies to glutamic acid decarboxylase (I = 1.14), manifestation of type 1 diabetes at the age of 1–4 years or more than 6 years (I = 0.98), increased blood urea level (I = 0.86), macrosomia at birth (I = 0.71), an increase in glycated hemoglobin content of more than 8 % at the onset of the disease (I = 0.7), a decrease in alkaline phosphatase level (I = 0.66), heredity for autoimmune illnesses (I = 0.62), concomitant diseases of the cardiovascular system (I = 0.61), hyperglycemia of more than 23 mmol/l (I = 0.56), delayed hospitalization of a child for more than 1 month from the manifestation of type 1 diabetes (I = 0.54), lack of feeding regimen during the 1st year of life (I = 0.52), glucosuria (I = 0.52), history of recurrent acute respiratory infections (I = 0.52), hypoproteinemia (I = 0.51), the presence of chronic foci of infection (I = 0.5). Conclusions. To improve the quality of diagnosis, prediction of the course and personalized treatment of diabetes, especially in patients with a newly diagnosed disease, it is necessary to determine specific autoantibodies against the islet apparatus of the pancreas. In cases with a negative result, a further referral for molecular genetic testing is recommended in order to exclude non-autoimmune types of diabetes. With laboratory verified autoimmune type 1 diabetes, an easy-to-use mathematical model with high valid features is proposed to predict the further course of the disease in children.
Вступ
Цукровий діабет (ЦД) як хвороба цивілізації є однією з головних причин смертності в більшості розвинених країн. Існують істотні докази, що збільшення поширеності діабету та його ускладнень може прийняти епідемічний характер у державах, що розвиваються. ЦД 1-го типу — це імуноопосередковане ушкодження підшлункової залози, і пошук новітніх маркерів хронічного низькорівневого запалення є важливим моментом персоніфікованого ведення хворих та запобігання стійкій гіперглікемії, пов’язаній із довгостроковими мікросудинними та макросудинними ускладненнями, когнітивною дисфункцією та незадовільним прогнозом. За даними 2018 року, загальна кількість хворих на ЦД 1-го типу дітей в Україні віком 0–18 років становила 9105 осіб. У структурі ендокринних хвороб ЦД діагностований у 1,8 % дітей на тлі невпинного зростання поширеності цього захворювання: із 9,81 у 2010 році до 12,52 у 2017 році на 10 тис. дитячого населення [6].
Саме автоімунний інсуліт є причиною абсолютної інсулінової недостатності в більшості (90–97 %) дітей [23]. Вагомого значення як маркерам автоімунного інсуліту в дитячому віці надають антитілам до глутаматдекарбоксилази (glutamate decarboxylase — GAD), протеїну-2 тирозинфосфатази або антигену-2 інсуліноми тирозинфосфатази (insulinoma antigen (IA)-2α), транспортерів цинку (ZnT8) та С-кінця транспортерів цинку (С-кінець ZnT8) [29]. Високий ризик неконтрольованого діабету 1-го типу з маніфестацією захворювання протягом наступних 10 років у 70–100 % випадків характеризується первинним одночасним підвищенням автоантитіл до двох та більше антигенів β-клітин підшлункової залози [31].
Мета дослідження: визначити фактори ризику неконтрольованого перебігу автоімунного ЦД 1-го типу в дітей.
Матеріали та методи
Робота є фрагментом науково-дослідної роботи кафедри педіатрії 1 та медичної генетики ДЗ «Дніпропетровська медична академія МОЗ України» «Генотип-асоційована персоналізація діагностичного та лікувального процесу в дітей із хворобами респіраторної, ендокринної та травної систем» (номер держреєстрації 0118U006629) та «Прогнозування розвитку дитячих захворювань, асоційованих з цивілізацією» (номер держреєстрації 0120U101324). Дослідження виконане за бюджетною програмою КПКВК 2301020 «Наукова і науково-технічна діяльність у сфері охорони здоров’я», фінансувалося Міністерством охорони здоров’я України за кошти державного бюджету. Дослідження проведене згідно із сучасними науковими стандартами, передбачені заходи щодо забезпечення здоров’я пацієнтa, дотримання його прав, людської гідності та морально-етичних норм відповідно до Гельсінської декларації, Конвенції Ради Європи про права людини і біомедицину, Загальної декларації про біоетику і права людини ЮНЕСКО, відповідних законів України (Конституції України (ст. 3, 21, 24, 28, 32), Основ законодавства України про охорону здоров’я (ст. 43.1, 44.1), Закону України «Про лікарські засоби» (ст. 7, 8).
Клінічні та параклінічні методи
Клінічне обстеження пацієнтів під час стаціонарного лікування на базі дитячого ендокринологічного відділення КНП «Дніпровська МКЛ № 9» ДМР» з аналізом та інтерпретацією отриманих клініко-анамнестичних, лабораторно-інструментальних даних було основним методом дослідження. Перелік додаткових параклінічних методів обстеження був складений згідно з наказами МОЗ України № 254 від 27.04.2006 року «Протокол надання медичної допомоги дітям, хворим на цукровий діабет» та № 864 від 07.10.2013 року «Про внесення змін до протоколу надання медичної допомоги дітям, хворим на цукровий діабет». Діагноз ЦД 1-го типу встановлювався на підставі критеріїв, запропонованих у консенсусі ISPAD 2014 року [11].
Лабораторне дослідження включало загальноклінічне обстеження, визначення С-пептиду та глікованого гемоглобіну (HbA1С), маркерів автоімунного ЦД 1-го типу за допомогою імуноферментного аналізу (ELISA) у венозній крові. Усім дітям проводилось ультразвукове дослідження органів черевної порожнини, нирок, наднирників, щитоподібної залози за допомогою апарата Siеmens Sonoline G 40 (Японія) із використанням конвекційного датчика з частотою 2,5–5 МГц при ультрасонографії органів черевної порожнини, нирок, наднирників та лінійного датчика з частотою 6–10 МГц для огляду щитоподібної залози за загальноприйнятою методикою [5, 7].
Визначення рівня глікованого гемоглобіну було виконано в лабораторії VitaLab імунотурбодиметричним методом, сертифікованим відповідно до National Glycohemoglobin Standardization Program (NGSP) та стандартизованим відповідно до референтних значень, прийнятих у Diabetes Control and Complications Trial (DCCT). Нормальним вважався рівень HbA1C 4–6 % від загального гемоглобіну у венозній крові [20]. Дослідження стійкого фрагмента ендогенно продукованого проінсуліну С-пептиду проводилось імуноферментним методом із використанням аналізатора та тест-системи Abbott із референтними значеннями, що становили 0,7–1,9 нг/мл.
Для верифікації автоімунного ЦД 1-го типу згідно з рекомендаціями Асоціації дитячих ендокринологів України проводилось визначення наявності автоантитіл до GAD, IA-2α, Zn8Т та C-кінця ТZn8 імуноферментним методом за допомогою набора Euroimmun у сертифікованій лабораторії Laboratory of Dr. Roedger, MDI (Німеччина). За даними різних авторів, методи дослідження антитіл до IA-2α і ZnT8 мають високу специфічність (100 і 97 %), але низьку чутливість (42 і 33,3 %). Метод визначення антитіл до GAD менш специфічний (70 %), але чутливість його більш висока (58,3 %) [10, 13, 14].
Для діагностики моногенних форм ЦД були використані молекулярно-генетичні методи: полімеразна реакція з ампліфікацією та геномне секвенування з використанням технології Illumina в Laboratory of Dr. Roedger, MDI (Німеччина). Діти з моногенними формами ЦД були виключені з подальшого дослідження.
Катамнестичне спостереження проводилось серед 53 осіб з автоімунним ЦД 1-го типу протягом 1 року.
Для побудови математичної моделі прогнозування ймовірності неконтрольованого перебігу автоімунного ЦД 1-го типу були сформовані 2 групи спостереження. Основну групу (n = 22) становили діти з неконтрольованим перебігом автоімунного ЦД 1-го типу, які згідно із цільовими показниками глікемічного контролю (Global IDF/ISPAD Guideline for Diabetes in Childhood and Adolescence) протягом 1 року катамнестичного спостереження мали високий ризик глікемічного контролю та рівень HbA1C понад 9 %. До контрольної групи (n = 31) увійшли пацієнти з контрольованим перебігом автоімунного ЦД 1-го типу, які мали ідеальний, оптимальний чи субоптимальний рівні глікемічного контролю та показник HbA1C менше ніж 9 %.
Статистичні методи
Для побудови прогностичної моделі застосовувалися алгоритми, засновані на теоремі Баєса (теоремі оберненої ймовірності події) та проводився послідовний (секвенціальний) аналіз Вальда методом обробки 100 клініко-анамнестичних, метаболічних, молекулярно-генетичних параметрів з обчисленням вагових діагностичних коефіцієнтів (ДК) за формулою:
де ДК — діагностичний коефіцієнт, Р1 — відносна частота ознаки в першому верифікованому стані, виражена в частках одиниці, Р2 — відносна частота ознаки в другому верифікованому стані, виражена в частках одиниці.
Критеpiй відносного ризику (ВР) розраховувався за формулою:
Інформативність кожного з діагностичних коефіцієнтів розраховувалася за формулою Кульбака [4]:
де І — інформативність діагностичного коефіцієнта, Ij — інформативність діапазону (градації) ознаки, а також за формулою:
Інформативною вважали ознаку з коефіцієнтом І ≥ 0,5 [3].
Статистичну обробку результатів проводили за допомогою Microsoft Excel (Office Home Business 2KB4Y-6H9DB-BM47K-749PV-PG3KT) та програмного продукта Statistica 6.1 (StatSoft Inc., серійний № AGAR909E415822FA). Аналіз отриманих даних з оцінкою статистичної вірогідності відмінностей проводився за допомогою пара- та непараметричних методів статистики. Критичне значення рівня статистичної значущості при перевірці усіх нульових гіпотез приймалося за 0,05 (5 %).
Результати та обговорення
За результатами дослідження контрінсулярного імуногенезу серед 100 дітей віком від 1 до 18 років із вперше діагностованим ЦД було виділено 98 (98 %) дітей з автоімунним ЦД 1-го типу та 2 (2 %) дитини з генетичними дефектами функції β-клітин: MODY 5-го типу (ген HNF1B) та синдромом Вольфрама 1-го типу (ген WFS1). Наявність різноманітного впливу на прогнозування неконтрольованого перебігу автоімунного ЦД 1-го типу в дітей вимагала його оцінювання на ранньому діагностичному етапі та протягом 1 року спостереження за сукупністю факторів.
Частка хлопчиків і дівчаток в основній та контрольній групах характеризувалась однорідним розподіленням (р > 0,05), тоді як, за результатами дослідження М. Hatio та співавт. [17], серед дітей із неконтрольованим ЦД 1-го типу домінували дівчатка (ВШ 3,39; ДІ 1,03–11,22; р = 0,045).
Спадковість
У нашому дослідженні відносний ризик ускладненого перебігу ЦД 1-го типу вірогідно частіше відмічався в осіб зі спадковою обтяженістю за автоімунною патологією взагалі (ЦД 1-го типу, автоімунний тиреоїдит, ревматоїдний артрит, целіакія): ВР = 5,64; ДК = 0,62. Згідно з даними літературних джерел, спадкова обтяженість зумовлює 40–50 % впливу на ризик виникнення автоімунного ЦД 1-го типу в пробанда [16]. Цікавим є той факт, що наявність ЦД 1-го типу в батьків пробанда рідше спостерігалась при неконтрольованому перебігу захворювання (із боку матері — ВР = 0,63; ДК = –2,03 та з боку батька — ВР = 0,6; ДК = –2,19), а з боку сибсів, навпаки, — частіше (ВР = 1,41; ДК = 1,49). Цю ситуацію можна пояснити більш ефективним контролем за перебігом ЦД та наочним прикладом з оволодіння навичкам самоконтролю для дитини з боку батьків, хворих на ЦД, ніж сибсів.
Вікові предиктори
Неконтрольований перебіг автоімунного ЦД 1-го типу відмічався частіше при дебюті захворювання в дітей віком 1–4 роки або понад 6 років (ВР = 1,41; ДК = 1,49), а саме в 10–12 років (ВР = 1,97; ДК = 2,95), тоді як найнижча вірогідність неконтрольованого перебігу спостерігалась у віці 4–6 років (ВР = 0,26; ДК = –5,91).
Соціальні предиктори
У дітей, які проживали в сільській місцевості, вірогідно частіше спостерігався неконтрольований перебіг автоімунного ЦД (ВР = 1,57; ДК = 1,94), ніж у міських жителів, що, ймовірно, пояснюється відносною віддаленістю спеціалізованої ендокринологічної допомоги та, згідно з результатами дослідження М. Michalska та співавт. [26], сильним кореляційним зв’язком (r = 2,396, р < 0,001) між концентрацією газоподібних забруднюючих речовин і твердих частинок в атмосферному повітрі (ТМ10) при використанні твердого палива, такого як вугілля і деревина, в домашніх господарствах.
Перинатальні чинники
За нашими даними, перебіг вагітності та черговість народження дитини від певної вагітності матері не асоціювались зі ступенем глікемічного контролю в разі маніфестації ЦД 1-го типу. У той же час народження дитини з масою тіла понад 4000 г (макросомія) було пов’язано з неконтрольованим перебігом наразі виникнення захворювання в дітей старше 6 років (ВР = 3,29; ДК = 5,17), що збігається з результатами дослідження R.R. Goldacre [16] із залученням 3,8 млн британських дітей. Було доведено, що діти, які народилися з масою тіла 4000 г після корекції гестаційного віку, мали більш високу захворюваність на ЦД 1-го типу, ніж діти, які народилися із середньою масою тіла (3000–3500 г): ВШ 1,23; 95% ДІ 1,03–1,23 і ВШ 1,16; 95% ДІ 1,02–1,31 відповідно, що вказує на статистично значиму тенденцію (р < 0,001). Гіпотеза передбачає, що збільшення маси тіла при народженні призводить до інсулінорезистентності в ранньому дитинстві і може викликати автоімунний процес в острівцях Лангерганса, що в кінцевому підсумку призведе до ЦД 1-го типу.
Нутритивні особливості
Грудне вигодовування в перші 6 місяців життя було частіше серед дітей контрольної групи спостереження (ВР = 1,02; ДК = 0,2), що пояснюється вірогідним зменшенням ризику активації автоантитіл до GAD під час введення першого злакового прикорму в цьому віковому періоді [28]. Відсутність дотримання режиму харчування на першому році життя збігалася з ризиком неконтрольованого перебігу ЦД 1-го типу після 6-річного віку (ВР = 1,18; ДК = 0,73).
Порушення фізичного розвитку
Неконтрольований перебіг автоімунного ЦД 1-го типу частіше відмічався в дітей з порушеннями фізичного розвитку: як при низькорослості (ВР = 2,82; ДК = 4,5), так і високорослості (ВР = 4,23; ДК = 6,26) та дефіциті маси тіла (ВР = 4,23; ДК = 6,26). До факторів ризику формування ЦД 2-го типу більшою мірою належить ожиріння [1, 2, 8, 9].
Перенесені інфекційні захворювання
У нашому дослідженні був виявлений високий відносний ризик ускладненого перебігу ЦД 1-го типу на тлі перенесеної скарлатини (ВР = 4,23; ДК = 6,26), грипу за 1 рік до маніфестації гіперглікемії (ВР = 6,34; ДК = 8,02) та частих гострих респіраторних вірусних інфекцій (ГРВІ) у перші 6 місяців життя (ВР = 2,01; ДК = 3,04), хронічних вогнищ інфекції (ВР = 2,11; ДК = 3,25), що свідчить про доцільність контролю над бактеріоносійством Streptococcus pyogenes, сезонної, у тому числі специфічної, профілактики ГРВІ саме серед дітей групи ризику. Згідно з літературним оглядом М. Rewers та J. Ludvigsson [28], бактеріальні інфекції не пов’язані з імуноопосередкованим запаленням у підшлунковій залозі, при якому найбільше значення надається вірусу червінки та персистуючій ентеровірусній інфекції. У той же час у багатьох проспективних дослідженнях повідомлялося про значне збільшення ризику автоімунного процесу в острівцях підшлункової залози серед дітей із більш частими респіраторними інфекціями протягом перших 6 місяців життя, асоціація була слабшою для перенесених ГРВІ у віці 6–12 місяців і відсутньою для осіб старше 1 року, що відповідає отриманим нами результатам [11].
Супутні захворювання
Неконтрольований перебіг автоімунного ЦД 1-го типу частіше спостерігався в дітей із супутньою серцево-судинною патологією (ВР = 5,64; ДК = 7,5), нирковими захворюваннями (ВР = 2,82; ДК = 4,5) та захворюваннями травного тракту (ВР = 1,41; ДК = 1,49). Отримані дані збігаються з результатами попередніх досліджень M.T. Jensen та співавт., які наголошують на використанні результатів ехокардіографічного обстеження для прогнозування ЦД 1-го типу [21]. Захворюваність на хронічний автоімунний тиреоїдит однаковою за значимістю мірою асоціювалась із ймовірністю неконтрольованого перебігу автоімунного ЦД незалежно від типу тиреоїдного статусу з ідентичними показниками (ВР = 2,82 та ДК = 4,5). Наявність алергологічної патології пов’язувалась із неконтрольованим перебігом ЦД 1-го типу (ВР = 1,81; ДК = 2,58). Початкові ознаки ретинопатії під час дебюту захворювання вірогідно частіше спостерігались серед дітей основної групи (ВР = 2,76; ДК = 4,41). Наявність супутньої гінекологічної патології в дівчат асоціювалась із неконтрольованим перебігом ЦД 1-го типу (ВР = 1,5; ДК = 1,76).
Особливості клінічного перебігу
У пацієнтів із неконтрольованим перебігом автоімунного ЦД 1-го типу відмічався значно подовжений термін (понад 1 місяць) між появою перших симптомів захворювання та первинним зверненням за медичною допомогою (ВР = 2,11; ДК = 3,25). При цьому первинна госпіталізація в пацієнтів із подальшим неконтрольованим перебігом ЦД 1-го типу частіше відбувалась у дитяче реанімаційне відділення у зв’язку з наявністю порушень функціонування життєво важливих органів (ВР = 1,1; ДК = 1,49), що, ймовірно, пояснюється не лише низьким ступенем відповідальності батьків за здоров’я дітей, бар’єром «неприйняття хвороби», а й з латентністю клінічних проявів. Цікавим є той факт, що в цих пацієнтів при дебюті захворювання частіше були відсутніми такі типові симптоми, як поліурія, полідипсія, слабкість (ВР = 0,97; ДК = –0,12). У той же час прогностично несприятливий фактор рівня контролю ЦД 1-го типу після 6-річного віку був зумовлений наявністю глюкозурії (ВР = 1,18; ДК = 0,73) та пов’язаного з нею енурезу (ВР = 1,28; ДК = 1,08).
Параклінічні предиктори
При біохімічному дослідженні крові гіперглікемія при маніфестації захворювання понад 23 ммоль/л була пов’язана з неконтрольованим перебігом ЦД 1-го типу (ВР = 1,41; ДК = 1,49). Рівень глікованого гемоглобіну при дебюті захворювання більше ніж 8 % асоціювався з незадовільним прогнозом захворювання (ВР = 2,75; ДК = 4,39). Низький рівень С-пептиду (менше ніж 1,18 нг/мл) поєднувався з ускладненим перебігом автоімунного ЦД 1-го типу (ВР = 1,16; ДК = 0,66), що збігалося з результатами інших досліджень [10, 14, 24].
Гіпопротеїнемія менше ніж 59,67 г/л (ВР = 2,11; ДК = 3,25), зниження лужної фосфатази менше 327,33 Од/л (ВР = 1,24; ДК = 2,87), підвищення сечовини понад 4,33 ммоль/л (ВР = 1,61; ДК = 2,07) та аланінамінотрансферази понад 39,33 Од/л (ВР = 8,45; ДК = 9,27) асоціювалося з неконтрольованим перебігом ЦД 1-го типу.
Зміни внутрішніх органів, що візуалізувались при ультразвуковому дослідженні, вірогідно частіше визначались у дітей основної групи з неконтрольованим перебігом ЦД 1-го типу у вигляді гепатозу (ВР = 1,69; ДК = 2,28) та порушень структури нирок (ВР = 1,31; ДК = 1,18).
Ризик розвитку залежно від таргетної молекули сприйнятливості до автоімунної агресії
За результатами нашого дослідження, найбільшого значення як маркерів неконтрольованого перебігу автоімунного інсуліту набули антитіла до GAD (ВР = 1,35; ДК = 1,29), що підтвердило результати дослідження H.B. Mortensen та співавт. [27]. Підвищення рівня антитіл під час первинної діагностики ЦД 1-го типу до GAD понад 673 Од/мл поєднувалося з неконтрольованим перебігом ЦД 1-го типу з ВР = 1,41 та ДК = 1,49 у віці понад 6 років. Підвищення антитіл до IA-2α в дебюті захворювання, за даними літератури, віддзеркалює агресивну деструкцію β-клітин підшлункової залози та більш характерне для дитячого, ніж дорослого, віку й, згідно з даними нашої науково-дослідної роботи, при значеннях, що перевищують 1336,6 Од/мл,
асоціювалось з ускладненим перебігом (ВР = 1,19; Д = 0,74). При маніфестації хвороби виявлення антитіл до ZnT8 серед дітей основної групи спостереження понад 25,3 Од/мл було пов’язане з несприятливим перебігом ЦД 1-го типу з ВР = 1,17 та ДК = 0,7. Наявність антитіл до С-кінця ZnT8 зі значенням, вищим від 54,3 Од/л, асоціювалась із несприятливим прогнозом із ВР = 2,11 та ДК = 3,25. За даними попередніх досліджень, у пацієнтів із ЦД 1-го типу антитіла до GAD визначались у 64–75 %, до IA2α — у 61–77 %, до ZnT8 — у 61–80 % випадків [17, 18, 24, 27]. Антитіла до хоча б одного з трьох представлених антигенів визначаються приблизно у 86 % пацієнтів із дебютом ЦД [30].
Алгоритм побудови прогностичної моделі включав такі етапи:
— обчислення вагових ДК із використанням послідовного аналізу Вальда та визначення коефіцієнта інформативності Кульбака (І) [4] для кожного фактора;
— відбір факторів із достатньою інформативністю (І ≥ 0,5) [4] та складання прогностичної таблиці, у яку включали тільки ті ознаки, що мали достатню інформативність;
— розрахунок сумарного бала діагностичних коефіцієнтів (ΣДК) для кожного спостереження;
— визначення параметрів логістичної регресії за сумарними балами та розрахунок теоретичної ймовірності неконтрольованого перебігу автоімунного ЦД 1-го типу в дітей для кожного спостереження;
— розробка шкали оцінки ймовірності неконтрольованого перебігу автоімунного ЦД 1-го типу в дітей за сумою балів;
— оцінка розробленої прогностичної моделі за таблицями спряженості ознак з аналізом передбачуваної цінності позитивного і негативного результатів.
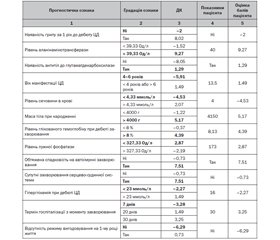
Ранжування за коефіцієнтом інформативності Кульбака (І) показало, що перші місця серед чинників, що прогнозують неконтрольований прогноз автоімунного ЦД 1-го типу в дітей на ранньому діагностичному етапі, посідають: наявність грипу в анамнезі за 1 рік до дебюту ЦД (І = 1,73), підвищення аланінамінотрансферази (І = 1,27), наявність антитіл до глутаматдекарбоксилази (І = 1,14), маніфестація ЦД у віці 1–4 роки або понад 6 років (І = 0,98), підвищення сечовини крові (І = 0,86), макросомія при народженні (І = 0,71), підвищення глікованого гемоглобіну понад 8 % при дебюті захворювання (І = 0,7), зниження лужної фосфатази (І = 0,66), обтяжена спадковість за автоімунними захворюваннями (І = 0,62), супутні захворювання серцево-судинної системи (І = 0,61), гіперглікемія понад 23 ммоль/л (І = 0,56), затримка госпіталізації дитини понад 1 місяць від маніфестації ЦД 1-го типу (І = 0,54), відсутність режиму вигодовування на 1-му році життя (І = 0,52), глюкозурія (І = 0,52), часті гострі респіраторні інфекції в анамнезі (І = 0,52), гіпопротеїнемія (І = 0,51), наявність хронічних вогнищ інфекції (І = 0,5). Низька прогностична інформативність (0,5 > I ≥ 0,20) встановлена: для наявності антитіл до С-кінця ZnT8 (І = 0,4), високорослості (І = 0,35), дефіциту маси тіла (І = 0,35). Ці чинники було вилучено з прогностичної таблиці.
На підставі проведеного аналізу для побудови моделі прогнозування ймовірності неконтрольованого перебігу автоімунного ЦД у дітей було відібрано 17 факторів зі статистично значущим (р < 0,05) впливом на результат. Усі ознаки в прогностичній таблиці розміщені в порядку зменшення їх інформативності. Знак плюс біля діагностичного коефіцієнта свідчить на користь виникнення неконтрольованого перебігу ЦД 1-го типу, знак мінус — на користь його відсутності (табл. 1).
/11.jpg)
Для діагностики (прогнозу) захворювання з використанням ДК виконується послідовна процедура шляхом підсумування діагностичних (прогностичних) коефіцієнтів, що відповідають виявленим у пацієнта ознакам до моменту досягнення діагностичного порогу. Вибір діагностичних порогів (суми діагностичних коефіцієнтів), що дозволяють спрогнозувати появу патології, проводять із використанням похибок 1-го та 2-го типу і для досягнення 95% вірогідності безпомилкового прогнозу орієнтуються на діапазон ∑ДК ≥ 17,0 (прогнозується наявність патології) або ∑ДК ≤ 17,0 (прогнозується відсутність патології). Відповідно для досягнення 99% вірогідності безпомилкового прогнозу орієнтуються на діапазон відповідно ∑ДК ≥ 20,0 та ∑ДК ≤ –20,0. Якщо сума була в межах між визначеними діагностичними порогами, робиться висновок про недостатність наявної інформації для прийняття рішення із заданим рівнем помилок [4, 20].
Використовувати розроблену модель прогнозування неконтрольованого перебігу автоімунного ЦД 1-го типу в дітей можна за зазначеним вище принципом роботи, що вважається класичними підходом. Тоді підсумовування балів для кожного пацієнта може закінчуватися при досягненні певного граничного значення ∑ДК без включення в загальну суму визначеної кількості прогностичних коефіцієнтів.
Як приклад використання моделі прогнозування вірогідності неконтрольованого перебігу автоімунного ЦД 1-го типу наводимо клінічну ситуацію: хворий Сергій С., 13 років 5 місяців, перебував у реанімаційному відділенні з приводу цукрового діабету, вперше виявленого, тяжкого перебігу, діабетичного кетоацидозу ІІІ ст., на сьогодні переведений в ендокринологічне відділення. З моменту дебюту захворювання до госпіталізації пройшло 1,5 місяця. При огляді: зріст — 1,62 м, маса тіла — 46 кг. З анамнезу відомо: дитина від першої фізіологічної вагітності, маса тіла при народженні — 4150 г. Штучне вигодовування з народження. Спадковість за ЦД необтяжена, у матері хронічний автоімунний тиреоїдит. Диспансерне спостереження в отоларинголога з приводу хронічного тонзиліту (за 1 рік до дебюту ЦД 4 випадки ГРВІ), у гастроентеролога — з приводу хронічного гастродуоденіту. На інфекційні захворювання не хворів. Порушень вікових норм ініціації пубертатного періоду не відмічалось. При обстеженні: глюкоза крові — 16 ммоль/л, у загальному аналізі сечі — глюкозурія. У біохімічному аналізі крові: креатинін — 65 мкмоль/л, аланінамінотрансфераза — 40 Од/л, лужна фосфатаза — 173 Од/л, загальний білок — 40 г/л, сечовина — 4 ммоль/л. Глікований гемоглобін — 8,13 %, С-пептид — 0,8 нг/мл, антитіла до GAD — 680 Од/мл (табл. 2).
/12.jpg)
/13.jpg)
Обравши діагностично значимі показники для пацієнта Сергія С., 13 років 5 місяців (табл. 2), ми отримали загальне діагностичне значення 29,69 бала, що відповідає дуже високій ймовірності неконтрольованого перебігу автоімунного ЦД 1-го типу. Наявність несприятливого перебігу ЦД 1-го типу була підтверджена вимірюванням глікованого гемоглобіну через 1 рік катамнестичного спостереження, що становив 9,1 % (І = 5,25; ВР = 2,62; ДК = 4,19).
Показники ефективності запропонованої нами математичної моделі прогнозування при використанні із залученням 53 пацієнтів становили: тест прогнозування негативного результату — 86,1 %. Частка правильного передбачення фактичної приналежності пацієнта до тієї чи іншої групи (має несприятливий перебіг автоімунного ЦД 1-го типу чи ні) становила 87,9 %, шо вказує на високу узгодженість реального розподілу спостережень за наявністю неконтрольованого перебігу автоімунного ЦД 1-го типу та розподілу на підставі прогностичної моделі.
Висновки
1. ЦД 1-го типу в більшості (98 %) дітей був обумовлений автоімунним пошкодженням острівцевого апарату підшлункової залози та лише у 2 % випадків був пов’язаний із генетичними моногенними порушеннями. Високий рівень автоімунного пошкодження підшлункової залози для прогнозу перебігу та персоніфікованого лікування автоімунного ЦД 1-го типу, особливо у хворих із вперше діагностованим захворюванням, потребує визначення специфічних автоантитіл. При отриманні негативних результатів рекомендоване подальше скерування для молекулярно-генетичного обстеження з метою виключення моногенних форм ЦД.
2. Факторами ризику розвитку неконтрольованого перебігу автоімунного ЦД 1-го типу з достатньо інформативною прогностичною значимістю (І ≥ 0,5) є: наявність грипу в анамнезі за 1 рік до дебюту ЦД (І = 1,73), підвищення аланінамінотрансферази (І = 1,27), наявність антитіл до глутаматдекарбоксилази (І = 1,14), маніфестація ЦД у віці 1–4 роки або понад 6 років (І = 0,98), підвищення сечовини крові (І = 0,86), макросомія при народженні (І = 0,71), підвищення глікованого гемоглобіну понад 8 % при дебюті захворювання (І = 0,7), зниження лужної фосфатази (І = 0,66), обтяжена спадковість за автоімунними захворюваннями (І = 0,62), супутні захворювання серцево-судинної системи (І = 0,61), гіперглікемія понад 23 ммоль/л (І = 0,56), затримка госпіталізації дитини понад 1 місяць від маніфестації ЦД 1-го типу (І = 0,54), відсутність режиму вигодовування на 1-му році життя (І = 0,52), глюкозурія (І = 0,52), часті гострі респіраторні інфекції в анамнезі (І = 0,52), гіпопротеїнемія (І = 0,51), наявність хронічних вогнищ інфекції (І = 0,5; р < 0,05).
3. Найбільш частою причиною автоімунного пошкодження підшлункової залози, що зустрічається в дітей із неконтрольованим перебігом автоімунного ЦД 1-го типу, є підвищення автоантитіл до GAD.
4. Розроблена математична таблиця дозволяє прогнозувати неконтрольований перебіг автоімунного ЦД 1-го типу в дітей та формувати групи, які потребують особливого спостереження.
Конфлікт інтересів: автори повідомляють про відсутність конфлікту інтересів при підготовці даної статті.
/8.jpg)
/8_4.jpg)
/8_2.jpg)
/8_3.jpg)

/11.jpg)
/12.jpg)
/13.jpg)