Журнал «Здоровье ребенка» Том 15, №2, 2020
Вернуться к номеру
Аналіз структури та антибіотикорезистентності етіологічно значущих патогенів хронічної інфекції нижніх дихальних шляхів у дітей із муковісцидозом, які мешкають у м. Дніпрі
Авторы: Ільченко С.І., Фіалковська А.О., Скрябіна К.В.
ДЗ «Дніпропетровська медична академія МО3 України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
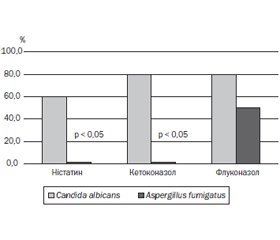
Актуальність. Хронічне інфекційне запалення нижніх дихальних шляхів, що формується на основі генетичного дефекту вже в перші роки життя, є ключовим фактором у хворих на муковісцидоз (МВ) та визначає прогноз захворювання. Спектр мікроорганізмів, що ідентифікуються з нижніх дихальних шляхів, є досить специфічним для МВ, але існують динамічні зміни, регіональні відмінності за фенотипами та чутливістю до антибіотиків. Мета дослідження — моніторинг результатів мікробіологічного дослідження мокротиння дітей м. Дніпра, хворих на МВ, для визначення особливостей місцевого профілю збудників, їх чутливості до антибіотиків і змін спектра за період із 2008 по 2019 рік. Матеріали та методи. Обстежені 37 дітей із МВ віком від 1 до 18 років. Усім хворим на МВ було проведено мікробіологічне дослідження мокротиння з визначенням видової належності виділених штамів бактерій і чутливості до антибіотиків. Також проаналізовано 1257 результатів мікробіологічного дослідження мокротиння хворих на МВ — мешканців Дніпропетровської області за 2008–2018 роки. Результати. Виявлено, що за останні 10 років у структурі етіологічно значущих патогенів хронічної інфекції нижніх дихальних шляхів у дітей із муковісцидозом спостерігається поступове збільшення частки Staphylococcus aureus та Pseudomonas aeruginosa при зменшенні поширеності Haemophilus influenzae. Серед грибів частіше висіваються Candida albicans та Aspergillus fumigatus. Установлено, що більшість виділених штамів Staphylococcus aureus були резистентними до дії незахищених амінопеніцилінів, карбоксипеніцилінів, цефалоспоринів I та II генерацій. Мукоїдні штами Pseudomonas aeruginosa характеризувалися досить високим рівнем антибіотикорезистентності до захищених цефалоспоринів III та IV генерацій, фторхінолонів. Висновки. За період спостереження з 2008 по 2019 рік видовий склад мікробіоти дихальних шляхів у дітей із муковісцидозом у м. Дніпрі не змінився, проте істотно змінилося співвідношення мікроорганізмів, що висіваються. Staphylococcus aureus та Pseudomonas aeruginosa залишаються провідними патогенами інфекцій нижніх дихальних шляхів у хворих на МВ, однак відмічається зростання резистентності вказаних патогенів до сучасних антибактеріальних препаратів. Визначення рівня резистентності мікроорганізмів у конкретного хворого сприяє адекватному підбору антибактеріальних препаратів для лікування загострень хронічної бронхолегеневої інфекції відповідно до розроблених протоколів лікування і перешкоджає селекції стійких штамів мікроорганізмів.
Актуальность. Хроническое инфекционное воспаление нижних дыхательных путей, которое формируется на основе генетического дефекта уже в первые годы жизни, является ключевым фактором у больных муковисцидозом (МВ) и определяет прогноз заболевания. Спектр микроорганизмов, которые идентифицируются в нижних дыхательных путях, является весьма специфическим для МВ, но существуют динамические изменения, региональные различия по фенотипам и чувствительности к антибиотикам. Цель исследования — мониторинг результатов микробиологического исследования мокроты детей г. Днепра, больных МВ, для определения особенностей местного профиля возбудителей, их чувствительности к антибиотикам и изменений спектра за период с 2008 по 2019 год. Материалы и методы. Обследованы 37 детей с МВ в возрасте от 1 до 18 лет. Всем больным МВ было проведено микробиологическое исследование мокроты с определением видовой принадлежности выделенных штаммов бактерий и чувствительности к антибиотикам. Также проанализированы 1257 результатов микробиологического исследования мокроты больных МВ — жителей Днепропетровской области за 2008–2018 годы. Результаты. Выявлено, что за последние 10 лет в структуре этиологически значимых патогенов хронической инфекции нижних дыхательных путей у детей с муковисцидозом наблюдается постепенное увеличение доли Staphylococcus aureus и Pseudomonas aeruginosa при уменьшении распространенности Haemophilus influenzae. Установлено, что большинство выделенных штаммов Staphylococcus aureus были резистентными к действию незащищенных аминопенициллинов, карбоксипенициллинов, цефалоспоринов I и II генераций. Мукоидные штаммы Pseudomonas aeruginosa характеризовались достаточно высоким уровнем антибиотикорезистентности к защищенным цефалоспоринам III и IV поколений, фторхинолонам. Выводы. За период наблюдения с 2008 по 2019 год видовой состав микробиоты дыхательных путей у детей с МВ в г. Днепре не изменился, однако существенно изменилось соотношение высеваемых микроорганизмов. Staphylococcus aureus и Pseudomonas aeruginosa остаются ведущими патогенами инфекций нижних дыхательных путей у больных МВ, однако отмечается рост резистентности указанных патогенов к современным антибактериальным препаратам. Определение уровня резистентности микроорганизмов у конкретного больного способствует адекватному подбору антибактериальных препаратов для лечения обострений хронической бронхолегочной инфекции в соответствии с разработанными протоколами лечения и препятствует селекции устойчивых штаммов микроорганизмов.
Background. Chronic infectious inflammation of the lower respiratory tract, which is formed on the basis of a genetic defect in the first years of life, is a key factor in patients with cystic fibrosis (CF) and determines the prognosis of the disease. The spectrum of microorganisms that are identified from the lower respiratory tract is very specific for CF, but there are dynamic changes, regional differences in phenotypes and sensitivity to antibiotics. The purpose of the study was to monitor the results of a microbiological study of sputum in children from Dnipro with CF, to determine the characteristics of the local profile of pathogens, their sensitivity to antibiotics and spectrum changes for the period from 2008 to 2019. Materials and methods. The study involved 37 children with CF aged 1 to 18 years. All patients with CF underwent a microbiological examination of sputum with a determination of the species of the isolated bacterial strains and sensitivity to antibiotics. There were also analyzed 1257 results of a microbiological study of sputum in patients with CF — residents of the Dnipropetrovsk region for 2008–2018. Results. It has been revealed that over the past 10 years in the structure of etiologically significant pathogens of chronic lower respiratory tract infection in children with CF, a gradual increase in the share of Staphylococcus aureus and Pseudomonas aeruginosa has been observed with a decrease in the prevalence of Haemophilus influenzae. Candida albicans and Aspergillus fumigatus were sown more often that other fungi. It was established that most of the isolated strains of Staphylococcus aureus were resistant to unprotected aminopenicillins, carboxypenicillins, first- and second-generation cephalosporins. The mucoid strains of Pseudomonas aeruginosa were characterized by a fairly high level of antibiotic resistance to protected third- and fourth-generation cephalosporins, fluoroquinolones. Conclusions. For the observation period from 2008 to 2019, the species composition of the microbiota of the respiratory tract in children with CF in Dnipro did not change, but the ratio of microorganisms sown was significantly changed. Staphylococcus aureus and Pseudomonas aeruginosa remain the leading pathogens of lower respiratory tract infections in patients with CF; however, an increase in the resistance of these pathogens to modern antibacterial drugs is noted. Determining the level of resistance of microorganisms in a particular patient contributes to the adequate selection of antibacterial drugs for the treatment of exacerbations of chronic bronchopulmonary infection in accordance with the developed treatment protocols and prevents the selection of resistant strains of microorganisms.
антибіотикорезистентність; муковісцидоз; мікробіота нижніх дихальних шляхів
антибиотикорезистентность; муковисцидоз; микробиота нижних дыхательных путей
antibiotic resistance; cystic fibrosis; microbiota of the lower respiratory tract
Вступ
Матеріали та методи
Результати
/18.jpg)
Обговорення
Висновки
- Ільченко С.І., Іванусь С.Г. Сучасні проблеми діагностики та особливості клінічного перебігу муковісцидозу у хворих дітей міста Дніпропетровська. Молодий вчений. 2014. № 6(09). С. 148-152.
- Ільченко С.І. Клініко-мікробіологічні особливості перебігу муковісцидозу у дітей великого промислового міста. Патологія. 2014. № 3(32). С. 73-77.
- Поликарпова С.В., Кондратьева Е.И., Шабалова Л.А. и др. Микрофлора дыхательных путей у больных муковисцидозом и чувствительность к антибиотикам. Медицинский совет. 2016. № 15. С. 84-89. DOI: 10.21518/2079-701X-2016-15-84-89.
- Клинические рекомендации (проект). Кистозный фиброз (муковисцидоз): микробиологическая диагностика хронической респираторной инфекции. 2018. 141 c. URL: http://www.antibiotic.ru/minzdrav/files/docs/clrec-cystic-fibrosis-2018-project.pdf
- Surette M.G. The cystic fibrosis lung microbiome. Ann. Am. Thorac. Soc. 2014, Jan 11. Suppl 1. Р. 61-5. DOI: 10.1513/AnnalsATS.201306-159MG.
- Frayman K.B., Armstrong D.S., Carzino R. et al. The lower airway microbiota in early cystic fibrosis lung disease: a longitudinal analysis. Thorax. 2017. 72(12). Р. 1104-1112. DOI: 10.1136/thoraxjnl-2016-209279.
- Sarath C. Ranganathan, Graham L. Hall, Peter D. Sly, Stephen M. Stick. Early Lung Disease in Infants and Preschool Children with Cystic Fibrosis. What Have We Learned and What Should We Do about It? Am. J. Respir. Crit. Care Med. 2017. 195(12). Р. 1567-1575. DOI: 10.1164/rccm.201606-1107CI.
- Кондратенко О.В., Лямин А.В., Жестков А.В. Структура и антибиотикорезистентность микрофлоры, выделенной из нижних дыхательных путей у пациентов с муковисцидозом в г. Самаре. Практическая медицина. 2012. № 1(56). С. 85-88.
- Шабалова Л.А., Поликарпова С.В., Пивкина Н.В. и др. Опыт применения колистиметата натрия (колистина) при синегнойной инфекции у детей с муковисцидозом. Педиатрия. Журнал им. Г.Н. Сперанского. 2016. № 6. С. 85-88.
- Абатуров А.Е., Крючко Т.А., Пода О.А., Никулина А.А. Синегнойная инфекция у детей: Монография. Хмельницкий: ФЛП Сторожук, 2017. 224 с.
- Горбунов В.А., Пугач В.В., Шишпоренок Ю.А. и др. Микробиологическая характеристика возбудителей респираторных инфекций, выявленных у пациентов с муковисцидозом на территории Республики Беларусь. Иммунопатология, аллергология, инфектология. 2018. № 1. С. 56-61.
- Чернуха М.Ю., Аветисян Л.Р., Шагинян И.А. и др. Фенотипические и генотипические особенности штаммов бактерий Burkholderia cepacia complex, выделенных от больных муковисцидозом. Педиатрия. Журнал им. Г.Н. Сперанского. 2014. № 93(4). С. 24-31.
- Афанасьева М.В., Красовский С.А., Амелина Е.Л. и др. Выживаемость взрослых больных муковисцидозом с хронической инфекцией респираторного тракта, обусловленной микроорганизмами Burkholderia cepacia complex. Практическая пульмонология. 2018. № 1. С. 60-64.
- European Cystic Fibrosis Society Patient Registry 2017. Annual Data Report. Ver. 1. 2019. URL: www.ecfs.eu. Accessed: 2020, January 27.
- Леженко Г.О., Абатуров О.Є., Пашкова О.Є. та ін. Патогенетичне значення антимікробних пептидів у реалізації антибактеріального захисту у дітей, хворих на муковісцидоз. Здоровье ребенка. 2013. № 3(46). С. 44-49.
- Шагинян И.А., Чернуха М.Ю., Аветисян Л.Р. и др. Эпидемиологические особенности хронической инфекции легких у больных муковисцидозом. Эпидемиология и вакцинопрофилактика. 2017. № 6(97). С. 5-13.
- Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Муковісцидоз»: Наказ МОЗ України № 723 від 15.07.2016 р. Київ: МОЗ України, 2016.
- Cystic Fibrosis Foundation, Patient Registry 2018 Annual Data Report, Cystic Fibrosis Foundation, Bethesda, Md, USA, 2019. URL: www.cff.org. Accessed: 2020, January 30.
- Canadian Cystic Fibrosis Patient Data Registry Report 2018. Published: December 2019. URL: www.cysticfibrosis.ca. Accessed 2020, January 30.
- Бурова Л.М., Бурова Є.Д. Антибіотикочутливість клінічних ізолятів Pseudomonas aeruginosa. Інфекційні хвороби. № 3(85). 2016. С. 74-77.
- Aktaş Z., Satana D., Kayacan C. et al. Antibiotic susceptibility rates and beta-lactam resistance mechanisms of Pseudomonas aeruginosa strains. Mikrobiyol. Bul. 2012. 3(46). Р. 386-397.
- Іщенко О.В., Юхименко А.О., Кошова І.П., Ільченко С.І., Степанський Д.О. Біоплівкоутворюючі властивості клінічних ізолятів Pseudomonas aeruginosa, виділених від дітей хворих на муковісцидоз, та можливості впливу Bacillus subtilis на них in vitro. Морфологія. 2019. Т. 13. № 3. С. 40-47.

/18_2.jpg)
/19.jpg)