Журнал «Здоровье ребенка» Том 15, №2, 2020
Вернуться к номеру
Особливості застосування пробіотиків при антибіотикоасоційованій діареї в дітей
Авторы: Няньковський С.Л.(1), Няньковська О.С.(1), Яцула М.С.(1), Городиловська М.І.(1), Томків Я.В.(2), Вівчарівська Г.З.(2), Шайдич В.Д.(2), Горайська О.М.(2), Заставна Л.В.(2), Томків З.В.(1)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — Комунальне некомерційне підприємство «Міська дитяча клінічна лікарня м. Львова», м. Львів, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
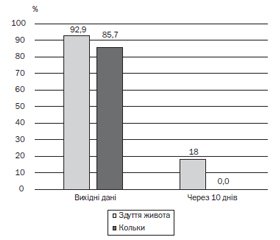
Антибіотикоасоційована діарея (ААД) виникає тоді, коли антибіотик порушує екологію мікробіоти кишечника, змінюючи різноманітність і кількість бактерій у ньому. Ці зміни можуть вплинути на здатність резидентної мікробіоти протистояти вторгненню патогенних мікроорганізмів або зростанню умовно-патогенних видів, що ендогенно присутні в мікробіомі. Тому AAД може призвести до тривалої госпіталізації, збільшення витрат і погіршення якості життя. Діарея найчастіше пов’язана із застосуванням антибіотиків широкого спектра дії. Пробіотики — це «живі мікроорганізми, які при застосуванні в достатній кількості дають користь здоров’ю хазяїна». Численні клінічні дослідження вивчають ефективність Lactobacillus rhamnosus GG для запобігання ААД. Метою роботи було вивчити ефективність застосування препарату Пробіолог Бейбі у дітей віком від 4 міс. до 9 років життя з діагнозом антибіотикоасоційованої діареї, а також дослідити його вплив на дисбіотичні зміни кишок. Під нашим спостереженням перебували 28 дітей віком від 4 міс. до 9 років (середній вік 4,6 ± 1,9 року) з діагнозом антибіотикоасоційованої діареї, серед них 57 % хлопчиків і 43 % дівчаток. Діти отримували Пробіолог Бейбі по 1 стіку на день протягом 10 днів. Через 10 днів лише у 2 дітей (7,2 %) були скарги на діарею проти 100 % на початку спостереження. Застосування штаму Lactobacillus rhamnosus GG (АТСС 53103) у дітей з антибіотикоасоційованою діареєю сприяє зменшенню діареї, кольок, здуття живота, нудоти, блювання, неспокою і поганого сну. Беручи до уваги комплексний вплив штаму Lactobacillus rhamnosus GG, можна стверджувати, що Пробіолог Бейбі збільшує рівень біфідобактерій і лактобактерій у випорожненнях, а також зменшує ріст грибків роду Candida й патогенної кишкової флори.
Антибиотикоассоциированная диарея (ААД) возникает тогда, когда антибиотик нарушает экологию микробиоты кишечника, изменяя разнообразие и количество бактерий в нем. Эти изменения могут повлиять на способность резидентной микробиоты противостоять вторжению патогенных микроорганизмов или росту условно-патогенных видов, которые эндогенно присутствуют в микробиоме. Поэтому AAД может привести к длительной госпитализации, увеличению расходов и ухудшению качества жизни. Диарея чаще всего связана с применением антибиотиков широкого спектра действия. Пробиотики — это «живые микроорганизмы, которые при применении в достаточном количестве приносят пользу здоровью хозяина». Многочисленные клинические исследования изучают эффективность Lactobacillus rhamnosus GG для предотвращения ААД. Целью работы было изучить эффективность применения препарата Пробиолог Бейби у детей в возрасте от 4 мес. до 9 лет жизни с диагнозом антибиотикоассоциированной диареи, а также исследовать его влияние на дисбиотические изменения кишечника. Под нашим наблюдением находилось 28 детей в возрасте от 4 мес. до 9 лет (средний возраст — 4,6 ± 1,9 года) с диагнозом антибиотикоассоциированной диареи, среди них 57 % мальчиков и 43 % девочек. Дети получали Пробиолог Бейби по 1 стику в день в течение 10 дней. Через 10 дней только у 2 детей (7,2 %) были жалобы на диарею против 100 % в начале наблюдения. Применение штамма Lactobacillus rhamnosus GG (АТСС 53103) у детей с антибиотикоассоциированной диареей способствует уменьшению диареи, колик, вздутия живота, тошноты, рвоты, беспокойства и плохого сна. Принимая во внимание комплексное воздействие штамма Lactobacillus rhamnosus GG, можно утверждать, что Пробиолог Бейби увеличивает уровень бифидобактерий и лактобактерий в кале, а также уменьшает рост грибов рода Candida и патогенной кишечной флоры.
Antibiotic-associated diarrhea arises when the antibiotic disrupts the ecology of the intestinal microbiota, by altering the diversity and number of bacteria in the gut. These changes can affect the capacity of the resident microbiota to resist the invasion of pathogenic microorganisms or the overgrowth of opportunistic pathogens species that are endogenously present in the microbiome. Therefore, antibiotic-associated diarrhea may result in prolonged hospitalization, increased health care costs and other complications. Diarrhea is most frequently associated with the use of broad-spectrum antibiotics. Probiotics are “live microorganisms that, when administered in adequate amounts, confer a health benefit on the host”. Numerous clinical researches evaluate the efficacy of Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhea. The aim of our research was to study the efficacy of the probiotic Probiolog Baby in children aged from 4 months to 9 years with antibiotic-associated diarrhea, and to investigate its effect on dysbiotic bowel changes. We observed 28 children aged from 4 months to 9 years (average age 4.6 ± 1.9 years) with antibiotic-associated diarrhea, including 57 % of boys and 43 % of girls. The children received the probiotic Probiolog Baby — 1 stick daily for 10 days. In 10 days, only 2 children (7.2 %) had complaints about diarrhea against 100 % at the beginning of our research. The use of Lactobacillus rhamnosus GG (ATCC 53103) in children with antibiotic-associated diarrhea helps reduce diarrhea, colic, bloating, nausea, vomiting, anxiety and poor sleep in children. Considering the combined effect of Lactobacillus rhamnosus GG strain, it can be argued that Probiolog Baby increases the levels of bifidobacteria and lactobacilli in the stool and also reduces the growth of Candida and pathogenic intestinal flora.
антибіотикоасоційована діарея; Lactobacillus rhamnosus GG; дисбіоз; Candida; біфідобактерії; лактобактерії; Пробіолог Бейбі; діти
антибиотикоассоциированная диарея; Lactobacillus rhamnosus GG; дисбиоз; Candida; бифидобактерии; лактобактерии; Пробиолог Бейби; дети
antibiotic-associated diarrhea; Lactobacillus rhamnosus GG; dysbiosis; Candida; bifidobacteria; lactobacilli; Probiolog Baby; children
Вступ
Матеріали та методи
Результати та обговорення
Висновки
1. Keeney K.M., Yurist-Doutsch S., Arrieta М.-С., Finlay В.В. Effects of antibiotics on human microbiota and subsequent disease. Annu. Rev. Microbiol. 2014. Vol. 68. P. 217-235.
2. Francino M.P. Antibiotics and the human gut microbiome: Dysbioses and accumulation of resistances. Front. Microbiol. 2016. Vol. 6. P. 1-11.
3. Sarker P., Mily A., Mamun A. et al. Ciprofloxacin affects host cells by suppressing expression of the endogenous antimicrobial peptides cathelicidins and beta-defensin-3 in colon epithelia. Antibiotics. 2014. Vol. 3. P. 353-374.
4. Croswell A., Amir E., Teggatz P. et al. Prolonged impact of antibiotics on intestinal microbial ecology and susceptibility to enteric Salmonella infection. Infect. Immun. 2009. Vol. 77. P. 2741-2753.
5. Jernberg C., Löfmark S., Edlund C., Jansson J.K. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota. ISME J. 2007. Vol. P. 56-66.
6. Turck D., Bernet J.-P., Marx J. et al. Incidence and risk factors of oral antibiotic-associated diarrhea in an outpatient pediatric population. J. Pediatr. Gastroenterol. Nutr. 2003. Vol. 37. P. 22-6.
7. Wiström J., Norrby S.R., Myhre E.B. et al. Frequency of antibiotic-associated diarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J. Antimicrob. Chemother. 2001. Vol. 47. P. 43-50.
8. Kramer M.S., Hutchinson T.A., Naimark L. et al. Antibiotic-associated gastrointestinal symptoms in general pediatric outpatients. Pediatrics. 1985. Vol. 76. P. 365-370.
9. Agamennone V., Krul C.A.M., Rijkers G., Kor R. A practical guide for probiotics applied to the case of antibiotic-associated diarrhea in The Netherlands. BMC Gastroenterology. 2018. Vol. 18. P. 103-115.
10. McFarland L.V. Systematic review and meta-analysis of Saccha-romyces boulardii in adult patients. World J. Gastroenterol. 2010. Vol. 14. P. 2202-2222.
11. Coté G.A., Buchman A.L. Antibiotic-associated diarrhoea. Expert Opin. Drug Saf. 2006. Vol. 5. P. 361-372.
12. Hurley B.W., Nguyen C.C. The spectrum of pseudomembranous enterocolitis and antibiotic-associated diarrhea. Arch. Intern. Med. 2002. Vol. 28. P. 2177-2184.
13. Szajewska H., Kołodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea inchildren and adults. Aliment. Pharmacol. Ther. 2015. Vol. 42. P. 1149-1157.
14. Surawicz C.M. Antibiotic-Associated Diarrhea in Children: How Many Dirty Diapers? Journal of Pediatric Gastroenterology and Nutrition. 2003. Vol. 37. P. 2-3.
15. Joint FAO/WHO expert consultation. Health and nutrition properties of probiotics in food including powder milk with live lactic acid bacteria. 2001.
16. Hill C., Guarner F., Reid G. et al. Expert consensus document: The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol. 2014. Vol. 11. P. 506-514.
17. Ritchie M.L. Romanuk T.N. A meta-analysis of probiotic efficacy for gastrointestinal diseases. PLoS One. 2012. Vol. 7. P. e34938.
18. Lee Y.K., Puong K.Y., Ouwehand A.C., Salminen S. Displacement of bacterial pathogens from mucus and Caco-2 cell surface by lactobacilli. J. Med. Microbiol. 2003. Vol. 52. P. 925-930.
19. Von Ossowski І., Reunanen J., Satokari R. et al. Mucosal adhesion properties of the probiotic Lactobacillus rhamnosus GG SpaCBA and SpaFED pilin subunits. Appl. Environ. Microbiol. 2010. Vol. 76. P. 2049-2057.
20. Collado M.C., González A., González R. et al. Antimicrobial peptides are among the antagonistic metabolites produced by Bifidobacterium against Helicobacter pylori. Int. J. Antimicrob. Agents. 2005. Vol. 25. P. 385-391.
21. Cotter P.D., Hill C., Ross P.R. et al. Bacteriocins: developing innate immunity for food. Nat. Rev. Microbiol. 2005. Vol. 3. P. 777-788.
22. Servin A.L. Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens. FEMS Microbiol. Rev. 2004. Vol. 28. P. 405-440.
23. Ashraf R., Shah N.P. Immune system stimulation by probiotic microorganisms. Crit. Rev. Food Sci. Nutr. 2014. Vol. 54. P. 938-956.
24. Guo Q., Goldenberg J.Z., Humphrey C., El Dib R., Johnston B.C. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database of Systematic Reviews 2019, Issue 4. Art. No.: CD004827. DOI: 10.1002/14651858.CD004827.pub5.
25. Gorbach S., Doron S., Magro F. The Microbiota in Gastrointestinal Pathophysiology. Implications for Human Health, Prebiotics, Probiotics, and Dysbiosis. 2017. P. 79-88.
26. Hawrelak J.A., Whitten D.L., Myers S.P. Is Lactobacillus rhamnosus GG effective inpreventing the onset of antibiotic-associated diarrhoea: a systematic review. Digestion. 2005. Vol. 72. P. 51-56.
27. Yan F., Polk D.B. Lactobacillus rhamnosus GG: an updated strategy touse microbial products to promotehealth. Funct. Food Rev. 2012. Vol. 4. P. 77-84.
28. Lu R., Fasano S., Madayiputhiya N. et al. Isolation, identification, andcharacterization of small bioactivepeptides from Lactobacillus GG conditional media that exert both anti-Gram-negative and Gram-positive bactericidal activity. Pediatr. Gastroenterol. Nutr. 2009. Vol. 49. P. 23-30.

/35.jpg)
/36.jpg)
/37.jpg)