Журнал «Здоровье ребенка» Том 15, №2, 2020
Вернуться к номеру
Лікування порушень кісткового обміну у хворих на вітамін-D-резистентний рахіт
Авторы: Марциняк С.М., Страфун С.С., Кінча-Поліщук Т.А.
ДУ «Інститут травматології та ортопедії НАМН України», м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета: визначити вплив консервативної терапії на генетично зумовлені порушення метаболізму кісткової тканини у хворих на вітамін-D-резистентний рахіт. Матеріали та методи. На базі консультативно-поліклінічного відділу ДУ «Інститут травматології та ортопедії НАМНУ» були обстежені та проліковані 39 пацієнтів із діагнозом «вітамін-D-резистентний рахіт, фосфат-діабет» (ВДPР). Консервативне лікування пацієнтів проводилось в кілька етапів. Перший етап включав повне обстеження пацієнта на визначення рівня кальцію і фосфору в крові та сечі, кальцидіолу та кальцитріолу крові, показників паратиреоїдного гормона та остеокальцину, а також маркера кісткоутворення P1NP і остеорезорбції B-CTx. На першому етапі в обов’язковому порядку діти проходили генетичне дослідження. Метою дослідження було виявлення змін (поліморфізму) в алелях рецепторів до вітаміну D (VDR) та колагену першого типу (COL1). Обстеження на наступних етапах проводилось повністю, окрім генетичних досліджень. Результати. Всебічне вивчення метаболізму вітаміну D та біохімічних показників життєдіяльності кісткової тканини у хворих на ВДРР, включаючи формування органічної основи кістки, дозволило ґрунтовно вивчити деякі питання патогенезу та сутності остеомаляційних і в подальшому остеопоротичних змін різного ступеня. Залежно від цих змін вдалось розробити різні схеми медикаментозної корекції порушень кісткового метаболізму при фосфат-діабеті. Висновки. Лікування ортопедичних проявів вітамін D-резистентного рахіту повинно розпочинатись з 60 000 одиниць вітаміну D, 12 мкг альфакальцидолу та 18 г кальцію гліцерофосфату на місяць. Після 3 місяців лікування повинно проводитись повторне вивчення показників кісткового метаболізму, внаслідок чого доза вітаміну D чи гормональної форми вітаміну D (альфакальцидолу) може змінюватись. Кальцій-фосфорну суміш діти повинні споживати в середній дозі 600–800 мг на добу.
Цель: определить влияние консервативной терапии на генетически обусловленные нарушения метаболизма костной ткани у больных витамин-D-резистентным рахитом. Материалы и методы. На базе консультативно-поликлинического отдела ГУ «Институт травматологии и ортопедии НАМНУ» было обследовано и пролечено 39 пациентов с диагнозом «витамин-D-резистентный рахит, фосфат-диабет» (ВДPР). Консервативное лечение пациентов проводилось в несколько этапов. Первый этап включал полное обследование пациента на определение уровня кальция и фосфора в крови и моче, кальцидиола и кальцитриола крови, показателей паратиреоидного гормона и остеокальцина, а также маркера костеобразования P1NP и остеорезорбции B-CTx. На первом этапе в обязательном порядке дети проходили генетическое исследование. Целью исследования было выявление изменений (полиморфизма) в аллелях рецепторов к витамину D (VDR) и коллагену первого типа (COL1). Обследование на следующих этапах проводилось полностью, кроме генетических исследований. Результаты. Всестороннее изучение метаболизма витамина D и биохимических показателей жизнедеятельности костной ткани у больных ВДРР, включая формирование органической основы кости, позволило основательно изучить некоторые вопросы патогенеза и сущности остеомаляционных и в дальнейшем остеопоротических изменений разной степени. В зависимости от этих изменений удалось разработать различные схемы медикаментозной коррекции нарушений костного метаболизма при фосфат-диабете. Выводы. Лечение ортопедических проявлений витамин-D-резистентного рахита должно начинаться с 60 000 единиц витамина D, 12 мкг альфакальцидола и 18 г кальция глицерофосфата в месяц. После 3 месяцев лечения должно проводиться повторное изучение показателей костного метаболизма, в результате чего доза витамина D или гормональной формы витамина D (альфакальцидола) может меняться. Кальций-фосфорную смесь дети должны потреблять в средней дозе 600–800 мг в сутки.
Background. The purpose was to determine the effect of drug therapy upon genetically determined disorders of bone tissue metabolism in patients with vitamin D-resistant rickets. Materials and methods. In the consultative out-patient department of the Institute of Traumatology and Orthopedics of the NAMSU, 39 patients who had been diagnosed with vitamin D-resistant rickets, phosphate diabetes (VDRR), were examined and treated. Medical treatment of the patients was carried out in several stages. Stage 1 included a patient complete examination to determine the level of calcium and phosphorus in blood and urine, calcidiol and calcitriol in blood, parathyroid hormone and osteocalcin parameters as well as the marker of bone formation P1NP and that of osteoresorption B-CTx. At the first stage, children were obliged to undergo a genetic study. The aim of the study was to detect changes (polymorphism) in receptor alleles to vitamin D (VDR) and collagen type 1 (COL1). The examination at the next stages was conducted entirely, in addition to genetic studies. Results. Comprehensive study of vitamin D metabolism and biochemical parameters of bone function in patients with VDRR, including the formation of the organic basis of bone, allowed examine thoroughly some issues of pathogenesis and the essence of osteomalacia and later osteoporotic changes of different degrees. Depending on these changes, it was possible to develop different regimens of medical correction of bone metabolism disorders in phosphate-diabetes. Conclusions. The treatment of orthopedic VDRR should begin with 60 000 units of vitamin D, 12 μg of alpha-calcidol and 18 g of calcium glycerophosphate per month. In 3 months of treatment, a re-examination of bone metabolism should be performed, resulting in alterations of vitamin D or the hormonal form of vitamin D alpha-calcidol intake. The calcium-phosphorus mixture should be consumed by children at an average dose of 600–800 mg per day.
D-резистентний рахіт; фосфат-діабет; спадкова фосфатемія; рахіт; метаболізм вітаміну D; кальцидіол; кальцитріол; деформації нижніх кінцівок у дітей
D-резистентный рахит; фосфат-диабет; наследственная фосфатемия; рахит; метаболизм витамина D; кальцидиол; кальцитриол; деформации нижних конечностей у детей
D-resistant rickets; phosphate diabetes; hereditary phosphatemia; rickets; vitamin D metabolism; calcidiol; calcitriol; deformations of lower extremities in children
Вступ
Матеріали та методи
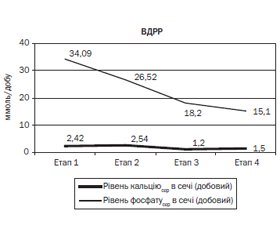
Результати та обговорення
/41.jpg)
Висновки
- Albright F., Butler A.M., Bloomberg E. Rick-ets resistant to vitamin D therapy. Am. J. Dis. of Child. Sept. 1937. 54. 529-547.
- Winters R.W., Graham J.B., Williams T.F. et al. A genetic study of familial hypophosphatemia and vitamin D resistant rickets with a review of the literature. Medicine. 1958. 7. 97-142.
- Grieff M., Mumm S., Waelz P. et al. Expression and cloning of the human X-linked hypophosphatemia gene cDNA. Biochem. Biophys. Res. Commun. 1997. 231. 635-639.
- Hochberg Z. Vitamin D and Rickets. Endocr. Dev. Basel: Karger. 126-155.
- Econs M.J. Bone disease resulting from inherited disorders of renal tubule transport and vitamin D metabolism. In Disorders of Bone and Mineral Metabolism. New York: Raven Press, 1992. 935-950.
- Fu G.K., Portale A.A., Miller W.L. Complete structure of the human gene for the vitamin D 1α-hydroxylase, P450c1α. DNA Cell. Biol. 1997.
- Holick M.F. The use and interpretation of assays for vitamin D and its metabolites. J. Nutr. 1990. 120(Suppl. 11). 1464-1469.
- Tohme J.F., Seibel M.J., Silverberg S. J. et al. Biochemical markers of bone metabolism. Zietschr. Rheumatol. 1991. 50. 133-141.
- Martsyniak S., Guk I., Kinchaya-Polishchuk1 T. et al. Results of conservative treatment in patients with phosphate diabetes. Bone Abstracts. 2015. 4. 194.
- Gattineni J., Baum M. Regulation of phosphate transport by fibroblast growth factor 23 (FGF-23): implications for disorders of phosphate metabolism. Pediatr. Nephrol. 2010. 25. 591-601.
- Ramon I., Kleynen P., Body J.J., Karmali R. Fibroblast growth factor 23 and its role in phosphate homeostasis. Eur. J. Endocrinol. 2010. 162. 1-10.
- Strom T.M., Juppner H. PHEX, FGF-23, DMP1 and beyond. Curr. Opin. Nephorol. Hypertens. 2008; 17. 357-62.

/42_2.jpg)
/42.jpg)
/43.jpg)
/44.jpg)