Резюме
Актуальність. Залізодефіцитна анемія (ЗДА) — це найпоширеніший позакишковий симптом при целіакії у дорослих. Досліджень наявності або відсутності залізодефіциту, зокрема прихованого, у пацієнтів, які мають целіакію, так само як і непереносимості глютену без целіакії (НГБЦ), раніше в нашій країні не проводилося. Мета дослідження: вивчити та проаналізувати загальноклінічні та біохімічні показники крові, що відображають наявність анемії та/або залізодефіциту у хворих на целіакію та НГБЦ на агліадиновій дієті (АГД). Матеріали та методи. У дослідження було включено 38 дорослих із діагностованими раніше видами непереносимості злаків — целіакією та НГБЦ. Усі вони перебували на дієті з повним виключенням глютену. Всім досліджуваним визначалися гематологічні показники: загальна залізозв’язуюча здатність крові, вміст еритроцитів, гемоглобіну, феритину, заліза та трансферину крові. Результати. Внаслідок обстеження 38 пацієнтів, які перебували на агліадиновій дієті протягом 6,5 (IQR 4–12) року, ЗДА легкого ступеня була виявлена у 13,16 % обстежених, при цьому латентний залізодефіцит визначався у 18,42 % обстежених. Зниження концентрації сироваткового заліза крові відзначено у 23,08 % хворих загальної групи, але частота залізодефіциту (зокрема латентного) в обстеженій групі за аналізом показників концентрації сироваткового феритину досягла 31,58 %, превалюючи над частотою виявлення ЗДА майже вдвічі. При цьому вміст еритроцитів був нормальним у 100 % обстежених. Серед пацієнтів із залізодефіцитом частіше зустрічаються особи з целіакію, ніж із НГБЦ (83,3 і 16,7 % відповідно). Висновки. Хворі на целіакію та НГБЦ залишаються в групі ризику з розвитку ЗДА, незважаючи на те, що вони знаходяться на агліадиновій дієті. Ізольований показник еритроцитів не є інформативним для діагностики не тільки прихованого залізодефіциту, але і ЗДА. Ізольований сироватковий рівень заліза також не є показовим для діагностики цих станів. Щодо цього саме феритин стає найбільш показовим маркером залізодефіциту. Необхідно цілеспрямовано спостерігати за цією групою хворих з метою виявлення прихованих форм мікронутрієнтного дефіциту, зокрема заліза, і здійснення обґрунтованої, індивідуалізованої корекції їх наслідків.
Актуальность. Железодефицитная анемия (ЖДА) — это наиболее частый внекишечный симптом при целиакии у взрослых. Исследований наличия или отсутствия железодефицита, в том числе скрытого, у пациентов, имеющих как целиакию, так и непереносимость глютена без целиакии (НГБЦ), ранее в нашей стране не проводилось. Цель исследования: изучить и проанализировать общеклинические и биохимические показатели крови, отражающие наличие анемии и/или железодефицита у больных целиакией и непереносимостью глютена без целиакии, находящихся на АГД. Материалы и методы. В исследование были включены 38 взрослых с диагностированными ранее основными видами непереносимости злаков — целиакией и НГБЦ. Все они находились на диете с полным исключением глютена. Всем исследуемым определялись гематологические показатели: общая железосвязывающая способность сыворотки, содержание эритроцитов, гемоглобина, ферритина, железа и трансферрина крови. Результаты. В результате обследования 38 пациентов, находящихся на аглиадиновой диете продолжительностью 6,5 (IQR 4–12) года, выявлено наличие ЖДА легкой степени у 13,16 % обследованных, при этом латентный железодефицит выявлялся у 18,42 % обследованных. Снижение концентрации сывороточного железа крови отмечено у 23,08 % больных общей группы, но частота железодефицита (в том числе латентного) в обследованной группе по анализу показателей концентрации сывороточного ферритина достигла 31,58 %, превалируя над частотой выявления ЖДА почти вдвое. При этом содержание эритроцитов было нормальным у 100 % обследованных. Среди пациентов с железодефицитом лица с целиакией встречаются чаще, чем среди пациентов с НГБЦ (83,3 и 16,7 % соответственно). Выводы. Больные целиакией и НГБЦ остаются в группе риска по развитию ЖДА, несмотря на то, что они находятся на аглиадиновой диете. Изолированный показатель эритроцитов не является информативным для диагностики не только скрытого железодефицита, но и ЖДА. Изолированный сывороточный уровень железа также не является показательным для диагностики данных состояний. В этом отношении именно ферритин становится наиболее показательным маркером железодефицита. Необходимо целенаправленное наблюдение за этой группой больных с целью выявления скрытых форм микронутриентного дефицита, в частности железа, и осуществления обоснованной, индивидуализированной коррекции их последствий.
Background. Iron deficiency anemia (IDA) is the most common extraintestinal symptom of celiac disease in adults. Studies of the presence or absence of iron deficiency, including cases of latent anemia, in patients with both celiac disease and non-celiac gluten sensitivity (NCGS) has not been previously carried out in our country. The purpose was to study and analyze general clinical and biochemical blood parameters of patients who are on a gluten-free diet with regards to the presence of anemia and/or iron deficiency. Materials and methods. The study included 38 adults previously diagnosed with one of the major types of cereal intolerance — celiac disease or NCGS. All of them were on a gluten-free diet. The following hematological parameters were studied and analyzed for each subject: erythrocyte count, hemoglobin, ferritin, total iron-binding capacity, iron, and blood transferrin levels. Results. The analysis revealed that 13.16 % of 38 patients had mild IDA as measured by hemoglobin levels, and latent iron deficiency was found in 18.42 % patients. In general, analysis of serum ferritin concentrations revealed the rate of iron deficiency of 31.58 % despite following a gluten-free diet for 6.5 (interquartile range of 4–12) years, suggesting that the rate of all iron deficiency cases (including the latent ones) almost twice exceeds the rate of IDA detected by hemoglobin analysis. Withal, the red blood cell count was normal in 100 % of the examined people, but a decrease in the concentration of serum iron in the blood was observed in 23.08 % of patients. Among individuals with iron deficiency, people with celiac disease are more likely to be found than those with NCGS (83.3 and 16.7 %, respectively). Conclusions. Patients with celiac disease and NCGS remain at risk for the development of IDA despite following a gluten-free diet. The isolated indicator of red blood cells is not informative for the diagnosis of not only latent iron deficiency but IDA as well. Isolated serum iron levels are also not indicative for the diagnosis of these conditions. In this regard, ferritin becomes the most significant marker of iron deficiency. Thus, it is necessary to carefully monitor this group of patients to identify latent forms of nutritional deficiency, in particular, iron deficiency, and to carry out the well-grounded individualized correction of their consequences.
Введение
Целиакия — аутоиммунное заболевание, поражающее тонкую кишку у генетически предрасположенных лиц и связанное с абсолютной пищевой непереносимостью глютена [1]. Последствием морфологических изменений при целиакии становится нарушение всасывания (мальабсорбция) с дальнейшим формированием различных видов макро- и микронутриентной недостаточности [2].
Непереносимость глютена без целиакии (НГБЦ) — патологическое состояние, связанное с непереносимостью злаков и возникающее по другим механизмам развития. Больные НГБЦ так же, как и при целиакии, находятся на аглиадиновой диете (АГД), значительно улучшающей качество их жизни. Но, несмотря на отличающиеся от целиакии механизмы патогенеза и особенности поражения слизистой оболочки (СО) кишечника, НГБЦ также часто сопровождается железодефицитной анемией (ЖДА) [3]. Согласно мировым данным, частота встречаемости ЖДА у пациентов с НГБЦ составляет 15,9 % [4].
Аглиадиновая диета, являющаяся единственным методом лечения как целиакии, так и НГБЦ, способствует восстановлению всасывания железа и, соответственно, нормализации его содержания в организме. Тем не менее появляются отдельные публикации, свидетельствующие о неполном восстановлении СО тонкой кишки (ТК) на фоне АГД, что может поддерживать персистенцию дефицитных состояний у взрослых пациентов [5]. Так, показано, что атрофия СО ТК сохраняется у пациентов с целиакией и АГД от 4 % [6] до 55 % [7]. Как известно, всасывание железа осуществляется в тонкой кишке, поэтому нелеченная целиакия часто сопровождается дефицитом данного микроэлемента, а ЖДА становится частым осложнением и внекишечным клиническим проявлением вовремя не диагностированной глютеновой энтеропатии (10–20 % случаев) [8]. Кроме того, длительное восстановление СО ТК также может быть причиной длительной отсрочки восстановления процессов всасывания, в частности железа, и приводить к развитию ЖДА у пациентов, следующих АГД. Таким образом, дефицит железа становится отражением несоответствия между поступлением железа и его потерей организмом. Общепринятым критерием диагностики анемии является снижение концентрации гемоглобина и/или эритроцитов в единице объема крови [9]. Достоверное подтверждение наличия ЖДА — низкий уровень ферритина в сыворотке крови [10]. Железодефицитная анемия, соответственно, формируется как следствие дефицита железа.
Характерным для клинического анализа крови при ЖДА традиционно является микроцитарная гипохромная анемия, низкая концентрация железа в сыворотке крови, повышенная общая железосвязывающая способность сыворотки (ОЖСС) крови и низкий уровень ферритина [11]. Однако в клинической практике отсутствие лабораторных проявлений ЖДА (а именно снижение концентрации эритроцитов и гемоглобина) не всегда свидетельствует об отсутствии самого железодефицита, имеющегося в латентной стадии ЖДА [12]. Поэтому для верификации подобных скрытых дефицитных состояний используется анализ концентрации сывороточного ферритина. Сывороточный ферритин зарекомендовал себя отличным маркером общих запасов железа в организме, поэтому при патологических состояниях последний становится и хорошим индикатором истощения этих запасов, то есть скрытого железодефицита. Согласно литературным данным, низкое содержание сывороточного ферритина выявляется у 19–33 % взрослых больных с целиакией на момент диагностики заболевания [13]. При задержке своевременного выявления скрытого железодефицита и его коррекции формируется железодефицитная анемия [14]. Поэтому исследование показателей сывороточного ферритина привлекло наше внимание в данном исследовании.
В Украине имеются единичные исследования, в которых фигурировали данные о частоте выявления анемического синдрома у больных целиакией [15]. Исследований наличия или отсутствия железодефицита, в том числе скрытого, у пациентов, имеющих как целиакию, так и НГБЦ, ранее в нашей стране не проводилось.
Цель исследования: изучить и проанализировать общеклинические и биохимические показатели крови, отражающие наличие анемии и/или железодефицита у больных целиакией и непереносимостью глютена без целиакии, находящихся на АГД.
Задачи:
— исследовать наличие или отсутствие ЖДА у больных целиакией/НГБЦ, находящихся на АГД;
— исследовать показатели крови у больных целиакией/НГБЦ, находящихся на АГД, отражающие наличие скрытого железодефицита;
— проанализировать связь и влияние АГД на показатели крови больных целиакией/НГБЦ.
Материалы и методы
В исследование были включены 38 взрослых — членов Всеукраинской общественной организации «Украинское общество целиакии» — с диагностированными ранее основными видами непереносимости злаков — целиакией и непереносимостью глютена без целиакии. Все они находились на диете с полным исключением глютена. Среди участников исследования было 9 (23,67 %) мужчин и 29 (76,33 %) женщин; медиана возраста составила 41 год (IQR 21–50 лет). Медиана времени пребывания на АГД — 6,5 (IQR 4–12) года.
Сначала все гематологические показатели были оценены в общей группе, затем все пациенты были разделены на 2 группы по их основному заболеванию: целиакия и НГБЦ. В группу целиакии вошли 28 человек, среди которых было 7 (25 %) мужчин и 21 (75 %) женщина, медиана возраста — 36,5 (IQR 18,75-50,0) года, медиана времени на диете — 8,75 (IQR 3–13) года. В группу НГБЦ вошли 10 человек — 2 (20 %) мужчин и 8 (80 %) женщин, медиана возраста — 42,0 (IQR 32,25–47,75) года, медиана времени на диете — 5,5 (IQR 5–7) года. Группы статистически не отличались по возрасту (р = 0,528), времени пребывания на диете (р = 0,326) и по половому признаку (p = 0,913). Внутри всех групп оказалось достоверно больше женщин, чем мужчин. И хотя преобладающей по женской популяции считается группа целиакии, однако в группе НГБЦ количество женщин также доминировало над количеством мужчин при соотношении 4 : 1 (табл. 1).
/43.jpg)
Следует отметить, что клинически у всех включенных в исследование отсутствовал сидеропенический синдром (пациентами не было отмечено выпадения волос, ломкости ногтей, сухости кожи). Всем исследуемым определялись следующие гематологические показатели: общая железосвязывающая способность сыворотки, содержание эритроцитов, гемоглобина, ферритина, железа и трансферрина крови.
В нашем исследовании были использованы общепринятые лабораторные критерии: гемоглобин — 135–172 г/л (для мужчин), 120–156 г/л (для женщин); ОЖСС — 45,5–81,9 мкмоль/л; сывороточное железо — 9–21,5 мкмоль/л; ферритин — 22–322 мкг/л для мужчин, 10–291 мкг/л для женщин; трансферрин — 2,15–3,6 г/л. В зависимости от полученного сочетания гематологических изменений (ферритин, гемоглобин) нами выделялись следующие патологические состояния: железодефицитная анемия (снижение уровня ферритина и гемоглобина), скрытый железодефицит (изолированное снижение уровня ферритина при нормальных показателях гемоглобина) и железодефицит (состояние, объединяющее 2 вышеописанных состояния — снижение уровня ферритина вне зависимости от других показателей).
В связи с различием референтных значений показателей ферритина некоторыми лабораториями нами выполнялся индивидуализированный расчет для принятия решения о наличии или отсутствии железодефицита.
Статистическая обработка результатов проводилась при помощи программного пакета EZR версии 1.38 (Saitama Medical Center, Jichi Medical University, Саитама, Япония), являющегося графическим интерфейсом пользователя программного пакета R (The R Foundation for Statistical Computing, Вена, Австрия) [16]. Для сравнения параметрических критериев использовался t-критерий Стьюдента, для непараметрических — U-критерий Манна — Уитни. Для определения корреляции между показателями использовался коэффициент корреляции Спирмена (двусторонняя альтернативная гипотеза). Для сравнения качественных показателей применялся точный критерий Фишера с поправкой Бонферрони для множественных сравнений.
Результаты
У обследованной нами группы пациентов средние количественные показатели эритроцитов и гемоглобина изменены не были. Остальные показатели общего анализа крови также сохранялись в пределах нормы. Уровни сывороточного ферритина как проявление возможного железодефицита в общей группе в среднем также находились в нормальных пределах лабораторных норм для взрослых. Средние значения ОЖСС, сывороточного железа и трансферрина в общей группе также изменены не были. Полученный результат может, на первый взгляд, косвенно свидетельствовать о достаточной компенсации исследуемой категории лиц, отражающей восстановление структуры СО ТК, длительно находящихся на АГД. Тем не менее он представляет лишь усредненный показатель, подразумевающий возможность отклонения от нормы данных показателей у отдельных лиц. Поэтому нами была проанализирована частота отклонения каждого из перечисленных выше гематологических показателей от нормы. Результаты анализа представлены в виде диаграммы на рис. 1.
Исходя из диаграммы (рис. 1), сниженный уровень железа у пациентов общей группы встречается реже, чем нормальный. Снижение обнаружено у 3 (23,08 %) пациентов (НГБЦ (n = 2); целиакия (n = 1); 15,39 и 7,69 % соответственно).
Частота выявления измененного (повышенного или сниженного) уровня трансферрина в общей группе обследованных регистрировалась намного реже, чем нормального, и только у больных целиакией (15,38 %, n = 2). Показатель ОЖСС оказывался чаще нормальным (92,3 %, n = 12), нежели измененным (рис. 1).
Как упоминалось выше, в общей группе исследования показатели эритроцитов изменены не были. Эта же тенденция сохранилась и при частотном анализе (рис. 1). Зато показатель гемоглобина был снижен у 5 (13,16 %) пациентов, из них 3 входили в группу целиакии, а 2 — НГБЦ. Таким образом, наличие ЖДА (снижение одновременно уровня ферритина и гемоглобина) было выявлено у 13,16 % больных общей группы.
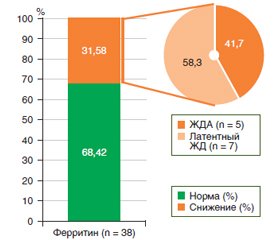
Поскольку в группе лиц с установленной ЖДА анемия была легкой степени, мы выдвинули гипотезу о наличии скрытого железодефицита, не выявляемого по данным вышепроведенных исследований. По этой причине наше внимание привлекло изучение показателей ферритина в исследуемой группе. Как известно, снижение концентрации последнего в крови свидетельствует о наличии скрытого (латентного) железодефицита задолго до формирования клинически выраженной ЖДА. Так, нами было выявлено снижение концентрации ферритина у 12 (31,58 %) обследованных, из них 26,32 % (n = 10) составили больные целиакией и 5,26 % (n = 2) — НГБЦ. Более детальный анализ подгруппы пациентов со сниженным уровнем ферритина представлен на рис. 2.
На рис. 2 представлены данные уровня ферритина (столбчатая диаграмма) в общей популяции исследования и анализ группы сниженного уровня ферритина (круговая диаграмма). Из всей обследованной популяции 68,42 % (n = 26) составили лица без железодефицита, 31,58 % — больные со снижением уровня ферритина (n = 12). Согласно анализу показателей эритроцитов и гемоглобина крови группы сниженного уровня ферритина, средние значения их показателей составили (M ± SD): эритроцитов — (4,511 ± 0,399) Т/л (95% доверительный интервал (ДИ) 4,306–4,717 Т/л), гемоглобина — (132,29 ± 16,42) г/л (95% ДИ 126,9–137,7 г/л). Исходя из этого, мы видим, что показатели эритроцитов в группе пациентов с железодефицитом остаются нормальными, в то время как уровень гемоглобина оказывается закономерно близким к нижней границе нормы. Подобная гематологическая картина становится частой причиной недостаточного внимания практикующих врачей к незначительно сниженным и не всегда связанным между собой числовым показателям концентраций эритроцитов и гемоглобина.
Анализ лиц с выявленной недостаточностью концентрации сывороточного ферритина (n = 12) показал, что среди них было 11 женщин (91,7 %) и 1 мужчина (8,3 %); а больных целиакией — заметно больше (83,3 %, n = 10), чем с НГБЦ (16,7 %, n = 2).
Среди всех лиц со сниженным уровнем ферритина 58 % больных имели нормальный уровень гемоглобина (n = 7; 6 женщин и 1 мужчина), все из группы целиакии, что не позволило диагностировать у них ЖДА, однако свидетельствовало об имеющемся латентном железодефиците. У 42 % лиц из группы со сниженным уровнем ферритина, у которых был снижен уровень гемоглобина (группа целиакии (n = 3) и НГБЦ (n = 2), все женщины), констатировано наличие ЖДА (рис. 2).
Итак, при снижении ферритина у 31,58 % человек общей группы исследования наличие ЖДА легкой степени отмечалось у трети из них (13,16 %), что свидетельствует о более выраженной и нераспознаваемой проблеме скрытого железодефицита у лиц, находящихся на АГД, не выявляемого рутинными общеклиническими анализами (рис. 3).
/44.jpg)
Согласно данным рис. 3, у обследованных пациентов достоверно чаще встречается нормальный уровень железа, чем железодефицитные состояния. Несмотря на это, нам удалось выявить больных с легкой ЖДА — 13,16 % и скрытым (латентным) железодефицитом — 18,42 %. После мы решили проанализировать частоту выявления ЖДА и ЛЖД в каждой группе. Среди 28 пациентов с диагнозом «целиакия» у 10 (35,72 %) выявлено снижение уровня ферритина и лишь у 3 (10,71 %) — одновременное снижение уровней ферритина и гемоглобина (ЖДА); таким образом, латентный железодефицит выявлен у 7 (25 %) пациентов из группы целиакии. Среди 10 пациентов с НГБЦ уровень ферритина оказался снижен у 2 (20 %), и у них же оказался снижен уровень гемоглобина (ЖДА).
Следующим шагом была проверка наличия корреляционной связи между длительностью пребывания пациентов на АГД и полученными показателями анализов крови. Выявлена значимо сильная негативная корреляционная связь между длительностью пребывания пациентов на АГД и содержанием эритроцитов (коэффициент корреляции р = –0,792; р = 0,006). Возможно, это связано с дефицитом фолиевой кислоты, который часто развивается у больных целиакией, находящихся на АГД. Данное предположение требует дальнейшего лабораторного подтверждения.
При количественном сравнении изучаемых показателей между группами (целиакия/НГБЦ) нами не было найдено статистически достоверного различия ни по одному из них (р > 0,1) (рис. 4).
Полученные данные также свидетельствуют о необходимости проведения индивидуализированного обследования с качественной персонализацией результатов анализов каждого конкретного пациента, находящегося на АГД, с целью выявления скрытых мальабсорбтивных нарушений.
Обсуждение
Нами проведено исследование взрослых пациентов с целиакией и НГБЦ, находившихся на АГД продолжительностью 6,5 (IQR 4–12) года. Несмотря на длительное лечение данных глютензависимых заболеваний, мы выявили и зарегистрировали персистирующие мальабсорбтивные нарушения, связанные с нарушенным метаболизмом железа, у 31,58 % обследованных. При этом легкая ЖДА зарегистрирована у 13,16 % больных. Несмотря на схожий процент выявленного снижения уровня ферритина у общего числа исследованных, в группе целиакии нам не удалось установить статистически достоверное отличие числа пациентов со сниженным уровнем ферритина от числа тех, у кого этот показатель находится в границах нормы. Отдельный этап исследования был посвящен попытке установить наличие возможно не выявляемого рутинно латентного железодефицита, остающегося нераспознаваемым традиционными общеклиническими анализами крови. Кроме того, использование статистического анализа средних значений исследованных показателей крови также не позволяет выявлять их клинически значимые сдвиги в группе. Это требовало от нас выполнения качественного анализа всех исследуемых показателей.
Таким образом, наше исследование продемонстрировало, что целиакия и НГБЦ, несмотря на длительное лечение и следование требованиям АГД, являются сохраняющейся причиной железодефицитных состояний. Среди обследованных нами пациентов ЖДА регистрировалась у 18,42 %; снижение концентрации сывороточного железа обнаружено у 23,08 % пациентов (15,39 % с НГБЦ (n = 2); 7,69 % с целиакией (n = 1)). Более детальное исследование показателей латентного железодефицита по результатам исследования концентрации сывороточного ферритина выявило его снижение у 31,58 % больных (35,7 % пациентов с целиакией и 20 % с НГБЦ).
Все эти данные свидетельствуют о том, что целиакия и НГБЦ даже на фоне АГД остаются потенциальными причинами микронутриентных нарушений. А применение рутинных лабораторных методов исследования крови с анализом уровней эритроцитов и гемоглобина, как и концентрации сывороточного железа, не позволяет с уверенностью заявлять об отсутствии скрытого железодефицита, как и о достаточном восстановлении слизистой оболочки на фоне проводимого лечения. Поэтому такие больные нуждаются в тщательном мониторинге показателей крови с использованием более тонких диагностических тестов, одним из которых должен стать анализ сывороточного ферритина.
Найденные нами литературные данные свидетельствуют о том, что вопросы восстановления микронутриентного статуса пациентов до сих пор являются нерешенными, особенно для больных НГБЦ (новое заболевание, протекающее со скрытой мальабсорбцией на фоне микроскопических и субмикроскопических изменений СО ТК) [17]. Публикации последних лет все чаще свидетельствуют о том, что, несмотря на очевидность пользы АГД, сама по себе жесткая ограничительная диета без глютена часто становится причиной нутритивных расстройств, вплоть до дефицитов. Одним из наиболее частых дефицитов вследствие АГД является дефицит кальция, железа, магния и цинка. В обзоре 2018 года представлены данные влияния АГД на больных целиакией и глютензависимыми заболеваниями, одним из которых является НГБЦ [18]. В других подобных статьях авторы обнаруживают и подчеркивают персистенцию микронутриентного дефицита у пациентов с АГД [19, 20], в особенности железа [20]. В статье, посвященной возможным путям улучшения результатов лечения на фоне АГД, делается вывод о необходимости контроля витаминов группы В, микроэлементов, особенно железа, у лиц, находящихся на АГД, и необходимости фортификации широко распространенных безглютеновых коммерческих продуктов упоминаемыми микронутриентами или индивидуализированной коррекции лабораторно выявляемых дефицитных состояний у таких больных [2].
Также нами выявлено негативное влияние АГД на содержание эритроцитов в крови — сильная негативная связь между данными показателями. Возможно, причиной этого явления стал фолиевый дефицит, возникающий из-за длительной диеты с исключением злаковых, однако данный вопрос требует отдельного исследования.
Выводы
В результате обследования 38 взрослых — членов Всеукраинской общественной организации «Украинское общество целиакии», находящихся на аглиадиновой диете продолжительностью 6,5 (IQR 4–12) года, — нами было выявлено наличие ЖДА легкой степени у 13,16 % обследованных, при этом латентный железодефицит выявлялся у 18,42 % пациентов. Снижение концентрации железа сыворотки крови отмечено у 23,08 % больных общей группы, но частота железодефицита (в том числе латентного) в обследованной группе по анализу показателей концентрации сывороточного ферритина достигла 31,58 %, превалируя над частотой выявления ЖДА почти вдвое. При этом содержание эритроцитов было нормальным у 100 % обследованных. Среди пациентов с железодефицитом лица с целиакией встречаются чаще, чем среди пациентов с НГБЦ (83,3 и 16,7 % соответственно).
Итак, больные целиакией и НГБЦ, несмотря на следование АГД, остаются группой риска формирования и персистенции скрытых мальабсорбтивных микронутриентных нарушений (в частности железа). Изолированный показатель эритроцитов не является информативным для диагностики не только скрытого железодефицита, но и ЖДА. Изолированный сывороточный уровень железа также не является показательным для диагностики данных состояний. В этом отношении именно уровень ферритина становится наиболее показательным маркером железодефицита.
Представленные данные свидетельствуют о необходимости целенаправленного наблюдения за больными с целиакией и НГБЦ на фоне АГД для выявления скрытых микронутриентных нарушений и осуществления обоснованной, индивидуализированной коррекции их последствий. Необходимы дальнейшие исследования на большей популяции больных глютензависимыми заболеваниями для более точного обнаружения зависимостей между исследуемыми показателями.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Вклад авторов в написание статьи: Губская Е.Ю., Наумова О.А. — концепция и дизайн исследования; Губская Е.Ю., Наумова О.А., Родионова И.А. — редактирование текста; Долько А.А. — сбор материала; Кузьминец А.А., Губская Е.Ю., Родионова И.А. — написание текста; Кузьминец А.А. — статистическая обработка данных.
Список литературы
1. Lebwohl B., Sanders D.S., Green P.H.R. Coeliac disease. Lancet. 2018. Vol. 391. № 10115. Р. 70-81. doi: 10.1016/S0140-6736(17)31796-8.
2. Theethira T.G., Dennis M. Celiac Disease and the Gluten-Free Diet: Consequences and Recommendations for Improvement. Dig. Dis. [Internet]. 2015 Apr 22 [cited 2020 Feb 10]; Vol. 33. № 2. Р. 175-82. doi: 10.1159/000369504. URL: https://www.karger.com/Article/FullText/369504.
3. Carroccio A., Mansueto P., Iacono G., Soresi M., D’alcamo A., Cavataio F. et al. Non-celiac wheat sensitivity diagnosed by double-blind placebo-controlled challenge: exploring a new clinical entity. Am. J. Gastroenterol. [Internet]. 2012 Dec. [cited 2020 Feb 10]. Vol. 107. № 12. P. 1898-906. doi: 10.1038/ajg.2012.236.
4. Tovoli F., Granito A., Negrini G., Guidetti E., Faggiano C., Bolondi L. Long term effects of gluten-free diet in non-celiac wheat sensitivity. Clin. Nutr. 2019 Feb 1. Vol. 38. № 1. P. 357-63. doi: 10.1016/j.clnu.2017.12.017.
5. Lanzini A., Lanzarotto F., Villanacci V., Mora A., Bertolazzi S., Turini D. et al. Complete recovery of intestinal mucosa occurs very rarely in adult coeliac patients despite adherence to gluten-free diet. Aliment. Pharmacol. Ther. [Internet]. 2009 Jun 1 [cited 2020 Feb 10]. Vol. 29. № 12. P. 1299-308. doi: 10.1111/j.1365-2036.2009.03992.x. URL: http://doi.wiley.com/10.1111/j.1365-2036.2009.03992.x.
6. Collin P., Mäki M., Kaukinen K., Green P.H.R., Rotterdam H. Complete small intestinal mucosal recovery is obtainable in the treatment of celiac disease. Gastrointest. Endosc. 2004 Jan 1. Vol. 59. № 1. P. 158-9. doi: 10.1016/S0016-5107(03)01311-7.
7. Ciacci C., Cirillo M., Cavallaro R., Mazzacca G. Long-term follow-up of celiac adults on gluten-free diet: prevalence and correlates of intestinal damage. Digestion [Internet]. 2002 [cited 2020 Feb 10]. Vol. 66. № 3. P. 178-85. doi: 10.1159/000066757. URL: https://www.karger.com/Article/FullText/66757.
8. Halfdanarson T.R., Litzow M.R., Murray J.A. Hematologic manifestations of celiac disease. Blood. 2007 Jan 15. Vol. 109. № 2. P. 412-421. doi: 10.1182/blood-2006-07-031104.
9. Scholl T.O., Hediger M.L. Anemia and iron-deficiency anemia: compilation of data on pregnancy outcome. Am. J. Clin. Nutr. [Internet]. 1994 Feb 1 [cited 2020 Feb 6]. Vol. 59. № 2. P. 492S-501S. doi: 10.1093/ajcn/59.2.492S. PMID: 8304287. URL: https://academic.oup.com/ajcn/article/59/2/492S/4731948.
10. Punnonen K., Irjala K., Rajamäki A., Rajamäki A. Serum transferrin receptor and its ratio to serum ferritin in the diagnosis of iron deficiency. Blood. 1997 Feb 1. Vol. 89. № 3. P. 1052-7. doi: 10.1182/blood.v89.3.1052.
11. Cook J.D. Diagnosis and management of iron-deficiency anaemia. Best Pract. Res. Clin. Haematol. 2005 Jun 1. Vol. 18 (2 SPEC. ISS). P. 319-32. doi: 10.1016/j.beha.2004.08.022.
12. Родіонова І.О., Губська О.Ю. Загальні та окремі питання анемічного синдрому в клінічній практиці лікаря-інтерна: посібник для лікарів-інтернів та слухачів курсів тематичного удосконалення. Київ, 2019. 65 с.
13. Harper J.W., Holleran S.F., Ramakrishnan R., Bhagat G., Green P.H.R. Anemia in celiac disease is multifactorial in etiology. Am. J. Hematol. [Internet]. 2007 Nov 1 [cited 2020 Feb 10]. Vol. 82. № 11. P. 996-1000. doi: 10.1002/ajh.20996. URL: http://doi.wiley.com/10.1002/ajh.20996.
14. Hallberg L., Sandström B., Ralph A., Arthur J. Iron, zinc and other trace elements. In: Human nutrition and dietetics. Churchill Livingstone, 2000. P. 177-207.
15. Губська О.Ю. Целіакія: поширеність, особливості клінічного перебігу, діагностики, лікування та одужання хворих: дис. на здобуття наук. ступеня д-ра мед. наук: 14.01. 36. Київ, 2009. 378 с.
16. Kanda Y. Investigation of the freely available easy-to-use software “EZR” for medical statistics. Bone Marrow Transplant. 2013. Vol. 48. № 3. P. 452-8. doi: 10.1038/bmt.2012.244.
17. Martín-Masot R., Nestares M.T., Diaz-Castro J., López-Aliaga I., Alférez M.J.M., Moreno-Fernandez J. et al. Multifactorial Etiology of Anemia in Celiac Disease and Effect of Gluten-Free Diet: A Comprehensive Review. Nutrients [Internet]. 2019 Oct 23 [cited 2020 Feb 19]. Vol. 11. № 11. P. 2557. doi: 10.3390/nu11112557. URL: https://pubmed.ncbi.nlm.nih.gov/31652803.
18. Rybicka I. The Handbook of Minerals on a Gluten-Free Diet. Nutrients [Internet]. 2018 Nov 5 [cited 2020 Feb 19]. Vol. 10. № 11. P. 1683. doi: 10.3390/nu10111683. PMID: 30400639. URL: https://pubmed.ncbi.nlm.nih.gov/30400639.
19. Caruso R., Pallone F., Stasi E., Romeo S., Monteleone G. Appropriate nutrient supplementation in celiac disease. Ann. Med. [Internet]. 2013 Dec [cited 2020 Feb 19]. Vol. 45. № 8. P. 522-31. doi: 10.3109/07853890.2013.849383. URL: https://www.tandfonline.com/doi/abs/10.3109/07853890.2013.849383?journalCode = iann20.
20. Vici G., Belli L., Biondi M., Polzonetti V. Gluten free diet and nutrient deficiencies: A review. Clinical Nutrition. Churchill Livingstone. 2016. Vol. 35. P. 1236-41. doi: 10.1016/j.clnu.2016.05.002.
/43_2.jpg)

/43.jpg)
/44.jpg)
/45.jpg)