Журнал "Гастроэнтерология" Том 54, №1, 2020
Вернуться к номеру
Оцінка мікробного пейзажу й показників цитопротекції товстої кишки у хворих із хронічними запорами
Авторы: Степанов Ю.М.(1), Власова О.М.(2), Кленіна І.А.(1)
(1) — ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
(2) — ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
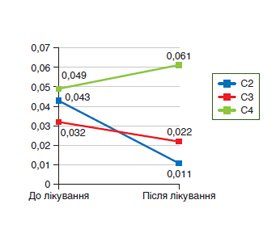
Актуальність. У статті розглядаються питання хронічних запорів. Показані результати власних досліджень, у яких визначався вміст коротколанцюгових жирних кислот (КЖК) у калі й стан мікробіоценозу у хворих із хронічними запорами до і на тлі лікування препаратом Ізіду. Матеріали та методи. Під спостереженням перебували 10 пацієнтів віком від 18 до 65 років із хронічним запором, від якого вони страждали близько 10 років. Пацієнти приймали проносний комплексний засіб Ізіду по 3 капсули на добу. З метою оцінки вмісту КЖК і мікробного пейзажу хворим (6 жінок, 4 чоловіки) двічі — до прийому препарату Ізіду та через 2 тижні після його прийому — проведено дослідження калу. Визначення КЖК здійснювалося методом хроматографічного дослідження з використанням апаратно-програмного комплексу для медичних досліджень на базі газового хроматографа «Хроматек-Кристал 5000». Результати. Виявлено суттєве підвищення вмісту в калі КЖК і зменшення лактобактерій до початку лікування. Після лікування вміст оцтової кислоти вірогідно знизився в 3,9 раза, до середнього значення (0,011 ± 0,005) мкл/мл (р < 0,05). Вміст масляної кислоти в 90 % хворих був суттєво підвищеним порівняно з контролем і відзначався на рівні 0,018–0,131 мкл/мл, середнє значення становило (0,0499 ± 0,0040) мкл/мл, що було вірогідно вище від контрольних показників (р < 0,001). Після лікування спостерігалося збільшення вмісту масляної кислоти до (0,061 ± 0,003) мкл/мл (р < 0,05). Після прийому Ізіду в 60 % пацієнтів склад мікрофлори кишечника покращувався, суттєво підвищувався вміст мікроорганізмів роду Lactobacillus (105 КУО/г фекалій), показники вмісту інших мікроорганізмів були в діапазоні контрольних значень. Висновки. Відмічене значне підвищення фракцій КЖК у калі у хворих із хронічними запорами на початку спостереження. Лікування комплексним препаратом Ізіду приводило до вірогідного підвищення вмісту масляної кислоти в калі (р < 0,05), що має позитивне прогностичне значення й свідчить про активацію захисних, детоксикаційних і цитопротекторних ефектів.
Актуальность. В статье рассматриваются вопросы хронических запоров. Показаны результаты собственных исследований, в которых определялось содержание короткоцепочечных жирных кислот (КЖК) в кале и состояние микробиоценоза у пациентов до и на фоне лечения препаратом Изиду. Материалы и методы. Под наблюдением находилось 10 больных в возрасте от 18 до 65 лет с хроническим запором, от которого они страдали около 10 лет. Пациенты принимали комплексное слабительное средство Изиду по 3 капсулы в сутки. С целью оценки содержания КЖК и микробного пейзажа больным (6 женщин, 4 мужчины) дважды — до приема препарата Изиду и через 2 недели после его приема — проведено исследование кала. Определение КЖК осуществляли методом хроматографического исследования с использованием аппаратно-программного комплекса для медицинских исследований на базе газового хроматографа «Хроматэк-Кристалл 5000». Результаты. Выявлено существенное повышение содержания в кале КЖК и снижение содержания лактобактерий до начала лечения. После лечения содержание уксусной кислоты достоверно снизилось в 3,9 раза до среднего значения (0,011 ± 0,005) мкл/мл (р < 0,05). Содержание масляной кислоты у 90 % пациентов было существенно повышено по сравнению с контролем и отмечалось на уровне 0,018–0,131 мкл/мл, среднее значение составляло (0,0499 ± 0,004) мкл/мл, что было достоверно выше контрольных показателей (р < 0,001). После лечения наблюдалось увеличение содержания масляной кислоты до (0,061 ± 0,003) мкл/мл (р < 0,05). После применения препарата Изиду у 60 % пациентов состав микрофлоры кишечника улучшался, существенно повысилось содержание микроорганизмов рода Lactobacillus (105 КОЕ/г фекалий), показатели содержания других микроорганизмов были в диапазоне контрольных значений. Выводы. Отмечено значительное повышение фракций КЖК в кале у больных с хроническими запорами в начале наблюдения. Лечение комплексным препаратом Изиду привело к достоверному увеличению содержания масляной кислоты в кале (р < 0,05), что имеет положительное прогностическое значение и свидетельствует об активизации защитных, детоксикационных и цитопротекторных эффектов.
Background. The article considers the problem of chronic constipations. The results of our own studies have been shown to determine the content of short-chain fatty acids (SCFA) and the status of microbiocenosis in patients with chronic constipations before and on the background of EasyDo treatment. Materials and methods. The study involved 10 patients aged 18 to 65 years with an average duration of chronic constipation of 10 years. Patients took the combination laxative EasyDo 3 capsules a day. In order to assess the level of SCFA and the microbial landscape in patients (6 women, 4 men), a stool analysis was performed twice: before EasyDo was administered and 2 weeks after treatment. SCFA content was determined by means of a chromatographic method using hardware and software system based on the Chromateс Crystal 5000 gas chromograph. Results. A significant increase in the content of SCFA and a decrease in lactobacilli before treatment were found. After treatment, the content of acetic acid decreased significantly — by 3.9 times, to an average value of (0.011 ± 0.005) µl/ml (p < 0.05). The content of butyric acid in 90 % of patients increased significantly and was at the level of 0.018–0.131 µl/ml compared to the controls, the average value was (0.0499 ± 0.0040) µl/ml, which was significantly higher than the control values (p < 0.001). After treatment, there was an increase in the content of butyric acid to (0.061 ± 0.003) µl/ml (p < 0.05). After taking EasyDo, 60 % of patients had an improvement in the composition of the gut microbiota, a significant increase in the content of microorganisms of the Lactobacillus genus (105 CFU/g of feces); indicators of the content of other microorganisms were in the range of control values. Conclusions. There was a significant increase in SCFA content in feces of patients with chronic constipations at the beginning of the observation. Treatment with the combination drug EasyDo led to a significant increase in the content of butyric acid in feces (p < 0.05), which has a positive prognostic value and indicates the activation of protective, detoxification and cytoprotective effects.
колоноцитопротекція; мікрофлора кишечника; коротколанцюгові жирні кислоти
колоноцитопротекция; микрофлора кишечника; короткоцепочечные жирные кислоты
colon cytoprotection; intestinal microflora; short-chain fatty acids
Вступ
Матеріали та методи
Результати
/65.jpg)
Висновки
1. Степанов Ю.М., Будзак І.Я., Кленіна І.А. Коротколанцюгові жирні кислоти: роль у розвитку синдрому подразненого кишечника. Гастроентерологія. 2019. № 1. С. 62-66.
2. Степанов Ю.М., Власова О.М. Нові можливості лікування хворих з хронічними запорами. Сучасна гастроентерологія. 2019. № 1(105). С. 35-40.
3. Barbara G., Zecchi L., Barbaro R. et al. Mucosal permeability and immune activation as potential therapeutic targets of probiotics in irritable bowel syndrome. J. Clin. Gastroenterol. 2012 Oct. 46. P. 52-55.
4. Brint E.K., MacSharry J., Fanning A. et al. Differential expression of toll-like receptors in patients with irritable bowel syndrome. Am. J. Gastroenterol. 2011. № 106. Р. 329-36.
5. Cuesta-Zuluaga J., Mueller N.T., Álvarez-Quintero R. et al. Higher Fecal Short-Chain Fatty Acid Levels Are Associated with Gut Microbiome Dysbiosis, Obesity, Hypertension and Cardiometabolic Disease Risk Factors. Nutrients. 2019. № 11. Р. 51.
6. Farup P.G., Rudi K., Hestad K. Faecal short-chain fatty acids — a diagnostic biomarker for irritable bowel syndrome? BMC Gastroenterol. 2016. № 16(1). Р. 51.
7. Ghoshal U., Shukla R., Ghoshal U., Gwee K., Ng S., Quigley E. The gut microbiota and irritable bowel syndrome: friend or foe? Int. J. Inflam. 2012. Р. 151085.
8. Guohua Zhao. Rapid determination of short-chain fatty acids in colonic contents and faeces of humans and rats by acidified water-extraction and direct-injection gas chromatography. Biomedical chromatography. 2006. № 20(8). Р. 675-682.
9. Hurst N.R., Kendig D.M., Murthy K.S., Grider J.R. The short chain fatty acids, butyrate and propionate, have differential effects on the motility of the guinea pig colon. Neurogastroenterol. Motil. 2014. № 26(11). Р. 1586-96.
10. Kimura I. Host energy regulation via SCFAs receptors, as dietary nutrition sensors, by gut microbiota. Yakugaku Zasshi. 2014. № 134(10). Р. 1037-42.
11. Martin C.R., Osadchiy V., Kalani A., Mayer E.A. The Brain-Gut-Microbiome Axis. Cell Mol. Gastroenterol. Hepatol. 2018. № 6(2). Р. 133-148.
12. Natarajan N., Pluznick J.L. From microbe to man: the role of microbial short chain fatty acid metabolites in host cell biology. Am. J. Physiol. Cell Physiol. 2014. № 307(11). Р. 979-985.
13. O’Malley D. Endocrine regulation of gut function — a role for glucagon-like peptide-1 in the pathophysiology of irritable bowel syndrome. Exp. Physiol. 2019. Jan. № 104(1). Р. 3-10.
14. Farup P.G., Rudi K., Hestad K. Faecal short-chain fatty acids — a diagnostic biomarker for irritable bowel syndrome? BMC Gastroenterology. 2016. Р. 16:51.
15. Rau M., Rehman A., Dittrich M. et al. Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United European Gastroenterol. J. 2018. № 6(10). Р. 1496-1507.
16. Simrén M., Barbara G., Flint H.J. et al. Intestinal microbiota in functional bowel disorders: a Rome foundation report. Gut. 2013. № 62. Р. 159-176.
17. Sood R., Gracie D.J., Law G.R., Ford A.C. Systematic review with meta-analysis: the accuracy of diagnosing irritable bowel syndrome with symptoms, biomarkers and/or psychological markers. Aliment. Pharmacol. Ther. 2015. № 42. Р. 491-503.
18. Tan J., McKenzie C., Potamitis M., Thorburn A.N., Mackay C.R., Macia L. The role of short-chain fatty acids in health and disease. Adv. Immunol. 2014. № 121. Р. 91-119.
19. Tolhurst G., Heffron H., Lam Y.S. et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via the G-protein-coupled receptor FFAR2. Diabetes. 2012. № 61. Р. 364-371.
20. Topping D.L., Clifton P.M. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides. Physiol. Rev. 2001. № 81. Р. 1031-1064.
21. Verdu E.F., Bercik P., Verma-Gandhu M. et al. Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice. Gut. 2006. № 55. Р. 182-90.
22. Vinolo M.A., Rodrigues H.G., Nachbar R.T., Curi R. Regulation of Inflammation by Short Chain Fatty Acids. Nutrients. 2011. № 3. Р. 858-876.