Резюме
Актуальність. Механізми функціональної взаємодії шлунка та щитоподібної залози (ЩЗ) пояснюються біологічною дією тіреоїдних гормонів. Згідно з європейськими рекомендаціями MAPS II, серед передракових станів виділяють атрофію та кишкову метаплазію (КМ) слизової оболонки шлунка (СОШ). Мета: оцінити структурно-функціональні зміни паренхіми ЩЗ у хворих із передраковими станами шлунка. Матеріали та методи. Дослідження проведено у 44 хворих із передраковими станами шлунка, серед обстежених хворих були 32 (72,7 %) жінки та 12 (27,3 %) чоловіків віком від 33 до 76 років, у середньому (59,7 ± 1,7) року. Верхню ендоскопію проводили з використанням системи EVIS EXERA III із гастроскопом Olympus 190 (Японія). За результатами ендоскопічного дослідження пацієнти були розподілені на групи: І група — 11 хворих з атрофією СОШ без КМ; ІІ група — 13 пацієнтів з атрофією СОШ з КМ, обмеженою антральним відділом або тілом шлунка; ІІІ група — 8 осіб з дифузною КМ на фоні атрофії СОШ. Групи були репрезентативними за віком та статтю. Всім обстеженим проводилось сонологічне дослідження ЩЗ на ультразвуковому сканері Toshiba Xario (Японія) з використанням мультичастотного лінійного трансдюсера з частотою 5–12 МГц. Для оцінки функціонального стану ЩЗ в сироватці крові визначали рівень тиреоглобуліну та тиреотропного гормону імуноферментним методом. Результати. Встановлено суттєве збільшення частоти дифузних та вогнищевих змін в ЩЗ у пацієнтів з дифузним поширенням КМ у шлунку (p < 0,05), що підтверджено кореляційним зв’язком частоти КМ тіла й антрального відділу шлунка з наявністю вузлів у ЩЗ (r = 0,44, p = 0,003 і r = 0,40, p = 0,006 відповідно). Водночас збільшення частоти вогнищевих гіперплазій СОШ асоціювалося з нерівністю контурів ЩЗ (r = 0,41, p = 0,03) та збільшенням щільності капсули ЩЗ (r = 0,49, p = 0,04), що є ознаками хронічного запального процесу. Поширення КМ СОШ супроводжувалось збільшенням рівня тиреоглобуліну у понад 3 рази (р = 0,0134). При цьому вміст тиреотропного гормону вірогідно знижувався у міру поглиблення перебудовних змін СОШ (р = 0,0474), а встановлений кореляційний зв’язок рівня цього гормону з КМ в тілі шлунка (r = –0,46, р < 0,05) свідчить про необхідність подальшого вивчення ролі гормонів ЩЗ у розвитку передракових станів шлунка. Висновки. У хворих на передракові стани шлунка спостерігається висока частота структурних змін паренхіми ЩЗ (81,8 %) як дифузного (75,0 %), так і вогнищевого (43,2 %) характеру. Поширення КМ в СОШ корелює зі структурними змінами паренхими ЩЗ, що супроводжується вірогідним збільшенням вмісту тиреоглобуліну та зниженням рівня тиреотропного гормону в сироватці крові. Частота структурних змін ЩЗ збільшується у міру поглиблення перебудовних змін шлунка, що підтверджується позитивним кореляційним зв’язком між змінами структури ЩЗ і наявністю ксантом СОШ, що є маркерами передракових станів СОШ (r = 0,52, p = 0,03).
Актуальность. Механизмы функционального взаимодействия желудка и щитовидной железы (ЩЖ) базируются на биологическом действии тиреоидных гормонов. Согласно европейским рекомендациям MAPS II, к предраковым состояниям желудка относятся атрофия и кишечная метаплазия (КМ) слизистой оболочки желудка (СОЖ). Цель: оценить структурно-функциональные изменения паренхимы ЩЖ у больных с предраковыми состояниями желудка. Материалы и методы. Исследование проведено у 44 больных с предраковыми состояниями желудка. Среди обследованных больных было 32 (72,7 %) женщины и 12 (27,3 %) мужчин в возрасте от 33 до 76 лет, в среднем (59,7 ± 1,7) года. Верхнюю эндоскопию выполняли с использованием системы EVIS EXERA III с гастроскопом Olympus 190 (Япония). По результатам эндоскопического исследования пациенты были распределены на группы: I группа — 11 больных с атрофией СОЖ без КМ; II группа — 13 пациентов с атрофией СОЖ с КМ, ограниченной антральными отделом или телом желудка; III группа — 8 человек с диффузной КМ на фоне атрофии СОЖ. Группы были репрезентативны по возрасту и полу. Всем обследованным проводилось сонологическое исследование ЩЖ на ультразвуковом сканере Toshiba Xario (Япония) с использованием мультичастотного линейного трансдюсера с частотой 5–12 МГц. Для оценки функционального состояния ЩЖ в сыворотке крови определяли уровень тиреоглобулина и тиреотропного гормона иммуноферментным методом. Результаты. Установлено существенное увеличение частоты диффузных и очаговых изменений в ЩЖ у пациентов с диффузным распространением КМ в желудке (p < 0,05), что подтверждено корреляционной связью частоты КМ тела и антрального отдела желудка с наличием узлов в ЩЖ (r = 0,44, p = 0,003 и r = 0,40, p = 0,006 соответственно). В то же время увеличение частоты очаговых гиперплазий СОЖ ассоциировалось с неровностью контуров ЩЖ (r = 0,41, p = 0,03) и увеличением плотности капсулы ЩЖ (r = 0,49, p = 0,04), что является признаками хронического воспалительного процесса. Распространение КМ сопровождалось увеличением уровня тиреоглобулина в более чем 3 раза (р = 0,0134). При этом содержание тиреотропного гормона достоверно снижалось по мере углубления перестроечных изменений СОЖ (р = 0,0474), а установленная корреляционная связь уровня этого гормона с наличием КМ в теле желудка (r = –0,46, р < 0,05) свидетельствует о необходимости дальнейшего изучения роли гормонов ЩЖ в развитии предраковых состояний желудка. Выводы. У больных с предраковыми состояниями желудка наблюдается высокая частота структурных изменений паренхимы ЩЖ (81,8 %) как диффузного (75,0 %), так и очагового (43,2 %) характера. Распространение КМ СОЖ коррелирует со структурными изменениями паренхимы ЩЖ, что сопровождается достоверным увеличением содержания тиреоглобулина и снижением уровня тиреотропного гормона в сыворотке крови. Частота структурных изменений ЩЖ увеличивается по мере углубления перестроечных изменений желудка, что подтверждается положительной корреляционной связью между изменениями структуры ЩЖ и наличием ксантом СОЖ, которые являются маркерами предраковых состояний СОЖ (r = 0,52, p = 0,03).
Background. The mechanisms of the functional interaction of the stomach and thyroid gland are based on the biological action of thyroid hormones. According to the European guidelines MAPS II, precancerous conditions of the stomach include atrophy and intestinal metaplasia of the gastric mucosa. The purpose of the work is to evaluate the structural and functional changes in the thyroid parenchyma in patients with precancerous conditions of the stomach. Materials and methods. The study was conducted in 44 patients with precancerous conditions of the stomach: 32 (72.7 %) women and 12 (27.3 %) men aged 33 to 76 years, on average (59.7 ± 1.7) years. Upper endoscopy was performed using the EVIS EXERA III system with an Olympus 190 gastroscope (Japan). According to the results of endoscopic examination, patients were divided into groups: group I — 11 people with atrophy of the gastric mucosa without intestinal metaplasia, group II — 13 individuals with atrophy of the gastric mucosa with intestinal metaplasia, limited by the antrum or body of the stomach, group III — 8 patients with diffuse intestinal metaplasia on the background of the gastric mucosa atrophy. The groups were representative by age and gender. All examined patients underwent a sonological examination of the thyroid gland with the ultrasound scanner Toshiba Xario (Japan) using a multi-frequency linear transducer with a frequency of 5–12 MHz. To assess the functional state of the thyroid gland, the levels of thyroglobulin and thyroid-stimulating hormone in the blood serum were determined by the enzyme immunoassay. Results. A significant increase in the frequency of diffuse and focal changes in the thyroid gland was found in patients with diffuse spread of intestinal metaplasia in the stomach (p < 0.05), which is confirmed by a correlation between the frequency of intestinal metaplasia of the body and antrum of the stomach with the presence of thyroid nodules (r = 0.44, p = 0.003; and r = 0.40, p = 0.006, respectively). At the same time, an increase in the frequency of focal hyperplasia of the gastric mucosa was associated with irregular contours of the thyroid gland (r = 0.41, p = 0.03) and an increase in the density of the thyroid capsule (r = 0.49, p = 0.04) that were the signs of a chronic inflammatory process. The spread of gastric intestinal metaplasia was accompanied by an increase in serum thyroglobulin by more than 3 times (p = 0.0134). Moreover, the level of thyroid-stimulating hormone significantly decreased as the precancerous changes in the gastric mucosa worsened (p = 0.0474), and the correlation between the level of this hormone and the presence of intestinal metaplasia in the stomach body (r = –0.46, p < 0.05) indicates the need for further study of the role of thyroid hormones in the development of precancerous conditions of the stomach. Conclusions. Patients with precancerous conditions of the stomach have a high frequency of structural changes in the thyroid parenchyma (81.8 %) of both diffuse (75.0 % of cases) and focal (43.2 %) nature. The spread of intestinal metaplasia in the gastric mucosa correlates with structural changes in the thyroid parenchyma, which is accompanied by a significant increase in thyroglobulin and a decrease in thyroid-stimulating hormone level in the blood serum. The frequency of structural changes in the thyroid gland increases with the development of precancerous changes in the stomach that is confirmed by a positive correlation between changes in the structure of the thyroid gland and the presence of xanthomas of the gastric mucosa, which are markers of precancerous conditions of the gastric mucosa (r = 0.52, p = 0.03).
Вступ
Взаємозв’язок захворювань шлунка та щитоподібної залози (ЩЗ) відомий ще з початку XX століття, коли механізми функціональної взаємодії пояснювалися біологічною дією тіреоїдних гормонів [1]. Трийодтиронін та тироксин виконують різноманітні фізіологічні та клітинні функції, що включають зростання, розвиток та обмін речовин в цілому [2]. До того ж відомо, що в регуляції шлункової секреції бере участь кальцитонін. Деякі дослідники вважають цей гормон ЩЗ потужним інгібітором шлункової секреції, що стимулюється не тільки введенням пентагастрину, але й гістаміном, інсуліном, кальцієм [3]. Інші автори вказують на зменшення об’єму шлункового соку та концентрації соляної кислоти під впливом кальцитоніну [4].
ЩЗ і шлунок розвиваються з однієї і тієї ж частини раннього ембріону — примітивного кишечника, що і поєднує їх властивості. Клітини ЩЗ і шлунка мають спільні функції, а саме транспортування йоду, що, в свою чергу, допомагає продукції гормонів залози і сприяє розмноженню клітин у шлунку [5]. Також ці органи поєднує фермент пероксидаза: в клітинах ЩЗ — тіреоїдна пероксидаза, в шлунку — шлункова, що забезпечує клітини антиоксидантними властивостями [6].
Відомо, що ЩЗ та шлунок мають генетичну спільність, що визначає єдині патогенетичні механізми формування автоімунних захворювань ЩЗ та автоімунного гастриту [7]. Рання поява атрофічних змін шлунка найхарактерніша для автоімунного гастриту, який часто виникає в осіб, які мають не тільки перніціозну анемію, але й інші автоімунні захворювання.
Порушення функції ЩЗ — дистиреоз розвивається у двох напрямках: посилення (гіпертиреоз) та зниження (гіпотиреоз). До патології ЩЗ схильний кожен другий житель Землі. В Україні близько 47 % загальної ендокринної патології становлять захворювання ЩЗ [8]. Висока частота захворювань ЩЗ пояснюється багатьма причинами: значним поширенням йододефіцитних станів, генетичною схильністю, високими техногенними навантаженнями, порушенням структури харчування і соціальними чинниками (умови праці, побуту, медичне обслуговування). Захворювання вражають частіше жінок [9]. Морфофункціональний стан ЩЗ залежить безпосередньо від антропогенних чинників і є маркером екологічного неблагополуччя конкретного регіону. У промислово розвинених країнах зростання частоти автоімунної тиреоїдної патології прямо пропорційне забрудненню довкілля [10].
Серед ендокринних захворювань патологія ЩЗ трапляється досить часто. За даними ВООЗ, страждає 7 % населення земної кулі. В Україні тиреоїдити у 2017 році становили 13,8 % від усієї тиреоїдної патології, гіпотиреоз — 7,5 %, гіпертиреоз — 4,1 % [11]. Відзначається також і зростання поширеності автоімунного тиреоїдиту в Україні. За останніх 10 років цей показник зріс на 82 % в перерахунку на 100 тис. населення. Тому не дивно, що автоімунний тиреоїдит — найпоширеніша тиреоїдна патологія (20–30 % від загальної кількості випадків ураження щитоподібної залози в Україні) [11].
Різні варіанти тиреоїдної дисфункції завдяки наявності у гормонів ЩЗ гастроінтестинальних ефектів часто супроводжують порушення моторики та секреції органів травлення, що підкреслює важливу роль ЩЗ у розвитку захворювань шлунково-кишкового тракту [12]. В окремих працях показано, що гіпермоторика шлунка, спорожнення якого відбувається швидше, ніж у нормі, спостерігається на початкових етапах гіпертиреозу [5]. При наростанні ступеня тяжкості та тривалості захворювання виявляється зниження моторно-евакуаторної функції шлунка та секреції гастрину. Дефіцит тиреоїдних гормонів призводить до зниження моторної активності шлунка зі зниженням об’єму шлункового соку та збільшенням рівня гастромукопротеїдів.
Суперечливі дані представлені щодо вивчення впливу гормонів ЩЗ на структурні порушення слизової оболонки шлунка. З одного боку, є дані, що при гіпотиреозі, який виник після тиреоїдектомії, відбувається гальмування регенераційних процесів слизової оболонки шлунка (СОШ), спостерігається деструкція епітелію усіх відділів шлунка [13]. В деяких працях показано захисну дію тиреоїдектомії на СОШ або відсутність структурних змін шлунка при експериментальному атиреозі [14]. Немаловажну роль в роботі ЩЗ відіграє гормон гіпофізу — тиреотропний гормон, вміст якого залежить від рівня тиреоїдних гормонів.
Вогнищеві зміни структури залози зустрічаються часто, серед них доброякісні вузлові (нодулярні) зоби становлять 80–90 % [15]. Однак у клінічній практиці є категорія пацієнтів, в яких при сонографічному дослідженні вузлових змін ЩЗ виявлено нормальні рівні гормональної панелі.
Для оцінки структурних змін ЩЗ протягом останніх десятиліть найкращим методом візуалізації є ультразвукова діагностика (УЗД). За допомогою УЗД можна оцінити об’єм, структуру і розміщення щитоподібної залози. Переваги УЗД очевидні: швидкість, безболісність, неінвазивність, доступність, абсолютна нешкідливість методу дозволяє виконувати високоточні та інформативні дослідження. В групах осіб з факторами ризику тіреоїдних захворювань УЗД може використовуватись як скринінговий метод [16].
У своєму дослідженні ми вирішили зосередити увагу на структурно-функціональних змінах ЩЗ в пацієнтів з передраковими станами шлунка, оскільки на сьогодні саме ця проблема практично не вивчена. Згідно з європейськими рекомендаціями Guidelines for the Management of Precancerous Conditions and Lesions in the Stomach (MAPS II) (2019), серед передракових станів виділяють атрофію та кишкову метаплазію слизової оболонки шлунка [17].
Мета роботи: оцінити структурно-функціональні зміни паренхіми ЩЗ у хворих із передраковими станами шлунка.
Матеріали та методи
Дослідження проведено у 44 хворих із передраковими станами шлунка, серед обстежених хворих були 32 (72,7 %) жінки та 12 (27,3 %) чоловіків віком від 33 до 76 років, у середньому (59,7 ± 1,7) року. Верхню ендоскопію виконували з використанням системи EVIS EXERA III з гастроскопом Olympus 190 (Японія). При застосуванні функції вузькосмугової візуалізації (NBI) і ближнього фокусу наявність атрофії СОШ визначали при зникненні рисунка капілярної субепітеліальної мережі з безладно розташованими збирковими венулами. Діагностику кишкової метаплазії (КМ) здійснювали при виявленні в режимі NBI пласко-піднятих і пласко-заглиблених вогнищ, які в режимі збільшення мали регулярну гребенеподібну або тубуловільозну мікроструктуру, що у більшості випадків супроводжувалось позитивним симптомом LBC — наявністю світло-блакитних гребенів (чітко видимі блідо-блакитні лінії або звивини, розташовані на гребені поверхні епітелію). Поширеність КМ визначали за топографією (антральний відділ, тіло, дифузне поширення) [2].
За результатами ендоскопічного дослідження зі збільшенням та NBI-режимом пацієнти були розподілені на групи: І група — 11 хворих з атрофією СОШ без КМ; ІІ група — 13 пацієнтів з атрофією СОШ із КМ, обмеженою антральним відділом або тілом шлунка; ІІІ група — 8 осіб із дифузною КМ на фоні атрофії СОШ. Групи були репрезентативними за віком та статтю.
Усім обстеженим проводилось сонологічне дослідження ЩЗ на ультразвуковому сканері Toshiba Xario (Японія) з використанням мультичастотного лінійного трансдюсера, з частотою 5–12 МГц. Для аналізу структурних характеристик ЩЗ користувалися В-режимом, кольоровим і енергетичним допплером. При аналізі розмірів ЩЗ враховували просторову величину органа, що характеризується лише сумарним об’ємом залозистої тканини. Тиреоїдний об’єм розраховували за формулою J. Brunn, що відповідає стандартам ВООЗ (сума трьох розмірів лівої та правої часток ЩЗ в см3 помножена на коефіцієнт 0,479). Сумарний об’єм ЩЗ складається з суми об’єму обох часток, без урахування розмірів перешийка. У 2D-режимі оцінювали стан контурів, капсули, ехогенність структури залози, додаткові утворення, регіонарні лімфатичні вузли. Дослідження доповнювали оцінкою кровотоку методом допплерографії. У разі візуалізації неоднорідної структури внаслідок чередування ділянок різної ехогенності з фіброзними тяжами, ущільненою капсулою залози можна зробити припущення щодо тривалого хронічного процесу в залозі.
Для оцінки функціонального стану ЩЗ в сироватці крові визначали рівень тиреоглобуліну та тиреотропного гормону імуноферментним методом за допомогою відповідних наборів реактивів фірми «Вектор-БЕСТ» (м. Новосибірськ, Росія).
Порівняння середніх значень показників здійснювали за непараметричними методами статистичного аналізу (U-критерій Манна — Уїтні, критерій Краскела — Уолліса). Для порівняння розподілу якісних змінних використовували критерій хі-квадрат з поправкою Йейтса (χ2). Статистичну значимість різниці оцінювали на рівні, не нижчому ніж 95,0 % (вірогідність помилки р < 0,05). Для з’ясування характеру зв’язку між досліджуваними показниками використовували ранговий коефіцієнт кореляції Спірмена (r). Статистичне опрацювання результатів виконали за допомогою пакета прикладних програм Statistica 6.1.
Результати
При вивченні стану ЩЗ за сонологічними даними у пацієнтів з передраковими станами було виявлено низку структурних змін (табл. 1).
В цілому структурні зміни паренхіми ЩЗ виявлено у 36 (81,8 %) обстежених хворих. У структурі порушень переважали дифузні зміни — 33 (75,0 %) випадки. При цьому найбільша їх частота відзначена серед хворих ІІІ групи, тоді як у І та ІІ групах дифузні зміни спостерігали у 1,5 раза рідше (χ2 = 7,44, р < 0,01 та χ2 = 5,93, р < 0,05 відповідно).
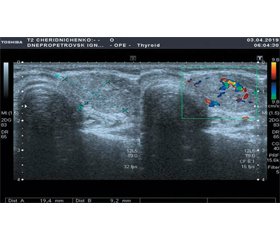
Вогнищеві зміни визначалися у 19 (43,2 %) хворих з передраковими станами шлунка, більшість з яких мали дифузну КМ на фоні атрофічних змін СОШ: 13 (65,0 %) випадків у ІІІ групі проти 3 (27,3 %) пацієнтів І групи (χ2 = 4,04, р < 0,05) та 3 (23,1 %) хворих ІІ групи (χ2 = 5,54, р < 0,05). На рис. 1 подана допплерограма вузла лівої частки ЩЗ у кольоровому та енергетичному режимі у хворого з дифузною КМ на фоні атрофії СО шлунка.
Частота КМ тіла й антрального відділу шлунка позитивно корелювала з наявністю вузлів у ЩЗ (r = 0,44, p = 0,003 і r = 0,40, p = 0,006 відповідно), що свідчить про взаємозв’язок між розвитком структурних змін у ЩЗ та розвитком передракових станів у СО шлунка.
У третини обстежених діагностовано гіперплазію ЩЗ і лише в одному випадку (ІІІ група) — гіпоплазію ЩЗ. Ультразвукові зміни, характерні для тиреоїдиту, хронічного автоімунного тиреоїдиту, аденоми та субтотальної резекції ЩЗ, виявлено в поодиноких випадках і не перевищували 10 % випадків у структурі тиреоїдної патології.
Розташування ЩЗ в усіх випадках було типовим, без зміни тіні трахеї. Середні значення тиреоїдного об’єму в обстежених хворих не виходили за межі норми та не мали вірогідної різниці в досліджуваних групах (табл. 2). Збільшення об’єму ЩЗ виявлено лише у 3 випадках — по одному в кожній з дослідних груп.
У хворих на передракові стани шлунка патологічна ознака контура ЩЗ у вигляді нерівності була виявлена у 3 (27,2 %) хворих ІІ групи та 7 (35,0 %) пацієнтів ІІІ групи. Нечітку візуалізацію контура діагностовано в 1 випадку в І групі, у 4 (36,4 %) хворих ІІ групи та у половини обстежених ІІІ групи. За даними кореляційного аналізу, нерівність контурів ЩЗ прямо корелювала з частотою вогнищевих гіперплазій СОШ, що характерні для атрофічно-гіперпластичного гастриту, наявність якого свідчить про виражені структурні зміни СОШ передракової спрямованості (r = 0,41, p = 0,03).
Ущільнену капсулу ЩЗ відзначено у 4 (36,4 %) пацієнтів з лише атрофічними змінами СОШ, що виявилося в 1,5 раза рідше порівняно з ІІ групою (р > 0,05) та у 2,0 раза — порівняно з ІІІ групою (χ2 = 4,47, р < 0,05) (табл. 3), що свідчить про тривалість хронічного процесу.
Збільшення щільності капсули ЩЗ, що спостерігається при тривалому перебігу тиреоїдного процесу, корелювало зі збільшенням частоти вогнищевих гіперплазій СОШ (r = 0,49, p = 0,04) і вираженістю атрофії СО тіла шлунка (r = 0,54, p = 0,004).
Зміни структури паренхіми ЩЗ виявлено у 37 (84,1 %) обстежених пацієнтів, при цьому частота структурних змін ЩЗ збільшувалася у міру поглиблення перебудовних змін шлунка, що підтверджується позитивним кореляційним зв’язком між змінами структури ЩЗ у вигляді неоднорідності паренхіми і наявністю ксантом СОШ, що є маркерами передракових станів СОШ (r = 0,52, p = 0,03). При розвитку КМ у СОШ в 3 рази збільшувалась частота спостереження фіброзних тяжів у ЩЗ, що є ознакою тривалого перебігу запального процесу в залозі.
Зміну ехогенності ЩЗ відзначено у 18 (40,9 %) хворих. Здебільшого зміни ехогенності паренхіми залози проявлялися її підвищенням, лише в 3 випадках ІІІ групи спостерігалася знижена ехогенність ЩЗ.
У хворих лише з атрофічними змінами СОШ частіше зустрічалася дрібна зернистість паренхіми — 7 (63,6 %) випадків, тоді як для пацієнтів з дифузною КМ характерною була великозерниста паренхіма ЩЗ, що виявлялася у 1,3 раза частіше порівняно з ІІ групою та в 1,7 раза порівняно з І групою, проте кореляційного зв’язку між різною зернистістю паренхіми ЩЗ і передраковими станами СО не виявлено.
Сонограми паренхіми ЩЗ обстежених хворих подано на рис. 2.
Ознаки лімфаденопатії спостерігалися лише у 2 (10,0 %) хворих з дифузною КМ на фоні атрофії СО шлунка.
Крім структурних особливостей ЩЗ нами було вивчено функціональний стан органа при прогресуванні патологічних змін СОШ передракової спрямованості. Так, аналіз рівня гормонів показав, що у більшості пацієнтів вміст тиреоглобуліну та тиреотропного гормону відповідав значенням норми, що вказує на збереження функції ЩЗ. Лише в одному випадку встановлено підвищення рівня тиреоглобуліну вище від нормальних значень, зниження вмісту тиреотропного гормону спостерігали в 3 (6,8 %) випадках та збільшення його рівня — в 2 (4,5 %) випадках. Слід відзначити, що 5 (11,4 %) обстежених хворих приймають L-тироксин.
Згідно з оцінкою функціонального стану ЩЗ по групах, виявлено збільшення рівня тиреоглобуліну у хворих із дифузною КМ на фоні атрофії СОШ — медіана становила 9,5 мОд/мл (3,1; 17,4) проти 2,5 мОд/мл (1,2; 6,3) у пацієнтів з лише атрофічними змінами СОШ та 2,9 мОд/мл (0,8; 5,8) у осіб з КМ, обмеженою антральним відділом шлунка (рис. 3). За результатами Kruskal-Wallis test, вірогідність різниці рівня тиреоглобуліну в обстежених хворих трьох груп становила 0,0134.
Одночасно спостерігали зниження вмісту тиреотропного гормону у міру поглиблення перебудовних змін СО шлунка. У хворих ІІІ групи медіана рівня тиреотропного гормону становила 0,8 мОд/мл (0,6; 1,3) і була вірогідно знижена в 1,9 раза (р < 0,05) відносно рівня гормону в І групі — 1,5 мОд/мл (1,3; 2,4) та в 1,6 раза (р < 0,05) порівняно з медіаною рівня гормону у хворих ІІ групи — 1,1 мОд/мл (0,6; 2,3). За результатами Kruskal-Wallis test, вірогідність різниці рівня тиреотропного гормону в обстежених груп хворих становила 0,0474 (рис. 4).
За даними кореляційного аналізу встановлено зворотний зв’язок рівня тиреотропного гормону в сироватці крові хворих з об’ємом ЩЗ за показниками УЗД (r = –0,43, р < 0,05) та наявністю КМ в тілі шлунка (r = –0,46, р < 0,05).
Обговорення
Аналіз літературних даних показав, що ЩЗ і шлунок мають деякі ембріологічні, біохімічні схожі особливості та генетичну спільність, що і визначає єдині патогенетичні механізми формування низки захворювань ЩЗ і шлунка, зокрема автоімунних захворювань ЩЗ і автоімунного гастриту [6, 7]. Проте досліджень, які стосуються взаємозв’язку між атрофічним гастритом і хворобами ЩЗ, украй мало, значна кількість з них застарілі.
Під час роботи нами було виявлено низку структурних змін ЩЗ за сонологічними даними у більшості пацієнтів з передраковими станами шлунка. Так, відзначено суттєве збільшення частоти дифузних та вогнищевих змін у ЩЗ пацієнтів із дифузним поширенням КМ в шлунку (p < 0,05), що підтверджено кореляційним зв’язком частоти КМ тіла і антрального відділу шлунка з наявністю вузлів у ЩЗ (r = 0,44, p = 0,003 і r = 0,40, p = 0,006 відповідно). Водночас збільшення частоти вогнищевих гіперплазій СОШ асоціювалося з нерівністю контурів ЩЗ (r = 0,41, p = 0,03) та збільшенням щільності капсули ЩЗ (r = 0,49, p = 0,04), що є ознаками хронічного запального процесу.
Одним із можливих факторів, які впливають на функціонально-морфологічний стан шлунка, є гормональний дисбаланс ЩЗ, однак дані щодо впливу гормонів ЩЗ на СОШ є достатньо суперечливими. За нашими даними, поширення КМ СОШ супроводжувалось збільшенням рівня тиреоглобуліну у понад 3 рази (р = 0,0134). При цьому вміст тиреотропного гормону вірогідно знижувався у міру поглиблення перебудовних змін СОШ (р = 0,0474), а встановлений кореляційний зв’язок рівня цього гормону з наявністю КМ в тілі шлунка (r = –0,46, р < 0,05) свідчить про необхідність подальшого вивчення ролі гормонів ЩЗ у розвитку передракових станів шлунка.
Висновки
1. У хворих на передракові стани шлунка спостерігається висока частота структурних змін паренхіми щитоподібної залози (81,8 %) як дифузного (75,0 %), так і вогнищевого (43,2 %) характеру.
2. Поширення КМ в СОШ корелює зі структурними змінами паренхіми ЩЗ, що супроводжується вірогідним збільшенням вмісту тиреоглобуліну та зниженням рівня тиреотропного гормону в сироватці крові.
3. Частота структурних змін ЩЗ збільшується у міру поглиблення перебудовних змін шлунка, що підтверджується позитивним кореляційним зв’язком між змінами структури ЩЗ і наявністю ксантом СОШ, що є маркерами передракових станів СОШ (r = 0,52, p = 0,03).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.

/11.jpg)
/12.jpg)
/12_2.jpg)
/13.jpg)