Резюме
Актуальність. Знижена кісткова маса (ЗКМ) у вигляді остеопенії (Оп) й остеопорозу (ОП) є однією з найбільш актуальних проблем охорони здоров’я. Постменопаузальний період у жінок вважається основним фактором ризику розвитку патологічного процесу. Мета дослідження: оцінити клініко-патогенетичні особливості ЗКМ у менопаузальних жінок. Матеріали та методи. Під наглядом перебувала 261 неменструююча жінка, середній вік 48 років, у яких в 91 % випадків мала місце фізіологічна менопауза, а у решти — патологічна. Критеріями виключення були жінки із запальними ревматичними хворобами суглобів, онкологічною патологією, захворюваннями системи крові та щитоподібної залози, які одержували глюкокортикоїдні гормони й антиконвульсанти. У 133 (51 %) жінок встановлено ЗКМ (основна група) у співвідношенні Оп і ОП 4 : 1, для діагностики якої застосовували методи рентгенівської абсорбціометрії та ультразвукової денситометрії. Серед маркерів кісткового метаболізму вивчали рівні в крові паратирину (паратгормону), кальцитоніну, остеокальцину, остеопонтину, лужної фосфатази й остеоасоційованих хімічних елементів. При обстеженні використовували біохімічний, імуноферментний, атомно-емісійний та атомно-абсорбційний методи. Результати. Вік жінок корелює з параметрами мінеральної щільності кісток, а розвиток ЗКМ у всіх випадках пов’язаний з високими показниками в крові остеокальцину, у 1/2 з них — остеопонтину, залежить від наявності коморбідних артеріальної первинної гіпертензії, цукрового діабету типу 2 і лейкоцитокластичного васкуліту. Від Оп формування ОП вірогідно відрізняється більш високими рівнями в крові паратирину (на 47 %), лужної фосфатази (на 19 %), фосфору (на 9 %) і свинцю (на 27 %), але меншими значеннями кальцію (на 4 %), причому активність лужної фосфатази має прогнознегативну значущість щодо вираженості ЗКМ. У патогенезі останнього беруть участь також кальцитонін, магній, стронцій та цинк. Висновки. ЗКМ розвивається у кожної другої жінки в постменопаузальному періоді, а подальша розробка патогенетичної терапії повинна бути спрямована на корекцію концентрацій в організмі остеокальцину й остеопонтину, причому критерієм ефективності лікувальних заходів може бути пригнічення активності лужної фосфатази.
Актуальность. Сниженная костная масса (СКМ) в виде остеопении (Оп) и остеопороза (ОП) является одной из наиболее актуальных проблем здравоохранения. Постменопаузальный период у женщин считается основным фактором риска развития патологического процесса. Цель исследования: оценить клинико-патогенетические особенности СКМ у женщин в постменопаузальном периоде. Материалы и методы. Под наблюдением находилась 261 неменструирующая женщина, средний возраст 48 лет, у которых в 91 % случаев имела место физиологическая менопауза, а у остальных — патологическая. Критериями исключения были женщины с воспалительными ревматическими болезнями суставов, онкологической патологией, болезнями системы крови и щитовидной железы, получавшие глюкокортикоидные гормоны и антиконвульсанты. У 133 (51 %) женщин установлена СКМ (основная группа) в соотношении Оп и ОП 4 : 1, для диагностики которой применяли методы рентгеновской абсорбциометрии и ультразвуковой денситометрии. Среди маркеров костного метаболизма изучали уровни в крови паратирина (паратгормона), кальцитонина, остеокальцина, остеопонтина, щелочной фосфатазы и остеоассоциированных химических элементов. При обследовании использовали биохимический, иммуноферментный, атомно-эмиссионный и атомно-абсорбционный методы. Результаты. Возраст женщин коррелирует с параметрами минеральной плотности костей, а развитие СКМ во всех случаях связано с высокими показателями в крови остеокальцина, у 1/2 из них — остеопонтина, зависит от наличия коморбидных артериальной первичной гипертензии, сахарного диабета типа 2 и лейкоцитокластического васкулита. От Оп формирование ОП достоверно отличается более высокими уровнями в крови паратирина (на 47 %), щелочной фосфатазы (на 19 %), фосфора (на 9 %) и свинца (на 27 %), но меньшими значениями кальция (на 4 %), причем активность щелочной фосфатазы имеет прогнознегативную значимость в отношении выраженности СКМ. В патогенезе последнего участвуют также кальцитонин, магний, стронций и цинк. Выводы. СКМ развивается у каждой второй женщины в постменопаузальном периоде, а дальнейшая разработка патогенетической терапии должна быть направлена на коррекцию концентраций в организме остеокальцина и остеопонтина, причем критерием эффективности лечебных мероприятий может быть угнетение активности щелочной фосфатазы.
Background. Low bone mass (LBM) in the form of osteopenia (Op) and osteoporosis (OP) is one of the most pressing public health problems. Рostmenopausal period in women is considered the main risk factor for the development of the pathological process. Objective of the research was to assess the clinical and pathogenetic features of LBM in women with menopause. Materials and methods. 261 non-menstruating women with an average age of 48 years were observed, physiological menopause occurred in 91 % of cases, and pathological in the rest. Exclusion criteria were women with inflammatory rheumatic diseases of the joints, oncological pathology, diseases of the blood system and thyroid gland, who received glucocorticoid hormones and anticonvulsants. In 133 (51 %) women, LBM (main group) was established in the ratio Op and ОР 4 : 1; diagnosis being made by the methods of conventional radiography and densitometry. Among the markers of bone metabolism, the following were used: blood levels of parathyrin (parathyroid hormone), calcitonin, osteocalcin, osteopontin, alkaline phosphatase, and osteo-associated chemical elements. During the examination, biochemical, enzyme immunoassay, atomic emission and atomic absorption methods were used. Results. The age of women correlates with the parameters of bone mineral density, and the LBM in all cases is associated with high blood levels of osteocalcin, in 1/2 of them — osteopontin, depends on the presence of comorbid primary arterial hypertension, type 2 diabetes mellitus, and leukocytoclastic vasculitis. OP formation significantly differs from Op in higher blood levels of parathyrin (by 47 %), alkaline phosphatase (by 19 %), phosphorus (by 9 %) and lead (by 27 %), but lower calcium values (by 4 %), moreover, the activity of alkaline phosphatase has predictive negative significance in relation to the severity of the LBM. Calcitonin, magnesium, strontium and zinc also participate in the pathogenetic constructions of the latter. Conclusions. LBM develops in every second postmenopausal woman, and the further development of pathogenetic therapy should be aimed at correcting the concentration of osteocalcin and osteopontin in the body, and inhibition of alkaline phosphatase activity may be a criterion for the effectiveness of therapeutic measures.
Введение
Сниженная костная масса (СКМ) в виде остеопении (Оп) и остеопороза (ОП) характеризуется хрупкостью скелета и подверженностью людей переломам, обусловленным уменьшением костной массы и ухудшением микроархитектуры кости [1]. Это метаболическое заболевание костей является серьезной проблемой здравоохранения во всех странах из-за высокой заболеваемости, смертности и значительных затрат на медицинское обслуживание [2]. В мире только ОП страдают более 200 миллионов человек [3], при этом он вызывает 1,5 миллиона переломов позвонков, бедренной кости и костей предплечья, затраты на лечение которых только в США составляют свыше 10 миллиардов долларов в год [4].
Хорошо известен половой диморфизм течения СКМ [5] со значительным превалированием ее частоты у женщин после наступления менопаузы, когда ломкость костей более выражена [6], а остеопоротические переломы позвоночника встречаются втрое чаще, но патогенез СКМ у таких неменструирующих женщин изучен недостаточно [7].
Цель исследования: оценить характер течения СКМ у постменопаузальных женщин, определить роль изменений костного метаболизма в формировании нарушений минеральной плотности кости (МПК).
Материалы и методы
В одномоментном исследовании под наблюдением находилась 261 неменструирующая женщина в возрасте от 34 до 72 лет (в среднем 48,40 ± 0,54 года). У 90,8 % из них наступила физиологическая менопауза, в 3,1 % наблюдений констатирована ранняя менопауза, соответственно в 3,5 % случаев имели место позднее начало менструаций и аменорея, в 2,7 % выполнена на предыдущих этапах овариэктомия, 4,6 % женщин были бесплодны. Критериями исключения были женщины с ревматическими болезнями костно-суставного аппарата, заболеваниями щитовидной железы и системы крови, со злокачественными опухолями, хронической болезнью почек II–IV стадий, лица, получавшие глюкокортикоидные гормоны и антиконвульсанты, т.е. те факторы, которые могли влиять на костный метаболизм с развитием СКМ.
Обследуемые женщины были распределены на две группы: 133 (51 %) женщины с СКМ (основная) и 128 (49 %) — с нормальной плотностью костей (группа сравнения). Контрольную группу составили 30 практически здоровых менструирующих женщин в возрасте от 23 до 48 лет (в среднем 35,50 ± 2,31 года). Исследование было одобрено этическим комитетом Донецкого национального медицинского университета, все обследуемые лица подписали добровольное информированное согласие на участие в нем.
Для диагностики СКМ использовали рентгенологический аппарат Multix-Compact-Siеmens (Германия), двухэнергетический рентгеновский денситометр для измерения МПК на уровне проксимального отдела бедренной кости QDR-4500-Delphi-Hologic (США), сонограф Envisor-Philips (Нидерланды), с помощью которого изучали скорость распространения ультразвука, его широкополосное ослабление, а у некоторых женщин — магнитно-резонансный томограф Signa-Excite-HD (Германия). МПК оценивали по Т-индексу (ТИ) остеоденситограмм, рентгенологическим индексам Барнетта — Нордина (ИБН), Рохлина (ИР) и клиновидности (ИК). В сыворотке крови исследовали активность щелочной фосфатазы (AP) с помощью биохимического анализатора Olympus-AU-640 (Япония), определение концентраций паратирина (паратгормона, PT), кальцитонина (CT), остеокальцина (OC) и остеопонтина (OP) проводили иммуноферментным методом (ридер PR2100-Sanofi diagnostic pasteur, Франция). Среди химических элементов изучали содержание в крови кальция (Ca), кобальта (Co), хрома (Cr), меди (Cu), магния (Mg), марганца (Mn), фосфора (P), олова (Pb), селена (Se), стронция (Sr) и цинка (Zn), применяя атомно-эмиссионный спектрометр с индуктивно связанной аргоновой плазмой IRIS-Intepid-II-XDL и атомно-абсорбционный спектрометр SolAAr-Mk2-MOZe с электрографитовым атомизатором (Великобритания).
Статистическая обработка полученных результатов выполнена с помощью компьютерного вариационного непараметрического корреляционного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные ошибки (SE) и отклонения (SD), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии однофакторной дисперсии (D), ее однородности Брауна — Форсайта (BF) и многофакторной Уилкоксона — Рао (WR), различий Стьюдента (t) и Мак-Немара — Фишера (χ2), достоверность статистических показателей (р). Подсчитывали прогностически позитивный результат модели (PPV).
Результаты
У 79 % от числа женщин с СКМ установлена Оп, а у остальных 21,1 % (или 10,7 % от общего числа) — ОП. У женщин с СКМ оказалась большей на 41 % частота коморбидной артериальной гипертензии (χ2 = 5,59; p = 0,02), а сопутствующий уролитиаз имел место только в таких случаях (χ2 = 4,91; p = 0,03). Лишь у таких женщин диагностировали случаи лейкоцитокластического васкулита, хронического обструктивного заболевания легких и туберкулеза.
По данным дисперсионного анализа и непараметрического коэффициента корреляции Кендалла, на развитие СКМ оказывает прямое влияние (p < 0,001) возраст женщин (D = 95,12; τ = +0,23). Установлена зависимость формирования СКМ от наличия первичной (эссенциальной) артериальной гипертензии (D = 4,45; p = 0,013), сахарного диабета (D = 13,97; p < 0,001) и лейкоцитокластического васкулита (D = 13,82; p < 0,001). В свою очередь, как свидетельствует многофакторный анализ Уилкоксона — Рао, сама СКМ способна оказывать влияние на интегральный характер сопутствующей патологии (WR = 3,13; p = 0,005). Возраст женщин с высокой достоверностью (p < 0,001) влияет на все изученные показатели МПК, что подтверждают дисперсионно-корреляционные связи с ТИ (BF = 30,37; τ = +0,22), ИБН (BF = 3,76; τ = –0,17), ИР (BF = 3,83; τ = –0,24) и ИК (BF = 7,09; τ = +0,25).
Неменструирующие женщины группы сравнения (без СКМ) отличаются от менструирующих практически здоровых женщин большими (в 2,8 раза) показателями в крови ОС (t = 14,31; p < 0,001) и на 29,6 % Sr (t = 4,02; p < 0,001) на фоне уменьшения содержания OP на 32 % (t = 3,30; p = 0,001), Са на 12,9 % (t = 3,84; p < 0,001) и Cu на 9,1 % (t = 2,86; p = 0,005). В случаях отсутствия СКМ уровень РТ в крови составил 27,30 ± 0,75 пг/мл, СТ — 15,70 ± 0,28 пг/мл, ОС — 12,50 ± 0,26 нг/мл, ОР — 14,00 ± 1,83 нг/мл, АР — 99,90 ± 2,19 Е/л, Са — 87,40 ± 1,59 мг/л, P — 404,40 ± 3,79 мг/л, Mg — 29,80 ± 0,25 мг/л, Co — 8,2 ± 0,3 мкг/л, Cr — 1,40 ± 0,06 мкг/л, Cu — 1,00 ± 0,02 мг/л, Mn — 15,60 ± 1,12 мкг/л, Pb — 55,60 ± 3,29 мкг/л, Se — 105,50 ± 2,18 мкг/л, Sr — 43,30 ± 1,08 мкг/л, Zn — 6,60 ± 0,08 мг/л.
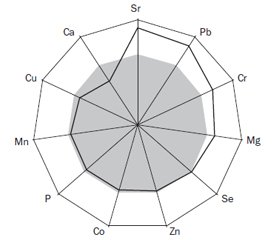
Женщины, страдающие Оп и ОП (рис. 1), характеризуются большими показателями (соответственно на 53,1 % и в 2,3 раза) РТ (t = 8,89, p > 0,001; t = 20,10, p < 0,001), на 29,6 и 33,6 % ОС (t = 9,01, p < 0,001; t = 6,24, p < 0,001), соответственно в 3,2 раза ОР (t = 10,94, p < 0,001; t = 10,42, p < 0,001), на 26,6 и 50,7 % АР (t = 7,47, p < 0,001; t = 10,67, p < 0,001), на 13,4 и 19,8 % Mg (t = 5,77, p < 0,001; t = 10,21, p < 0,001), на 9,2 и 16,9 % Sr (t = 2,26, p = 0,025; t = 2,88, p = 0,005) при уменьшении на 45,9 и 49 % СТ (t = 14,93, p < 0,001; t = 10,47, p < 0,001), на 31,3 и 34,3 % Са (t = 15,45, p < 0,001; t = 8,79, p < 0,001), соответственно на 9,1 % Zn (t = 4,30, p < 0,001; t = 3,14, p = 0,002).
/59.jpg)
При СКМ частота отклонений показателей маркеров костного метаболизма (МКМ) < M ± SD > менструирующих женщин контрольной группы была следующей: повышение содержания в крови РТ, ОС, ОР, AР, Mg, Cr, Pb, Se и Sr соответственно установлено в 33; 100; 49,4; 42,9; 7,3; 15,3; 3,5; 19,9 и 41 % случаев, а уменьшение СТ, Са, Р, Со, Cu, Mn и Zn — в 39,9; 3,1; 15,7; 6,1; 10,7; 0,8 и 17,2 %. На рис. 2 представлены различия трехмерных интегральных гистограмм остеоассоциированных макроэлементов (Ca + P + Mg) у женщин разных групп.
/59_2.jpg)
Существуют у женщин с СКМ корреляционные связи показателей МПК с уровнями в крови PT, CT, OC, OP, AP, Ca, Mg и Pb (значения ТИ и ИК разнонаправлены по отношению к ИБН и ИР). Кроме того, показатель ИБН обратно коррелирует с содержанием в крови Cu (r = –0,343; p = 0,008), ИР — с Со (r = –0,437; p = 0,001), а ИК прямо соотносится с концентрацией Sr (r = +0,277; p = 0,047). При сравнении женщин с ОП и Оп оказалось, что ОП протекает с достоверно большим (на 47,4 %) уровнем в крови РТ (t = 6,41; p < 0,001), на 19 % АР (t = 4,27; p < 0,001), на 9,4 % Р (t = 4,97; p < 0,001) и на 26,9 % Pb (t = 2,58; p = 0,011), но меньшей на 4,3 % концентрацией Са (t = 5,16; p < 0,001).
Обсуждение
Маркеры костного метаболизма образуют при СКМ у постменопаузальных женщин единый гомеостатический механизм регуляции обмена Са и Р [8]. РТ оказывает негативное влияние на структуру костной ткани [9], а при снижении концентрации Са у женщин с СКМ может возрастать секреция РТ и остеокласты увеличивают растворение минеральных соединений, содержащихся в костях. В случаях гипокальциемии обычно уменьшается секреция СТ, который воздействует на остеобласты, происходит повышение продукции кальцитриола, в результате чего увеличивается мобилизация Са и Р из костей. Гамма-карбоксилированный белок ОС синтезируется остеобластами, а процессы минерализации костной ткани регулируются витамином D [10]. Доказана значимость в патогенезе СКМ у неменструирующих женщин воздействий ОС на остеобласты через процессы остеокластогенеза с усиленным синтезом провоспалительного интерлейкина-6 [11], инсулиноподобного фактора роста, остеопротегерина, ядерного фактора kB [12, 13], С-телопептида коллагена [14].
Изменения в организме постменопаузальных женщин содержания Sr являются одним из факторов, индуцирующих СКМ. Этот микроэлемент по отношению к кости обладает антирезорбтивным действием, уменьшает дифференцировку остеокластов, стимулирует образование кости через пролиферацию преостеобластов. Необходимо отметить, что, по нашим данным, СКМ у неменструирующих женщин сопровождается увеличением стронцемии, которое превалирует в случаях ОП. В связи с этим отметим, что повышенное содержание ионов Sr, замещая ионы Са в костях, может вызывать ломкость последних. Для реализации деструктивного действия матриксных металлопротеиназ на кости у больных СКМ необходимо наличие ионов Zn. В присутствии Zn аггреканаза, желатиназа, коллагеназа, стромелизин и эластаза вовлекают в патогенез костной патологии нарушения соотношений между аггреканом, бигликаном, верзиканом, декорином, фибромодулином и фибронектином. Отметим, что у женщин с СКМ уровень Zn в сыворотке крови, возможно, уменьшается за счет связывания с протеинами.
На формирование параметров МПК не оказывают влияния уровни в крови Со, Mn и Pb, а с концентрацией Cr и Se был связан только ИК (соответственно D = 2,00, p = 0,003 и D = 1,46, p = 0,049). С учетом выполненного вариационного дисперсионного и корреляционного анализа нами сделано заключение, имеющее практическую направленность: показатель активности в крови АР > 158 Е/л (> M + SD женщин с ОП) отражает тяжелое течение имеющегося СКМ (PPV = 76 %).
Выводы
Таким образом, СКМ (в соотношении Оп и ОП 4 : 1) развивается у каждой второй неменструирующей женщины, что во всех случаях связано с высокими показателями в крови ОС, у 1/2 из них — ОР, зависит от наличия коморбидных артериальной первичной гипертензии, СД и лейкоцитокластического васкулита, причем от Оп формирование ОП достоверно отличается более высокими уровнями в крови PT, P, Pb и АР (имеет прогнознегативную значимость), но меньшими значениями Са, а в патогенезе СКМ участвуют также СТ, Mg, Sr и Zn.
Конфликт интересов, финансовая поддержка. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждения.
Информация о вкладе каждого автора: Синяченко О.В. — концепция исследования и написание текста; Климовицкий Ф.В. — сбор и статистическая обработка результатов исследования; Морозюк Д.М. — инструментальное и лабораторное обследование женщин; Ермолаева М.В. — анализ данных литературы, дизайн исследования и анализ полученных данных; Ливенцова Е.В. — анализ полученных данных и иллюстрации.
Список литературы
1. Sugimoto T., Sato M., Dehle F.C. et al. Lifestyle-related metabolic disorders, osteoporosis, and fracture risk in Asia: A systematic review. Value Health Reg. Issues. 2016. 9(1). 49-56. doi: 10.1016/j.vhri.2015.09.005.
2. Wong S.K., Chin K.Y., Suhaimi F.H. et al. The relationship between metabolic syndrome and osteoporosis: a review. Nutrients. 2016. 8(6). S347. doi: 10.3390/nu8060347.
3. Reginster J.Y., Burlet N. Osteoporosis: a still increasing prevalence. Bone. 2016. 38(2). 4-9.
4. Nayak N.K., Khedkar C.C., Khedkar G.D., Khedkar C.D. Osteoporosis: encyclopedia of food and health. Oxford: Academic Press, 2016.
5. Ochsmann E., Raјger H., Kraus T., Drexler H. Gender-specific risk factors for acute low back pain: starting points for target-group-specific prevention. Schmerz. 2019. 29(4). 55-8. doi: 10.1016/S2213-8587(14)70055-5.
6. D’Amelio P., Rossi P., Isaia G., Lollino N. Bone mineral density and singh index predict bone mechanical properties of human femur. Connect. Tissue Res. 2008. 49(2). 99-104. doi: 10.1093/ageing/afq034.
7. Horikawa K., Kasai Y., Yamakawa T., Sudo A. Prevalence of osteoarthritis, osteoporotic vertebral fractures, and spondylolisthesis among the elderly in a Japanese village. J. Orthop. Surg. 2016. 14(1). 9-12.
8. Rousseau J.C., Delmas P.D. Biological markers in osteoarthritis. Nat. Clin. Pract. Rheumatol. 2017. 3(6). 346-56. doi: 10.1038/s41598-020-58760-7.
9. Hintzpeter B., Scheidt-Nave C., Müller M.J. Higher prevalence of vitamin D deficiency is associated with immigrant background among children and adolescents in Germany. J. Nutrition. 2018. 138(8). 1482-90. doi: 10.1359/jbmr.2018.18.12.2180.
10. Hari Kumar K.V., Muthukrishnan J., Verma A., Modi K.D. Correlation between bone markers and bone mineral density in postmenopausal women with osteoporosis. Endocr. Pract. 2018. 14(9). 1102-7.
11. Pernow Y., Granberg B., Weidenhielm L. Osteoblast dysfunction in male idiopathic osteoporosis. Calcif. Tissue Int. 2016. 78(2). 90-7. doi: 10.1371/journal.pone.0129116.
12. Nakamura M., Nakamichi Y., Nakamura H., Udagawa N. Osteoclastogenesis and bone resorption. Nippon Rinsho. 2009. 67(5). 889-96.
13. Xu R. Effect of whey protein on the proliferation and differentiation of osteoblasts. J. Dairy Sci. 2009. 92(7). 3014-8. doi: 10.3892/mmr.2009.1572.
14. Trento L.K., Pietropolli A., Ticconi C., Gravotta E. Role of type I collagen C telopeptide, bone-specific alkaline phosphatase and osteocalcin in the assessment of bone status in postmenopausal women. J. Obstet. Gynaecol. Res. 2009. 35(1). 152-9.
/59.jpg)

/59_2.jpg)