Хронічна кропив’янка (ХК) — складна міждисциплінарна патологія, що, за даними експертів європейських країн та США, вражає близько 1–3 % загальної популяції як дорослих, так і дітей [1, 2]. І якщо ще 10 років тому вважалось, що хворіють переважно підлітки та дорослі пацієнти, то сьогодні в нашій практиці є випадки виникнення цього захворювання в дітей першого року життя. Крім того, у 40–50 % хворих не вдається ідентифікувати причину ХК, навіть незважаючи на сучасні можливості лабораторної та інструментальної діагностики, а в близько половини з них прояви кропив’янки супроводжуються ангіонабряком, у тому числі набряком гортані, що є життєзагрожуючим станом [3].
За твердженням наших італійських колег Carlo Caffarelli, Francesco Paravat та ін., існує чимало рекомендацій із приводу діагностики та лікування хронічної кропив’янки, але жодне з них не стосується виключно педіатричної практики, що свідчить про складнощі діагностики цієї патології в дітей. Один із небагатьох таких клінічних гайдлайнів був розроблений останнім часом та надає інформацію щодо ведення дітей із ХК [4].
Метою досліджень, що сьогодні проводяться серед пацієнтів із ХК, є виявлення задіяних патогенетичних механізмів, оскільки це найбільш обґрунтований шлях до визначення етіологічного чинника. Це пріоритетний напрямок більшості необхідних наступних досліджень, що були визначені експертами EAACI/GA2LEN/EDF/WAO [5].
Хронічна кропив’янка в більшості настанов зазначена як група захворювань, що характеризуються розвитком пухирів, ангіонабряку або й того, й іншого щодня або майже щодня впродовж понад 6 тижнів або з короткими безсимптомними періодами на тлі медикаментозного лікування [1, 4–6], на противагу гострій кропив’янці, симптоми якої можуть персистувати до 6 тижнів. Але лікарі, які щільно працюють із такими пацієнтами, досить часто стикаються зі складнощами в остаточній верифікації ХК як діагнозу. Це пов’язано з необхідністю тривалого спостереження за пацієнтами, навіть, якщо був проведений максимально повний комплекс досліджень. У таких випадках, на наш погляд, існування діагнозу «рецидивуюча кропив’янка» цілковито обґрунтоване, тим більше, що Міжнародна класифікація хвороб 10-го перегляду з австралійською модифікацією (МКХ-10-АМ) дає таку можливість (L50.8 Кропив’янка хронічна та кропив’янка, що періодично повторюється). Хоча потенційно рецидивний перебіг пухирів підлягає диференціальній діагностиці, як при ХК, і має бути доведений до логічного завершення з формуванням коректного, згідно зі світовими консенсусами, діагнозу.
Що стосується класифікації, то максимально відповідає нагальним потребам класифікація ХК, наведена в табл. 1. Окремої класифікації для дитячого віку не існує.
Завдяки значним досягненням у вивченні патогенезу ХК класифікація 1988 року, запропонована S. Finemann та модифікована Е.С. Феденко у 2000 р., сьогодні є історичною [6].
Діагностичний пошук при рецидивах уртикаріїв має 3 напрямки: 1) виключити диференціальні діагностики; 2) оцінити активність захворювання, його вплив та рівень контролю; 3) виявити тригери, що спричиняють загострення. Тобто лікар, який стикається з проблемою ХК, передусім має відповісти на такі питання: чи є у мого пацієнта системні захворювання, що проявляються пухирями/ангіонабряком? Яка активність та як контролюється його захворювання, чи достатній обсяг лікування отримує пацієнт? Кропив’янка індукована чи спонтанна? Чим індукується? Який із можливих чинників спонтанної кропив’янки є у мого пацієнта? Із цих питань найпростішим виглядає питання про тяжкість та контрольованість хвороби, хоча і цей розділ потребує валідації опитувальників та шкал у педіатричній практиці. Але передусім слід прагнути до встановлення етіологічного фактора.
Індукована кропив’янка — це підгрупа ХК, що характеризується рецидивним утворенням сверблячих пухирів та/або ангіонабряку тривалістю більше 6 тижнів та спричинена специфічним фактором [7]. Тобто дія фактора передує появі специфічних ознак кропив’янки, і ми можемо утворити причинно-наслідкові зв’язки між ними. Якщо пухирі та/або ангіонабряк персистують більше 6 тижнів та виникають спонтанно, без чіткого зв’язку із зовнішнім стимулом, то таку кропив’янку ми розцінюємо як спонтанну. Згідно з табл. 1, до спонтанної кропив’янки відносять автоімунну форму та кропив’янку, спричинену інфекційними агентами, тому використовувати термін «ідіопатична» сьогодні не рекомендується [8].
Визначення клінічного типу ХК — дуже складне завдання, особливо в педіатрії, оскільки потребує широкого диференційного пошуку, що є дорогим, тривалим за часом, виснажливим морально як для пацієнта, так і для лікаря, а крім того, деякі тести не уніфіковані. Найімовірніше, діагностика та підбір терапії мають бути проведені спеціалістами-алергологами в спеціалізованих відділеннях. На наш погляд, навіть початкову діагностику має проводити алерголог, а не сімейний лікар, оскільки пацієнт, виснажений діагностикою, що не дає результату, потім може не дійти до спеціаліста.
Підходи до збору анамнезу
Анамнезу слід приділяти особливу увагу, тому що коректно зібрана історія хвороби дозволяє запобігти необґрунтованим діагностичним та лікувальним призначенням. При цьому важливо врахувати усі фактори, що можуть бути причиною висипу. Є тригери, які відомі і для яких встановлений зв’язок із виникненням симптомів. Ці фактори внесені до спеціальних опитувальників, які дозволять провести анамнестичний скринінг пацієнта і є квінтесенцією діагностичних питань, що рекомендовані робочою групою EAACI/GA²LEN/EDF/WAO 2017 р. [5] (див. нижче). Слід звертати увагу на те, що деякі фактори здебільшого провокують розвиток пухирів, а деякі — ангіонабряку. Відповіді на ці питання мають бути записані лікарем і ретельно проаналізовані. З огляду на те, що близько 50 % випадків спонтанної кропив’янки залишаються етіологічно не діагностованими, необхідно звертати увагу на найменші дрібниці (можливо, пізніше лікар зможе встановити зв’язок у разі повторної дії фактора). Усім нашим пацієнтам із ХК ми радимо вести щоденник самоспостереження, де необхідно відмічати дату виникнення висипу, тривалість елементів, можливі тригери, ефективність медикаментів (і навіть регрес висипу без використання ліків).
Крім того, у перелік питань, які рекомендовані експертами робочої групи EAACI/GA²LEN/EDF/WAO, ми включили специфічні для педіатричної практики питання: наявність інвазії гельмінтами та латентних бактеріальних або вірусних інфекцій, оскільки в дітей це досить частий чинник розвитку уртикаріїв [9]. Чому ми акцентуємо на анкетуванні так багато уваги? Тому що це дійсно один із найпотужніших інструментів у діагностиці ХК. Напевне, 70 % успіху залежить від анкетування.
Основні питання при зборі анамнезу пацієнта з хронічною кропив’янкою (згідно з EAACI/GA2LEN/EDF/WAO 2017 р., із модифікацією авторів)
1. Опис елементів висипу пацієнтом/представниками пацієнта — форма, розмір та розташування елементів висипки.
2. Час початку хвороби.
3. Частота та тривалість пухирів (обов’язкова фіксація елементів маркером для шкіри).
4. Добові коливання.
5. Зв’язок із мандрівками, святами або вихідними днями.
6. Наявність ангіонабряку.
7. Наявність суб’єктивних симптомів — свербіж, біль або інше.
8. Спадковість стосовно атопії та кропив’янки/ангіонабряку.
9. Попередні або наявні захворювання пацієнта — алергія, інфекції або захворювання внутрішніх органів.
10. Психосоматичні або психіатричні стани.
11. Хірургічні маніпуляції або наявність імплантів (у тому числі стоматологічні процедури).
12. Гастроентерологічні проблеми (характер випорожнень, наявність метеоризму тощо).
13. Чи провокують якісь фізичні стимули (тепло, холод, тиск та ін.) або фізичні вправи появу пухирів.
14. Використання медикаментів (використання будь-яких медикаментів має бути записане).
15. Чи є зв’язок із прийомом їжі — ця позиція має бути ретельно обговорена з пацієнтом із включенням питань щодо неімунологічних механізмів реакцій на їжу (використання їжі, що містить ксенобіотики; сьогодні це актуальне питання).
16. Наявність зв’язку з менструальним циклом.
17. Статус паління.
18. Характер праці пацієнта.
19. Хобі пацієнта.
20. Наявність стресу (хронічного або гострого, як позитивних емоцій, так і негативних).
21. Якість життя пацієнта, пов’язана з наявністю кропив’янки.
22. Попереднє лікування та відповідь пацієнта на нього (препарати, дози, тривалість).
23. Результати попередньої діагностики.
*24. Чи є домашні тварини? Чи проводиться їм дегельмінтизація? Чи є в дитини симптоми, що можуть бути асоційованими з гельмінтозами?
*25. Чи є в дитини гіпертрофія лімфоїдної тканини та персистуюча закладеність носа (ознаки наявності латентної інфекції).
Примітка: * — питання, додані авторами.
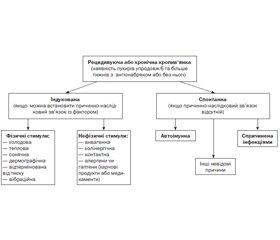
Після ретельної оцінки анамнестичних даних деякі можливі тригери можна виключити або підтвердити, як імовірні в провокації загострень у конкретного пацієнта. Залежно від цього і мають бути проведені наступні дослідження. Ми не розглядаємо в цій статті випадки ангіонабряку без кропив’янки (випадки негістамінергічного набряку), тому не розглядаємо тих обстежень, які необхідні в цьому разі. Для простішого уявлення про етіологію ХК ми користуємось графологічною структурою, наведеною на рис. 1, що розроблена нами за класифікацією та з урахуванням найбільш частих чинників того чи іншого виду кропив’янки. Необхідно пам’ятати, що виникнення пухирів може бути спричинено комбінацією дії декількох факторів. Зверніть увагу на те, що згідно із сучасною класифікацією досить цікаво розподілені фізичні та нефізичні стимули. Аквагенна кропив’янка належить до розділу впливу нефізичних чинників. Тоді як тепло, холод та сонце — до фізичних чинників (фізичні стимули опосередковують дегрануляцію тучних клітин прямо внаслідок механічної дії). Це розподіл робочий і може бути ще не один раз змінений під впливом нових даних щодо патогенезу цих субтипів кропив’янки. Але зараз ми наводимо ті дані, які актуальні сьогодні.
/40.jpg)
Наступним кроком у верифікації діагнозу є проведення лабораторної, інструментальної та специфічної алергологічної діагностики. Згідно з рекомендаціями експертів робочої групи рутинне використання усіх інструментів діагностики недоцільне, тому необхідні методи маємо обирати на підставі аналізу анамнезу.
Хронічна індукована кропив’янка, спричинена фізичними стимулами
Якщо в анамнезі є вказівка на зв’язок розвитку пухирів із дією фізичного стимулу, то це обов’язково має бути підтверджене провокаційними тестами. При цьому з урахуванням того, що в більшості пацієнтів реєструється не один, а декілька тригерів, провокаційні проби мають бути проведені з усіма фізичними факторами. Звісно, і в цьому розділі діагностики є проблемні питання, особливо в педіатрії, але останнім часом досягнуто значного прогресу в уніфікації цих тестів у дорослих, і ми можемо з обачністю використовувати їх і в дітей [4, 10]. Передусім акцентуємо вашу увагу на тому, що на результати провокаційних тестів можуть впливати різні фактори, в тому числі медикаменти, які отримує хворий, тому, як і перед проведенням прик-тестування, необхідно витримати так званий «період відмиву», строки якого для різних медикаментів представлені в табл. 2.
/41.jpg)
Окрім відміни лікарських засобів, слід здійснити оцінку стану ділянки шкіри, де ви плануєте провести тестування. Шкіра має бути неуражена. Необхідно обрати ту ділянку, де впродовж як мінімум 24 годин (за рекомендаціями експертів EAACI/GA2LEN/EDF/UNEV), а краще 3 днів не було пухирів (внаслідок феномена виснаження антитіл реакція може бути хибно негативною) [7]. З тієї ж причини тестування слід проводити не менше ніж через 2 тижні після перенесеного загострення будь-якого алергічного захворювання. Краще використовувати шкіру передпліччя та верхньої частини спини для того, щоб отримані дані можна було уніфікувати та порівнювати з даними інших дослідників. Якщо ви все ж провели провокаційну пробу, вона виявилась негативною, але ви майже впевнені у впливі тригера, слід повторити цей тест через деякий час.
При проведенні провокаційних проб із фізичними чинниками ми маємо на меті визначити, який саме фактор має значення для конкретного пацієнта, та встановити його пороговий рівень. У педіатрії це зробити складно, оскільки спеціалізовані відділення не оснащені необхідним обладнанням. Але завдяки роботі науковців усього світу є практичні рекомендації, які ми можемо втілювати в життя [7]. За ініціативи міжнародної організації GA2LEN у світі з 2015 року створено референтні центри з діагностики та лікування кропив’янки, особливістю яких є стандартизовані підходи. На жаль, в Україні не зареєстровано жодного UCARE центру (https://www.ga2len-ucare.com/centers.html) [13].
Розглянемо більш детально окремі типи індукованої кропив’янки та методологію їх визначення (табл. 3).
/42.jpg)
/43.jpg)
Симптоматичний дермографізм (уртикарний дермографізм, дермографічна кропив’янка) — форма фізичної кропив’янки, що характеризується виникненням свербежу та/або печіння шкіри, сверблячих пухирів (або ангіонабряку) внаслідок дії сили при терті, дряпанні або очищенні шкіри. Слід пам’ятати, що симптоматичний дермографізм може бути ранньою ознакою пігментного/системного мастоцитозу і тому потребує диференційного пошуку в цьому напрямку [14]. Залежно від мети (скринінг або детальна діагностика) є можливість використовувати різні інструменти для підтвердження цього діагнозу. Як представлено в підготовленій нами на підставі сучасних протоколів табл. 3, як скринінговий можна використовувати перший метод, що не потребує фінансових витрат, але не дає уяви про пороговий рівень дії тригерного фактора [15–17]. Для чого потрібно визначати пороговий рівень? Одним зі складних питань при веденні хворого з ХК є незадовільна відповідь на найбільш поширені терапевтичні агенти. Тому актуальним завданням залишається розробка методів десенситизації при фізичних кропив’янках. На сьогодні розроблено такі протоколи для теплової, сонячної та холодової форм [18]. Тому можемо сподіватись на створення їх і для інших типів.
Відтермінована кропив’янка від тиску розвивається при тривалій дії фактора (близько 15 хвилин) на шкіру. Цей підтип ХК слід розрізняти від симптоматичного дермографізму, симптоми якого з’являються відразу після дії тригера. Крім того, виникнення симптомів залежить від величини тиску та площі поверхні, на яку цей тиск діє. Пацієнтам необхідно пояснювати, що якщо неможливо уникнути дії фактора, то слід розподілити навантаження на ділянки шкіри (наприклад, носити не сумку, а рюкзак із широкими ременями).
Холодова кропив’янка є другим за поширеністю й одним із найбільш вивчених типів. Крім того, цей тип кропив’янки пов’язаний із високим ризиком розвитку анафілаксії, тому потребує особливої уваги. Холодова кропив’янка виникає відразу після дії холоду (холодне повітря, рідина або предмети) та може тривати до 60 хвилин. Із цієї причини пацієнтам із холодовою кропив’янкою слід рекомендувати з обережністю купатися у відкритих водоймах. Розрізняють первинну та вторинну холодову кропив’янку. Однією з причин вторинної холодової кропив’янки може бути спадкова IgG або змішана кріоглобулінемія, про що необхідно пам’ятати, якщо ви спостерігаєте такого пацієнта [19]. Можливі діагностичні тести подані в табл. 3. Скринінгове тестування з кубиком льоду слід проводити з обережністю, використовуючи пакет, у який кладуть лід. Це роблять для запобігання некоректній інтерпретації реакції (диференціальна діагностика з реакцією на воду). Якщо використовується Temp Test, то для скринінгу (без визначення порогового рівня) краще встановити найнижчу температуру (4 °С) і в разі позитивної реакції проводити титрування температур для встановлення порогового рівня. Деякі пацієнти можуть потребувати зміни часу провокації (як у бік скорочення, так і у бік подовження часу) [7, 20].
Після підтвердження реакції на холод необхідно встановити порогові рівні часу впливу та температури. Порогом часу дії вважається найкоротший проміжок часу аплікації холоду, що викликає появу пухирів. Вважається, що індукція уртикаріїв після 3-хвилинної стимуляції асоціюється з високою активністю захворювання. Порогом температури вважається найвища температура, що індукує появу симптомів. Поріг температури може бути оцінений тільки за допомогою спеціального обладнання [7].
Теплова ХК, як правило, розвивається внаслідок впливу температур, вищих від температури тіла людини [19]. Цей різновид ХК слід диференціювати від сонячної та холінергічної кропив’янки, оскільки в цих випадках також має місце дія високих температур. Після підтвердження впливу цього фактора необхідно визначити поріг часу впливу та поріг температури, аналогічно як і при холодовій кропив’янці.
Сонячна ХК виникає внаслідок дії сонячних променів (здебільшого типу А та видимого світла) упродовж декількох хвилин і зникає після закінчення експозиції світла. Якщо в пацієнта пухирі виникають не тільки на відкритих ділянках шкіри, але і під одягом, це не виключає сонячні промені з переліку причин кропив’янки. Влітку промені можуть діяти навіть через одяг людини [19, 21]. Цей тип ХК складний для підтвердження, оскільки сонячне світло — багатокомпонентний тригер, що включає УФ-випромінення типу А, типу В, видимий спектр, дія яких має бути верифікована. Під час підтвердження можуть виникнути складнощі, тому що обладнання для таких досліджень не доступне для рутинного використання. Останнім часом розрізняють 2 типи сонячної кропив’янки залежно від спектра променів [21]. Реакції на сонячне світло можуть бути фототоксичними та фотоалергічними, необхідно диференціювати ці реакції, і тому інтерпретація провокаційних проб має проводитися з особливою уважністю [22].
До того ж важливою є підготовка до проведення тестування. Окрім виключення антигістамінних та системних глюкокортикоїдів, слід також уникати впливу сонцезахисних засобів та фоточутливих препаратів. Дія фоточутливих препаратів стимулює виникнення фототоксичних медикаментозних реакцій (побічна дія) і не є сонячною кропив’янкою, тому необхідний ретельний збір анамнезу. Така активність притаманна таким групам лікарських засобів: антибіотики (фторхінолони, тетрацикліни, сульфонаміди), антимікотики (ітраконазол, вориконазол), для лікування серцево-судинної патології (аміодарон, дилтіазем, хінідин, фуросемід, дихлортіазид), нейролептики (фенотіазини та тіоксантени), нестероїдні протизапальні засоби (ібупрофен, кетопрофен, напроксен), параамінобензойна кислота [21].
Провокаційний тест із використанням джерела сонячного випромінювання може бути виконаний на сідницях. Для цього окремо оцінюють реакцію на УФА, УФВ та видиме світло. Результат інтерпретують через 10–20 хвилин після експозиції. Після підтвердження факту сонячної кропив’янки визначають пороговий рівень часу провокації та рівень потужності випромінювання шляхом зміни цих показників.
Вібраційна кропив’янка (ангіонабряк) — форма ангіонабряку (частіше ніж кропив’янки), що виникає у відповідь на дію вібрації (хропіння, їзда на велосипеді, дія стоматологічного бура, перфоратора та ін.). Провокаційні проби відображено в табл. 3.
Хронічна індукована кропив’янка, спричинена нефізичними стимулами
Холінергічна кропив’янка виникає після фізичного навантаження та пасивного нагрівання тіла дитини (приймання гарячої ванни, підвищення температури тіла при інфекційному процесі, фізичних вправах, вживанні гострої їжі тощо) як наслідок підвищення концентрації ацетилхоліну. Особливістю цього типу є дрібні уртикарії, які оточені зоною гіперемії та супроводжуються вираженим свербінням, тривають 15–60 хвилин. Вважають, що є декілька субтипів цього варіанта кропив’янки залежно від реакції на піт: внаслідок наявності гіперреактивності до поту, ангідроз/гіпогідроз та ідіопатичний варіант. Для диференціальної діагностики цих підтипів проводять інтрадермальні тести з власним потом за аналогією із тестом з автологічною сироваткою [23].
У разі холінергічної кропив’янки необхідно провести диференціальну діагностику з анафілактичним типом реакції на фізичне навантаження. Для цього існують стандартизовані провокаційні тести (табл. 3) [24]. Якщо тест із фізичним навантаженням виявився позитивним, то для диференціальної діагностики з анафілаксією проводять провокацію з пасивним нагріванням (не раніше ніж через 24 години після попередніх тестів) [25]. Диференціальна діагностика різних варіантів холінергічної кропив’янки є важливою, оскільки різні підтипи по-різному реагують на лікування та десенситизацію.
Аквагенна кропив’янка — форма ХК, що зустрічається рідко, тригером є вода будь-якої температури. При цьому необхідно пам’ятати про диференціальну діагностику з холінергічною, тепловою та холодовою кропив’янками, а також аквагенним свербежем. Ці провокаційні тести слід проводити перед тестуванням на аквагенну кропив’янку. Існують дослідження, які свідчать про наявність у воді епідермальних алергенів, до яких чутливий пацієнт, тому автори цих праць розцінюють аквагенну кропив’янку як контактну на епідермальні алергени.
Контактна кропив’янка виникає внаслідок контакту шкіри з будь-якими речовинами, як правило, впродовж 30 хвилин після нього. Сучасні уявлення базуються на даних щодо імунного, неімунного та недиференційованого підтипів контактної кропив’янки. У разі неімунного підтипу клінічні прояви можуть розвинутись після першого контакту з речовиною і, як правило, локалізуються в місці контакту. Імунна контактна кропив’янка може бути генералізованою, тобто висип поширюється на місця, які не контактували безпосередньо з тригером, і розвивається після повторного контакту. Найчастішою причиною контактної кропив’янки та навіть анафілактичних реакцій у відділеннях інтенсивної терапії є латекс. Для підтвердження цього типу використовують прик-тестування й аплікаційні проби з підозрюваною речовиною.
І останній варіант індукованих реакцій — це вплив харчових продуктів або медикаментів. Як правило, цей варіант частіше зустрічається в разі гострої кропив’янки. Механізми розвитку кропив’янки внаслідок впливу їжі (харчової гіперчутливості) можуть бути різними: імунологічно-опосередкованими або неімунними [26, 27]. Продукти харчування провокують кропив’янку як унаслідок IgE-опосередкованих механізмів (істинні алергічні реакції), так і внаслідок впливу ксенобіотиків за неIgE-опосередкованим типом (барвників, підсилювачів смаку тощо). Це саме стосується впливу лікарських засобів: реакція може бути пов’язана безпосередньо з діючою речовиною або з іншими компонентами медикаментів. Діагностика в цьому випадку включає діагностичну дієтотерапію з наступним пробним введенням продукту харчування або період відмиву для підозрюваного лікарського засобу, прик-, патч-тестування, визначення рівня специфічних IgE, внутрішньошкірні проби, пероральні провокаційні проби з підозрюваними речовинами.
Спонтанна кропив’янка
До 50–80 % випадків ХК є спонтанними [28]. Перші повідомлення про спонтанну кропив’янку опубліковані майже 70 років тому, і на сьогодні досягнуто значного прогресу в розумінні механізмів розвитку хвороби, розроблено стандарти лікування, але ця патологія все ще залишається terra incognita сучасної алергології. Це той різновид кропив’янки, коли ми призначаємо максимальну кількість обстежень, а стандартна терапія є ефективною не у всіх випадках [29]. Завдяки дослідженням вчених усього світу було визначено прогностичні фактори більш тяжкого та тривалого перебігу захворювання: супутній ангіонабряк, тяжкі загострення кропив’янки (на підставі оцінки за шкалою UAS7), наявність автореактивності та комбінація спонтанної кропив’янки з дією фізичних чинників. За даними Maurer (2013), до 40 % спонтанної кропив’янки супроводжується розвитком ангіонабряку [8].
У структурі спонтанних кропив’янок 30–50 % випадків є автоімунними. Найчастіше в дітей діагностують патологію щитоподібної залози та целіакію [4]. Крім того, близько 1 % випадків асоційовані з цукровим діабетом 1-го типу, ревматоїдним (ідіопатичним) артритом, вітиліго, гемолітичною анемією [28]. Тому діагностичний алгоритм полягає в зборі анамнезу з включенням питань щодо цих захворювань та лабораторних/інструментальних досліджень. З огляду на патогенез автоімунної кропив’янки необхідно проводити серологічні (визначення рівнів антитіл класу IgG проти високоафінного рецептора до IgE (FcεR1α) (тип II) або антиIgE-антитіл (тип I) та тест активації базофілів) та in vivo тести (з автологічною сироваткою й автологічною плазмою). Ці дослідження не є взаємозамінними, оскільки визначають різні патогенетичні механізми і по можливості мають бути проведені в повному обсязі. На жаль, сьогодні визначення антитіл не є можливим для рутинної практики, навіть на комерційній основі. А ось проведення тестів активації базофілів та внутрішньошкірних проб із власною сироваткою або плазмою є доступним та доволі простим у виконанні. У дорослих тест з автологічною плазмою дає більший відсоток позитивних відповідей, ніж тест із власною сироваткою. Автори пояснюють це тим, що цитратна плазма має прокоагулянтну активність і процеси автоактивації можуть бути пов’язані з механізмами фібринолізу та коагуляції, що залучені до патогенезу [30–32]. Аналогічних досліджень для дітей, описаних у літературі, ми не зустріли.
Необхідно пам’ятати, що отримання негативного результату тестів з автологічною сироваткою (або плазмою) не виключає діагнозу автоімунної кропив’янки. Тому обов’язковим є визначення антитиреоїдних (антимікросомальні, до тиреоглобуліну та тиреопероксидази) антитіл у пацієнтів зі спонтанною кропив’янкою, зважаючи на те, що 57,4 % пацієнтів із ХСК мають автоімунне захворювання щитоподібної залози [33, 34]. Але і це не виключає автоімунного характеру спонтанної кропив’янки, і тому, якщо є можливість, слід провести диференціальну діагностику з іншими автоімунними захворюваннями й автозапальними синдромами [5, 35]. Перелік цих захворювань наводимо нижче.
Автозапальні захворювання, асоційовані з хронічною кропив’янкою (згідно з EAACI/GA²LEN/EDF/WAO Guideline 2017 р.)
— Кріопіринасоційовані періодичні синдроми (сімейний холодовий автозапальний синдром (FCAS), синдром Макла — Уельса (MWS), мультисистемне запальне захворювання неонатального віку (NOMID), синдром гіперімуноглобулінемії D (HIDS), періодичний синдром, асоційований із α-рецептором фактора некрозу пухлин (TRAPS)).
— Синдром Шнітцлера.
— Синдром Уельса.
— Синдром Глейха.
— Ювенільний ідіопатичний артрит.
Наступним блоком причин, що необхідно виключити в разі спонтанної ХК, є гострі чи хронічні інфекції. Роль інфекційних факторів не до кінця вивчена і є предметом подальших наукових досліджень, що заявлені EAACI/ GA2LEN. У дітей це особливо актуально, оскільки саме в дитинстві людина знайомиться з більшістю патогенів. Але частота та значимість тієї чи іншої інфекції значно варіюють залежно від географії та особливостей харчування пацієнта. Так, один із гельмінтів Anisakis simplex є причиною рецидивного перебігу кропив’янки в тих пацієнтів, які споживають морську рибу в сирому вигляді [36, 37]. Загалом чинниками розвитку ХК можуть бути найпростіші, гельмінти, бактерії, віруси чи гриби. Для кращого уявлення про них ми згрупували літературні дані в табл. 4.
/45.jpg)
На сьогодні у світі ідентифіковано близько 400 видів гельмінтів, що можуть уражати людину. Серед всіх гельмінтозів, зареєстрованих в Україні у 2011 р., 90 % належать до педіатричної практики. Звісно, що наявність не всіх із них ми можемо зафіксувати об’єктивними методами, доступними сучасній медицині. Тому важливо знати особливості клінічної картини, що може спостерігатися при гельмінтозі. І врешті-решт, терапія ex juvantibus має право на існування: якщо після ерадикаційного лікування висип не рецидивує, з високою вірогідністю можна говорити про те, що пацієнт був інфікований [9, 38, 39].
Серед бактеріальних агентів найбільш вивченою є Helicobacter pylori, участь інших не доведена в добре організованих дослідженнях, але зустрічаються описання клінічних випадків, у яких доведена ефективність ерадикаційної терапії. Наприклад, у пацієнтів із наявними ознаками тонзилярної інфекції призначення антибактеріальної терапії або тонзилектомія призводили до зникнення епізодів кропив’янки. Але деякими дослідниками подібні case reports трактуються як «анекдотичні», хоча, на наш погляд, вивчення ролі цих збудників має сенс, оскільки до 50 % спонтанних кропив’янок залишаються етіологічно не розшифрованими [40]. Серед вірусів згадують віруси групи герпесу (Епштейна — Бар віруси, герпес 6-го типу), віруси гепатитів В та С, парвовірус В19, норовірус. Щодо мікозів, то є поодинокі дослідження в дорослих пацієнтів із хронічною кропив’янкою та поверхневою дерматофітією, у яких поліпшення перебігу ХК відбулося після курсу антимікотиків [41]. Тому питання щодо будь-якої з цих інфекцій мають бути поставлені пацієнтові, після цього можливе призначення специфічної діагностики.
Визначення індивідуальних особливостей тяжкості хронічної кропив’янки
Як ми зазначали раніше, одним із завдань діагностики є визначення ступеня активності та контролю захворювання. У педіатричній практиці немає жодного валідованого опитувальника, тому у всьому світі користуються та рекомендують використання опитувальників для дорослих [4]. Шкала Urticaria Activity Score (UAS7) (табл. 5) була затверджена експертами EAACI/GA2LEN/EDF/WAO і має використовуватись рутинно в клінічній практиці для початкової оцінки активності захворювання та змін на тлі терапії. Шкала заповнюється пацієнтом щодня впродовж усього періоду лікування.
Ця шкала дозволяє оцінити як перебіг ХК, так і ступінь тяжкості загострення або тяжкості гострої кропив’янки. Інтерпретація тяжкості загострення така: 0–2 бали — легке загострення, 3–4 бали — середньої тяжкості, 5–6 балів — тяжке загострення. Від ступеня тяжкості залежить обсяг лікування. Оцінка перебігу ХК полягає в підрахунку балів, записаних пацієнтом за тиждень, максимально — 42 бали [42].
Для оцінки контролю захворювання використовують Urticaria Control Test (UCT), що також заповнюється пацієнтом самостійно й оцінюється кожні 4 тижні (див. нижче). На підставі суми балів, отриманих після тестування, перебіг кропив’янки оцінюється як добре контрольований (якщо сума балів дорівнює 12 та більше) або погано контрольований і дозволяє приймати рішення щодо подальшої терапії.
Тест контролю кропив’янки (переклад англійської версії, може бути використаним тільки для клінічних цілей) [43]
1. Наскільки сильно ти страждав від фізичних проявів кропив’янки (свербіж, плями та/або припухлість) за останні 4 тижні?
Відповіді: дуже сильно (0), сильно (1), трохи (2), не сильно (3), зовсім не страждав (4).
2. Наскільки сильно була порушена твоя якість життя внаслідок кропив’янки впродовж останніх 4 тижнів?
Відповіді: дуже сильно (0), сильно (1), трохи (2), не сильно (3), зовсім не страждав (4).
3. Як часто за останні 4 тижні лікування щодо кропив’янки не було ефективним для контролю симптомів?
Відповіді: дуже часто (0), часто (1), іноді (2), рідко (3), ніколи (4).
4. Взагалі наскільки добре за останні 4 тижні контролювалась твоя кропив’янка?
Відповіді: зовсім не контролювалась (0), не сильно (1), трохи (2), добре (3), дуже добре (4).
Окрім вищезазначених тестів Консенсус із діагностики ХК 2018 р. рекомендує визначати рівень якості життя пацієнта за допомогою опитувальника з якості життя (CU-Q2oL).
Таким чином, діагностика рецидивуючої та хронічної кропив’янки — це кропітка робота, що потребує злагоджених дій усіх учасників процесу, вимагає часу та терпіння, довірливих відносин пацієнта і лікаря. Сучасні літературні джерела дають нам багато прекрасних алгоритмів діагностики ХК, але в педіатричній практиці залишається безліч відкритих питань, які можуть бути джерелом для подальших наукових розробок. Ми бачимо такі невирішені питання:
1. Епідеміологічні дослідження гострої та хронічної кропив’янки з ангіонабряком або без нього в дітей.
2. Проведення валідизації існуючих опитувальників та шкал для визначення якості життя, тяжкості, тривалості перебігу та рівня контролю кропив’янки для дітей в Україні та впровадження їх у рутинну клінічну практику.
3. Проведення стандартизації провокаційних тестів для індукованих кропив’янок.
4. Імплементування в рутинну клінічну практику тестів з автологічною сироваткою та плазмою.
5. Визначення ефективних методів діагностики інфекційних захворювань та їх ролі при спонтанних кропив’янках у дітей.
Конфлікт інтересів. Автори зазначають відсутність конфлікту інтересів.
Інформація про внесок кожного автора: Недельська С.М. — концепція та напрямок дослідження; Ярцева Д.О. — збір, обробка отриманих даних, написання тексту.

/38.jpg)
/40.jpg)
/41.jpg)
/42.jpg)
/43.jpg)
/45.jpg)
/46.jpg)