Журнал «Здоровье ребенка» Том 15, №4, 2020
Вернуться к номеру
К вопросу о вторичном амилоидозе почек при ювенильном ревматоидном артрите у детей
Авторы: Борисова Т.П., Самсоненко С.В., Бадогина Л.П.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
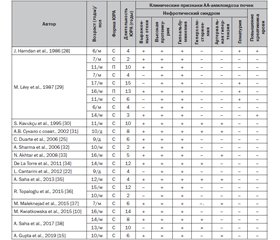
В огляді літератури викладені сучасні дані щодо частоти, механізмів розвитку, клінічних проявів, діагностики та лікування вторинного амілоїдозу (АА-амілоїдозу) нирок у дітей з ювенільним ревматоїдним артритом (ЮРА). Частота розвитку АА-амілоїдозу нирок при ЮРА у дітей становить від 0,8 до 2 %, у дорослих з тривалістю ЮРА 28,3 року — 8,9 %. Останнім часом на тлі імунобіологічної терапії частота АА-амілоїдозу нирок у дорослих зменшилася до 2 %. На сьогодні встановлений основний механізм розвитку АА-амілоїдозу, що полягає в постійному або періодичному підвищенні концентрації сироваткового амілоїду А (SAA). Встановлено, що на синтез SAA впливають прозапальні цитокіни: інтерлейкін-1 (ІЛ-1), ІЛ-6, фактор некрозу пухлини альфа (ФНП-α), ІЛ-2, ІЛ-11 та ін. Для реалізації амілоїдогенного потенціалу SAA необхідний не тільки вплив запального процесу в організмі, але і його тривалість. Обговорюється роль генетичних факторів у розвитку АА-амілоїдозу нирок при ЮРА. АА-амілоїдоз нирок найчастіше розвивається у дітей при системній формі, у дорослих — при системній і поліартикулярній формах ЮРА. Першим симптомом АА-амілоїдозу нирок є ізольована протеїнурія, що трансформується в нефротичний синдром. Особливості нефротичного синдрому полягають у відсутності в більшості випадків гіперхолестеринемії, поєднанні у деяких хворих з артеріальною гіпертензією, гематурією, порушенням функції нирок. Основним методом, що підтверджує діагноз АА-амілоїдозу нирок, є прижиттєве морфологічне дослідження нирок із забарвленням біоптатів конго червоним. Підвищення рівня SAA в крові у дітей з ЮРА відображає ступінь запального процесу і розглядається як фактор ризику розвитку АА-амілоїдозу нирок. Застосування імунобіологічних препаратів (тоцилізумаб, анакінра) при АА-амілоїдозі нирок у дітей з ЮРА має терапевтичну ефективність.
В обзоре литературы изложены современные данные о частоте, механизмах развития, клинических проявлениях, диагностике и лечении вторичного амилоидоза (АА-амилоидоза) почек у детей с ювенильным ревматоидным артритом (ЮРА). Частота встречаемости АА-амилоидоза почек при ЮРА у детей составляет от 0,8 до 2 %, у взрослых с длительностью ЮРА 28,3 года — 8,9 %. В последние годы на фоне иммунобиологической терапии частота АА-амилоидоза почек у взрослых уменьшилась до 2 %. На сегодняшний день установлен основной механизм развития АА-амилоидоза, который заключается в постоянном или периодическом повышении концентрации сывороточного амилоида А (SAA). Установлено, что на синтез SAA влияют провоспалительные цитокины: интерлейкин-1 (ИЛ-1), ИЛ-6, фактор некроза опухоли альфа (ФНО-α), ИЛ-2, ИЛ-11 и другие. Для реализации амилоидогенного потенциала SAA необходимо не только воздействие воспалительного процесса в организме, но и его продолжительность. Обсуждается роль генетических факторов в развитии АА-амилоидоза почек при ЮРА. АА-амилоидоз почек чаще всего развивается у детей при системной форме, у взрослых — при системной и полиартикулярной формах ЮРА. Первым симптомом АА-амилоидоза почек является изолированная протеинурия, которая трансформируется в нефротический синдром. Особенности нефротического синдрома заключаются в отсутствии в большинстве случаев гиперхолестеринемии, сочетании у некоторых больных с артериальной гипертензией, гематурией, нарушением функции почек. Основным методом, подтверждающим диагноз АА-амилоидоза почек, является прижизненное морфологическое исследование почек с окраской биоптатов конго красным. Повышение уровня SAA в крови у детей с ЮРА отражает степень воспалительного процесса и рассматривается как фактор риска развития АА-амилоидоза почек. Применение иммунобиологических препаратов (тоцилизумаб, анакинра) при АА-амилоидозе почек у детей с ЮРА имеет терапевтическую эффективность.
The literature review provides up-to-date data on the frequency, developmental mechanisms, clinical manifestations, diagnosis and treatment of secondary renal amyloidosis (AA amyloidosis) in children with juvenile rheumatoid arthritis (JRA). The incidence of AA amyloidosis in children with JRA is from 0.8 to 2 %, in adults with JRA duration of 28.3 years — 8.9 %. In recent years, on the background of immunobiological therapy, the frequency of AA amyloidosis in adults has decreased to 2 %. To date, the main mechanism for the development of AA amyloidosis has been established, which consists in a constant or periodic increase in the concentration of serum amyloid A (SAA). It has been established that the synthesis of SAA is influenced by proinflammatory cytokines: interleukin-1 (IL-1), IL-6, tumor necrosis factor alpha, IL-2, IL-11 and others. To realize the amyloidogenic potential of SAA, it is necessary to influence not only the inflammatory process in the body, but also its duration. The role of genetic factors in the development of AA amyloidosis in patients with JRA is discussed. AA amyloidosis most often develops in children with a systemic form, in adults — with systemic and polyarticular forms of JRA. The first symptom of AA amyloidosis is isolated proteinuria, which transforms into nephrotic syndrome. The peculiarity of the nephrotic syndrome is the absence of hypercholesterolemia in most cases, and combination with arterial hypertension, hematuria, and impaired renal function in some patients. The main method confirming the diagnosis of AA amyloidosis is a morphological study of the kidneys biopsy specimens with Congo red. An increase in blood SAA in children with JRA reflects the degree of the inflammatory process and is considered as a risk factor for the development of AA amyloidosis. The use of immunobiological preparations (tocilizumab, anakinra) in children with JRA and AA amyloidosis has therapeutic efficacy.
ювенільний ревматоїдний артрит; діти; вторинний амілоїдоз; огляд
ювенильный ревматоидный артрит; дети; вторичный амилоидоз; обзор
juvenile rheumatoid arthritis; children; secondary amyloidosis; review
Выводы
1. Palman J., Shoop-Worrall S., Hyrich K., McDonagh J.E. Update on the epidemiology, risk factors and disease outcomes of Juvenile idiopathic arthritis. Best Pract. Res. Clin. Rheumatol. 2018. 32(2). P. 206-222. doi: 10.1016/j.berh.2018.10.004.
2. Fellas A., Hawke F., Santos D., Coda A. Prevalence, presentation and treatment of lower limb pathologies in juvenile idiopathic arthritis: A narrative review. J. Paediatr. Child Health. 2017. 53(9). P. 836-840. doi: 10.1111/jpc.13646.
3. Abdwani R., Abdalla E., Al Abrawi S. et al. Epidemiology of juvenile idiopathic arthritis in Oman. Pediatr. Rheumatol. 2015. 13. 33. https://doi.org/10.1186/s12969-015-0030-z
4. Бойко Я.Є. Віддалені наслідки ювенільного ревматоїдного артриту: Результати спостереження 70 хворих. Український ревматологічний журнал. 2014. № 2. С. 67-72. http://nbuv.gov.ua/UJRN/Urj_2014_2_13
5. Okamoto N., Yokota S., Takei S. et al. Clinical practice guidance for juvenile idiopathic arthritis (JIA) 2018. Mod. Rheumatol. 2019. 29(1). P. 41-59. doi: 10.1080/14397595.2018.1514724.
6. Бережний В.В., Марушко Т.В., Марушко Ю.В. Особливості клінічного перебігу ревматоїдного артриту у дітей підліткового віку. Здоровье ребенка. 2006. 1(1). С. 23-26. URL: http://www.mif-ua.com/archive/article/220.
7. Barišić Kutija M., Perić S., Knežević J., Juratovac Z., Vukojević N. Complication and prognosis of juvenile idiopathic arthritis associated uveitis in the era of modern immunomodulatory treatment. Psychiatr. Danub. 2019. 31(suppl. 1). P. 44-49. PMID: 30946717.
8. Liu Y.C., Tu Y.L., Wu R.C., Huang J.L., Yao T.C. Life-threatening pneumonitis complicating low-dose methotrexate treatment for juvenile idiopathic arthritis in a child. Pediatric Emergency Care. 2014 Jun. 30(6). P. 415-417. doi: 10.1097/pec.0000000000000151.
9. Sihvonen S., Korpela M., Mustonen J., Laippala P., Pasternack A. Renal disease as a predictor of increased mortality among patients with rheumatoid arthritis. Nephron. Clin. Pract. 2004. 96(4). P. 107-114. doi: 10.1159/000077372.
10. Kwiatkowska M., Jednacz E., Rutkowska-Sak L. Juvenile idiopathic arthritis complicated by amyloidosis with secondary nephrotic syndrome - effective treatment with tocilizumab. Reumatologia. 2015. 53(3). P. 157-160. doi: 10.5114/reum.2015.53138.
11. Joss N., McLaughlin K., Simpson K., Boulton-Jones J.M. Presentation, survival and prognostic markers in AA amyloidosis. QJM. 2000. 93(8). P. 535-542. doi: 10.1093/qjmed/93.8.535.
12. Cimaz R., Von Scheven A., Hofer M. Systemic-onset juvenile idiopathic arthritis: the changing life of a rare disease. Swiss Med. Wkly. 2012. 142. w13582. doi: 10.4414/smw.2012.13582.
13. Sack G.H. Serum amyloid A — a review. Mol. Med. 2018. 24(1). P. 46. https://doi.org/10.1186/s10020-018-0047-0
14. Rameev V.V., Kozlovskaya L.V., Malinina E.A. et al. Determination of circulating amyloid precursor proteins in the diagnosis and monitoring of systemic amyloidosis. Clinical Nephrology. 2009. № 2. P. 55-62. https://www.elibrary.ru/item.asp?id=12993062
15. Gupta A., Bagri N.K., Tripathy S.K., Barwad A., Phulware R.H., Hari P. Successful use of tocilizumab in amyloidosis secondary to systemic juvenile idiopathic arthritis. Rheumatol. Int. 2020. 40(1). P. 153-159. doi: 10.1007/s00296-019-04363-z.
16. Papa R., Lachmann H.J. Secondary, AA, Amyloidosis. Rheum. Dis. Clin. North Am. 2018. 44(4). P. 585-603. doi: 10.1016/j.rdc.2018.06.004.
17. Степанова A.A., Савенкова Н.Д., Новик Г.A., Дементьева E.A., Гурина O.П. Диагностическое значение концентрации цитокинов IL-1β, IL-6, TNF-α и белка-предшественника амилоида SAA в крови у пациентов с ювенильным ревматоидным артритом. Российский вестник перинатологии и педиатрии. 2015. 60(5). https://cyberleninka.ru/article/n/diagnosticheskoe-znachenie-kontsentratsii-tsitokinov-il-1-il-6-tnf-i-belka-predshestvennika-amiloida-saa-v-krovi-u-patsientov-s-yuvenilnym
18. Cope A.P., Aderka D., Doherty M. et al. Increased levels of soluble tumor necrosis factor receptors in the sera and synovial fluid of patients with rheumatic diseases. Arthritis Rheum. 1992. 35(10). P. 1160-1169. doi: 10.1002/art.1780351008.
19. Саркисова И.А. Ревматоидный артрит как ведущая причина развития вторичного АА-амилоидоза (Обзор литературы). Нефрология и диализ. 2006. 8(1). С. 15-26. http://journal.nephro.ru/index.php?r=journal/downloadPdfFile&articleId=894
20. Cunnane G. Amyloid precursors and amyloidosis in inflammatory arthritis. Current Opinion in Rheumatology. 2001 Jan. 13(1). P. 67-73. doi: 10.1097/00002281-200101000-00011
21. Yamada T., Okuda Y., Takasugi K., Itoh K., Igari J. Relative serum amyloid A (SAA) values: the influence of SAA1 genotypes and corticosteroid treatment in Japanese patients with rheumatoid arthritis. Ann. Rheum. Dis. 2001. 60(2). P. 124-127. doi:10.1136/ard.60.2.124.
22. Cantarini L., Lucherini O.M., Simonini G., Galeazzi M., Baldari C.T., Cimaz R. Systemic-onset juvenile idiopathic arthritis complicated by early onset amyloidosis in a patient carrying a mutation in the MEFV gene. Rheumatol. Int. 2012. 32(2). P. 465-467. doi: 10.1007/s00296-009-1331-7.
23. Lane T., Pinney J.H., Gilbertson J.A. et al. Changing epidemiology of AA amyloidosis: clinical observations over 25 years at a single national referral centre. Amyloid. 2017. 24(3). P. 162-166. doi: 10.1080/13506129.2017.1342235.
24. David J., Vouyiouka O., Ansell B.M., Hall A., Woo P. Amyloidosis in juvenile chronic arthritis: a morbidity and mortality study. Clin. Exp. Rheumatol. 1993. 1(11). P. 85-90. PMID: 8453805.
25. Duarte C., Gomes C., Correia A.J., Salgado M. Renal amyloidosis: an uncommon complication of juvenile idiopathic arthritis. Clinical Rheumatology. 2006 Jul. 25(4). P. 548-549. doi: 10.1007/s10067-005-0048-6.
26. Packham J.C., Hall M.A. Long-term follow-up of 246 adults with juvenile idiopathic arthritis: functional outcome. Rheumatology. 2002. 14(12). P. 1428-1435. https://doi.org/10.1093/rheumatology/41.12.1428
27. Bilginer Y., Akpolat T., Ozen S. Renal amyloidosis in children. Pediatr. Nephrol. 2011. 26(8). P. 1215-1227. doi: 10.1007/s00467-011-1797-x.
28. Hamdan J., Manasra K., Ilahi F. Amyloidosis secondary to juvenile rheumatoid arthritis: a case report from Saudi Arabia. Ann. Trop. Paediatr. 1986. 6(4). P. 279-282. doi: 10.1080/02724936.1986.11748456.
29. Lévy M., Prieur A.-M., Gubler M.-C. et al. Renal Involvement in Juvenile Chronic Arthritis: Clinical and Pathologic Features. American Journal of Kidney Diseases. 1987. 9(2). P. 138-146. https://doi.org/10.1016/S0272-6386(87)80091-4
30. Kavukçu S., Türkmen M., Saatçi O., Başdemir G., Gülay Z., Cevik N.T. Juvenile rheumatoid arthritis and renal amyloidosis (case report). Int. Urol. Nephrol. 1995. 27(3). P. 251-256. doi: 10.1007/BF02564758.
31. Сукало А.В., Кравцова Г.И., Краева С.С. Вторичный амилоидоз почек у девочки 10 лет с ювенильным ревматоидным артритом. Белорусский медицинский журнал. 2002. № 2. С. 122-124. https://file:///C:/Users/User %20Dell/Downloads/20121130110418122.pdf
32. Sharma A., Gupta A., Mitra S., Nada R., Bhattad S., Singh S. Systemic Juvenile Idiopathic Arthritis with Amyloidosis: An Uncommon Complication with a Favourable Outcome. Indian J. Pediatr. 2016. 83(5). P. 477-478. doi: 10.1007/s12098-015-1913-1.
33. Akhtar N., Kiran S., Hussain A., Suleman B.A., Jaleel S. Renal amyloidosis in juvenile rheumatoid arthritis. J. Coll. Physicians Surg. Pak. 2009. 19(2). P. 130-132. PMID: 19208322.
34. De La Torre M., Arboleya L., Pozo S., Pinto J., Velasco J. Rapid and sustained response to tocilizumab, anti-interleukin-6 receptor antibody, in a patient with nephrotic syndrome secondary to systemic juvenile idiopathic arthritis-related amyloidosis. NDT Plus. 2011. 4(3). P. 178-180. doi: 10.1093/ndtplus/sfr004.
35. Saha A., Chopra Y., Theis J.D., Vrana J.A., Sethi S. AA amyloidosis associated with systemic-onset juvenile idiopathic arthritis. Am. J. Kidney Dis. 2013. 62(4). P. 834-838. doi: 10.1053/j.ajkd.2013.02.377.
36. Topaloglu R., Batu E.D., Orhan D. et al. Anti-interleukin 1 treatment in secondary amyloidosis associated with autoinflammatory diseases. Pediatr. Nephrol. 2016. 31. P. 633-640. https://doi.org/10.1007/s00467-015-3249-5
37. Maleknejad M., Moshari J., Azarfar A. et al. Renal Amyloidosis Due to Juvenile Rheumatoid Arthritis Occurring in Early Childhood. J. Ped. Nephrology. 2015. 3(2). P. 79-81. https://doi.org/10.22037/jpn.v3i2.8203
38. Saha A., Pais P., Iyengar A.A., Abraham A.K. Proteinuria in children with juvenile idiopathic arthritis: Making the case for early urinary screening. Saudi J. Kidney Dis. Transpl. 2017. 28(6). P. 1408-1411. doi: 10.4103/1319-2442.220854.
39. Chevrel G., Jenvrin C., McGregor B., Miossec P. Renal type AA amyloidosis associated with rheumatoid arthritis: a cohort study showing improved survival on treatment with pulse cyclophosphamide. Rheumatology. 2001 July. 40(7). P. 821-825. https://doi.org/10.1093/rheumato–logy/40.7.821
40. Jagusiak A., Rybarska J., Konieczny L. et al. Amyloids, Congo red and the apple-green effect. Acta Biochim. Pol. 2019. 66(1). P. 39-46. doi: 10.18388/abp.2018_2667.
41. Степанова А.А. Предшественник амилоида SAA-белок в крови и патология почек при ревматоидном артрите у детей и подростков: автореф. дис. … канд. мед. наук. Санкт-Петербург, 2013. 25 с. https://www.dissercat.com/content/predshestvennik-amiloida-saa-belok-v-krovi-i-patologiya-pochek-pri-revmatoidnom-artrite-u-de/read

/65.jpg)