Журнал «Здоровье ребенка» Том 15, №4, 2020
Вернуться к номеру
Цитомегаловірусний езофагіт у підлітка з ВІЛ-інфекцією: клінічний випадок
Авторы: Борисова Т.П.(1), Бадогіна Л.П.(1), Аллахвердієва З.С.(1), Заболотня Л.Д.(2), Щудро С.О.(2)
(1) — ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
(2) — КП «Дніпропетровська обласна дитяча клінічна лікарня» ДОР, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Ураження шлунково-кишкового тракту є одним з основних елементів у низці патологічних змін при ВІЛ-інфекції в дітей. Таке пошкодження може бути викликане прямим впливом вірусу, опортуністичними інфекціями, тривалим прийомом лікарських препаратів (антибіотики, противірусні, протигрибкові). При прогресуванні ВІЛ-інфекції ймовірність патології травної системи зростає. Серед опортуністичних захворювань на особливу увагу заслуговує цитомегаловірусна (ЦМВ) інфекція, при якій у патологічний процес залучаються всі органи й системи дитини, у тому числі шлунково-кишковий тракт. Езофагіт — друге за частотою після коліту ураження системи травлення в таких хворих. При ЦМВ-езофагіті у ВІЛ-інфікованих дітей клінічні симптоми неспецифічні. Достатньо інформативним є ендоскопічне обстеження. У доступній літературі є описи езофагіту в дітей із ВІЛ-інфекцією, однак переважна увага приділяється ураженню стравоходу, викликаному грибами. Поданий клінічний випадок демонструє розвиток ЦМВ-езофагіту в підлітка з ВІЛ-інфекцією. Порушення прихильності до терапії в дитини дозволило захворюванню розвиватися природно, з прогресуючим зниженням показників імунного статусу, виникненням опортуністичної ЦМВ-інфекції з переважним ураженням стравоходу й розвитком тяжкого ЦМВ-езофагіту. Розвиток даного ушкодження не давав можливості проводити корекцію антиретровірусної терапії. Даний клінічний випадок ілюструє прогресуючий перебіг ВІЛ-інфекції з розвитком тяжкого ЦМВ-езофагіту в підлітка на тлі відсутності прихильності до антиретровірусної терапії.
Поражение желудочно-кишечного тракта является одним из основных элементов в ряду патологических изменений при ВИЧ-инфекции у детей. Такое поражение может быть вызвано прямым воздействием вируса, оппортунистическими инфекциями, длительным приемом лекарственных препаратов (антибиотики, противовирусные, противогрибковые). При прогрессировании ВИЧ-инфекции вероятность патологии пищеварительной системы возрастает. Среди оппортунистических заболеваний особого внимания заслуживает цитомегаловирусная (ЦМВ) инфекция, при которой в патологический процесс вовлекаются все органы и системы ребенка, в том числе желудочно-кишечный тракт. Эзофагит — второе по частоте после колита поражение органов пищеварения у таких больных. При ЦМВ-эзофагите у ВИЧ-инфицированных детей клинические симптомы неспецифичны. Достаточно информативным является эндоскопическое обследование. В доступной литературе имеются описания эзофагита у детей с ВИЧ-инфекцией, однако преимущественное внимание уделяется поражению пищевода, вызванному грибами. Представленный клинический случай демонстрирует развитие ЦМВ-эзофагита у подростка с ВИЧ-инфекцией. Нарушение приверженности к терапии у ребенка позволило заболеванию развиваться естественно, с прогрессирующим снижением показателей иммунного статуса, возникновением оппортунистической ЦМВ-инфекции с преимущественным поражением пищевода и развитием тяжелого ЦМВ-эзофагита. Развитие данного осложнения не давало возможности проводить коррекцию антиретровирусной терапии. Данный клинический случай иллюстрирует прогрессирующее течение ВИЧ-инфекции с развитием тяжелого ЦМВ-эзофагита у подростка на фоне отсутствия приверженности к антиретровирусной терапии.
Gastrointestinal disorder is one of the main elements in a number of pathological changes characteristic of human immunodeficiency virus (HIV) infection in children. Such lesion can be caused by direct impact of the virus on the gastrointestinal tract, opportunistic infections, prolonged use of drugs (antibiotics, antivirals, antifungals).With the progression of HIV-infection, the risk of pathology of the digestive system increases. Among opportunistic diseases, a special attention should be paid to cytomegalovirus (CMV) infection, in which all the organs and systems of the child are involved in the pathological process, including the gastrointestinal tract. Esophagitis is the second most common gastrointestinal disorder after colitis in such patients. With CMV esophagitis in HIV-infected children, the clinical symptoms are nonspecific. Endoscopic examination is quite informative. Available literature contains descriptions of esophagitis in children with HIV-infection, but the focus was made on damage to the esophagus caused by fungi. The presented clinical case demonstrates the development of CMV esophagitis in an adolescent with HIV-infection. Poor patient’s adherence to therapy allowed the disease to develop naturally, with a progressive decline in the immune status, the occurrence of an opportunistic CMV infection with a predominant lesion of the esophagus and severe CMV esophagitis. The development of this complication did not make it possible to correct antiretroviral therapy. This clinical case illustrates the progressive course of HIV-infection with the development of severe CMV esophagitis in an adolescent against the background of poor adherence to antiretroviral therapy.
ВІЛ-інфекція; діти; імунодефіцит; шлунково-кишковий тракт; цитомегаловірусна інфекція; езофагіт
ВИЧ-инфекция; дети; иммунодефицит; желудочно-кишечный тракт; цитомегаловирусная инфекция; эзофагит
human immunodeficiency virus infection; children; immunodeficiency; gastrointestinal tract; cytomegalovirus infection; esophagitis
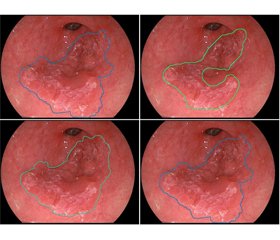
Клінічний випадок
1. Наказ Міністерства охорони здоров’я України № 92 від 24.02.2015 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги ВІЛ-інфікованим дітям». URL: https://www.dec.gov.ua/wp-content/uploads/2019/11/2015_92_nakaz_vil_dity.pdf.
2. Хасанова Г.М., Урунова Д.М., Ахмеджанова З.И., Гиясова Г.М., Черникова А.А., Хасанова А.Н. Поражение желудочно-кишечного тракта при ВИЧ-инфекции. Тихоокеанский медицинский журнал. 2019. № 3. С. 24-28. URL: https://doi.org/10.17238/PmJ 1609-1175.2019.3.24-28.
3. Тимченко В.Н., Архипова Ю.А. Поражение желудочно-кишечного тракта при ВИЧ-инфекции у детей. Детские инфекции. 2010. № 30. С. 22-26. URL: https://cyberleninka.ru/ article/n/porazhenie-zheludochno-kishechnogo-trakta-pri-vich-infektsii-u-detey/viewer.
4. Wang H.W., Kuo C.J., Lin W.R. et al. The clinical characteristics and manifestations of cytomegalovirus esophagitis. Dis. Esophagus. 2016. 29(4). P. 392-399. DOI:10.1111/dote.12340.
5. Gori A., Tincati C., Rizzardini G. et al. Early impairment of gut function and gut flora supporting a role for alteration of gastrointestinal mucosa in human immunodeficiency virus pathogenesis. J. Clin. Microbiol. 2008. № 2(46). P. 757-758. DOI: 10.1128/JCM.01729-07.
6. Bordea M.A., Pîrvan A., Gheban D. et al. Infectious Esophagit is in Romanian Children: From Etiology and Risk Factors to Clinical Characteristics and Endoscopic Features. J. Clin. Med. 2020. 9(4). P. 939. doi: 10.3390/jcm9040939.
7. Няньковський С.Л., Городиловська М.І., Іванців В.А., Бойко О.І. Диференційна діагностика езофагітів у школярів. Здоров’я дитини. 2016. № 8(76). С. 56-61. DOI: 10.22141/2224-0551.8.76.2016.90825.
8. Rosołowski M., Kierzkiewicz M. Etiology, diagnosis and treatment of infectious esophagitis. Prz. Gastroenterol. 2013. 8(6). P. 333-337. doi: 10.5114/pg.2013.39914.
9. Hoversten P., Kamboj A.K., Wu T.T., Katzka D.A. Risk Factors, Endoscopic Features and Clinical Outcomes of Cytomegalovirus Based on a 10-year Analysis at a Single Center. Clin. Gastroenterol. Hepatol. 2020. 18(3). P. 736-738. doi: 10.1016/j.cgh.2019.04.066.
10. Machadoa N.C., Carvalhoa M.A., Ortolanb E.V.P., Rodriguesc M.A.M. Severe Distal Cytomegalovirus Esophagitis With Aerodigestive Symptoms in an Immunocompetent Infant. Int. J. Clin. Pediatr. 2013. 2(1). P. 40-43. doi:10.4021/ijcp78w.
11. Madsen M., Nielsen H. Cytomegalovirus esophagitis in a child with human immunodeficiency virus-1 infection presenting as fever of unknown origin and stunted growth. Short Report. Eur. J. Pediatr. 2006. 165(9). P. 665-666. doi:10.1007/ s00431-006-0144-x.
12. Bobak D.A. Gastrointestinal Infections Caused by Cytomegalovirus. Curr. Infect. Dis. Rep. 2003. 5(2). P. 101-107. doi: 10.1007/s11908-003-0044-4.
13. Apont J., Vera J.D., Chaar A., Martin D., Yency F. Cytomegalovirus Infection (CMV) and Human Immunodeficiency Virus: Diagnostic and Therapeutic Challenges in Virology Arch. Microbiol. Immunology. 2018. 2. P. 018-035. DOI: 10.26502/ami. 936500 19.
14. Jung K.H., Choi J., Gong E.J. et al. Can endoscopist differentiate cytomegalovirus esophagitis from herpes simplex virus esophagitis based on gross endoscopic findings? Medicine (Baltimore). 2019. 98(23). P. e15845. doi: 10.1097/MD.0000000000015845.
15. Sheth A., Boktor M., Diamond K., Lavu K., Sangster G. Complete esophageal obliteration secondary to cytomegalovirus in AIDS patient. Dis. Esophagus. 2010. 23(6). P. 32-34. DOI: 10. 1111/j.1442-2050.2010.01095.x.
16. Diamond G.H., Mascarenhas M.R. Pediatric Esophagitis Updated: 2017. Sep 20. URL: https://emedicine.medscape.com/article/928891-overview.
17. Marques S., Carmo J., Pinto D., Bispo M., Ramos S., Chagas C. Cytomegalovirus Disease of the Upper Gastrointestinal Tract: A 10-Year Retrospective Study. GE Port. J. Gastroenterol. 2017. 24(6). P. 262-268. DOI:10.1159/000479232.
18. Hanisch B.R., Belani K. CMV Esophagitis as a Cause of Failure to Thrive. Minn. Med. 2014. 97(9). P. 50. PMID: 25282774.
19. Velocci V., Piper M.H. Cytomegalovirus Esophagitis Overview of Cytomegalovirus. Updated: 2019. Apr 01. URL: https://emedicine.medscape.com/article/1952121-overview.
20. Lim D.S., Lee T.H., Jin S.Y., Lee J.S. Cytomegalovirus esophagitis in an immunocompetent patient: case report. Turk. J. Gastroenterol. 2014. 25(5). P. 571-574. doi:10.5152/tjg.2014.40 73.
21. Cooke M.L., Goddard E.A., Brown R.A. Endoscopy findings in HIV-infected children from Sub-Saharan Africa. J. Trop. Pediatr. 2009. 55(4). P. 238-243. doi:10.1093/tropej/fmn 114.
22. Nachega J.B., Hislop M., Dowdy D.W., Chaisoon R.E., Regensberg L., Maartens G. Adherence to nonnucleoside reverse transcriptase inhibitor-based HIV therapy and virologic outcomes. Ann. Intern. Med. 2007. 146(8). P. 564-573. DOI:10.7326/0003-4819-146-8-007 04170-00007.
23. Reddi A., Leeper S.C. Antiretroviral therapy adherence in children: outcomes from Africa. AIDS. 2008. 22(7). P. 906-907. DOI:10.1097/QAD.0b013e3282f706ba.
24. Наказ Міністерства охорони здоров’я України № 1292 від 05.06.2019 «Про затвердження нового Клінічного протоколу із застосування антиретровірусних препаратів для лікування та профілактики ВІЛ-інфекції». URL: http://search.ligazakon.ua/l_doc2.nsf/link1/MOZ31458.html.
25. Martin S., Elliott-DeSorbo D.K., Wolters P.L. et al. Patient, care giver and regimen characteristics associated with adherence to highly active antiretroviral therapy among HIV-infected children and adolescents. Pediatr. Infect. Dis. J. 2007. 26(1). P. 61-67. doi:10.1097/01. inf. 0000250625.80340.48.
26. Kim S.H., Gerver S.M., Fidler S., Ward H. Adherence to antiretroviral therapy in adolescents living with HIV: systematic review and meta-analysis. AIDS. 2014. 28(13). P. 1945-1956. DOI:10.1097/QAD.0000000000000316.