Журнал «Здоровье ребенка» Том 15, №4, 2020
Вернуться к номеру
Полисахаридразрушающие ферменты как агенты, диспергирующие бактериальные биопленки
Авторы: Абатуров А.Е.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Розвиток бактеріальних біоплівок залежить від секреції і збереження позаклітинних полісахаридів або екзополісахаридів, що являють собою основні компоненти позаклітинної полісахаридної речовини біоплівок. Екзополісахариди позаклітинної полісахаридної речовини забезпечують структурну стабільність біоплівки, адгезію і агрегацію мікроорганізмів, фізичний та хімічний захист бактерій від дії протимікробних препаратів і ефекторів імунної системи макроорганізму. Бактеріальні клітини, розташовані в біоплівці, захищені від антибактеріальних ендо- та екзофакторів позаклітинним полімерним матриксом. Для ініціювання диспергування біоплівок мікроорганізми поряд з іншими ферментами використовують специфічні глікозидгідролази, що руйнують полісахариди бактеріальних біоплівок. Глікозидгідролази реалізують свою дію через гідроліз глікозидних зв’язків: амілази розщеплюють α-1,4-; целюлази — β-1,4-; β-галактозидази — β-1,3-глікозидний зв’язок. Основними глікозидгідролазами, що чинять антибіоплівкову дію, є: α-лізоцим, амілази, дисперсин B, целюлази, гіалуронідаза, α- і β-манозідази, альгінат-ліази. Ці ферменти викликають руйнування полісахаридних полімерів, сприяючи вивільненню бактерій. Бактерії, які втратили захист полісахаридного каркасу, піддаються впливу антибактеріальних агентів. З огляду на те, що деградація екзополісахаридів біоплівок глікозидгідролазами призводить до вираженого диспергування бактерій, даний антибіоплівковий метод лікування може являти собою універсальний підхід до терапії інфекцій, що перебігають із формуванням біоплівок. Медикаментозні методи диспергування біоплівок за допомогою полісахариддеградуючих ферментів, без сумніву, розширять арсенал антибіоплівкової терапії хронічних та рецидивуючих бактеріальних інфекцій, особливо викликаних антибіотико-резистентними бактеріями.
Развитие бактериальных биопленок зависит от секреции и сохранения внеклеточных полисахаридов, или экзополисахаридов, которые являются основными компонентами внеклеточного полисахаридного вещества биопленок. Экзополисахариды внеклеточного полисахаридного вещества обеспечивают структурную стабильность биопленки, адгезию и агрегацию микроорганизмов, физическую и химическую защиту бактерий от действия противомикробных препаратов и эффекторов иммунной системы макроорганизма. Бактериальные клетки, расположенные в биопленке, защищены от антибактериальных эндо- и экзофакторов внеклеточным полимерным матриксом. Для инициирования диспергирования биопленок микроорганизмы наряду с другими ферментами используют специфические гликозидгидролазы, которые разрушают полисахариды бактериальных биопленок. Гликозидгидролазы реализуют свое действие через гидролиз гликозидных связей: амилазы расщепляют α-1,4-; целлюлазы — β-1,4-; β-галактозидазы — β-1,3-гликозидные связи. Основными гликозидгидролазами, которые обладают антибиопленочным действием, являются: α-лизоцим, амилазы, дисперсин B, целлюлазы, гиалуронидаза, α- и β-маннозидазы, альгинат-лиазы. Данные ферменты вызывают разрушение полисахаридных полимеров, способствуя высвобождению бактерий. Бактерии, которые лишились защиты полисахаридного каркаса, подвергаются воздействию антибактериальных агентов. С учетом того, что деградация экзополисахаридов биопленок гликозидгидролазами приводит к выраженному диспергированию бактерий, данный антибиопленочный метод лечения может представлять собой универсальный подход к терапии инфекций, протекающих с формированием биопленок. Медикаментозные методы диспергирования биопленок при помощи полисахаридразрушающих ферментов, без сомнения, расширят арсенал антибиопленочной терапии хронических и рецидивирующих бактериальных инфекций, особенно вызванных антибиотикорезистентными бактериями.
The development of bacterial biofilms depends on the secretion and preservation of extracellular polysaccharides, or exopolysaccharides, which are the main components of the extracellular polysaccharide substance of the biofilms. Exopolysaccharides of the extracellular polysaccharide substance provide the structural stability of the biofilm, the adhesion and aggregation of microorganisms, the physical and chemical protection of bacteria from the action of antimicrobials and immune system effectors of the macroorganism. Bacterial cells located in the biofilm are protected from antibacterial endo- and exofactors by an extracellular polymeric matrix. To initiate the dispersion of biofilms, microorganisms, along with other enzymes, use specific glycoside hydrolases, which destroy polysaccharides of bacterial biofilms. Glycoside hydrolases realize their action through the hydrolysis of glycosidic bonds: amylases cleave α-1,4-; cellulases — β-1,4-; β-galactosidases — β-1,3-glycosidic bonds. The main glycoside hydrolases that have antibiotic action are: α-lysozyme, amylases, dispersin B, cellulases, hyaluronidase, α- and β-mannosidases, alginate lyases. These enzymes cause the destruction of polysaccharide polymers, contributing to the release of bacteria. Bacteria that have lost the protection of the polysaccharide scaffold are exposed to antibacterial agents. Considering that the degradation of exopolysaccharides of biofilms by glycoside hydrolases leads to pronounced dispersion of bacteria, this antibiofilm treatment method can be a universal approach to the treatment of infections occurring with the formation of biofilms. Drug methods of dispersing biofilms using polysaccharide-degrading enzymes will no doubt expand the arsenal of antibiofilm therapy for chronic and recurrent bacterial infections, especially those caused by antibiotic-resistant bacteria.
бактеріальні біоплівки; диспергування; полісахаридруйнуючі ферменти
бактериальные биопленки; диспергирование; полисахаридразрушающие ферменты
bacterial biofilms; dispersion; polysaccharide-degrading enzymes
Введение
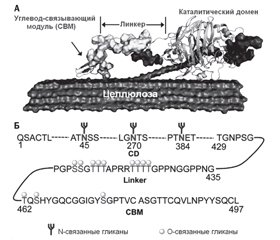
Основные бактериальные гликозидгидролазы
Выводы
- Alkawash M.A., Soothill J.S., Schiller N.L. Alginate lyase enhances antibiotic killing of mucoid Pseudomonas aeruginosa in biofilms. APMIS. 2006 Feb. 114 (2). 131-8. doi: 10.1111/j.1600-0463.2006.apm_356.x.
- Arnal G., Stogios P.J., Asohan J., Attia M.A., Skarina T., Viborg A.H., Henrissat B., Savchenko A., Brumer H. Substrate specificity, regiospecificity, and processivity in glycoside hydrolase family 74. J. Biol. Chem. 2019 Sep 6. 294 (36). 13233-13247. doi: 10.1074/jbc.RA119.009861.
- Baroroh U., Yusuf M., Rachman S.D., Ishmayana S., Syamsunarno M.R.A.A., Levita J., Subroto T. The Importance of Surface-Binding Site towards Starch-Adsorptivity Level in α-Amylase: A Review on Structural Point of View. Enzyme Res. 2017. 2017. 4086845. doi: 10.1155/2017/4086845.
- Berlemont R., Martiny A.C. Phylogenetic distribution of potential cellulases in bacteria. Appl Environ Microbiol. 2013 Mar. 79 (5). 1545-54. doi: 10.1128/AEM.03305-12.
- Chaignon P., Sadovskaya I., Ragunah Ch., Ramasubbu N., Kaplan J.B., Jabbouri S. Susceptibility of staphylococcal biofilms to enzymatic treatments depends on their chemical composition. Appl Microbiol. Biotechnol. 2007 May. 75 (1). 125-32. DOI: 10.1007/s00253-006-0790-y.
- Chen K.J., Lee C.K. Twofold enhanced dispersin B activity by N-terminal fusion to silver-binding peptide for biofilm eradication. Int. J. Biol. Macromol. 2018 Oct 15. 118 (Pt A). 419-426. doi: 10.1016/j.ijbiomac.2018.06.066.
- Cockburn D., Wilkens C., Ruzanski C. et al. Analysis of surface binding sites (SBSs) in carbohydrate active enzymes with focus on glycoside hydrolase families 13 and 77 — a mini-review. Biologia (Poland) 2014. 69 (6). 705-712. doi: 10.2478/s11756-014-0373-9.
- Craigen B., Dashiff A., Kadouri D.E. The Use of Commercially Available Alpha-Amylase Compounds to Inhibit and Remove Staphylococcus aureus Biofilms. Open Microbiol. J. 2011. 5. 21-31. doi: 10.2174/1874285801105010021.
- Ertesvåg H. Alginate-modifying enzymes: biological roles and biotechnological uses. Front. Microbiol. 2015 May 27. 6. 523. doi: 10.3389/fmicb.2015.00523.
- Fekete A., Borbás A., Gyémánt G., Kandra L., Fazekas E., Ramasubbu N., Antus S. Synthesis of β- (1–6)-linked N-acetyl-D-glucosamine oligosaccharide substrates and their hydrolysis by Dispersin B. Carbohydr. Res. 2011 Sep 6. 346 (12). 1445-53. doi: 10.1016/j.carres.2011.03.029.
- Fleming D., Chahin L., Rumbaugh K. Glycoside Hydrolases Degrade Polymicrobial Bacterial Biofilms in Wounds. Antimicrob Agents Chemother. 2017 Jan 24. 61 (2). pii: e01998-16. doi: 10.1128/AAC.01998-16.
- Fleming D., Rumbaugh K.P. Approaches to Dispersing Medical Biofilms. Microorganisms. 2017 Apr 1. 5 (2). pii: E15. doi: 10.3390/microorganisms5020015.
- Ghadam P., Akhlaghi F., Ali A.A. One-step purification and characterization of alginate lyase from a clinical Pseudomonas aeruginosa with destructive activity on bacterial biofilm. Iran J. Basic. Med. Sci. 2017 May. 20 (5). 467-473. doi: 10.22038/IJBMS.2017.8668.
- Greene E.R., Himmel M.E., Beckham G.T., Tan Z. Glycosylation of Cellulases: Engineering Better Enzymes for Biofuels. Adv. Carbohydr. Chem. Biochem. 2015. 72. 63-112. doi: 10.1016/bs.accb.2015.08.001.
- Hogan S., Zapotoczna M., Stevens N.T., Humphreys H., O'Gara J.P., O'Neill E. Potential use of targeted enzymatic agents in the treatment of Staphylococcus aureus biofilm-related infections. J. Hosp. Infect. 2017 Jun. 96 (2). 177-182. doi: 10.1016/j.jhin.2017.02.008.
- Janeček Š., Gabriško M. Remarkable evolutionary relatedness among the enzymes and proteins from the α-amylase family. Cell. Mol. Life Sci. 2016 Jul. 73 (14). 2707-25. doi: 10.1007/s00018-016-2246-6.
- Kalpana B.J., Aarthy S., Pandian S.K. Antibiofilm activity of α-amylase from Bacillus subtilis S8-18 against biofilm forming human bacterial pathogens. Appl. Biochem. Biotechnol. 2012 Jul. 167 (6). 1778-94. doi: 10.1007/s12010-011-9526-2.
- Kerrigan J.E., Ragunath C., Kandra L., Gyémánt G., Lipták A., Jánossy L., Kaplan J.B., Ramasubbu N. Modeling and biochemical analysis of the activity of antibiofilm agent Dispersin B. Acta Biol. Hung. 2008 Dec. 59 (4). 439-51. doi: 10.1556/ABiol.59.2008.4.5.
- Kurasin M., Väljamäe P. Processivity of cellobiohydrolases is limited by the substrate. J. Biol. Chem. 2011 Jan 7. 286 (1). 169-77. doi: 10.1074/jbc.M110.161059.
- Lamppa J.W., Ackerman M.E., Lai J.I., Scanlon T.C., Griswold K.E. Genetically engineered alginate lyase-PEG conjugates exhibit enhanced catalytic function and reduced immunoreactivity. PLoS One. 2011 Feb 14. 6 (2). e17042. doi: 10.1371/journal.pone.0017042.
- Lombard V., Bernard T., Rancurel C., Brumer H., Coutinho P.M., Henrissat B. A hierarchical classification of polysaccharide lyases for glycogenomics. Biochem J. 2010 Dec 15. 432 (3). 437-44. doi: 10.1042/BJ20101185.
- Ma L., Conover M., Lu H., Parsek M.R., Bayles K., Wozniak D.J. Assembly and development of the Pseudomonas aeruginosa biofilm matrix. PLoS Pathog. 2009 Mar. 5 (3). e1000354. doi: 10.1371/journal.ppat.1000354.
- Pozzi C., Waters E.M., Rudkin J.K., Schaeffer C.R., Lohan A.J., Tong P., Loftus B.J., Pier G.B., Fey P.D., Massey R.C., O'Gara J.P. Methicillin resistance alters the biofilm phenotype and attenuates virulence in Staphylococcus aureus device-associated infections. PLoS Pathog. 2012. 8 (4). e1002626. doi: 10.1371/journal.ppat.1002626.
- Ragunath C., DiFranco K., Shanmugam M., Gopal P., Vyas V., Fine D.H., Cugini C., Ramasubbu N. Surface display of Aggregatibacter actinomycetemcomitans autotransporter Aae and dispersin B hybrid act as antibiofilm agents. Mol. Oral. Microbiol. 2016 Aug. 31 (4). 329-39. doi: 10.1111/omi.12126.
- Ramasubbu N., Thomas L.M., Ragunath C., Kaplan J.B. Structural analysis of dispersin B, a biofilm-releasing glycoside hydrolase from the periodontopathogen Actinobacillus actinomycetemcomitans. J. Mol. Biol. 2005 Jun 10. 349 (3). 475-86.
- Saxena P., Joshi Y., Rawat K., Bisht R. Biofilms: Architecture, Resistance, Quorum Sensing and Control Mechanisms. Indian J. Microbiol. 2019 Mar. 59 (1). 3-12. doi: 10.1007/s12088-018-0757-6.
- Sukharnikov L.O., Cantwell B.J., Podar M., Zhulin I.B. Cellulases: ambiguous nonhomologous enzymes in a genomic perspective. Trends Biotechnol. 2011 Oct. 29 (10). 473-9. doi: 10.1016/j.tibtech.2011.04.008.
- Thallinger B., Prasetyo E.N., Nyanhongo G.S., Guebitz G.M. Antimicrobial enzymes: an emerging strategy to fight microbes and microbial biofilms. Biotechnol J. 2013 Jan. 8 (1). 97-109. doi: 10.1002/biot.201200313.
- van Dijl J.M., Hecker M. Bacillus subtilis: from soil bacterium to super-secreting cell factory. Microb. Cell. Fact. 2013 Jan 14. 12. 3. doi: 10.1186/1475-2859-12-3.
- Waryah C.B., Wells K., Ulluwishewa D. et al. In Vitro Antimicrobial Efficacy of Tobramycin Against Staphylococcus aureus Biofilms in Combination With or Without DNase I and/or Dispersin B: A Preliminary Investigation. Microb. Drug. Resist. 2017 Apr. 23 (3). 384-390. doi: 10.1089/mdr.2016.0100.
- Watters C.M., Burton T., Kirui D.K., Millenbaugh N.J. Enzymatic degradation of in vitro Staphylococcus aureus biofilms supplemented with human plasma. Infect. Drug Resist. 2016 Apr 27. 9. 71-8. doi: 10.2147/IDR.S103101.
- Xu F., Wang P., Zhang Y.Z., Chen X.L. Diversity of Three-Dimensional Structures and Catalytic Mechanisms of Alginate Lyases. Appl. Environ. Microbiol. 2018 Jan 17. 84 (3). pii: e02040-17. doi: 10.1128/AEM.02040-17.
- Yan S., Wu G. Bottleneck in secretion of α-amylase in Bacillus subtilis. Microb. Cell. Fact. 2017 Jul 19. 16 (1). 124. doi: 10.1186/s12934-017-0738-1.
- Zhu B., Yin H. Alginate lyase: Review of major sources and classification, properties, structure-function analysis and applications. Bioengineered. 2015. 6 (3). 125-31. doi: 10.1080/21655979.2015.1030543.

/93.jpg)
/94.jpg)
/94_2.jpg)
/95.jpg)
/96.jpg)
/97.jpg)