Журнал «Здоровье ребенка» Том 15, №5, 2020
Вернуться к номеру
Протизапальні ефекти пробіотичної терапії хронічних гастродуоденітів у дітей
Авторы: Абатуров О.Є.(1), Кайдашев І.П.(2), Нікуліна А.O.(1), Токарева Н.М.(1), Кривуша О.Л.(1), Ликова А.Е.(1)
1) ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
2) ВДНЗ України «Українська стоматологічна академія», НДІ генетичних та імунологічних основ розвитку патології та фармакогенетики, м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Хронічний гастродуоденіт у дітей і підлітків у даний час є найпоширенішим захворюванням шлунково-кишкового тракту. У штамів Lactobacillus rhamnosus GG (LGG) є унікальні якості, які можуть відповідати за певні імунологічні, метаболічні й антимікробні ефекти, що вкрай важливі при запаленні слизової оболонки шлунка й дванадцятипалої кишки. Мета дослідження: визначити ефективність і безпечність використання LGG у комплексній терапії хронічних гастродуоденітів у дітей шляхом дослідження факторів, що ініціюють хронічний запальний процес. Матеріали та методи. Обстежено 43 дитини, хворих на хронічний гастродуоденіт, віком 10–14 років, із них сформовано 2 групи порівняння. До основної групи (n = 25) увійшли пацієнти, для лікування яких поруч із традиційною терапією використовувався пробіотичний препарат у дозуванні 5 крапель, що містили 5 × 109 ліофілізованих життєздатних бактерій LGG (ATCC 53103), — Лактіалє GG. Контрольну групу (n = 18) становили хворі, які отримували лише традиційну терапію. Тривалість лікування пробіотиком Лактіалє GG становила 14 днів. Для доведення ефективності й безпечності використання LGG визначали рівень експресії мРНК TLR4, NLRC1/NOD1 за допомогою полімеразної ланцюгової реакції зі зворотною транскрипцією. Активність експресії NF-κB+CD40+-клітин досліджували з використанням моноклональних антитіл методом проточної цитофлуорометрії. Результати. В основній групі до лікування рівень експресії мРНК TLR4 становив 3,23 ± 0,15 RU ∆mRNA TLR4/RNA actin, через 14 днів лікування рівень експресії мРНК TLR4 був 3,15 ± 0,13 RU ∆mRNA TLR4/RNA actin, р > 0,05. У контрольній групі рівень експресії мРНК TLR4 до лікування становив 3,19 ± 0,14 RU ∆mRNA TLR4/RNA actin, через 14 днів лікування — 3,07 ± 0,08 RU ∆mRNA TLR4/RNA actin, р > 0,05. В основній групі до лікування рівень експресії гена NOD1 був в 1,5 раза вищим, ніж після лікування, а саме 2,86 ± 0,24 RU ∆mRNA NOD1/RNA GAPDH і 1,9 ± 0,06 RU ∆mRNA NOD1/RNA GAPDH відповідно. У контрольній групі до лікування рівень експресії гена NOD1 становив 2,72 ± 0,35 RU ∆mRNA NOD1/RNA GAPDH, після лікування не відмічалось його статистично значущого зменшення — 2,57 ± 0,37 RU ∆mRNA NOD1/RNA GAPDH. В основній групі спостереження до лікування активність NF-κB лімфоцитів становила 48,1 ± 3,2 %; після лікування — 30,2 ± 2,3 %, p < 0,05. Тоді як у групі порівняння не відмічалось статистично значущого зниження активності NF-κB: до лікування — 45,8 ± 1,8 %; після лікування — 40,9 ± 5,2 %, p > 0,05. Висновки. Вплив пробіотичної терапії LGG на експресію генів факторів рекогніції вродженої імунної системи TLR4 і NLRC1/NOD1 при хронічному гастродуоденіті в дітей характеризується доведеним зниженням експресії NLRC1/NOD1 з подальшою деактивацією прозапальних NF-κB-асоційованих сигнальних шляхів.
Актуальность. Хронический гастродуоденит у детей и подростков в настоящее время является самым распространенным заболеванием желудочно-кишечного тракта. У штаммов Lactobacillus rhamnosus GG (LGG) есть уникальные свойства, которые могут отвечать за определенные иммунологические, метаболические и антимикробные эффекты, которые крайне важны при воспалении слизистой оболочки желудка и двенадцатиперстной кишки. Цель исследования: определить эффективность и безопасность использования Lactobacillus rhamnosus GG в комплексной терапии хронических гастродуоденитов у детей путем исследования факторов, инициирующих хронический воспалительный процесс. Материалы и методы. Обследовали 43 ребенка, больных хроническим гастродуоденитом, в возрасте 10–14 лет, из них были сформированы 2 группы сравнения. В основную группу (n = 25) вошли пациенты, для лечения которых наряду с традиционной терапией использовался пробиотический препарат в дозировке 5 капель, содержащих 5 × 109 лиофилизированных жизнеспособных бактерий LGG (ATCC 53103), — Лактиале GG. Контрольную группу (n = 18) составили больные, получавшие только традиционную терапию. Продолжительность лечения пробиотиком Лактиале GG составляла 14 дней. Для доказательства эффективности и безопасности использования LGG определяли уровень экспрессии мРНК TLR4, NLRC1/NOD1 с помощью полимеразной цепной реакции с обратной транскрипцией. Активность продукции NF-κB CD40+ клетками исследовали с использованием моноклональных антител методом проточной цитофлуорометрии. Результаты. В основной группе до лечения уровень экспрессии мРНК TLR4 составлял 3,23 ± 0,15 RU ΔmRNA TLR4/RNA actin, через 14 дней лечения уровень экспрессии мРНК TLR4 составил 3,15 ± 0,13 RU ΔmRNA TLR4/RNA actin, р > 0,05. В контрольной группе уровень экспрессии мРНК TLR4 до лечения составил 3,19 ± 0,14 RU ΔmRNA TLR4/RNA actin, через 14 дней лечения — 3,07 ± 0,08 RU ΔmRNA TLR4/RNA actin, р > 0,05. В основной группе до лечения уровень экспрессии гена NOD1 был в 1,5 раза выше, чем после лечения, а именно 2,86 ± 0,24 RU ΔmRNA NOD1/RNA GAPDH и 1,9 ± 0,06 RU ΔmRNA NOD1/RNA GAPDH. В контрольной группе до лечения уровень экспрессии гена NOD1 составлял 2,72 ± 0,35 RU ΔmRNA NOD1/RNA GAPDH, после лечения не отмечалось его статистически значимого уменьшения — 2,57 ± 0,37 RU ΔmRNA NOD1/RNA GAPDH. В основной группе наблюдения до лечения активность NF-κB лимфоцитов составляла 48,1 ± 3,2 %; после лечения — 30,2 ± 2,3 %, p < 0,05. Тогда как в группе сравнения не отмечалось статистически значимого снижения активности NF-κB: до лечения — 45,8 ± 1,8 %; после лечения — 40,9 ± 5,2 %, p > 0,05. Вывод. Влияние пробиотической терапии LGG на экспрессию генов факторов рекогниции врожденной иммунной системы TLR4 и NLRC1/NOD1 при хроническом гастродуодените у детей характеризуется доказанным снижением экспрессии NLRC1/NOD1 с последующей деактивацией провоспалительных NF-κB-ассоциированных сигнальных путей.
Background. Chronic gastroduodenitis in children and adolescents is currently the most common disease of the gastrointestinal tract. The strains of Lactobacillus rhamnosus GG (LGG) have unique properties that can be responsible for certain immunological, metabolic and antimicrobial effects, which are extremely important for inflammation of the mucous membrane of the stomach and duodenum. The purpose was to determine the effectiveness and safety of the use of Lactobacillus rhamnosus GG in the comprehensive treatment of chronic gastroduodenitis in children by examining the factors initiating the chronic inflammatory process. Materials and methods. Forty-three children with chronic gastroduodenitis aged 10–14 years were examined, of which 2 comparison groups were formed. The main group (n = 25) included patients for the treatment of which, along with traditional therapy, a probiotic preparation Lactiale GG was used at a dose of 5 drops containing 5 · 109 lyophilized viable LGG bacteria (ATCC 53103). The control group (n = 18) was represented by patients who received only traditional therapy. The duration of treatment with Lactiale GG probiotic was 14 days. To prove the efficacy and safety of LGG, the expression level of TLR4, NLRC1/NOD1 mRNA was determined using reverse transcription polymerase chain reaction. The production activity of NF-κB CD40+ cells was investigated using monoclonal antibodies by flow cytometry. Results. In the main group before treatment, the expression level of TLR4 mRNA was 3.23 ± 0.15 RU ΔmRNA TLR4/RNA actin, after 14 days of treatment, it was 3.15 ± 0.13 RU ΔmRNA TLR4/RNA actin, p > 0.05. In the control group, the expression level of TLR4 mRNA before treatment was 3.19 ± 0.14 RU ΔmRNA TLR4/RNA actin, after 14 days of treatment — 3.07 ± 0.08 RU ΔmRNA TLR4/RNA actin, p > 0.05. In the main group before treatment, the level of NOD1 gene expression was 1.5 times higher than after treatment, namely, 2.86 ± 0.24 and 1.90 ± 0.06 RU ΔmRNA NOD1/RNA GAPDH, respectively. In the control group, the level of NOD1 gene expression before treatment was 2.72 ± 0.35 RU ΔmRNA NOD1/RNA GAPDH; after treatment, its statistically significant decrease was not observed — 2.57 ± 0.37 RU ΔmRNA NOD1/RNA GAPDH. In the main observation group before treatment, the activity of NF-κB lymphocytes was 48.1 ± 3.2 %; after treatment — 30.2 ± 2.3%, p < 0.05. Whereas in the comparison group, there was no statistically significant decrease in NF-κB activity: before treatment — 45.8 ± 1.8 %; after treatment — 40.9 ± 5.2 %, p > 0.05. Conclusions. The effect of LGG probiotic therapy on expression of TLR4 and NLRC1/NOD1 genes of innate immune system recognition factors in chronic gastroduodenitis in children is characterized by a proven decrease in NLRC1/NOD1 expression followed by deactivation of pro-inflammatory NF-κB-associated signaling pathways.
пробіотична терапія; Lactobacillus rhamnosus GG; хронічний гастродуоденіт; діти
пробиотическая терапия; Lactobacillus rhamnosus GG; хронический гастродуоденит; дети
probiotic therapy; Lactobacillus rhamnosus GG; chronic gastroduodenitis; children
Вступ
Хронічний гастродуоденіт (ХГД) — найпоширеніша форма хронічної гастродуоденальної патології в дітей, що становить у структурі захворювань шлунка й дванадцятипалої кишки 58–74 % [3]. В Україні спостерігається невпинне зростання частоти виявлення ХГД у дітей всіх вікових груп: від 81,6 у дошкільників до 100–130,8 у дітей віком 7–15 років і 141 і більше (залежно від регіону) — у підлітків на 1000 дитячого населення за відсутності тенденції до її зниження. Поряд із неухильним зростанням захворюваності на ХГД відзначається обтяження перебігу патологічного процесу: у 2,5 раза збільшилася питома вага ерозивних, субатрофічних і атрофічних форм [5].
Незважаючи на досягнення сучасної фармакотерапії, наявність стійких факторів, що ініціюють хронічний запальний процес до стандартної терапії, зростання числа повторних загострень і формування подальших ускладнень з приводу ХГД у дитячій популяції збільшують проблеми для клініцистів у всьому світі й вимагають подальшого вивчення ад’ювантних стратегій лікування.
Спираючись на результати попередніх досліджень, а також враховуючи, що молочнокислі бактерії, які природно локалізуються в шлунку й двана–дцятипалій кишці, здавна пов’язані з ферментацією їжі та вважаються безпечними для перорального застосування як складова частина харчового продукту або добавка в загальноприйнятому дозуванні, ми припускаємо, що призначення саме LGG буде сприяти більш ефективному лікуванню хронічних гастродуоденітів у дітей.
Мета дослідження: визначити ефективність використання Lactobacillus rhamnosus GG у комплексній терапії хронічних гастродуоденітів у дітей за рахунок дослідження факторів, що ініціюють хронічний запальний процес.
Матеріали та методи
Робота є фрагментом науково-дослідної роботи кафедри педіатрії 1 і медичної генетики ДЗ «Дніпропетровська медична академія МОЗ України» «Генотип-асоційована персоналізація діагностичного та лікувального процесу в дітей з хворобами респіраторної, ендокринної та травної систем» (номер держреєстрації 0118U006629) і «Прогнозування розвитку дитячих захворювань, асоційованих з цивілізацією» (номер держреєстрації 0120U101324). Дослідження виконане за бюджетною програмою КПКВК 2301020 «Наукова і науково-технічна діяльність у сфері охорони здоров’я», фінансувалося Міністерством охорони здоров’я України за кошти державного бюджету. Дослідження проведене згідно із сучасними науковими стандартами, передбачені заходи щодо забезпечення здоров’я пацієнтa, дотримання його прав, людської гідності та морально-етичних норм відповідно до Гельсінської декларації, Конвенції Ради Європи про права людини і біомедицину, Загальної декларації про біоетику і права людини ЮНЕСКО, відповідних законів України (Конституції України (ст. 3, 21, 24, 28, 32), Основ законодавства України про охорону здоров’я (ст. 43.1, 44.1), Закону України «Про лікарські засоби» (ст. 7, 8)).
Клінічне обстеження пацієнтів під час стаціонарного лікування на базі дитячого гастроентерологічного відділення КНП «Дніпровська МКЛ № 9» ДМР» з аналізом та інтерпретацією отриманих клініко-анамнестичних, лабораторно-інструментальних даних було основним методом дослідження. Перелік додаткових параклінічних методів обстеження був складений згідно з Наказом МОЗ України № 59 від 29.01.2013 «Уніфікований клінічний протокол медичної допомоги дітям із хронічним гастродуоденітом».
Лабораторне дослідження окрім загальноклінічного й мікробіологічного (кількісної ідентифікації кишкової флори) обстеження включало молекулярно-генетичні методи дослідження, проведені в сертифікованій лабораторії НДІ генетичних та імунних основ розвитку патології і фармакогенетики Вищого державного навчального закладу України «Українська медична стоматологічна академія» (м. Полтава) до та після призначеної терапії.
Відносні рівні експресії мРНК мембранних TLR4 (Toll-like receptors 4) і цитоплазматичних рецепторів NLRC1/NOD1 (Nod-like receptors) визначали за допомогою полімеразної ланцюгової реакції зі зворотною транскрипцією з використанням детектувального ампліфікатора ДТ-322 («ДНК-Технологія», РФ), як описано в протоколі виробника. Виділення загальної РНК зі слизової оболонки шлунка проводили за допомогою пакета реагентів «РИБО-золь-В» (AmpliSens, РФ). Для отримання кДНК у реакції зворотної транскрипції використовували праймер оліго (dT)18 і зворотну транс–криптазу M-MuLV (SibEnzyme, РФ). Температура відпалу праймерів становила 62 °C. Аналізували експресію генів TLR4 і NLRC1/NOD1 методом полімеразної ланцюгової реакції в режимі реального часу в присутності барвника SYBR Green I шляхом відносного кількісного аналізу. При визначенні рівня експресії мРНК TLR4 як референтний ген використовували ген b-актину. При визначенні рівня експресії мРНК NLRC1/NOD1 як референтний ген використовували ген GAPDH. Для аналізу даних застосовували пороговий Ct-метод з розрахунком за формулою: 2-∆Ct (або геометричний Cp-метод із розрахунком за формулою: ∆Ср = Ср (TLR4) – – Ср (b-актину), або ∆Cp = Cp (NLRC1/NOD1) – Cp (GAPDH)).
Для визначення експресії NF-kB CD40+-клітинами суспензію мононyклеapів пеpифеpичної крові iнкyбyвaли з моноклональними антитілами (мкАТ) до поверхневих антигенів CD40. До 50 мкл суспензії (105 клітин) додавали 5 мкл мкАТ, мічених FITC, проти CD40 (Caltag, CШA) й інкубували 20 хв при 4 °C. Потім клітини відмивали шляхом центрифугування з 1 мл фосфатно-сольового буфера (ФСБ) при 1500 об/хв протягом 5 хв. Ресуспендовані клітини фiксували розчином (Caltag, США) 20 хв при 4 °С. Пермеабілізацію проводили при мкАТ проти субодиниць р65 молекули NF-kB (BD Biosciences Pharmingen, США) протягом 40 хв при 4 °С. Після одноразового відмивання до ресуспендованих клітин додавали інші мкАТ, мiченi РЕ (Caltag, США). Пiсля 20-хвилинної інкубації клітини вiдмивали, додавали 0,5 мл ФСБ та аналiзували проби на проточному цитофлуориметрi EPIX LX-MCL (Beckman Coulter, США), використовуючи програму System IITM Software. Для збудження флуоресценції використовували аргоновий лазер iз хвилею завдовжки 488 нм. Додатково до флуоресцентних параметрів проводили реєстрацію прямого й бокового світорозсіювання клітин, що дозволяло виключати з дослідження конгломерати клітин, їх уламки.
Усім дітям було виконано фіброезофагогастродуоденоскопічне дослідження (ФЕГДС, Pentax FG-15W, Японія) з вилученням біоптату слизової оболонки шлунка.
Для визначення ефективності й безпечності використання LGG із 43 дітей, хворих на ХГД, віком 10–14 років сформували 2 групи порівняння. До основної групи (n = 25) увійшли пацієнти, для лікування яких поруч із традиційною терапією використовувався пробіотичний препарат у дозуванні 5 крапель, що містили 5 ´ 109 ліофілізованих життєздатних бактерій LGG (ATCC 53103), — Лактіалє GG. Контрольну групу (n = 18) становили хворі, що отримували лише традиційну терапію. Тривалість лікування пробіотиком Лактіалє GG становила 14 днів.
Критеріями клінічної ефективності лікування вважали: відсутність клінічних проявів ХГД (абдомінального больового, диспептичного, астеновегетативного синдромів), нормалізацію фізіологічного складу кишкового мікробіому й відсутність прозапальної імунної відповіді за результатами молекулярно-генетичних методів досліджень.
Статистичну обробку результатів проводили за допомогою Microsoft Excel (Office Home Business 2KB4Y-6H9DB-BM47K-749PV-PG3KT) і програмного продукта Statistica 6.1 (StatSoft Inc., серійний № AGAR909E415822FA). Аналiз отриманих даних з оцiнкою статистичної вірогідності відмінностей проводився за допомогою пара- і непараметричних методів статистики. Критичне значення рівня статистичної значущості при перевірці усіх нульових гіпотез приймалося рівним 0,05 (5 %).
Результати
Основна група і група порівняння обстежених пацієнтів за віком і статтю вірогідно не відрізнялись одна від одної. Середній вік дітей, хворих на ХГД, в основній групі був 13,23 ± 0,62 року, в контрольній групі — 12,56 ± 0,54 року. Хлопчики в основній групі дітей становили 60,3 %, у групі порівняння — 55,9 %; дівчатка — 39,7 і 44,1 % відповідно.
У клінічній картині більшості спостережуваних пацієнтів домінували больовий, диспептичний і астеновегетативний синдроми. Провідним клінічним синдромом у дітей обох груп був абдомінальний больовий, проте його характер і вираженість у дітей основної групі відрізнялися від таких у пацієнтів контрольної групи. При порівнянні динаміки клінічних проявів в обох групах хворих було встановлено, що на тлі лікування комбінованою терапією з використанням препарату Лактіалє GG спостерігався більш швидкий регрес інтенсивності основних синдромів захворювання. Клінічною особливістю в дітей, які отримували комбіновану терапію з пробіотичним препаратом LGG, була менш виражена інтенсивність болю, який вони характеризували як ниючий з почуттям розпирання в епігастральній ділянці, і скорочена тривалість больового синдрому, що в середньому становила 8,0 ± 1,2 дня.
Тоді як у пацієнтів із групи порівняння, які не отримували пробіотичний препарат LGG, абдомінальний біль мав частіше виразковоподібний перебіг у 1/3 (33,4 %) дітей за відсутності ерозивно-виразкового ураження слизової оболонки шлунка або дванадцятипалої кишки й відрізнявся більшою тривалістю, що становила 13,0 ± 1,6 дня.
Диспептичні прояви на 7-й день лікування також були більш вираженими в дітей контрольної групи порівняно з пацієнтами основної групи й частіше характеризувались відсутністю апетиту (у 1,2 раза), метеоризмом, нестійкістю випорожнень зі схильністю до запорів (у 1,8 раза).
Астеновегетативний синдром реєструвався в дітей в основній і контрольній групі в середньому упродовж однакового проміжку часу — 13,0 ± 2,3 дня і 14,0 ± 1,8 дня відповідно.
При порівнянні динаміки клінічних проявів в обох групах хворих було встановлено, що на тлі комбінованої терапії з використанням препарату Лактіалє GG відбувався більш швидкий регрес інтенсивності основних синдромів захворювання.
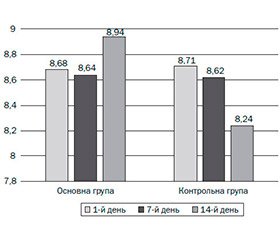
Дослідження фекальної мікробіоти в основній і контрольній групах до лікування характеризувалось приблизно однаковою кількістю біфідумбактерій — 8,68 ´ 109 КУО/г і 8,71 ´ 109 КУО/г відповідно. Починаючи із 7-го дня лікування кількість зазначених коменсальних бактерій починає збільшуватись в основній групі спостереження з 8,64 ´ 109 КУО/г до 8,94 ´ 109 КУО/г фекалій. Тоді як у контрольній групі спостерігалось вірогідне зменшення біфідумбактерій починаючи з 7-го дня спостереження — до 8,24 ´ 109 КУО/г фекалій (рис. 1).
Кількість лактобактерій в основній і контрольній групах до лікування також принципово не відрізнялась і становила 6,66 ´ 107 КУО/г і 7 ´ 107 КУО/г відповідно. На 7-й день лікування кількість зазначених коменсальних бактерій характеризується відносним зменшенням в основній групі спостереження до 6,44 ´ 107 КУО/г із поступовим збільшенням до 7,12 ´ 107 КУО/г на 14-й день лікування. Тоді як у контрольній групі спостерігалось вірогідне зменшення лактобактерій починаючи з 7-го дня спостереження до 6,67 ´ 107 КУО/г з мінімально зареєстрованою їх кількістю на 14-й день спостереження на рівні 6,14 ´ 107 КУО/г фекалій (рис. 2).
У той же час при дослідженні умовно-патогенних бактерій у кишковому вмісті в основній і контрольній групах спостереження на 14-й день лікування ми отримали вірогідно значиме їх зростання в контрольній групі. Рівень зростання гемолізуючої Escherichia coli Hly+ переважав у 2 рази, кокової флори — у 2,34 раза, Staphylococcus saprophyticus — у 1,9 раза, ентерококів — у 5 разів порівняно з основною групою (рис. 3).
У дітей із хронічним гастродуоденітом у періоді загострення спостерігався відносно підвищений рівень експресії TLR4 (рівень активності 1,9–2,8) RU ∆mRNA TLR4/RNA actin і NLRC1/NOD1 (рівень активності ≥ 4,2 06 RU ∆mRNA NOD1/RNA GAPDH).
Незалежно від лікування рівень експресії мРНК TLR4 практично не змінювався до періоду реконвалесценції. В основній групі до лікування рівень експресії мРНК TLR4 становив 3,23 ± 0,15 RU ∆mRNA TLR4/RNA actin, через 14 днів лікування рівень експресії мРНК TLR4 становив 3,15 ± 0,13 RU ∆mRNA TLR4/RNA actin, р > 0,05. У контрольній групі рівень експресії мРНК TLR4 до лікування становив 3,19 ± 0,14 RU ∆mRNA TLR4/RNA actin, через 14 днів лікування — 3,07 ± 0,08 RU ∆mRNA TLR4/RNA actin, р > 0,05.
У той же час на тлі терапії Лактіалє GG спостерігалось зниження експресії мРНК цитоплазматичних рецепторів NLRC1/NOD1. В основній групі до лікування рівень експресії гена NOD1 був в 1,5 раза вищим, ніж після лікування, а саме 2,86 ± 0,24 RU ∆mRNA NOD1/RNA GAPDH і 1,9 ± 0,06 RU ∆mRNA NOD1/RNA GAPDH. У контрольній групі до лікування рівень експресії гену NOD1 становив 2,72 ± 0,35 RU ∆mRNA NOD1/RNA GAPDH, після лікування не відмічалось його статистично значимого зменшення — 2,57 ± 0,37 RU ∆mRNA NOD1/RNA GAPDH.
Наше дослідження також продемонструвало, що терапія Лактіалє GG супроводжувалась статистично значимим зниженням активності фактора транс–крипції NF-kB: його рівень до лікування становив 48,1 ± 3,2 %; після лікування — 30,2 ± 2,3 %, p < 0,05. Тоді як у групі порівняння не відмічалось статистично значущого зниження активності NF-kB: до лікування — 45,8 ± 1,8 %; після лікування 40,9 ± 5,2 %, p > 0,05.
Обговорення
Нами показано, що комбінована терапія з призначенням пробіотичних бактерій LGG у періоді загострення здатна здійснювати процес саногенезу більш швидко при клінічно визнаних хронічних захворюваннях гастроуоденальної зони, ніж стандартне лікування. Подібний ефект був відзначений авторами в попередніх роботах та інших дослідженнях [6, 10].
Отримані результати дослідження кишкового мікробіому свідчать про асоціацію між зниженням лакто- та біфідумбактерій і зростанням умовно-патогенної флори в кишковому люмені дітей, які не отримували при лікуванні ХГД пробіотичний препарат LGG. Тоді як призначення Лактіалє GG сприяло більш ефективному зростанню лакто- і біфідумбактерій у дітей. W. Zhang і співавт. [21] у 2018 році також було доведено, що Lactobacillus rhamnosus GG можуть відновити баланс мікробіоти в кишечнику й зберегти кишковий епітеліальний бар’єр, пов’язаний з автофагією, тим самим контролюючи зростання не тільки умовно-патогенної, a й патогенної кишкової флори Salmonella enterica serovar Infantis за рахунок промоторування рецептора епідермального фактора зростання й фосфорилювання від’ємного посередника Akt, який запобігає загибелі кишкових епітеліоцитів і стимулює зростання L.amylovorus, L.agilis та інших представників родини Proteobacteria, Firmicutes і Bacteroideа. Вважається, що зменшення запалення відбувається за рахунок зниження патогенного зростання бактерій за рахунок посилення бар’єрних функцій, які запобігають вторгненню в щільні з’єднання за рахунок зниження рН кишечника й стимулювання неспецифічних і специфічних імунних реакцій [18].
Імунна система слизової оболонки шлунково-кишкового тракту виявляє мікроорганізми, розрізняючи симбіотичні й патогенні за допомогою вдосконаленої консервативної системи образ-розпізнавальних рецепторів (pattern recognition receptors — PRR), включно з мембранозв’язаними рецепторами, що асоційовані з мембраною TLR, і цитоплазматичними NLR. Бактерії LGG лімітують активність механізмів, що беруть участь у розвитку запальних реакцій [8, 16]. Патоген-асоційовані молекулярні структури, зокрема ліпополісахарид (LPS), розпізнаються TLR4, тим самим індукують синтез прозапальних цитокінів, хемокінів [4]. Згідно з результатами нашого дослідження, активність експресії генів TLR4 не змінювалась на тлі лікування пробіотичними бактеріями LGG. Імовірно, бактерії LGG не чинять значного впливу на експресію рецепторів TLR4 [7, 14], але запобігають взаємодії LPS патогенних бактерій із TLR4. Так, доведено, що пробіотичні бактерії LGG індукують продукцію аксесуарної молекули sCD14 моноцитами й дендритними клітинами, що перешкоджає взаємодії патоген-асоційованих структур з mCD14 і продукції цитокінів [2, 12].
Терапія Лактіалє GG супроводжувалась вірогідним зниженням експресії NLRC1/NOD1. Дослідження in vitro продемонстрували, що протизапальна функція LGG принаймні частково опосередковується через NLR. Jiao Yu і співавт. у 2017 році також довели можливість бактерій LGG пригнічувати активність рецепторів NLRC1/NOD1 при індукованому сальмонельозному ентериті in vivo у свиней [20]. З родини NLR NOD1 і NOD2 активуються під впливом пептидогліканових компонентів мезодіамінопімелевої кислоти й мурамілдипептиду відповідно [19].
Відомо, що ключовим каскадом, який запускає процес запалення, є шлях від збудження образ-розпізнавальних рецепторів до підвищення рівня експресії прозапальних генів, що асоціюються з ядерним фактором транскрипції каппа-енхансеру легкого ланцюга активованих В-клітин (nuclear factor kappa-light-chain-enhancer of activated В cells, NF-kB) і реалізується відповідною активацією TLR4/MyD88/TAK1 і NLRC1/NOD1/TAK1 сигнальних шляхів [13, 15], призводить до вироблення протизапальних цитокінів, хемокінів та антимікробних пептидів, тим самим сприяючи запальній реакції в організмі [1].
Терапія Лактіалє GG супроводжувалась зниженням активності фактора транскрипції NF-kB. Технологія таргетування генів Cre/lox доводить специфічну активацію NF-kВ у різних клітинних лініях і підкреслює, що NF-kB має тканинно-специфічні ефекти в запальній відповіді [9]. За даними L. Eckmann та співавт. [11], запалення, індуковане тканинними макрофагами, спричинене умовно-патогенними бактеріями при порушенні цілісності епітеліальних бар’єрів кишечника, пов’язане зі специфічною активацією фактора транс–крипції NF-kB.
У дослідженнях S.R. Qi та співавт. [17] продемонстровано, що навіть нежиттєздатні пробіотичні компоненти LGG чинять протизапальну дію на епітеліальні клітини шлунково-кишкового тракту. Попередня інкубація з окремими компонентами або комбінацією компонентів LGG, а саме білком поверхневого шару (surface layer protein — SLP) і геномною ДНК (genomic DNA, gDNA), зазвичай інгібувала активацію Toll-подібних рецепторів, мітоген-активованих протеїнкіназ, позаклітинних регульованих протеїнкіназ і сигнальних шляхів NF-kB у клітинах макрофагів мишей RAW264.7, стимульованих LPS, що, як правило, призводило до ослаблення виробництва запальних цитокінів IL-6 і TNF-a.
Сигнальний шлях NF-kB регулює синтез запальних цитокінів, рекрутинг лейкоцитів і виживання клітин, що є важливими компонентами запальної реакції. У той же час антиапоптичні функції NF-kB можуть у випадку відновлення епітеліального бар’єра травного тракту підтримувати запальну реакцію завдяки стійкій активації лейкоцитів [17].
Отже, у дітей із хронічним гастродуоденітом спостерігався дещо підвищений рівень експресії мРНК TLR4, NLRC1/NOD1 у слизовій оболонці шлунка й активності NF-kB у периферичних лімфоцитах без статистично значимих розбіжностей у групах порівняння, р > 0,05. Терапія препаратом Лактіалє GG сприяє клінічному одужанню дітей із хронічними гастродуоденітами, ймовірно, за рахунок інгібування активності запального процесу, пригнічення активності експресії NLRC1/NOD1 та активності фактора транскрипції NF-kB.
Висновки
Доведено, що NF-kB контролює запалення різними механізмами за типом зворотного зв’язку, впливаючи на активність і тривалість запальної реакції. Призначення терапії пробіотичним препаратом Лактіалє GG у дітей із хронічним гастродуоденітом сприяє більш швидкому регресу клінічних проявів: больового, диспептичного й астеновегетативного синдромів. Терапія препаратом Лактіалє GG супроводжується відновленням рівня вмісту біфідумфлори й лактобактерій у кишковому біотопі. Призначення Лактіалє GG приводить до більш швидкого зниження рівня запалення за рахунок пригнічення активності експресії рецепторів NLRC1/NOD1 і фактора транскрипції NF-kB.
Конфлікт інтересів. Автори повідомляють про відсутність конфлікту інтересів при підготовці даної статті.
- Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Инициация воспалительного процесса при вирусных и бактериальных заболеваниях, возможности и перспективы медикаментозного управления. Харьков: С.А.М., 2011. 392 с.
- Абатуров О.Є., Герасименко О.Н. Особливості експресії TLR-4 та TLR-аксесуарних молекул у дітей, хворих на хронічний гастродуоденіт. Современная педиатрия. 2011. 3(37). 100-103.
- Абатуров А.Е., Герасименко О.Н., Завгородняя Н.Ю. Хронические CagA(+) Helicobacter pylori-ассоциированные гастриты у детей: монография. Х.: С.А.М., 2014. 412 с.
- Абатуров О.Є. Модуляція активності TLR4 епітеліоцитів слизової оболонки шлунка при хелікобактерній інфекції. Современная педиатрия. 2009. 6(28). 141-146.
- Волосовец А.П., Бекетова Г.В., Выговская Щ.В. и др. Организация педиатрической помощи населению. Педиатрия. Восточная Европа. 2018. 1(6). 7-25.
- Кривуша О.Л., Бабич В.Л., Леоненко Н.Й. Пробіотична корекція функціональних порушень шлунково-кишкового тракту в дітей раннього віку. Здоровье ребенка. 2019. 14(5). 38-43. doi: 10.22141/2224-0551.14.1.2019.157876.
- Bäuerl C., Abitayeva G., Sosa-Carrillo S. et al. P40 and P75 Are Singular Functional Muramidases Present in the Lactobacillus casei /paracasei/rhamnosus Taxon. Front Microbiol. 2019 Jun 26. 10. 1420. doi: 10.3389/fmicb.2019.01420.
- Bezirtzoglou E., Stavropoulou E. Immunology and probiotic impact of the newborn and young children intestinal microflora. Anaerobe. 2011 Dec. 17(6). 369-74. doi: 10.1016/j.anaerobe.2011.03.010.
- Chen L.W., Egan L., Li Z.W., Greten F.R., Kagnoff M.F., Ka–rin M. The two faces of IKK and NF-kB inhibition: Prevention of systemic inflammation but increased local injury following intestinal ischemia-reperfusion. Nat. Med. 2003. 9. 575-581. doi: 10,1038 / нм849.
- Cruchet S., Furnes R., Maruy A. et al. The use of probiotics in pediatric gastroenterology: a review of the literature and recommendations by Latin-American experts. Paediatr. Drugs. 2015. 17(3). 199-216. doi:10.1007/s40272-015-0124-6.
- Eckmann L., Nebelsiek T., Fingerle A.A. et al. Opposing functions of IKKb during acute and chronic intestinal inflammation. Proc. Natl Acad. Sci. 2008. 105. 15058-15063. doi: 10.1073 / pnas.0808216105.
- Gao K., Wang C., Liu L., Dou X., Liu J., Yuan L., Zhang W., Wang H. Immunomodulation and signaling mechanism of LGG and its components on porcine intestinal epithelial cells stimulated by lipopolysaccharide. J. Microbiol. Immunol. Infect. 2017 Oct. 50(5). 700-713. doi: 10.1016/j.jmii.2015.05.002.
- Hajjar A.M., Ernst R.K., Yі J., Yam C.S. et al. Expression level of human TLR4 rather than sequence is the key determinant of LPS responsiveness. PLoS One. 2017. 12(10). e0186308. doi: 10.1371/journal.pone.0186308.
- Khailova L., Petrie B., Baird C.H., Dominguez Rieg J.A., Wischmeyer P.E. LGG and Bifidobacterium longum attenuate lung injury and inflammatory response in experimental sepsis. PLoS One. 2014 May 15. 9(5). e97861. doi: 10.1371/journal.pone.0097861.
- Mitchell J.P., Carmody R.J. NF-kB and the Transcriptional Control of Inflammation. Int. Rev. Cell Mol. Biol. 2018. 335. 41-84. doi:10.1016/bs.ircmb.2017.07.007.
- Molska M., Reguła J. Potential Mechanisms of Probiotics Action in the Prevention and Treatment of Colorectal Cancer. Nutrients. 2019 Oct 14. 11(10). 2453. doi: 10.3390/nu1110245.
- Qi S.R., Cui Y.J., Liu J.X., Luo X., Wang H.F. LGG components, SLP, gDNA and CpG, exert protective effects on mouse macrophages upon lipopolysaccharide challenge. Lett. Appl. Microbiol. 2020. 70(2). 118-127. doi:10.1111/lam.13255.
- Ritchie M.L., Romanuk T.N. A meta-analysis of probiotic efficacy for gastrointestinal diseases. PLoS One. 2012. 7(4). e34938. doi:10.1371/journal.pone.0034938.
- Wu Q., Liu M.C., Yang J., Wang J.F., Zhu Y.H. Lactobacillus rhamnosus GR-1 Ameliorates Escherichia coli-Induced Inflammation and Cell Damage via Attenuation of ASC-Independent NLRP3 Inflammasome Activation. Appl. Environ. Microbiol. 2015. 82(4). 1173-1182. doi:10.1128/AEM.03044-15.
- Yu J., Zhu Y.H., Yang G.Y., Zhang W., Zhou D., Su J.H., Wang J.F. Anti-inflammatory capacity of LGG in monophasic variant Salmonella infected piglets is correlated with impeding NLRP6-mediated host inflammatory responses. Vet. Microbiol. 2017 Oct. 210. 91-100. doi: 10.1016/j.vetmic.2017.08.008.
- Zhang W., Zhu Y.H., Yang G.Y. et al. Lactobacillus rhamnosus GG Affects Microbiota and Suppresses Autophagy in the Intestines of Pigs Challenged with Salmonella Infantis. Front. Microbiol. 2018. 8. 2705. Published 2018 Jan 17. doi:10.3389/fmicb.2017.02705.

/20-1.jpg)
/20-2.jpg)