Журнал «Здоровье ребенка» Том 15, №5, 2020
Вернуться к номеру
Диференціальна діагностика синдрому ранньої дитячої нервовості у практиці педіатра
Авторы: Кирилова Л.Г., Мірошников О.О.
ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової НАМН України», м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті поданий огляд сучасних наукових даних щодо ранньої дитячої нервовості — групи станів у немовлят та дітей раннього віку, що обумовлюють патологічний фон для розвитку психоневрологічної патології. Наведені класифікації цих станів, проаналізовані підходи до діагностики й лікування, у тому числі до медикаментозної терапії. Подані результати власного дослідження ефективності препаратів Сілента та Когівіс при синдромі ранньої дитячої нервовості в дітей дошкільного віку.
В статье представлен обзор современных научных данных о ранней детской нервности — группе состояний у младенцев и детей раннего возраста, обусловливающих патологический фон для развития психоневрологической патологии. Приведены классификации данных состояний, проанализированы подходы к диагностике и лечению, в том числе к медикаментозной терапии. Приведены результаты собственного исследования эффективности препаратов Силента и Когивис при синдроме ранней детской нервности у детей дошкольного возраста.
The article provides an overview of current scientific data on early childhood anxiety — a group of conditions in infants and young children that determine the pathological background for the development of psychoneurological pathology. The article provides the classifications of these conditions, analyzes the approaches to the diagnosis and treatment, including those to drug therapy. The results of our own study on the effectiveness of Silenta and Cogivis in early childhood anxiety syndrome in preschool children are presented.
рання дитяча нервовість; невропатія; неврозоподібний стан; Сілента; Когівіс
ранняя детская нервность; невропатия; неврозоподобное состояние; Силента; Когивис
early childhood anxiety; neuropathy; neurosis-like state; Silenta; Cogivis
Вступ
Синдром ранньої дитячої нервовості (РДН), або невропатії, являє собою один із найбільш поширених нервово-психічних розладів у дітей раннього та дошкільного віку. Провідне місце у структурі синдрому займає підвищена збудливість, емоційна лабільність, підвищена чутливість до зовнішніх подразників у поєднанні зі швидким виснаженням нервової системи. Для дітей із синдромом РДН також характерні підвищена тривожність, лякливість, страх перед усім новим. Отже, прояви РДН є неспецифічними та можуть як безслідно минати з часом, так і бути першими клінічними ознаками невротичних станів або порушень нейророзвитку (англ. neurodevelopmental disorders), таких як розлади аутистичного спектра (РАС) або розлад дефіциту уваги з гіперактивністю [1].
У немовлят та дітей раннього віку в симптоматиці РДН на перший план переважно виходять різноманітні вегетативні розлади та порушення сну. Серед соматовегетативних розладів домінують порушення функції органів шлунково-кишкового тракту та розлади сну. Для немовлят із синдромом РДН характерні часті зригування, відрижка, захлинання молоком та поперхування, надмірне збудження та неможливість заспокоїтися під час їжі, епізоди надмірного раптового крику, спричинені шлунково-кишковими розладами, що зазвичай описуються як коліки. Переважно вони трапляються в соматично здорових дітей та проявляються нападами дратівливості, рухової активності та тривалого плачу — не менше 3 годин на добу [2, 3].
У немовлят із РДН можуть розвиватися порушення харчової поведінки, наприклад відмова смоктати під час бадьорості, водночас дитина їсть лише під час дрімоти або під час особливих ритуалів: тільки в певному положенні, із певним світлом, під час поглажування тощо. При порушенні ритуалів дитина відмовляється від їжі та реагує плачем. Якщо дитина починає смоктати під час дрімоти, але прокидається, то може відмовлятися від їжі та голодувати по 11–20 годин підряд. Як правило, порушення харчової поведінки з’являються у віці 1–3 міс. та можуть тривати протягом першого року життя. Подібна поведінка може призводити до дефіциту маси тіла, іноді значного (англ. failure to thrive). При тяжких порушеннях харчування необхідна диференціальна діагностика з гастроезофагеальним рефлюксом, діафрагмальною грижею, алергією до білка коров’ячого молока, а також із психіатричними проблемами в матері (депресія, синдром Мюнхгаузена, жорстоке поводження — англ. child abuse) тощо. Порушення харчової поведінки в немовлят мають декілька причинних факторів, серед яких вроджений тип нервової системи, що характеризується надмірною реакцією на зовнішні стресові фактори, наявність в анамнезі травматичного досвіду, пов’язаного з годуванням, що зафіксувався у психіці дитини, а також особистісні характеристики матері, яка годує, рівень її тривожності та емоційного інтелекту [4].
Зауважимо, що в більшості дітей проблеми зі шлунково-кишковим трактом та харчовою поведінкою минають до кінця першого року життя. У дітей із розладами аутистичного спектра порушення травлення, вибірковість у їжі, розлади харчової поведінки можуть зберігатися тривалий час. Близько 40 % дітей із РАС мають хронічні проблеми із ШКТ у вигляді запорів, болю в животі та діареї порівняно з 25 % нейротипових дітей. Від 36 до 50 % дітей із РАС мають хоча б один діагноз, пов’язаний із порушенням травлення, однак подібна ситуація характерна і для інших порушень розвитку. Деякі дослідження показують, що генетичні мутації, пов’язані з розвитком РАС, можуть призводити до змін у мікробіомі кишечника, що спричинює як симптоми РАС, так і порушення харчування [5, 6].
У дітей із РАС порушення харчової поведінки першого року життя продовжуються в ранньому та дошкільному віці у вигляді вибірковості в харчуванні, переїдання або пікацизму (споживання неїстівного). Часто в дітей із РАС дуже обмежений раціон харчування, дитина може їсти всього 1–3 види продуктів, наприклад хліб, макарони, шоколад. Часто раціон таких дітей бідний на вітаміни та інші корисні нутрієнти, зате містить надмірну кількість простих вуглеводів, трансжирів, підсилювачів смаку тощо. Зловживання такими продуктами призводить до надмірної ваги, запорів, гіперінсулінемії та розвитку порушення толерантності до глюкози. Батьки можуть мати серйозні проблеми при спробах розширити раціон харчування дитини. У цілому від 50 до 70 % батьків дітей із РАС повідомляють про проблеми у своїх дітей із розширенням раціону [7].
В основі розвитку вибірковості в харчуванні можуть лежати сенсорні порушення. Діти з РАС часто надмірно гостро сприймають деякі смаки, температуру, запахи. Неприємна їжа може стати причиною проявів крайніх форм тривожності. Якщо діти пробують з’їсти щось нове, то можуть почати корчити гримаси, відкашлювати їжу, намагатися відригнути або виблювати, а після такого неприємного досвіду, швидше за все, будуть відмовлятися навіть спробувати щось хоч віддалено схоже на неприємний продукт. Такі діти складно погоджуються пробувати щось нове, а іноді можуть відмовлятися навіть від звичної їжі, якщо вона лежала поруч із чимось неприємним або незнайомим [5–7].
У грудному і ранньому дитячому віці в симптоматиці невропатії та синдрому РДН на перший план виступають різноманітні соматовегетативні розлади й порушення сну. Серед соматовегетативних розладів переважають порушення функції органів травлення (часті відрижки, блювання, запори, які часто змінюються поносами, зниження апетиту або вибірковість у їжі, розлади харчування), дихання (дихальна аритмія), серцево-судинні розлади (блідість і мармуровість шкірних покривів, ціаноз носогубного трикутника, нестійкість пульсу тощо) [8, 9].
Відзначаються й інші вегетативні порушення, як, наприклад, субфебрилітет, не пов’язаний із соматичними захворюваннями, порушення сну, що проявляється недостатньою глибиною і порушенням формули сну (сонливість удень і занепокоєння в нічний час).
У немовлят, тодлерів та дітей дошкільного віку з синдромом РДН проблеми з засинанням та підтриманням сну, як правило, мають поведінковий характер та минають після корекції режиму засинання.
Однією з найчастіших причин порушень нічного сну є розлад асоціацій при засинанні (англ. sleep onset association disorder — SOAD). Цей розлад найчастіше зустрічається в дітей між 6-м і 36-м місяцями життя, причому у хлопчиків у 3 рази частіше, ніж у дівчаток. Причина в тому, що дитина не вміє засинати самостійно. При засинанні дитини завжди присутні мати або батько, які здійснюють певні дії, для того щоб дитина заснула: гойдають, гладять по спині, тримають на руках, дають соску. Таким чином, створюються певні обставини, які асоціюються в дитини з засинанням [10].
У нормі під час нічного сну відбувається чергування фаз глибокого повільного сну й поверхневого швидкого сну. Ця фаза сну супроводжується рухами очей під опущеними повіками, звідси й походить його назва — rapid eye movement sleep, або REM-сон. Відразу після засинання настає фаза глибокого сну. Надалі фази REM-cну з’являються кілька разів за ніч, іноді під час них дитина може прокидатися на короткий час і швидко засинати, якщо вона має звичку це робити самостійно. Тобто в дитини присутні навички самозаспокоєння, регуляції своїх емоцій, для чого немає необхідності у присутності батьків. У дитини з розладом асоціацій процес засинання довший. У подальшому кожні 2–3 години виникають пробудження, пов’язані з фазами REM-сну. Під час них дитині потрібне повторення обставин, які зазвичай супроводжують засинання. Наприклад, дитина, яка звикла засинати під час годування груддю, із соскою або під час гойдання, починає при пробудженні шукати звичні обставини.
Від порушень нічного сну страждає не тільки дитина, а й батьки. За даними досліджень, у сім’ях, у яких дитина страждає від розладу асоціацій при засинанні, у батьків більш високий рівень депресії й нижчий показник сімейної близькості між батьками. Перш за все депривація сну негативно впливає на матерів — у них відмічається підвищений рівень тривожності та депресії. Ключ до розв’язання цієї проблеми — навчити дитину засинати самостійно.
У дітей дошкільного віку (3–6 років) частіше зустрічається вид поведінкової інсомнії, при якій дитина відмовляється лягати спати. Щовечора відхід у ліжко перетворюється в сутичку з бурею емоцій. Це може бути проявом розладу сну, що називається limit-settings sleep disorders — розлад сну, пов’язаний із порушенням меж засинання. Ознака цього порушення — відмова дитини лягати спати в певний час. Це супроводжується протестами, сльозами і криком. Також дитина йде на різні хитрощі для того, щоб відкласти час вкладання в ліжко. Батьки вкладають дитину спати, але вона знову і знову кличе їх й вимагає уваги [11].
Найчастіше, щоб відтягнути момент засинання, дитина може:
— просити пити;
— проситися в туалет;
— кидати речі;
— ставити одне запитання за іншим;
— просити розповісти ще одну казку, заспівати пісеньку;
— просити знову обійняти, потерти спинку;
— скаржитися на те, що їй страшно (без явних –ознак страху) тощо.
Про розлад засинання йдеться тоді, коли час засинання відкладається більше ніж на 1 годину. Корекція цього розладу зазвичай немедикаментозна, застосовується методика поступового погашення негативної поведінки.
Розлади ритмічних рухів (rhythmic movement disorder — RMD) — пов’язаний зі сном незвичайний варіант дитячих парасомній (порушень сну). Це група стереотипних, повторюваних, ритмічних рухів під час сну, у які залучаються великі групи м’язів голови, тулуба і кінцівок. Частота рухів — від 0,5 до 2 Гц, тривалість епізоду — зазвичай до 15 хв. Епізоди ритмічних рухів можуть відзначатися до 10 разів поспіль із короткими інтервалами [12].
У більшості випадків цей розлад зустрічається в немовлят або дітей молодшого віку, але може бути і в старших дітей (частота виникнення з віком зменшується). Найчастіше зустрічається на першому році життя дитини, коли більшість немовлят можуть мати ритмічну рухову активність під час засинання або сну, наприклад рухи головою з боку в бік. Рухи можуть виникати протягом нічного або денного сну або під час засинання, можуть з’являтися в будь-якій стадії сну. Більшість епізодів виникає при засинанні й поверхневому повільному сні.
Точні причини розладу ритмічних рухів залишаються невідомими. Відповідно до сучасних уявлень, ритмічні рухи розглядаються як несвідомі автоматизми, які проявляються на тлі незрілості неспецифічних систем мозку. Можливо, ці рухи можуть виконувати роль самоза–спокоєння, що допомагає переходити від стану неспання до сну. Як правило, ритмічні рухи проходять самі, при цьому дитина не пам’ятає, що відбувалося з нею вві сні.
У віці понад 18 міс. ритмічні рухи під час сну частіше відмічаються в дітей із затримкою психомовленнєвого розвитку, РАС, синдромом гіперактивності та дефіциту уваги, у дорослих зрідка розвиваються після черепно-мозкових травм або герпетичного енцефаліту.
Виділяють такі типи ритмічних рухів під час сну:
— похитування всього тіла та кінцівок, нагадує заколисування або розгойдування;
— хитання головою: дитина лежить на спині і здійснює рівномірні, плавні маятникоподібні хитальні рухи головою з боку в бік, зазвичай виникає у дітей до 1 року;
— удари головою, або яктації, — ритмічні удари лобом або щокою об подушку або матрац; при цьому малюк піднімається на витягнутих руках, частіше зустрічається в дітей до 1 року;
— хитання головою назад і вперед;
— ритмічні рухи ногами;
— епізоди ритмічних рухів можуть супроводжуватися звуковими феноменами (гудіння, дзижчання, монотонний спів).
Діагностика RMD ґрунтується на клінічній картині і результатах полісомнографії з відеомоніторингом. Таке дослідження дозволяє виключити епілептиформну активність як причину рухового розладу та диференціювати епілептичні напади та парасомнії. Як правило, розлади ритмічних рухів не вимагають терапії й самостійно зникають до 3–4 років. У разі збереження симптомів у більш пізньому віці необхідні консультації невролога і супутніх фахівців. Якщо симптоми розладів ритмічних рухів зберігаються у старших дітей, можливі застосування поведінкової терапії, прийом бензодіазепінів (клоназепам тощо).
На відміну від нейротипових дітей, у дітей із РАС проблеми зі сном є більш поширеними та стійкими, складно піддаються корекції поведінковими методами. Проблеми із засинанням та тривалістю сну мають 44–86 % дітей з аутизмом [14].
Найчастіші порушення сну в дітей із РАС:
— відмова лягати спати, неможливість заснути без присутності дорослого;
— тривале засинання;
— часті пробудження;
— мала тривалість сну;
— денна сонливість, дратівливість, порушення уваги, пов’язані з регулярною нестачею сну.
Американська академія неврології в новому керівництві щодо розладів сну в дітей і підлітків з аутизмом рекомендує починати з виключення можливої побічної дії лікарських засобі на сон, а також із корекції соматичних проблем (наприклад, розладів шлунково-кишкового тракту).
Ефективні поведінкові методи корекції порушень сну, рекомендовані для дітей із РАС:
— режим сну з постійним графіком часу засинання та пробудження;
— уникати тривалого сну вдень;
— збільшити фізичну активність вдень;
— не переїдати на ніч;
— виключити гаджети перед сном;
— темрява, тиша і прохолода в спальні;
— використовувати ліжко тільки для сну;
— привчати дитину засинати самостійно у власному ліжку;
— якщо проблеми зі сном зберігаються, можливе призначення мелатоніну.
Дослідження показують, що штучна форма мелатоніну безпечна й ефективна для дітей і підлітків з аутизмом протягом 3 місяців прийому. Можливі побічні ефекти включають головний біль, запаморочення, діарею і висипання. Оптимальним варіантом може бути поєднання мелатоніну з поведінковими стратегіями. Деякі батьки використовують обтяжені ковдри для того, щоб зменшити тривогу і створити сенсорний комфорт у дітей із РАС, що сприяє розслабленню й поліпшенню сну [15].
У дослідженнях показано, що підвищення рівня гомоцистеїну у крові, можливо, пов’язане з невеликою тривалістю сну, особливо в пацієнток жіночої статі та з надмірною вагою. Відомо, що високий рівень гомоцистеїну пов’язаний із підвищеним ризиком розвитку атеросклерозу, серцево-судинних захворювань і смертності. У пацієнтів із високим рівнем гомоцистеїну також було виявлено зниження вітамінів В12, В6 і фолієвої кислоти в крові. Таким чином, короткий нічний сон також може бути фактором ризику розвитку запалення в стінках судин й підвищеного ризику серцево-судинних захворювань [16].
Отже, рання дитяча нервовість (невропатія, вроджена нервовість, конституційна нервовість, невропатична конституція, ендогенна нервовість, нервовий діатез тощо) — найбільш поширена форма психоневрологічних порушень у дітей раннього віку, що проявляється вираженими емоційними, поведінковими й вегетативними розладами. Цей стан не є конкретною хворобою, а являє собою лише особливості нервової системи дитини, що зумовлюють схильність до розвитку в подальшому неврозів і неврозоподібних станів, патологічного розвитку особистості [17].
У розвитку ранньої дитячої нервовості домінуюче значення мають спадковість та органічні ураження головного мозку в перинатальний період. У багатьох випадках один або обидва батьки в дитинстві мали підвищену збудливість, у родині можуть зустрічатися випадки емоційних, тривожних та поведінкових розладів. Перинатальні фактори включають гінекологічну та екстрагенітальну патологію матері під час вагітності, гестози та загрози переривання вагітності, аномалії передлежання плода, слабкість пологової діяльності, недоношеність, гіпоксично-ішемічну енцефалопатію, пологову травму та внутрішньошлуночкові крововиливи. Причиною РДН також можуть бути органічні ураження головного мозку різного генезу в перші місяці життя [18].
У корекції синдрому РДН у дітей із розладами аутистичного спектра співробітники нашого відділення широко застосовують препарати з групи нейроадаптогенів — Сілента та Когівіс, що мають збалансований склад, уміщують необхідні вітаміни, мікроелементи та амінокислоти. Завдяки застосуванню цих препаратів відбувається швидка нормалізація балансу збуджувальних та гальмівних нейромедіаторів, що позитивно впливає на емоційну, поведінкову та когнітивну сферу дитини.
При синдромі РДН, що характеризується тривогою, підвищеною збудливістю, порушеннями засинання та сну, наявністю парасомній, емоційної лабільності, вегетативних розладів, гіперактивності, показане застосування препарату Сілента. До його складу входить 50 мг амінокислоти L-триптофан, 30 мг магнію, 80 мг екстракту квітів ромашки, 50 мг екстракту листків меліси і 20 мг екстракту суцвіть липи широколистої.
L-триптофан являє собою амінокислоту, що виступає в ролі попередника нейрогормону серотоніну, який бере участь у регуляції настрою, циркадних ритмів та поведінки. Завдяки вмісту L-триптофану, магнію та трав’яних екстрактів Сілента має виражену седативну, анксіолітичну та нормотимічну дію, знижує м’язове напруження та частоту серцевих скорочень, усуває прояви гіперактивності та психомоторного збудження.
У дітей із синдромом РДН, що проявляється астеноневротичним синдромом, слабкістю, підвищеною стомлю–ваністю, примхливістю, порушенням здатності до навчання і засвоєння нової інформації, складністю запам’ятовування, супроводжується затримкою розвитку мовлення, когнітивними порушеннями, затримкою розумового і фізичного розвитку, при вегетативній дисфункції (ваготонія) доцільне призначення сиропу Когівіс.
До складу препарату Когівіс входить 35 мг аспарагіну, 32,5 мг глутаміну, 35 мг DL-фосфосерину і 0,75 мг вітаміну В6. Амінокислота аспарагін допомагає захистити ЦНС, перешкоджаючи надмірному збудженню й гальмуванню, тим самим стабілізуючи нервові процеси в організмі; також відіграє важливу роль в обміні аміаку. Глутамін — замінна амінокислота, є попередником багатьох мозкових нейротрансмітерів, покращує діяльність головного мозку. DL-фосфосерин є компонентом, що міститься в мембранах усіх клітин організму, найбільше — в головному мозку, здійснює нейропротекторну й енерготропну дію. Вітамін В6, як кофермент, бере участь у значній кількості метаболічних процесів, а також необхідний для нормального функціонування центральної й периферичної нервової системи.
У сукупності всі компоненти сиропу Когівіс чинять м’яку стимулюючу й тонізуючу дію на нервову систему, підвищують розумову й фізичну працездатність, сприяють відновленню процесів збудження.
Метою дослідження було визначення ефективності впливу препаратів нейроадаптогенної дії Когівіс та Сілента на прояви синдрому РДН у дітей із розладами аутистичного спектра.
Матеріали та методи
Під час дослідження були обстежені 44 дитини з РАС віком від 3 до 6 років (середній вік становив 49,30 ± 3,33 міс.). Серед них було 30 хлопчиків і 14 дівчат, які перебували на обстеженні та лікуванні у відділенні психоневрології для дітей із перинатальною патологією та орфанними захворюваннями ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової НАМН України». Усім дітям був встановлений діагноз РАС на підставі клінічного огляду та результатів опитувальників M-CHAT (модифікований скринінговий тест на аутизм для дітей раннього віку) і СARS (рейтингова шкала аутизму в дітей), а також відповідно до критеріїв DSM-V.
Дослідження проводилося згідно з принципами біоетики й деонтології й було узгоджене з локальною етичною комісією.
Усім дітям було проведене комплексне обстеження, яке включало збір анамнезу з уточненням особливостей перебігу пре- і перинатального періоду, клініко-неврологічне обстеження, оцінку за шкалою Autism Treatment Evaluation Checklist (ATEC), інструментальні методи: електроенцефалографію (ЕЕГ), відео-ЕЕГ-моніторинг (у тому числі під час нічного сну), магнітно-резонансну томографію (МРТ) головного мозку та МР-трактографію з використанням магнітно-резонансного томографа Philips Achieva 3.0 Tesla.
Усі діти були розділені на 2 групи залежно від клінічних особливостей та проявів синдрому РДН:
— 1-ша група (24 дитини) — діти з переважанням у симптомокомплексі тривоги, дратівливості, гіперактивності, стереотипної поведінки, порушень нічного сну;
— 2-га група (20 дітей) — діти з переважанням підвищеної втомлюваності, зниженням концентрації уваги та запам’ятовування, затримкою розвитку мовлення та когнітивних функцій, астеноневротичним синдромом.
Дітям з 1-ї групи призначався препарат нейро–адаптогенної дії Сілента по 5 мл 2 рази на день протягом 14 днів. Діти з 2-ї групи отримували сироп Когівіс 2,5 мл 2 рази на день протягом 14 днів. Результати лікування оцінювалися за допомогою шкали АТЕС та повторної МР-трактографії через 2 тижні після закінчення курсу лікування.
Результати та обговорення
Для оцінки ефективності лікування використовувалася шкала ATEC, що складається з 4 субшкал: I — мовлення й комунікативні функції; II — соціальні функції; III — сенсорні й когнітивні функції; IV — фізичні функції, поведінка. Ефективність лікування оцінювалась за окремими шкалами в кожній групі обстежених дітей:
— без покращення (збільшення кількості балів за відповідною шкалою менше ніж на 20 %);
— помірне покращення (збільшення кількості балів за відповідною шкалою на 20–50 %);
— значне покращення (збільшення кількості балів за відповідною шкалою більше ніж на 50 %).
Клінічні результати проведеного лікування наведені в табл. 1.
У табл. 1 наочно показано відсоток позитивних відповідей на застосовану в дослідженні схему лікування за чотирма субшкалами методики АТЕС. У 1-й групі було найбільше дітей із позитивною відповіддю (91,7 %) на терапію за субшкалою IV (фізичні функції, поведінка), у той же час більше ніж 50 % дітей мали позитивні результати за субшкалою III (сенсорні і когнітивні функції). У дітей цієї групи ми відмічали виражене зменшення тривоги, дратівливості, емоційної лабільності, гіперактивності та стереотипної поведінки, нормалізацію засинання та нічного сну.
У дітей 2-ї групи було найбільше позитивних відповідей за субшкалами I (мовлення й комунікативні функції) та IV (фізичні функції, поведінка) — 95,0 %. У дітей цієї групи відмічалося поліпшення життєвого тонусу, збільшення інтересу до занять, поліпшення пам’яті та концентрації уваги, мовленнєвих та когнітивних функцій.
Для об’єктивної оцінки стану центральної нервової системи обстеженим дітям проводилася МРТ головного мозку, додатково — МР-трактографія.
За допомогою 3D-реконструкції проводиться оцінка таких провідних шляхів головного мозку:
— передній відділ дугоподібного тракту — пучок складно виділити ізольовано, оскільки він включає багато провідних волокон, що з’єднують лобну, скроневу та тім’яну частки мозку. До пучка входять довгі поздовжні та короткі U-подібні волокна. Основна функція — артикуляційний компонент мовлення, координація рухів;
— задній відділ дугоподібного тракту — з’єднує скроневу та потиличну частки. Провідні волокна від верхньої, середньої та нижньої скроневих звивин зв’язують бічну та полюсну поверхні потиличної частки. Цей тракт проходить уздовж нижнього рогу бічного шлуночка та по бічній стінці потиличної частки;
— гачкоподібний тракт — з’єднує гачок скроневої частки з орбітальною та полюсною корою лобової частки (ділянка нижньої лобової звивини). Також його волокна з’єднують полюс скроневої частки, верхню та середню скроневі звивини, мигдалеподібне тіло, гіпокамп. У домінуючій півкулі мозку цей пучок бере участь у соціальній взаємодії та розумінні мовлення;
— мозолисте тіло — містить проєкційні провідні шляхи від різних відділів кори головного мозку та асоціативні волокна, що поєднують праву та ліву півкулі мозку. Ураження провідних шляхів мозолистого тіла лежить в основі розладів вищих соціальних та комунікативних функцій.
Метод МР-трактографії, який застосовувався до та після початку лікування, дозволяє отримати кількісні характеристики анатомічної будови провідних шляхів, а саме фракційну анізотропію (FA) та коефіцієнт дифузії (ADC) білої речовини трактів, товщину та довжину окремих трактів. Показники глибини залягання провідних шляхів можуть також вказувати на функції відповідних відділів мозку. Отримані результати вимірювання показників фракційної анізотропії та коефіцієнта дифузії в дітей із РАС наведені у табл. 2.
За результатами проведеного обстеження виявлене статистично вірогідне підвищення середніх показників фракційної анізотропії та коефіцієнта дифузії в передніх та задніх відділах дугоподібного тракту домінантної півкулі, правого та лівого гачкоподібних трактів, а також у коліні та валику мозолистого тіла (p < 0,01). Отримані показники фракційної анізотропії свідчать про відносне збільшення товщини та довжини вказаних трактів, а підвищення показника дифузії вказує на збільшення насиченості провідних шляхів молекулами води, що міститься переважно в мієлінових оболонках. Таким чином, підвищення FA відображає збільшення товщини провідного шляху, а ADA — збільшення вмісту мієліну.
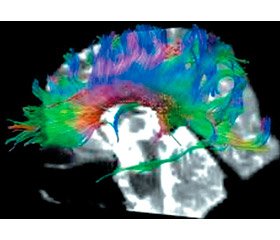
Як приклади клінічних спостережень наводимо зображення МР-томограм головного мозку дітей із когнітивною дезінтеграцією та проявами РАС (рис. 1, 2). За даними МР-трактографії в обох дітей виявлене виражене збільшення товщини та довжини асоціативних провідних шляхів, які є субстратом вищих соціальних та когнітивних функцій.
Висновки
Призначення препаратів нейроадаптогенної дії Сілента та Когівіс у дітей з розладами аутистичного спектра, які мають прояви синдрому ранньої дитячої нервовості, сприяє поліпшенню якості життя завдяки швидкій нормалізації емоційної та поведінкової сфери. Дітям з переважанням у симптомокомплексі тривоги, дратівливості, гіперактивності, стереотипної поведінки, порушень нічного сну рекомендоване застосування препарату Сілента. У дітей цієї групи відмічаються виражене зменшення тривоги, дратівливості, емоційної лабільності, гіперактивності та стереотипної поведінки, нормалізація засинання та нічного сну протягом 2 тижнів прийому препарату Сілента. Дітям, які мають прояви підвищеної втомлюваності, зниження концентрації уваги та запам’ятовування, затримку розвитку мовлення та когнітивних функцій, астеноневротичний синдром, показане застосування сиропу Когівіс. Терапія з включенням сиропу –Когівіс протягом 14 днів сприяє поліпшенню життєвого тонусу, збільшенню інтересу до занять, покращенню пам’яті та концентрації уваги, мовленнєвих та когнітивних функцій.
За результатами проведеної МР-трактографії до та після курсу лікування препаратами Сілента та Когівіс виявлене статистично вірогідне підвищення середніх показників фракційної анізотропії та коефіцієнта дифузії в передніх та задніх відділах дугоподібного тракту домінантної півкулі, правого та лівого гачкоподібних трактів, а також у коліні та валику мозолистого тіла. Дані провідні шляхи є функціональним субстратом розвитку експресивного та рецептивного мовлення, складних соціальних та виконавчих функцій. Отримані показники фракційної анізотропії свідчать про відносне збільшення товщини та довжини вказаних трактів, а підвищення показника дифузії вказує на збільшення насиченості провідних шляхів молекулами води, що міститься переважно у мієлінових оболонках, що свідчить про збільшення вмісту мієліну у провідних шляхах. Отримані результати потребують подальшого дослідження та перевірки на більших вибірках із включенням до дослідження контрольної групи. Як приклади наведені дані МР-трактографії двох дітей із РАС, які мали виражене збільшення товщини та довжини провідних шляхів у мозолистому тілі та зоні Брока після курсу лікування.
Конфлікт інтересів. Не заявлений.
- Буторин Г.Г., Буторина Н.Е. Клинические и клинико-динамические проблемы детской и подростковой невропатии. Челябинск: Сити-Принт, 2015. 252 с.
- Sung V. Infantile colic. Australian prescriber. 2018. 41(4). 105-110. doi: 10.18773/austprescr.2018.033.
- Kim J.S. Excessive crying: behavioral and emotional regulation disorder in infancy. Korean journal of pediatrics. 2011. 54(6). 229-33. doi: 10.3345/kjp.2011.54.6.229.
- Chatoor I. Feeding disorders in infants and toddlers: diagnosis and treatment. Child Adolesc. Psychiatr. Clin. N. Am. 2002. 11(2). 163-183. doi: 10.1016/s1056-4993(01)00002-5
- Wasilewska J., Klukowski M. Gastrointestinal symptoms and autism spectrum disorder: links and risks — a possible new overlap syndrome. Pediatric health, medicine and therapeutics. 2015. 6. 153-166. doi: 10.2147/PHMT.S85717.
- Srikantha Piranavie, M. Hasan Mohajeri. The Possible Role of the Microbiota-Gut-Brain-Axis in Autism Spectrum Disorder. International journal of molecular sciences. 2019. 20. doi: 10.3390/ijms20092115.
- Cermak Sharon A. et al. Food selectivity and sensory sensitivity in children with autism spectrum disorders. Journal of the American Dietetic Association. 2010. 110(2). 238-46. doi: 10.1016/j.jada.2009.10.032.
- Буторин Г.Г., Бенько Л.А. Синдромы невропатии и психического инфантилизма в структуре психических расстройств детского возраста. Сибирский психологический журнал. 2016. 60. 108-119.
- Буторин Г.Г. Синдром детской невропатии: содержание, критерии и принципы диагностики. Сибирский психологический журнал. 2015. 56. 109-121.
- Lee Sihyoung et al. Depression and marital intimacy level in parents of infants with sleep onset association disorder: a preliminary study on the effect of sleep education. Korean journal of pediatrics. 2013. 56 (5). 211-7. doi: 10.3345/kjp.2013.56.5.211.
- Vriend Jennifer, Corkum Penny. Clinical management of behavioral insomnia of childhood. Psychology research and behavior management. 2011. 4. 69-79. doi: 10.2147/PRBM.S14057.
- Chiaro Giacomo et al. Sleep-Related Rhythmic Movement Disorder and Obstructive Sleep Apnea in Five Adult Patients. Journal of clinical sleep medicine. 2017. 13(10). 1213-1217. doi: 10.5664/jcsm.6778.
- Alves R.S., Alóe F., Silva A.B., Tavares S.M. Jactatio capitis nocturna with persistence in adulthood. Case report. Arq Neuropsiquiatr. 1998. 56(3B). 655-657. doi: 10.1590/s0004-282x1998000400022.
- Devnani Preeti A., Hegde Anaita U. Autism and sleep disorders. Journal of pediatric neurosciences. 2015. 10(4). 304-7. doi: 10.4103/1817-1745.174438.
- Ann M. Reynolds. Sleep Problems in 2- to 5-Year-Olds With Autism Spectrum Disorder and Other Developmental Delays. Pediatrics Mar. 2019. 143 (3). e20180492. DOI: 10.1542/peds.2018-0492.
- Fuentes-Albero M., Cauli O. Homocysteine Levels in Autism Spectrum Disorder: A Clinical Update. Endocr. Metab. Immune Disord. Drug Targets. 2018. 18(4). 289-296. doi: 10.2174/1871530318666180213110815.
- Шалькевич Л.В. Синдром ранней детской нервности в практике детского невролога. Педиатрия. Восточная Европа. 2017. 5. 3.
- Smarius L.J.C.A., Strieder T.G.A., Loomans E.M., Doreleijers T.A.H., Vrijkotte T.G.M., Gemke R.J., van Eijsden M. Excessive infant crying doubles the risk of mood and behavioral problems at age 5: evidence for mediation by maternal characteristics. Eur. Child Adolesc. Psychiatry. 2016. 15. 1-10. [PMC free article] [PubMed] [Google Scholar]

/28-1.jpg)
/31-1.jpg)
/29-1.jpg)