Журнал «Здоровье ребенка» Том 15, №5, 2020
Вернуться к номеру
Вплив застосування пробіотичного препарату, що містить штам Lactobacillus rhamnosus GG, на рівні людського β-дефензину 2 (HbD-2) і кателіцидину (LL-37) у секреті верхніх дихальних шляхів і респіраторну захворюваність у дітей, хворих на бронхіальну астму й алергічний риніт
Авторы: Больбот Ю.К., Бордій Т.А., Віленський Я.В.
Державний заклад «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. На сьогодні алергічні захворювання респіраторного тракту, зокрема бронхіальна астма й алергічний риніт, у дітей є актуальною медико-соціальною проблемою, асоційованою з високим ризиком інвалідизації, суттєвим зниженням якості життя пацієнтів та їх сімей, а також значним фінансовим навантаженням на пацієнтів і державу. Бронхіальна астма й алергічний риніт часто співіснують, обтяжуючи перебіг одне одного. Діти, хворі на респіраторні алергічні захворювання, особливо вразливі до розвитку гострої респіраторної вірусної інфекції (ГРВІ), а респіраторні віруси, в свою чергу, відіграють важливу роль у патогенезі бронхіальної астми й алергічного риніту, сприяючи розвитку захворювань і виступаючи тригерами їх загострень. Однією з можливих причин схильності до частих ГРВІ у дітей з алергічною патологією респіраторної системи може бути недостатність неспецифічних факторів мукозального імунітету респіраторного тракту — ендогенних катіоноактивних амфіфільних антимікробних пептидів, зокрема кателіцидину (LL-37) та людських дефензинів. За даними низки досліджень, дані антимікробні пептиди проявляють противірусну, антимікробну та імуномодулюючу дію. При цьому даних щодо стану продукції антимікробних пептидів та їх впливу на респіраторну захворюваність у дітей з алергічними захворюваннями в сучасній літературі недостатньо. В той же час в низці літературних джерел описано позитивний вплив окремих пробіотичних штамів, зокрема Lactobacillus rhamnosus GG, на загальну резистентність до респіраторної вірусної інфекції та профілактику атопічних захворювань. Метою нашої роботи стало вивчення рівнів антимікробних пептидів (людського β-дефензину 2 (HbD-2) та LL-37) у секреті слизових оболонок верхніх дихальних шляхів у дітей з бронхіальною астмою й алергічним ринітом, з’ясування їх ролі у захисті від респіраторної вірусної інфекції у даного контингенту хворих та оцінка ефективності застосування пробіотичного препарату, що містить Lactobacillus rhamnosus GG, з метою профілактики ГРВІ та зниження частоти вірус-індукованих загострень алергічної патології. Матеріали та методи. Нами було проведено клініко-лабораторне обстеження 76 дітей віком від 7 до 17 років, з яких у 24 був діагностований алергічний риніт, у 28 дітей — бронхіальна астма, а у 24 — бронхіальна астма й алергічний риніт. Групу контролю становили 20 клінічно здорових дітей відповідного віку та статі. Окрім загальноклінічних, методи дослідження включали аналіз патернів респіраторної захворюваності, визначення рівнів антимікробних пептидів LL-37, HbD-2 у секреті верхніх дихальних шляхів методами імуноферментного та статистичного аналізу. Результати. Встановлено, що діти з алергічними захворюваннями респіраторного тракту характеризуються більшою частотою ГРВІ (на 30 %) з більш частим залученням у запальний процес нижніх дихальних шляхів (на 72 %), що обумовлює більшу тривалість захворювань (на 95 %) порівняно із здоровими дітьми. У дітей з алергічним ринітом і бронхіальною астмою виявлено суттєве зниження рівнів антимікробних пептидів у секреті верхніх дихальних шляхів порівняно з групою контролю. На рівні антимікробних пептидів у секреті верхніх дихальних шляхів найбільшою мірою негативно впливає ступінь активності алергічного запалення, що супроводжується відсутністю контролю симптомів, а позитивно — прийом препаратів базисної терапії та відсутність симптомів. Разом з тим навіть за наявності повного контролю симптомів алергічних захворювань, тобто при мінімальному рівні алергічного запалення в дихальних шляхах, рівні антимікробних пептидів були вірогідно нижчими, ніж у дітей контрольної групи. Встановлено, що існує зворотний зв’язок між рівнями антимікробних пептидів і частотою та тривалістю ГРВІ у дітей з алергічними захворюваннями, найбільш виражений при бронхіальній астмі. Висновки. Прийом пробіотичного препарату, що містить штам Lactobacillus rhamnosus GG, протягом 1 місяця додатково до базисної терапії алергічного риніту та бронхіальної астми сприяв вірогідному підвищенню рівнів HbD-2 (в середньому на 27 %) та LL-37 (в середньому на 60 %) у секреті верхніх дихальних шляхів, що супроводжувалось зниженням частоти ГРВІ в середньому на 26 % (в тому числі й епізодів із залученням нижніх дихальних шляхів), зменшенням середньої тривалості ГРВІ на 22 % протягом наступного року та зниженням вірус-індукованих загострень на 25,7 %.
Актуальность. На сегодняшний день аллергические заболевания респираторного тракта, в частности бронхиальная астма и аллергический ринит, у детей являются актуальной медико-социальной проблемой, ассоциированной с высоким риском инвалидизации, существенным снижением качества жизни пациентов и их семей, а также значительной финансовой нагрузкой на пациентов и государство. Бронхиальная астма и аллергический ринит часто сосуществуют, обременяя течение друг друга. Дети, больные респираторными аллергическими заболеваниями, являются особенно уязвимыми к развитию острой респираторной вирусной инфекции (ОРВИ), а респираторные вирусы, в свою очередь, играют важную роль в патогенезе бронхиальной астмы и аллергического ринита, способствуя развитию заболеваний и выступая триггерами их обострений. Одной из возможных причин склонности к частым ОРВИ у детей с аллергической патологией дыхательной системы может быть недостаточность неспецифических факторов мукозального иммунитета респираторного тракта — эндогенных катионоактивных амфифильных антимикробных пептидов, в частности кателицидина (LL-37) и человеческих дефензинов. По данным ряда исследований, эти антимикробные пептиды проявляют противовирусное, антимикробное и иммуномодулирующее действие. При этом данных о состоянии продукции антимикробных пептидов и их влиянии на респираторную заболеваемость у детей с аллергическими заболеваниями в современной литературе недостаточно. В то же время в ряде литературных источников описано положительное влияние отдельных пробиотических штаммов, в частности Lactobacillus rhamnosus GG, на общую резистентность к респираторной вирусной инфекции и профилактику атопических заболеваний. Целью нашей работы стало изучение уровней антимикробных пептидов (человеческого β-дефензина 2 (HbD-2) и LL-37) в секрете слизистых оболочек верхних дыхательных путей у детей с бронхиальной астмой и аллергическим ринитом, выяснение их роли в защите от респираторной вирусной инфекции у данного контингента больных и оценка эффективности применения пробиотического препарата, содержащего Lactobacillus rhamnosus GG, с целью профилактики ОРВИ и снижения частоты вирус-индуцированных обострений аллергической патологии. Материалы и методы. Нами было проведено клинико-лабораторное обследование 76 детей в возрасте от 7 до 17 лет, из которых у 24 был диагностирован аллергический ринит, у 28 детей — бронхиальная астма, а у 24 — бронхиальная астма и аллергический ринит. Группу контроля составили 20 клинически здоровых детей соответствующего возраста и пола. Кроме общепринятых клинических, методы исследования включали анализ паттернов респираторной заболеваемости, определение уровней антимикробных пептидов LL-37, HbD-2 в секрете верхних дыхательных путей методами иммуноферментного и статистического анализа. Результаты. Установлено, что дети с аллергическими заболеваниями респираторного тракта характеризуются большей частотой ОРВИ (на 30 %) с более частым вовлечением в воспалительный процесс нижних дыхательных путей (на 72 %), что обусловливает более длительную продолжительность заболеваний (на 95 %) по сравнению со здоровыми детьми. У детей с аллергическим ринитом и бронхиальной астмой обнаружено существенное снижение уровней антимикробных пептидов в секрете верхних дыхательных путей по сравнению с группой контроля. На уровни антимикробных пептидов в секрете верхних дыхательных путей в наибольшей степени негативно влияет степень активности аллергического воспаления, сопровождающегося отсутствием контроля симптомов, а положительно — прием препаратов базисной терапии и отсутствие симптомов. Вместе с тем даже при наличии полного контроля симптомов аллергических заболеваний, то есть при минимальном уровне аллергического воспаления в дыхательных путях, уровни антимикробных пептидов были достоверно ниже, чем у детей контрольной группы. Установлено, что существует обратная связь между уровнями антимикробных пептидов и частотой и продолжительностью ОРВИ у детей с аллергическими заболеваниями, которая в наибольшей степени выражена при бронхиальной астме. Выводы. Прием пробиотического препарата, содержащего штамм Lactobacillus rhamnosus GG, в течение 1 месяца дополнительно к базисной терапии аллергического ринита и бронхиальной астмы способствовал достоверному повышению уровней HbD-2 (в среднем на 27 %) и LL-37 (в среднем на 60 %) в секрете верхних дыхательных путей, что сопровождалось снижением частоты ОРВИ в среднем на 26 % (в том числе и эпизодов с привлечением нижних дыхательных путей), уменьшением средней продолжительности ОРВИ на 22 % в течение следующего года и снижением вирус-индуцированных обострений на 25,7 %.
Background. Today, allergic respiratory diseases in children, including asthma and allergic rhinitis, are a relevant medical and social problem associated with a high risk of disability, a significant reduction in the quality of life of patients and their families, and a significant financial burden on patients and the government. Bronchial asthma and allergic rhinitis often coexist, complicating the course of each other. Children with respiratory allergic diseases are particularly vulnerable to acute respiratory infections. Respiratory viruses, in turn, play an important role in the pathogenesis of bronchial asthma and allergic rhinitis, contributing to the development of diseases and acting as triggers for their exacerbations. One of the possible causes of predisposition to frequent acute respiratory infections in children with allergic pathology of the respiratory system may be a lack of nonspecific factors of mucosal immunity of the respiratory tract — endogenous cationic amphiphilic antimicrobial peptides, in particular, cathelicidin and human defensin. According to many studies, these antimicrobial peptides have antiviral, antimicrobial and immunomodulatory effects. However, nowadays there is insufficient data on the state of production of antimicrobial peptides and their impact on respiratory morbidity in children with allergic diseases. At the same time, some literature sources describe the positive effect of individual probiotic strains, in particular Lactobacillus rhamnosus GG, on the overall resistance to respiratory viral infection and the prevention of atopic diseases. The purpose of our research was to study the concentrations of antimicrobial peptides (HbD-2 and LL-37) in the secretion of the mucous membranes of the upper respiratory tract in children with bronchial asthma and allergic rhinitis, to clarify their role in protection against respiratory viral infection and to estimate the effectiveness of a probiotic preparation containing Lactobacillus rhamnosus GG in the prevention of acute respiratory infections and reduction of the frequency of virus-induced exacerbations of allergic pathology. Materials and methods. We conducted a clinical and laboratory examination of 76 children aged 7 to 17 years, 24 of whom were diagnosed with allergic rhinitis, 28 children — bronchial asthma, and 24 — bronchial asthma and allergic rhinitis. The control group consisted of 20 clinically healthy children of matched age and sex. Research methods also included the analysis of respiratory disease patterns, determination of concentrations of antimicrobial peptides: cathelicidin (LL-37), human β-defensin 2 (HbD-2) in the secretion of the upper respiratory tract by ELISA, and statistical analysis. Results. It was found that children with allergic diseases of the respiratory tract are characterized by a higher frequency of acute respiratory infections (30 %) with more frequent involvement of the lower respiratory tract in the inflammatory process (72 %), which causes a longer duration of disease (95 %) compared to healthy children. The children with allergic rhinitis and bronchial asthma had a significant decrease in the concentrations of antimicrobial peptides in the secretion of the upper respiratory tract compared with the control group. It was found that the level of antimicrobial peptide concentrations in the secretion of the upper respiratory tract is most negatively affected by the allergic inflammation severity, accompanied by a lack of symptom control, and the use of basic therapy and no symptoms have a positive effect. However, even in the presence of complete control of the symptoms of allergic diseases, the levels of antimicrobial peptides were significantly lower than in children of the control group. It was found that there is an inverse relationship between the levels of antimicrobial peptides and the frequency and duration of acute respiratory infections in children with allergic diseases, most pronounced in bronchial asthma. Conclusions. Taking a probiotic drug containing a strain of Lactobacillus rhamnosus GG for a month in addition to the basic therapy of allergic rhinitis and bronchial asthma contributed to a significant increase in levels of HbD-2 (average 27 %) and LL-37 (average 60 %) in secretions of the upper respiratory tract, which was accompanied by a decrease in the frequency of acute respiratory infections by an average of 26 % (including episodes involving the lower respiratory tract), a decrease in the average duration of acute respiratory infections by 22 % over the next year and a decrease in virus-induced exacerbations by 25.7 %.
діти; бронхіальна астма; алергічний риніт; антимікробні пептиди; кателіцидин; LL-37; людський β-дефензин 2; HbD-2; пробіотичний препарат; Lactobacillus rhamnosus GG; LGG; респіраторна захворюваність
дети; бронхиальная астма; аллергический ринит; антимикробные пептиды; кателицидин; LL-37; человеческий β-дефензин 2; HbD-2; пробиотический препарат; Lactobacillus rhamnosus GG; LGG; респираторная заболеваемость
children; bronchial asthma; allergic rhinitis; antimicrobial peptides; cathelicidin; LL-37; human defensin beta-2; HbD-2; probiotic preparation; Lactobacillus rhamnosus GG; LGG, respiratory morbidity
Вступ
Алергічні захворювання, зокрема бронхіальна астма (БА) й алергічний риніт (АР), у дітей залишаються актуальною медико-соціальною проблемою. Прогресуюче зростання захворюваності на БА та АР, їх рання маніфестація та мультифакторність, труднощі у діагностиці та досягненні контролю симптомів зумовлюють постійний інтерес клініцистів і науковців до цих захворювань. За різними оцінками, у близько 80 % дітей з БА виявляється АР, а до 40 % хворих на АР мають прояви БА, тому АР вважається важливим фактором ризику формування БА у дітей [3, 5]. Бронхіальна астма й алергічний риніт часто співіснують, обтяжуючи перебіг одне одного [7].
Діти, хворі на алергічні захворювання, зокрема на БА та АР, особливо вразливі до розвитку гострої респіраторної вірусної інфекції (ГРВІ). Так, наприклад, за даними D. Kurai, хворі з БА в 6,2 раза частіше хворіють на гострі респіраторні захворювання, ніж здорові [12]. Як відомо, респіраторні віруси відіграють особливо важливу роль в патогенезі БА та АР, сприяючи як розвитку захворювань, так і виникненню їх загострень [4]. Схильність до частих респіраторних інфекцій у дітей з алергічними захворюваннями респіраторного тракту може пояснюватись порушенням бар’єрної функції респіраторного епітелію та порушенням функціонування мукозального імунітету респіраторного тракту, а саме його неспецифічних факторів — антимікробних пептидів (АМП). На сьогодні активно вивчається роль у функціонуванні місцевого імунітету верхніх дихальних шляхів (ВДШ) двох родин ендогенних катіоноактивних АМП — людських дефензинів і кателіцидину (LL-37). Людські b-дефензини (HbD) експресуються в усіх епітеліальних тканинах, у тому числі і в епітелії порожнини рота. Вони присутні в епітелії ясен, язика, слинних залоз і слизовій оболонці ротової порожнини та проявляють широку противірусну дію щодо аденовірусу, вірусів грипу А, вірусів простого герпесу 1-го та 2-го типів, а також РС-вірусу шляхом інгібіції проникнення вірусу у клітину, руйнування вірусної оболонки та інактивації віріону. HbD беруть участь в імунній відповіді з перших годин запалення, посилюючи міграцію моноцитів у вогнище запалення та стимулюючи продукцію фактору росту епітеліальних клітин [8, 11]. Кателіцидин являє собою катіоноактивну молекулу, яка складається з 37 амінокислотних залишків та експресується в гранулах нейтрофілів і клітинах епітелію. Як і всі АМП, він має широкий спектр антимікробної активності проти грамнегативних і грампозитивних бактерій, а також проявляє антивірусну дію, зокрема індукує пряме пошкодження вірусної оболонки респіраторно-синцитіального вірусу та забезпечує синергічний антибактеріальний ефект з HbD [1, 6].
Незважаючи на це, роль HbD та LL-37 як фактора захисту при алергічних захворюваннях дихальної системи на сьогодні вивчена недостатньо. Можна припустити, що у дітей з алергічними захворюваннями спостерігаються деякі дефекти синтезу АМП, але літературні дані щодо цієї теми досі обмежені та несистемні.
Варто зауважити, що в низці літературних джерел доведений позитивний вплив окремих пробіотичних штамів, зокрема і Lactobacillus rhamnosus GG (LGG), на резистентність до респіраторної вірусної інфекції. –Зокрема відмічається, що прийом пробіотичних засобів, що містять штам LGG, сприяв зменшенню кількості днів пропусків у дитячих шкільних і дошкільних закладах, зумовлених респіраторною інфекцією, зниженню загальної захворюваності на ГРВІ, зменшенню числа випадків призначення антибіотиків. Також доведено профілактичну дію LGG щодо розвитку атопічних захворювань завдяки механізму збудження імунної відповіді типу Th1 і зниження запальної реакції [2, 9]. Тому перспективним вбачається вивчення впливу прийому пробіотичного засобу, що містить штам LGG, на місцевий захист слизової оболонки респіраторного тракту у контексті профілактики гострих респіраторних інфекцій у дітей з респіраторними алергічними захворюваннями.
З огляду на вищезазначене метою нашої роботи стало вивчення рівнів антимікробних пептидів (HbD-2 та LL-37) у секреті слизових оболонок верхніх дихальних шляхів у дітей з бронхіальною астмою та алергічним ринітом, з’ясування їх ролі у захисті від респіраторної вірусної інфекції у даного контингенту хворих та оцінка ефективності застосування пробіотичного препарату, що містить Lactobacillus rhamnosus GG, з метою профілактики ГРВІ та зниження частоти вірус-індукованих загострень алергічної патології.
Матеріали та методи
За характером дане дослідження є динамічним, проспективним і когортним. Дослідження проводилось на базі КП «Спеціалізований медико-реабілітаційний центр для дітей та підлітків» ДОР» з вересня 2018 по січень 2020 р. (директор — к.м.н. Коваленко Т.Ю.).
Проведено клініко-лабораторне обстеження 76 дітей віком від 7 до 18 років, з яких у 24 був діагностований алергічний риніт, у 28 — бронхіальна астма, а у 24 — бронхіальна астма й алергічний риніт (БА + АР). Групу контролю становили 20 клінічно здорових дітей відповідного віку та статі.
Критерії включення дітей у дослідження: інформована згода батьків на участь у дослідженні, верифікований діагноз бронхіальної астми та/або алергічного риніту тривалістю не менше ніж 1 рік, вік від 7 до 17 років. Критерії виключення: наявність хронічних, спадкових і вроджених захворювань бронхолегеневої системи, загострення хронічної алергічної або неалергічної патології дихальних шляхів, наявність на момент дослідження гострого інфекційного захворювання, прийом системних чи місцевих протимікробних або пробіотичних засобів протягом 1 місяця до початку дослідження.
Діагноз бронхіальної астми та алергічного риніту встановлювався на основі Уніфікованого протоколу первинної, вторинної (спеціалізованої) медичної допомоги «Бронхіальна астма у дітей» МОЗ України № 868 від 8 жовтня 2013 р. та Наказу МОЗ України «Про затвердження Протоколів діагностики та лікування алергологічних хвороб у дітей» № 767 від 27.12.2005.
Анамнестичні дані оцінювались за допомогою анкетування батьків та аналізу медичної документації дитини. Усім дітям проводилось стандартне клініко-лабораторне обстеження, передбачене відповідними національними нормативними документами, включаючи визначення рівнів загального імуноглобуліну Е (IgE) та ідентифікацію причинно-значущих алергенів за допомогою шкірних прик-тестів або визначення специфічних IgE в сироватці крові. Окрім цього були проаналізовані патерни респіраторної захворюваності: частота, тривалість і характер гострих респіраторних інфекцій протягом останніх трьох років.
Кількісне визначення рівня антимікробних пептидів у секреті ВДШ було проведено за допомогою імуноферментного аналізу (Human LL-37 ELISA test kit, Human DEFβ2/DEFB2 ELISA test kit, Hycult biotech, Нідерланди). Досліджуваний матеріал (1 мл змішаної нестимульованої слини) збирали в першій половині дня, натщесерце, до проведення гігієнічних процедур порожнини рота, шляхом прямого стікання слини в пробірку. Зібраний матеріал центрифугували зі швидкістю 3000 об/хв протягом 15 хвилин. Для дослідження використовували надосадову рідину. Імунологічні дослідження виконувались в Лікувально-діагностичному центрі ТОВ «Аптека медичної академії», м. Дніпро (завідувач лабораторією — к.біол.н. О.В. Братусь).
З метою вивчення ефективності застосування пробіотичного препарату, що містить LGG, дітей з алергічною патологією методом пар-копій було розподілено на дві групи: до основної групи ввійшло 38 дітей, які в комплексі лікувальних заходів додатково приймали пробіотичний препарат, що містив 10 мільярдів КУО LGG у добовій дозі, протягом 1 місяця. До групи порівняння ввійшло 38 дітей, які отримували лише стандартне лікування (базисна терапія).
Статистичну обробку даних проводили за допомогою стандартних пакетів прикладного статистичного аналізу Statistica for Windows v. 6.1. Перевірка нормальності розподілу кількісних показників проводилась за допомогою критерію Шапіро — Уїлка. Оскільки переважна більшість отриманих даних характеризувалась типом розподілу, що відрізняється від нормального, при статистичному аналізі результатів дослідження розраховувались непараметричні показники: кількісні дані наведені у вигляді медіани (Ме) та інтерквартильного розмаху (IQR) — Q1 (25-й перцентиль) і Q3 (75-й перцентиль). Для оцінки вірогідності відмінностей між незалежними групами для кількісних ознак використовувався критерій Манна — Уїтні (U), для оцінки залежності між парними групами для кількісних ознак використовувався критерій Вілкоксона (T). Для визначення зв’язку між досліджуваними параметрами розраховували показники рангової кореляції Спірмена. Критичне значення рівня значущості (p) приймалося < 5 % (р < 0,05).
Проведення наукової роботи дозволено комісією з питань біомедичної етики Державного закладу «Дніпропетровська медична академія Міністерства охорони здоров’я України».
Клінічна характеристика обстежуваних хворих
Середній вік обстежених дітей становив 10,0 ± 0,2 року. Переважна більшість дітей (94,7 %) була молодшого та середнього шкільного віку. При вивченні гендерної складової виявлено переважання хлопчиків у групах БА та БА + АР (57,1 ± 9,0 % та 83,3 ± 7,0 % відповідно). Дівчаток було дещо більше лише у групі з ізольованим АР (58,3 ± 10,0 %).
Середня тривалість захворювання на АР становила 5,10 ± 0,48 року. При цьому частка хворих із сезонними проявами АР виявилась більшою у групі дітей, хворих на ізольований АР, тоді як у групі БА + АР більша частка пацієнтів мала цілорічні прояви (58 ± 10 % та 42 ± 9 % відповідно, р < 0,05). При ізольованому АР помірна ступінь тяжкості риніту була у 54 ± 10 %, а у групі БА + АР — у 53 ± 9 %. Контрольований перебіг АР спостерігався у 64 ± 8 % пацієнтів. На момент початку проведення дослідження серед пацієнтів з групи АР терапію отримували 75 ± 8 %.
Середня тривалість захворювання на БА становила 5,70 ± 0,41 року. При ізольованій БА переважна більшість пацієнтів мала прояви інтермітуючої астми — 54 ± 9 %, легка персистуюча форма була виявлена у 27 ± 9 % з них, а персистуюча середнього ступеня — у 19 ± 7 %. При поєднанні БА та АР також найчастіше зустрічався інтермітуючий перебіг астми — 66 ± 9 %, а у решти пацієнтів було діагностовано легку персистуючу астму — 34 ± 9 %. На момент включення у дослідження астма була контрольованою у 88 ± 4 % дітей, у решти (12 ± 4 %) — частково контрольованою. Базисну терапію отримували 57 ± 6 % дітей, а серед пацієнтів, які отримували базисну терапію, у групі дітей з БА конт–рольований перебіг астми спостерігався у 82 ± 7 % випадків, а у групі дітей БА + АР — у 91 ± 5 % випадків.
Причинно-значущими алергенами при ізольованому АР були: пилкові алергени — у 54 ± 10 % випадків, епідермальні алергени — у 37 ± 9 %, плісняві гриби — у 25 ± 8 %, побутові алергени — у 8 ± 5 % випадків. При ізольованій БА як причинно-значущі алергени були виявлені: пилкові — у 62 ± 9 % випадків, епідермальні — у 33 ± 9 %, плісняві гриби — у 20 ± 8 %, побутові алергени — у 25 ± 8 % випадків. У випадку поєднання АР та БА структура причинно-значущих алергенів була такою: пилкові алергени — у 29 ± 9 %, епідермальні алергени — у 33 ± 9 %, плісняві гриби — у 12 ± 6 %, побутові алергени — у 37 ± 9 %. У більшості хворих відзначались еозинофілія та підвищення рівня загального IgE, що підтверджує атопічну природу захворювання. При цьому суттєвої різниці в середніх рівнях еозинофілів та IgE між групами ми не виявили.
Результати та обговорення
При аналізі патернів респіраторної захворюваності було виявлено, що діти з алергічними захворюваннями респіраторного тракту хворіють на ГРВІ на 30 % частіше порівняно з групою контролю, найбільша частота спостерігалась у групах дітей з наявністю БА. Як свідчать дані табл. 1, найвищою частота респіраторної захворюваності виявилась у хворих на БА. Вони хворіли не тільки майже у 2 рази частіше, ніж діти контрольної групи, але вірогідно частіше, ніж діти з АР. Майже такою ж високою була захворюваність у групі з поєднанням АР та БА. Найнижчою частота ГРІ була у дітей з ізольованим АР, але все одно вона виявилась вірогідно вищою, ніж у групі контролю. Крім того, діти з БА вірогідно частіше переносили ГРВІ у вигляді захворювань нижніх дихальних шляхів (81,0 ± 0,8 % — у групі БА, 83,0 ± 0,7 % — у групі АР + БА, р < 0,05 порівняно з групою контролю). Більш часте залучення нижніх дихальних шляхів у запальний процес при ГРВІ супроводжувалось вірогідним подовженням середньої тривалості одного епізоду захворювання. Найбільшим цей показник виявився в групі дітей, хворих на БА та АР, — майже у 2,6 раза, ніж у групі контролю, тоді як при ізольованій БА — у 2 рази вищим, а при АР — в 1,5 раза.
Проведений аналіз рівнів АМП в секреті верхніх дихальних шляхів у дітей, хворих на алергічні захворювання респіраторної системи, виявив статистично значущі відмінності рівнів HbD-2 між досліджуваними групами. Так, рівні HbD-2 у секреті ротової порожнини були вірогідно нижчими, ніж у контролі, у всіх досліджуваних групах, найбільш у дітей, хворих на БА + АР (на 50 %). У дітей, хворих на ізольований АР та ізольовану БА, рівні були нижчими в середньому на 22,4 та 39,2 % (рис. 1).
Також було виявлене вірогідне зниження рівнів LL-37 в секреті верхніх дихальних шляхів у дітей усіх досліджуваних груп порівняно з показниками групи контролю. Найнижчі рівні LL-37 було зареєстровано у хворих на БА (рис. 2).
Проведений кореляційний аналіз засвідчив, що рівні досліджуваних АМП зворотно залежали від ступеня тяжкості алергічної патології. Так, виявлено зв’язок середньої сили між рівнем LL-37 та ступенем тяжкості АР (r = –0,68; р < 0,05), ступенем тяжкості БА (r = –0,54; р < 0,05), а також між рівнем в секреті ротової порожнини HbD-2 та ступенем тяжкості АР (r = –0,64; р < 0,05). Сильний негативний зв’язок відзначався між рівнем HbD-2 та ступенем тяжкості БА (r = –0,86; р < 0,05). Рівень LL-37 зворотно залежав від факту відсутності контролю симптомів БА (r = –0,36; р < 0,05). Факт наявності базисної терапії на момент проведення дослідження мав вірогідно позитивний зв’язок як із рівнем LL-37 (r = 0,32; р < 0,05), так і HbD-2 (r = 0,73, р< 0,05). В той же час ми не виявили залежності рівнів АМП від тривалості захворювань, еозинофілії, IgE в сироватці крові та характером сенсибілізації.
Враховуючи виявлений сильний зв’язок між рівнями АМП у секреті верхніх дихальних шляхів і ступенем тяжкості захворювань, а також рівнем контролю захворювань, ми визнали за доцільне дослідити, чи не пов’язане зниження рівнів АМП виключно із наявністю поточного алергічного запалення в дихальних шляхах. З цією метою ми вивчили рівні АМП залежно від наявності симптомів захворювань. Результати наведені в табл. 2.
Як свідчать дані аналізу, рівні АМП у дітей за відсутності повного контролю симптомів БА виявились вірогідно нижчими, ніж при контрольованій БА: –HbD-2 — в 1,5 раза, LL-37 — в 1,1 раза, тоді як у хворих на АР різниці в рівнях АМП були несуттєвими. Разом з тим навіть за наявності повного контролю симптомів алергічних захворювань, тобто при мінімальному рівні алергічного запалення в дихальних шляхах, рівні АМП були вірогідно нижчими, ніж у дітей контрольної групи.
Аналіз зв’язків між рівнями АМП та показниками гострої респіраторної захворюваності дітей, хворих на АР та БА, виявив наявність зворотного зв’язку середньої сили між частотою ГРВІ та рівнем LL-37 в групі дітей з БА (r = –0,65; р < 0,05), а також зворотний слабкий зв’язок між рівнями LL-37 та HbD-2 в секреті ротової порожнини з середньою тривалістю одного епізоду ГРВІ при БА (r = –0,31; р < 0,05 та r = –0,48 відповідно; р < 0,05). Отримані дані демонструють можливість впливу низьких рівнів АМП на схильність до розвитку респіраторних інфекцій, до більш тривалого їх перебігу у дітей з алергічними захворюваннями.
Таким чином, ми виявили, що всім дітям з алергічними захворюваннями дихальних шляхів властиве зниження рівнів HbD-2 та LL-37 у секреті верхніх дихальних шляхів, що супроводжується збільшенням частоти та тривалості ГРВІ, які у більшості випадків призводять до загострення алергічної патології. Навіть при повному контролі симптомів (з проведенням базисної терапії чи без неї) рівні АМП у секреті ротової порожнини у дітей, хворих на БА та АР, залишаються зниженими. Тому ми визнали за доцільне вивчити ефективність застосування пробіотичного препарату, що містить лактобактерії LGG, як доповнення до стандартної (базисної) терапії з метою профілактики ГРВІ та пов’язаних із ними загострень алергічних захворювань. Як уже було зазначено вище, вибір даного пробіотика був зумовлений його доведеною ефективністю при профілактиці ГРВІ у дорослих і дітей, а також можливістю впливу на продукцію АМП.
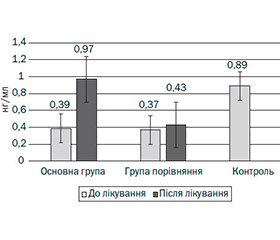
Через 1 місяць прийому пробіотичного препарату ми спостерігали суттєвий приріст рівнів АМП у секреті верхніх дихальних шляхів. Так, рівень HbD-2 в динаміці зріс майже на 27 %, практично до рівнів контрольної групи, на відміну від групи порівняння (рис. 3).
/37-1.jpg)
Ще більш вираженим виявилось збільшення рівнів LL-37 у секреті ротової порожнини — після прийому LGG протягом 1 місяця вони зросли майже на 60 %, тоді як у групі порівняння відмінності були незначними (рис. 4).
Катамнестичне спостереження протягом 1 року показало суттєве зниження частоти ГРВІ у дітей з основної групи в середньому на 26 %. Максимальний ефект зниження частоти ГРВІ спостерігався протягом перших 3 місяців. Крім того, у дітей основної групи протягом наступного після проведеного лікування року на 16,5 % зменшилась частка інфекцій нижніх дихальних шляхів, тоді як у групі порівняння вона знизилась всього на 3 %. Зменшення частоти залучення нижніх дихальних шляхів у запальний процес при ГРВІ супроводжувалось вірогідним зниженням середньої тривалості одного епізоду захворювання загалом на 22,6 %. У групі порівняння зниження середньої тривалості ГРВІ було несуттєвим і залишилось майже на тому самому рівні. Також спостерігалось зниження частоти вірус-індукованих загострень алергічної патології у дітей основної групи на 25,7 %, тоді як у групі порівняння частота вірус-індукованих загострень знизилась всього на 10,3 %.
Узагальнюючи вищевикладені дані, можна стверджувати, що прийом пробіотичного препарату, який містить штам LGG, протягом 1 місяця супроводжувався як приростом рівнів АМП в секреті верхніх дихальних шляхів у дітей, хворих на АР та БА, так і вірогідним зниженням показників гострої респіраторної захворюваності та зниженням частоти пов’язаних з респіраторними інфекціями загострень алергічної патології. Відповідно до існуючих уявлень, механізм впливу LGG на продукцію АМП, швидше за все, може бути опосередкований мікробіомом кишечника [2, 13, 14]. Метаболіти LGG, отримані після ферментації пробіотика мікробіомом кишечника, шляхом зв’язування з рецепторами жирних кислот активують сигнальний білок STAT3, дозволяючи модулювати гени для збільшення експресії АМП [10]. Позитивний вплив LGG на показники респіраторної захворюваності, на нашу думку, пов’язаний з підвищенням рівнів АМП у секреті верхніх дихальних шляхів, хоча можуть мати місце й інші механізми, вивчення яких може стати метою подальших досліджень, також як і вивчення впливу різних режимів прийому пробіотика.
Висновки
1. Діти з алергічними захворюваннями респіраторного тракту характеризуються більшою частотою ГРІ (на 30 %) з більш частим залученням у запальний процес нижніх дихальних шляхів (на 72 %), що обумовлює більшу тривалість захворювань (на 95 %) порівняно із здоровими дітьми.
2. У дітей з алергічним ринітом і бронхіальною астмою виявлене суттєве зниження рівнів антимікробних пептидів у секреті верхніх дихальних шляхів порівняно з групою контролю. Рівні HbD-2 у дітей, хворих на АР, були нижчими в середньому на 22,4 %, у дітей, хворих на БА, — на 39,2 %, а при поєднанні цих нозологій — на 50 %. Показники рівнів LL-37 у дітей, хворих на АР, були нижчими, ніж в контролі, на 51,2 %, при БА — на 66 %, при БА та АР — на 59,1 %.
3. Виявлено, що на рівні АМП в секреті верхніх дихальних шляхів найбільш негативно впливає ступінь активності алергічного запалення, що супроводжується відсутністю контролю симптомів, а позитивно — прийом препаратів базисної терапії та відсутність симптомів. Разом з тим навіть за наявності повного контролю симптомів алергічних захворювань, тобто при мінімальному рівні алергічного запалення в дихальних шляхах, рівні АМП були вірогідно нижчими, ніж у дітей контрольної групи.
4. Встановлено, що існує зворотний зв’язок між рівнями АМП та частотою і тривалістю ГРВІ у дітей з алергічними захворюваннями, найбільш виражений при БА.
5. Прийом пробіотичного препарату, що містить штам Lactobacillus rhamnosus GG, протягом 1 місяця додатково до базисної терапії АР та БА сприяв вірогідному підвищенню рівнів HbD-2 (в середньому на 27 %) та LL-37 (в середньому на 60 %) у секреті верхніх дихальних шляхів, що супроводжувалось зниженням частоти ГРІ в середньому на 26 % (в тому числі й епізодів із залученням нижніх дихальних шляхів), зменшенням середньої тривалості ГРІ на 22 % протягом наступного року та зниженням вірус-індукованих загострень на 25,7 %.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Участь авторів в підготовці статті: Больбот Ю.К. — розробка концепції та дизайну дослідження, обробка статті на фінальному етапі; Бордій Т.А. — збір даних та їх аналіз, написання тексту статті, критичний огляд результатів дослідження; Віленський Я.В. — збір даних та їх аналіз, відповідальність за статистичну обробку даних, написання тексту статті.
- Абатуров А.Е., Крючко Т.А., Леженко Г.А., Завгородняя Н.Ю. Антимикробные пептиды и протеины респираторного тракта, диагностическая значимость и терапевтические возможности. Монография. Харьков: Планета-Принт, 2018. 496 с.
- Каннер Е.В., Горелов А.В., Печкуров Д.В., Горелова Е.А., Максимов М.Л., Ермолаева А.С. Мукозальная иммунная система пищеварительного и респираторного трактов: возможности профилактики и лечения инфекционных заболеваний. Медицинский совет. 2019. № 11. С. 100-107. https://doi.org/10.21518/2079-701X-2019-11-100-107.
- Романюк Л.И. Аллергический ринит как коморбидное состояние бронхиальной астмы. Астма та алергія. 2013. № 2. С. 62-65.
- Чернышева О. Е. Роль инфекционно-воспалительного процесса в формировании бронхиальной астмы у детей. Здоровье ребенка. 2014. № 4. С. 117-124. Режим доступу: http://nbuv.gov.ua/UJRN/Zd_2014_4_22.
- Brozek J.L., Bousquet J., Baena-Cagnani C.E. et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 Revision. J. Allergy Clin. Immunol. 2010. Vol. 126. P. 466-76.
- Currie S.M., Findlay E.G., McHugh B.J. et al. The human cathelicidin LL-37 has antiviral activity against respiratory syncytial virus. PLos One. 2013 Aug 30. № 8(8). Р.e73659. doi: 10.1371/journal. Pone.0073659.
- Hansen T.E., Evjenth В., Holt J. Increasing prevalence of asthma, allergic rhinoconjunctivitis and eczema among schoolchildren: three surveys during the period 1985–2008. Foundation Acta Раеdiatrica. 2013. Vol. 102. P. 47-52.
- Jenssen H., Hamill P., Hancock R.E.W. Clin. Microbiol. Rev. 2006. Vol. 7. P. 491-511.
- Ng S.C., Hart A.L., Kamm M.A. Mechanisms of action of probio–tics: recent advances. Inflamm. Bowel Dis. 2009. 15(2). 301-312. WGO. Probiotics and Prebiotics. World Gastroenterology Organization. 2011. http://www. worldgastroenterology.org.
- Carole Brosseau, Amandine Selle, Debra J. Palmer, Susan L. Prescott, Sйbastien Barbarot, Marie Bodinier. Prebiotics: Mechanisms and Preventive Effects in Allergy. Nutrients. 2019 Aug. 11(8). 1841. Published online 2019 Aug 8. doi: 10.3390/nu11081841.
- Tomas Canz. J. Leukoc. Biol. 2004. Vol. 75. P. 34-38.
- Kurai D., Saraya T., Ishil H., Takixawa H. Virus-induced exacerbations in asthma and COPD. Fronters in Microbiology. 2013. Vol. 4. P. 1-9.
- Villena J., Chiba E., Tomosada Y. et al. Orally administered Lactobacillus rhamnosus modulates the respiratory immune response triggered by the viral pathogen-associated molecular pattern poly(I:C). BMC Immunol. 2012. № 13(53). https://doi.org/10.1186/1471-2172-13-53.
- Vladimir Ivashkin, Oxana Zolnikova, Nino Potskherashvili, Alexander Trukhmanov, Natalia Kokina, Natiya Dzhakhaya. A correction of a gut microflora composition for the allergic bronchial asthma complex therapy. Italian Journal of Medicine. 2018. Vol. 12. № 4. https://doi.org/10.4081/itjm.2018.931.

/36-1.jpg)
/36-2.jpg)
/38-1.jpg)