Журнал «» Том 13, №4, 2020
Вернуться к номеру
Принципи профілактичного та лікувального застосування альфа-ліпоєвої кислоти та коензиму Q10 при коморбідних метаболічних станах
Авторы: Філіппова О.Ю.
Державний заклад «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
У статті викладені результати аналізу літератури, присвячені обговоренню переваг та потенційних можливостей альфа-ліпоєвої кислоти і коензиму Q10 (убіхінону) у пацієнтів із кардіо-васкулярними захворюваннями, хронічними дифузними захворюваннями печінки, цукровим діабетом та іншими метаболічними станами. Сьогодні ведеться активний пошук додаткових джерел, що сприяють покращенню вуглеводного й ліпідного обміну, метаболічних та енергетичних процесів в організмі, які підвищують стійкість серцево-судинної системи та печінки до різних порушень і патологічних впливів, а також сприяють відновленню функцій різних органів при їх ушкодженнях. В Україні комбінація альфа-ліпоєвої кислоти та коензиму Q10 представлена вітчизняним комплексом Ліпофарм від компанії «Фармаком».
В статье изложены результаты анализа литературы, посвященные обсуждению преимуществ и потенциальных возможностей альфа-липоевой кислоты и коэнзима Q10 (убихинон) у пациентов с кардиоваскулярными заболеваниями, хроническими диффузными заболеваниями печени, сахарным диабетом и другими метаболическими состояниями. Сегодня ведется активный поиск дополнительных источников, способствующих улучшению углеводного и липидного обмена, метаболических и энергетических процессов в организме, которые повышают устойчивость сердечно-сосудистой системы и печени к различным нарушениям и патологическим воздействиям, а также способствуют восстановлению функций различных органов при их повреждениях. В Украине комбинация альфа-липоевой кислоты и коэнзима Q10 представлена отечественным комплексом Липофарм от компании «Фармаком».
The article presents the results of the literature analysis to discuss the benefits and potential of alpha-lipoic acid and coenzyme Q10 (Ubiquinone) in patients with cardiovascular diseases, chronic diffuse liver diseases, diabetes mellitus and other metabolic conditions. Today, an active search for additional sources is being carried out that improve carbohydrate and lipid metabolism, metabolic and energy processes in the body, which increase the resistance of the cardiovascular system and liver to various disorders and pathological influences, and also contribute to the restoration of the functions of various organs in case of their damage. In Ukraine, a combination of alpha-lipoic acid and coenzyme Q10 is represented by the domestic complex Lipofarm manufactured by the Farmakom company.
альфа-ліпоєва кислота; коензим Q10; кардіоваскулярні захворювання; хронічні дифузні захворювання печінки; цукровий діабет, Ліпофарм; огляд
альфа-липоевая кислота; коэнзим Q10; кардиоваскулярные заболевания; хронические диффузные заболевания печени; сахарный диабет; Липофарм; обзор
alpha-lipoic acid; coenzyme Q10; cardiovascular diseases; chronic diffuse liver disease; diabetes mellitus, Lipofarm; review
Вступ
Сьогодні ведеться активний пошук додаткових джерел, що сприяють покращенню вуглеводного й ліпідного обміну, метаболічних та енергетичних процесів в організмі, які підвищують стійкість серцево–судинної системи та печінки до різних порушень і патологічних впливів, а також сприяють відновленню функцій різних органів при їх ушкодженнях. Практично щороку ми стаємо свідками появи нових лікувальних комплексів, різнорідних за своїми характеристиками. Практичні лікарі завжди віддають перевагу засобам, що різнобічно діють на різні метаболічні функції організму людини.
Слід зауважити, що сьогодні жоден комплексний препарат, який використовують на практиці, повністю не відповідає наведеним вище вимогам. Зазначений факт, ймовірно, є своєрідним стимулом до пошуку і створення ідеального лікувального засобу з потужними антиоксидантними властивостями, що здатний працювати в умовах оксидативного стресу й розвитку низки метаболічно асоційованих станів.
Кардіоваскулярні захворювання (КВЗ) зберігають своє значення як найважливіша причина смерті населення в багатьох країнах світу. КВЗ поширені переважно серед осіб похилого та старечого віку, що пояснює наявність полі– та коморбідних станів у цих пацієнтів — артеріальної гіпертензії (АГ), цукрового діабету (ЦД), ожиріння, облітеруючого атеросклерозу судин нижніх кінцівок, хронічної ішемічної хвороби серця (ХІХС), серцевої недостатності (СН), неалкогольної жирової хвороби печінки (НАЖХП) та інших, які безпосередньо впливають на ризик розвитку кардіоваскулярних ускладнень і загальну смертність [13, 15, 16, 36]. Ведення таких пацієнтів — непросте завдання, що вимагає від лікаря індивідуального підходу до кожного хворого, пошуку оптимальних терапевтичних рішень. На жаль, незважаючи на всі зусилля, застосування декількох класів препаратів, результат лікування цих пацієнтів не завжди задовольняє лікаря. Можливо, тому, що не всі препарати впливають на першопричину патологічного стану, тоді як прицільний вплив саме на базові процеси відкриває найбільші перспективи в лікуванні не тільки серцево–судинних, а й будь–яких інших захворювань, а саме ЦД, хронічних дифузних захворювань печінки (ХДЗП) [13].
Мета цього огляду літератури — обговорення переваг та потенційних можливостей альфа–ліпоєвої кислоти й коензиму Q10 (убіхінону) у пацієнтів із КВЗ, ХДЗП, ЦД та іншими метаболічними станами.
Роль оксидативного стресу в розвитку метаболічних станів
Оксидативний стрес відіграє важливу роль у патогенезі різних захворювань людини: ХІХС, захворювань судин, ЦД, ХДЗП, захворювань головного мозку, шлунково–кишкового тракту, раку, передчасного старіння і цілої низки інших патологічних станів [33]. В організмі людини щодня утворюється величезна кількість вільних радикалів кисню. Вони виникають там, де змінюється хімічна структура речовини, і це пов’язано з обміном речовин [13]. Вільні радикали утворюються при диханні, травленні, продукції тепла і виробництві енергії, регенерації, а також при видаленні продуктів обміну речовин. Існує тісний взаємозв’язок між обміном речовин і утворенням вільних радикалів: чим вища активність обмінних процесів, тим більше їх утворюється. Це не повинно призводити до помилкового висновку, що їжа, дихання, прийом рідини і рух в кінцевому підсумку є патологією, оскільки при всіх цих процесах збільшується кількість вільних радикалів [8].
В організмі людини є специфічна система, що в процесі обміну речовин виконує роль «пастки» (нейтралізації) для вільних радикалів і пригнічує їх хімічну агресивність [33]. Вільні радикали кисню відіграють і позитивну роль, тому що їх продукція необхідна для підтримки чистоти внутрішнього середовища: вони руйнують чужорідні речовини, віруси й бактерії. В останнє сторіччя значно змінилися умови життя (зміни в навколишньому середовищі, стреси, накопичення пестицидів у харчових продуктах, променеве навантаження, смог), як наслідок, природні регулятори більше не в змозі нейтралізувати надлишкове утворення вільних радикалів, що викликає розвиток оксидативного стресу [13].
Враховуючи роль окиснювального стресу в розвитку метаболічних захворювань, їх ускладнень, актуального значення набуває проблема розробки фармакологічних засобів регулювання цих процесів. Останнім часом для зменшення оксидативного стресу й нормалізації процесів перекисного окиснення ліпідів широке застосування отримали інгібітори вільнорадикального окиснення — антиоксиданти [5, 45]. Слід зазначити, що здатність безпосередньо реагувати з перекисними радикалами ліпідів мають тільки антиоксиданти, причому їх вплив на загальну швидкість вільнорадикального окиснення значно перевищує ефективність впливу інших систем. Особливий інтерес у зв’язку з цим викликають такі антиоксиданти, як альфа–ліпоєва кислота (АЛК) та коензим Q10 (убіхінон) [1, 6, 16].
Антиоксидантні ефекти альфа–ліпоєвої кислоти й убіхінону
АЛК — це ендогенно утворена речовина, яка є природним метаболітом, бере участь у багатьох фізіологічних процесах, пов’язаних з обміном речовин, є ефективним засобом метаболічної фармакотерапії. Альфа–ліпоєва кислота є дисульфідним похідним октанової кислоти [5, 8]. Основна біологічна роль АЛК полягає в модуляції активності деяких мітохондріальних ферментів циклу Кребса [22, 29]. Завдяки наявності в структурі молекули хелатного комплексу АЛК демонструє виражену активність як «пастка» вільних радикалів [25]. АЛК діє як коензим у мультиферментних комплексах мітохондрій, які прискорюють окисне декарбоксилювання альфа–кетокислот. Через ферментативне й хімічне відновлення з АЛК синтезується дигідроліпоєва кислота. Система «альфа–ліпоєва — дигідроліпоєва кислота» виконує антиоксидантну функцію в організмі, активуючи такі системи, як глутатіонова, вітамінів С/Е, цистеїн/цистин, і підвищує утилізацію глюкози [22, 32, 39] (рис. 1).
Установлено, що АЛК не тільки має самостійний антиоксидантний потенціал, а й забезпечує потужну підтримку роботи інших антиоксидантних ланок в організмі. У цьому відношенні її протективна дія тісно пов’язана з гомеостазом у системі убіхінону [22].
Убіхінон (коензим Q10 — КоQ10) є не менш важливим антиоксидантом в організмі людини. Убіхінон синтезується в організмі з амінокислоти тирозину за участю вітамінної групи В, С, а також фолієвої, пантотенової кислот і низки мікроелементів [6, 26]. Раніше запобігання окисненню клітинних мембран пов’язували з вітамінами–антиоксидантами, особливо з вітаміном Е. Усередині клітин убіхінон локалізований в основному в мітохондріях і являє собою невелику гідрофобну молекулу, розчинену в ліпідному бішарі. Найбільше його міститься в мітохондріях клітин таких енергоспоживаючих органів, як серце, печінка, нирки, підшлункова залоза [28]. Синтез КоQ10 в організмі залежить від віку людини. У здоровому організмі до 40 років синтезується необхідна для клітинного дихання та вироблення енергії кількість КоQ10. З віком (приблизно з 40 років) рівень КоQ10 в організмі знижується. Серце, печінка, нирки, підшлункова залоза особливо чутливі до нестачі КоQ10, оскільки процеси метаболізму в них найбільш активні [6, 45].
Сьогодні накопичується все більше даних про те, що убіхінон є одним із найбільш важливих антиоксидантів, оскільки він виробляється в самому організмі. Ще однією вагомою особливістю КоQ10 є здатність постійно й самостійно відновлювати свою антиоксидантну активність, тобто з окисненої форми (убіхінол Q10) переходить у відновлену форму (убіхінон Q10). Тому співвідношення убіхінол Q10/убіхінон Q10 може розглядатися як один із важливих показників стану антиоксидантної системи організму [2, 23]. Як антиоксидант, КоQ10 перевершує всі інші природні антиоксиданти й тому вважається найбільш перспективним для застосування в клінічній практиці. Втрата убіхінону прогресивно зростає при фізичних і емоційних навантаженнях, при частих простудних захворюваннях, хронічному стресі, що обумовлює ймовірність розвитку його дефіциту [26, 28, 40]. Особливого значення набуває дефіцит убіхінону при низці захворювань. Клінічними дослідженнями встановлено, що розвиток багатьох обмінних і дистрофічних захворювань, патологія імунної системи, передчасне старіння, надмірна маса тіла тісно пов’язані з недоліком енергоутворення в організмі і пошкодженням клітинних генераторів енергії [40].
Отже, завдяки властивостям АЛК і убіхінону відновлювати запаси глутатітону, брати участь у синтезі АТФ, запобігати пошкодженню мітохондрій і загибелі клітин, що обумовлена впливом фактора некрозу пухлини, АЛК і убіхінон знай–шли широке застосування в кардіології, гастроентерології, ендокринології та інших галузях медичної практики.
Терапевтичні можливості альфа–ліпоєвої кислоти й убіхінону в кардіології
Установлено, що дисфункція ендотелію є фундаментальним фактором ризику формування та прогресування уражень органів–мішеней, а також тригерним й інтегральним механізмом реалізації мікро– і макроваскулярних ускладнень при КВЗ [18, 29]. Крім того, дисфункція ендотелію, як ранній етап виникнення КВЗ, має надзвичайно високе прогностичне значення щодо ризику загальної смерті і серйозних кардіоваскулярних й атеротромботичних подій для багатьох категорій пацієнтів. У низці досліджень виявлено зниження циркулюючого і/або внутрішньоклітинного рівня АЛК при низці КВЗ і ЦД [4, 11, 15, 19, 42]. Установлено, що дотація АЛК не тільки відновлює активність ендогенних антиоксидантних систем, а й сприяє поліпшенню вазоактивних якостей ендотелію, що визначило підвищений інтерес до терапевтичних можливостей цього антиоксиданту [5, 7].
Існують докази того, що АЛК здатна істотно знижувати ендогенну продукцію низки вільних радикалів в атеросклеротичній бляшці і субінтимі коронарних артерій, що сприяє підвищенню механічних якостей судинної стінки, зниженню уразливості покришки атероми і реверсії вираженості дисфункції ендотелію [42]. Зменшуючи ангіотензин–II–індуковану активацію мононуклеарів і Т–лімфоцитів в атеромі, АЛК бере активну участь у стабілізації її покришки і зниженні прокоагулянтного потенціалу на її поверхні. Останній ефект частково реалізується за рахунок супресії ядерного фактора транскрипції, що контролює експресію генів прозапальних цитокінів та адгезивних моле– кул [9, 22].
АЛК продемонструвала вазопротекторну активність при АГ, тісно пов’язану зі зменшенням накопичення в судинній стінці активованих макрофагів, зниження темпів акумуляції недоокиснених ліпідів, супресію продукції прозапальних цитокінів. Результатом такої активності є реверсія дисфункції ендотелію й тенденція до нормалізації рівня системного артеріального тиску [4, 38].
АЛК у попередніх дослідженнях виявила здатність підтримувати скоротливість міокарда переважно за рахунок стимуляції експресії цитопротекторних генів, супресії апоптозу кардіоміоцитів і реверсії внутрішньоклітинного ацидозу. Завдяки цим якостям АЛК продемонструвала свою здатність запобігати формуванню і прогресуванню лівошлуночкової дисфункції в пацієнтів із ЦД [4, 42, 43]. У цілому можливості АЛК як цитопротектора при СН різної етіології ще недостатньо чітко визначені, її потенціал потребує подальшого вивчення.
Найбільш вивчено вплив КоQ10 на серцево–судинну систему. Майже 40–річний досвід клінічних досліджень його застосування переконливо доводить істотну роль дефіциту убіхінону в розвитку кардіологічної патології, що не дивно, бо саме в клітинах серцевого м’яза найбільш великі енергетичні потреби. Установлено, що якщо рівень КоQ10 знижується на 25 %, то клітини відчувають дефіцит енергії, погіршується біоенергетичний метаболізм серцевого м’яза. Зниження вмісту КоQ10 на 75 % призводить до загибелі клітин [2, 3, 20].
У клінічній практиці робилися численні спроби використання КоQ10 для корекції порушень клітинного енергообміну. Відзначена ефективність застосування КоQ10 у пацієнтів із різними формами серцево–судинної патології. Зареєстроване статистично значуще поліпшення міокардіальної функції при використанні КоQ10 у дозі від 75 до 600 мг на день. КоQ10 — безпечний і ефективний додатковий засіб для лікування широкого спектра серцево–судинних захворювань, використання якого не тільки поліпшує клінічні результати, а й дозволяє знизити сумарні витрати на лікування [2, 3, 26, 27]. У дослідженнях установлено поліпшення функціональної потужності, ендотеліальної функції та скоротливості лівого шлуночка без будь–яких побічних ефектів [37, 40, 41, 46].
КоQ10 використовувався і для лікування артеріальної гіпертензії. Відзначене поступове поліпшення функціонального статусу пацієнтів і зниження потреби в гіпотензивній терапії. Також відзначене істотне поліпшення товщини стінки лівого шлуночка й діастолічної функції міокарда [2, 46].
Позитивний клінічний вплив убіхінону при КВЗ:
— підвищення скоротливої здатності міокарда;
— поліпшення кровотоку в міокарді;
— підвищення толерантності до фізичного навантаження, особливо у хворих із кардіологічною патологією;
— антиаритмічний та гіпотензивний вплив;
— нормалізація порушеного ліпідного обміну крові;
— антиатеросклеротичний ефект при атеросклерозі.
Терапевтичні можливості альфа–ліпоєвої кислоти й убіхінону в гепатології
З огляду на потенційні терапевтичні можливості АЛК спектр її клінічного застосування не обмежується рамками кардіології. В останні десятиліття відзначений підвищений інте–рес до вивчення властивостей цього універсального антиоксиданту, не припиняється пошук нових точок його ефективного застосування в повсякденній клінічній практиці при досить широкому спектрі патологій. Так, гепатотропна й дезінтоксикаційна дія дозволяють з успіхом застосовувати АЛК при хронічних дифузних захворюваннях печінки, в терапії вірусного гепатиту С, цирозу печінки, НАЖХП, а також при отруєннях і хронічних інтоксикаціях [4, 10, 25, 29, 31].
Особливе значення в ураженні печінки має вільнорадикальне окиснення. Печінка займає центральне місце в обміні речовин і знешкодженні значної кількості ендогенних токсинів і екзогенних ксенобіотиків [13]. Ліпідна пероксидація є важливим механізмом знешкодження багатьох чужорідних речовин. Це дозволяє перетворити погано розчинні у воді токсини в розчинні сполуки й вивести їх з організму. Особливо сприятливі умови для виникнення оксидативного стресу створює таке поширене явище, як жирова інфільтрація печінки [10]. У сучасній практиці виділяють жирову інфільтрацію алкогольного і неалкогольного генезу. За певних умов ця патологія може прогресувати до стеатогепатиту, що в певної кількості пацієнтів прогресує до цирозу печінки [13].
Шкідлива дія алкоголю на печінку опосередковується різними механізмами, але всі вони в кінцевому підсумку призводять до утворення величезної кількості вільних радикалів, що індукують перекисне окиснення ліпідів клітинних мембран. Механізм захисної дії АЛК при алкогольних ураженнях печінки пов’язаний зі зниженням концентрації токсичних продуктів метаболізму етанолу, зниженням пероксидації ліпідів, підвищенням синтезу глутатіону, що призводить до переважання активності антиоксидантних систем над процесами вільнорадикального окиснення [4]. Було доведено, що АЛК, знижуючи вміст аміаку в крові, зменшує прояви печінкової енцефалопатії у хворих із гіперамоніємією, зумовленою прямим портокавальним анастомозом [7].
При НАЖХП АЛК бере участь у процесах окиснення жирних кислот у мітохондріях, що, крім енергозабезпечення клітини, зменшує вміст у ній субстратів для синтезу тригліцеридів і тим самим запобігає розвитку жирової дистрофії печінки [10].
Широке використання препаратів АЛК при хронічних дифузних захворюваннях печінки зумовлюють такі ефекти:
— участь в окисненні жирних кислот і ацетату (запобігає розвитку жирового стеатозу печінки);
— зниження концентрації жирних кислот, загального холестерину і його ефірів у плазмі;
— здатність знижувати рівень перекисного окиснення ліпідів (зв’язує вільні радикали і вільне тканинне залізо);
— відновлення глутатіону;
— декарбоксилювання бета–кетокислот (енергозабезпечення клітини і профілактика розвитку кетоацидозу);
— підвищення трансмембранного транспорту глюкози в клітину (накопичення глікогену в клітині, збільшення її енергетичного балансу);
— пригнічення синтезу оксиду азоту гепатоцитами (профілактика та купірування реологічних розладів і судинних порушень).
Таким чином, препарати АЛК рекомендується використовувати при алкогольному та неалкогольному стеатогепатиті, при жировому стеатозі для профілактики прогресування й розвитку ускладнень. Лікування можливо проводити у вигляді монотерапії і в поєднанні з іншими антиоксидантними і гепатотропними препаратами [10, 13].
Позитивний клінічний вплив убіхінону при ХДЗП [28]:
— стимуляція процесів енергетичного спалювання жирів;
— збагачення жирової тканини киснем, що забезпечує ефективне зниження маси;
— нормалізація порушеного ліпідного обміну крові;
— регулювання вуглеводного обміну — рівня глюкози, поліпшення реологічних властивостей крові;
— стимуляція гемопоезу;
— імуномодуляція;
— гепатотропний ефект;
— впливу на апоптоз й уповільнення процесів старіння.
Терапевтичні можливості альфа–ліпоєвої кислоти й убіхінону в ендокринології
У розвитку діабетичного ураження периферичних нервів основну роль відіграє оксидативний стрес, обумовлений при ЦД надлишковим утворенням вільних радикалів, з одного боку, і слабкістю власних антиоксидантних систем організму — з іншого. У результаті оксидативного стресу розвивається ураження клітинних структур, у тому числі волокон периферичних нервів, порушується ендоневральний кровотік через зміни ендотелію, судинної стінки й погіршення реологічних властивостей крові. Причиною блокади обміну глюкози при ЦД є активізація регенеративних полімераз, що виникає у відповідь на руйнування мітохондріальної ДНК одним із найбільш активних вільних радикалів — супероксидом, який відіграє провідну роль у формуванні пізніх ускладнень ЦД [12].
АЛК є найбільш ефективним засобом для лікування периферичної нейропатії, що підтвердили такі широкомасштабні багатоцентрові багаторічні дослідження, як ALADIN (Alpha–Lipoic Acid in Diabetic Neuropathy) і DEKAN (Deutsche Kardiale Autonome Neuropathie). У 1999 р. діабетичним товариством лікарів Німеччини було визнано, що АЛК є єдиним засобом із доведеною ефективністю в лікуванні діабетичної нейропатії. Клінічне використання АЛК при діабетичній ней– ропатії засноване на безлічі біохімічних і фізіологічних ефектів цієї речовини. АЛК підсилює ендоневральний кровотік, запобігає інгібуванню NO–синтетази і таким чином запобігає ішемічному пошкодженню нервової тканини; прискорює процес проведення імпульсу по нерву й нормалізує рівні глутатіону [14].
Останнім часом з’являються дані щодо профілактичного застосування АЛК при діабетичній ретинопатії і діабетичній нефропатії. Також виявлено, що АЛК має здатність пригнічувати глюконеогенез у печінці [1, 17]. У більшості хворих АЛК знижує рівень необхідної дози інсуліну та оральних гіпоглікемічних препаратів. Поряд із контролем цукру в крові важливою ланкою патогенетичної терапії ЦД є застосування АЛК, яка, виявляючи потужну антиоксидантну дію, забезпечує не тільки профілактику, але і лікування пізніх ускладнень цукрового діабету [21].
Доведено, що АЛК істотно редукує вираженість і частоту рецидивів основних сенсорних ознак нейропатичного синдрому, включаючи біль і оніміння. Крім того, АЛК позитивно впливає на кардіоваскулярну автономну нейропатію і сприяє поліпшенню показників варіабельності серцевого ритму [24]. Більше того, метааналіз чотирьох рандомізованих плацебо–контрольованих досліджень (ALADIN I, ALADIN III, SYDNEY, NATHAN II), що сумарно включає більше 1 тис. пацієнтів, підтвердив ці результати [43, 44]. Дані клінічних досліджень обнадійливі, оскільки неврологічний дефіцит і кардіоваскулярна автономна нейропатія є головними факторами ризику розвитку мікро– і макроангіопатії, діабетичної стопи й кардіоваскулярної смерті [35].
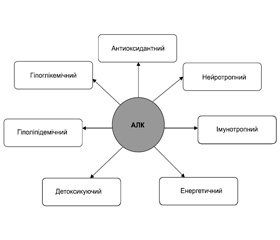
Установлено, що АЛК має безліч метаболічних ефектів, які активно застосовуються не тільки в клінічній практиці лікаря–ендокринолога, а й в загальній клінічній практиці (рис. 2).
Призначення КoQ10 хворим на ЦД супроводжується зниженням глікемії й рівня кетонових тіл у крові, стимуляцією секреції інсуліну й поліпшенням периферичної утилізації глюкози. У хворих на ЦД часто відзначається тенденція до розвитку недостатності КоQ10 порівняно з особами, які не страждають від ЦД, яка може бути первинною причиною зниженої глюкозостимульованої секреції інсуліну. Певна роль у патогенезі ЦД 2–го типу відводиться нестачі КоQ10, наявної при діабеті, що супроводжується погіршенням метаболізму мітохондрій, а також підвищенням ступеня вираженості окиснювального стресу [34]. Слід зазначити, що крім глюкозотоксичності наявна при ЦД ліпотоксичність знижує експресію в β–клітинах генів ферментів, зокрема глюкокінази і гліцерин–3–дегідрогенази, які опосередковують недостатність глюкозостимульованої секреції інсуліну, особливо в умовах відносної недостатності у них КоQ10 [41]. Це ще раз підтверджує необхідність застосування у хворих на ЦД 2–го типу екзогенного КоQ10 для поліпшення функціональної активності β–клітин і стану вуглеводного обміну.
З урахуванням того, що ендогенний синтез КоQ10 знижується починаючи з 40–річного віку, його застосування як харчової добавки або лікарського препарату у хворих на цукровий діабет 2–го типу не викликає сумнівів. Крім цього, КоQ10 має великі переваги в енергетичному метаболізмі β–клітин, функція яких у хворих на ЦД 2–го типу знижена. Тому застосування КоQ10 може бути рекомендоване хворим на ЦД 2–го типу, а також хворим на ожиріння і метаболічний синдром [34].
Ліпофарм — додаткове джерело лікувально–профілактичного призначення
Препарати АЛК і КоQ10 є додатковим джерелом лікувально–профілактичного призначення для періодичного, тривалого або невизначено довгого застосування. Без сумніву, альфа–ліпоєва кислота та коензим Q10 займають значне місце в лікуванні та профілактиці метаболічних захворювань, їх властивості максимально наближені до універсальних лікувальних компонентів.
Пріоритетність використання їх як особливих компонентів терапії обумовлена не тільки доведеною високою клінічною ефективністю. АЛК і коензим Q10 за своїми властивостями є потужними ендогенними й екзогенними антиоксидантами [22, 28, 45].
В Україні комбінація альфа–ліпоєвої кислоти та коензиму Q10 представлена вітчизняним комплексом Ліпофарм від компанії «Фармаком». Ліпофарм розглядають як один із вельми цікавих і перспективних засобів лікувальної та профілактичної спрямованості при низці захворювань, розвиток яких пов’язаний з окиснювальним стресом (рис. 3).
Потенційні вигоди застосування препаратів на основі АЛК і КоQ10, продемонстровані в експериментальних і клінічних дослідженнях, свідчать про те, що спектр патологічних станів, при яких доцільне застосування цього природного антиоксиданту, найближчим часом може бути значно розширений. Ліпофарм, будучи природним антиоксидантом, впливає на клітинний метаболізм на різних рівнях. Висока ефективність, добра переносимість, відсутність або мала вираженість побічних ефектів є факторами, що визначають вибір антиоксидантів у комплексному лікуванні хворих із КВЗ, хронічними захворюваннями печінки, цукровим діабетом, при різних інтоксикаціях і на тлі метаболічних факторів ризику [2, 4, 16, 19, 27, 30].
Конфлікт інтересів. Не заявлений.
1. Антонова К.Б., Недосугова А.В. Роль и место тиоктовой кислоты в комплексной терапии сахарного диабета. Трудный пациент. 2008. № 6. С. 17–22.
2. Аромов Д.М. Применение коэнзима Q10 в кардиологической практике. РМЖ. 2004. № 12(15). С. 905–909.
3. Белая О.Л. Опыт применения коэнзима Q10 в комплексной терапии ишемической болезни сердца с дислипидемией. Клиническая медицина. 2006. № 5. С. 59–62.
4. Бустаманте Д., Лодж Д., Маркоччи Л. Метаболизм α–липоевой кислоты при различных формах патологии. Международный мед. журн. 2001. № 2. С. 133–41.
5. Воробьева О.В. Тиоктовая (альфа–липоевая) кислота — спектр клинического применения. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011. Т. 111. № 10. С. 86–90.
6. Ключников С.О., Гнетнева Е.С. Убихинон (Коэнзим Q10): теория и клиническая практика. Педиатрия. 2008. Т. 87. № 3. С. 103–110.
7. Корпачев В.В., Щербак А.В. Тиоктовая кислота: проблемы и перспективы. Вісник фамакології та фармації. 2003. № 3. С. 20–28.
8. Корнякова В.В., Конвай В.Д., Степанова И.П. Перспективы применения альфа–липоевой кислоты при оксидативном стрессе. Международный журнал прикладных и фундаментальных исследований. 2017. № 11–1. С. 63–67.
9. Лукьянчук В.Д., Немятых О.Д. Современный взгляд на фармакологию альфа–липоевой кислоты. Журнал практич. лікаря. 2003. № 3. С. 61–64.
10. Маев И.В., Дичева Д.Т., Андреев Д.Н. Роль тиоктовой (α–липоевой) кислоты в терапии неалкогольной жировой болезни печени. Гастроэнтерология. 2011. № 2. С. 52–57.
11. Маньковский Б.Н. Диабетическая полинейропатия и α–липоевая кислота: нюансы терапии в свете доказательной медицины. Здоров’я України. 2010. № 2. С. 20–21.
12. Недосугова А.В. Альфа–липоевая кислота в комплексном лечении диабетической нейропатии. Международный мед. журнал. 2007. № 2. С. 49–51.
13. Степанов Ю.М., Філіппова О.Ю. Еволюція уявлень про неалкогольну жирову хворобу печінки: від ризику до катастрофи. Запорожский медицинский журнал. 2020. № 2(119). С. 267–275. DOI: 10.14739/2310–1210.2020.2.200637.
14. Строков И.А., Ахметжанова Л.Т., Солоха О.А. Эффективность лечения диабетической полиневропатии таблетированной формой альфа–липоевой кислоты. Трудный пациент. 2010. № 8(3). С. 17–21.
15. Чапидзе Г.Э., Капанадзе Н.К., Долидзе Н.К. Комбинированная терапия антиоксидантом Q10 и симвастатином больных коронарным атеросклерозом. Кардиология. 2006. № 8. С. 11–13.
16. Чуканова Е.И., Чуканова А.С. Применение антиоксидантных препаратов в комплексной патогенетической терапии сосудистых когнитивных нарушений. РМЖ. 2014. № 10. С. 759–761.
17. Чуканова Е.И., Чуканова А.С. Альфа–липоевая кислота в лечении диабетической полинейропатии. Журнал неврологии и психиатрии. 2018. № 1. С. 103–109. https://doi.org/10.17116/jnevro201811811103–109
18. Щербак А.В. Мультифакторные эффекты альфа–липоевой (тиоктовой) кислоты в патогенетической терапии диабетической полинейропатии и других патологических состояний. Ліки. 2001. № 1. С. 45–56.
19. Agathos E., Tentolouris A., Eleftheriadou I. Effect of α–lipoic acid on symptoms and quality of life in patients with painful diabetic neuropathy. Int. Med. Res. 2018. Vol. 46(5). P. 1779–1790. doi: 10.1177/0300060518756540.
20. Atukeren P., Aydin S., Uslu E. Redox homeostasis of albumin in relation to alpha–lipoic acid and dihydrolipoic acid. Oxid. Med. Cell Longev. 2010. Vol. 3 (3). P. 206–213.
21. Bartkoski S., Day M. Alpha–Lipoic Acid for Treatment of Diabetic Peripheral Neuropathy. Am. Fam. Physician. 2016. Vol. 1. № 93(9). Р. 786.
22. Bast A., Haenen G.R. Lipoic acid: a multifunctional antioxidant. Biofactors. 2003. Vol. 17 (1–4). P. 207–213.
23. Berthold H., Naini A., Di Mauros et al. Effect of ezetimibe and/or simvastatin on coenzyme Q10 levels in plasma: a randomised trial. Drug Saf. 2006. Vol. 29(8). Р. 703–712.
24. Bitar M.S., Ayed A.K., Abdel–Halim S.M. et al. Inflammation and apoptosis in aortic tissues of aged type II diabetes: amelioration with α–lipoic acid through phosphatidylinositol 3–kinase. Akt–dependent mechanism. Life Sci. 2010. Vol. 86. P. 844–853.
25. Goraca A., Huk–Kolega H., Piechota A. Lipoic acid — biological activity and therapeutic potential. Pharmacological Reports. 2011. Vol. 63. P. 849–858.
26. Haas R. The evidence basis for coenzyme Q10 therapy in oxidative phosphorylation disease. Mitochondrion. 2007. № 7. Suppl. Р. 136–145.
27. Khatta M., Alexander B., Krichten C. The effect of coenzyme Q10 in patients with congestive heart failure. Ann. Intern. Med. 2000. Vol. 132. Р. 636–640.
28. Littaru G., Tiano L. Bioenergetic and antioxidant pro–perties of coenzyme Q10: recent developments. Mol. Biotechnol. 2007. Vol. 37(1). Р. 31–37.
29. Padmalayam I., Hasham S., Saxena U., Pillarisetti S. Lipoic acid synthase (LASY): a novel role in inflammation, mitochondrial function, and insulin resistance. Diabetes. 2009. Vol. 58. P. 600–608.
30. Papanas N., Ziegler D. Efficacy of α–lipoic acid in diabetic neuropathy. Expert Opin. Pharmacother. 2014. Vol. 15(18). Р. 2721–31. doi: 10.1517/14656566.2014.972935.
31. Park K.G., Min A.K., Koh E.H. Alpha–lipoic acid decreases hepatic lipogenesis through adenosine monophosphate–activated protein kinase (AMPK)–dependent and AMPK–independent pathways. Hepatology. 2008. Vol. 48. P. 1477–1486.
32. Park S., Karunakaran U., Jeoung N.H. Physiological effect and therapeutic application of alpha lipoic acid. Curr. Med. Chem. 2014. Vol. 21(32). Р. 3636–45. doi: 10.2174/0929867321666140706141806.
33. Patel M.K., Riley M.A., Hobbs S. Can α–lipoic acid mitigate progression of aging–related decline caused by oxidative stress? South Med. J. 2014. Vol. 107(12). Р. 780–7. doi: 10.14423/SMJ.0000000000000198.
34. Playford D.A., Watts G.F., Croft K.D. Combined effect of coenzyme Q10 and fenofibrate on forearm microcirculatory function in type 2 diabetes. Atherosclerosis. 2003. Vol. 168.P. 169–179.
35. Rochette L., Ghibu S., Muresan A. Alpha–lipoic acid: molecular mechanisms and therapeutic potential in diabetes. Can. J. Physiol. Pharmacol. 2015. Vol. 93(12). Р. 1021–7. doi: 10.1139/cjpp–2014–0353.
36. Sander S., Coleman C., Patel A. The impact of coenzyme Q10 on systolic function in patients with chronic heart failure. J. Card. Fail. 2006. Vol. 12(6). Р. 464–472.
37. Sandor P., Clemente L., Conpola G. Efficacy of coenzyme Q10 in migraine prophylaxis. A randomized controlled trial. Neurology. 2005. Vol. 64. Р. 713–715.
38. Shay K.P., Moreau R.F., Smith E.J. Alpha–lipoic acid as a dietary supplement: molecular mechanisms and therapeutic potential. Biochim. Biophys. Acta. 2009. Vol. 1790 (10). P. 1149–1160.
39. Szeląg M., Mikulski D., Molski M. Quantum–chemical investigation of the structure and the antioxidant properties of α–lipoic acid and its metabolites. J. Mol. Model. 2012. Vol. 18 (7). P. 2907–2916.
40. Tiano L., Bellardinelli R., Carnevali P. Effect of coenzyme Q10 administration on endothelial function and extracellular superoxide dismutase in patients with ischaemic heart disease: a double–blind, randomized controlled study. Eur. Heart J. 2007. Vol. 28(18). Р. 2249–2255.
41. Watts G.F., Playford D.A., Croft K.D. Coenzyme Q10 improves endothelial dysfunction of the brachial artery in type II diabetes mellitus. Diabetologia. 2002. Vol. 45. P. 420–426.
42. Wollin S.D., Jones P.J. Alpha–lipoic acid and cardiovascular disease. J. Nutr. 2003. Vol. 133 (11). P. 3327–3330.
43. Ziegler D., Hanefeld M., Ruchan K. ALADIN Study–group. Treatment of symptomatic diabetic peripheral neuropathy with antioxidant alpha–lipoic acid. Diabetologia. 1995. Vol. 38. Р. 1425–1433.
44. Ziegler D. et al. Alpha–lipoic acid in the treatment diabetic polyneuropathy in Germany: current evidence from clinical trials. Exp. Clin. Endocrinol. Diabetes. 1999. Vol. 107. Р. 421–430.
45. Zinnane A., Eastwood H. Coenxyme Q10 — Antoxidant. Redox Mitochondrion. 2004. P. 1–11.
46. Zittarru G., Zangsjoen P. Coenzyme Q10 and statins: biochemical and clinical implications. Mitochondrion. 2007. Vol. 7. Suppl. S 168–174.

/27-1.jpg)
/30-1.jpg)