Журнал «Боль. Суставы. Позвоночник» Том 10, №3, 2020
Вернуться к номеру
Ревматическая полимиалгия: объединяя усилия европейских ревматологических обществ
Авторы: Пузанова О.Г.(1), Мошковская Ю.О.(2), Соболь В.О.(2)
(1) — Киевский медицинский университет, г. Киев, Украина
(2) — Национальный медицинский университет имени А.А. Богомольца, г. Киев, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Постаріння популяції є передумовою зміцнення доказової бази специфічних геріатричних синдромів, ревматичних захворювань з пізнім дебютом і ревматичних хвороб похилого віку. Серед останніх найпоширенішою є ревматична поліміалгія, наявність і ведення якої пов’язане з проблемами переносимості знеболювальної та протизапальної терапії і вчасного виявлення гігантоклітинного артеріїту та злоякісних пухлин. В Європі, зокрема в німецькомовних країнах, зберігаються суттєві відмінності в підходах до ведення пацієнтів з ревматичною поліміалгією в клінічній практиці. Цим обумовлено створення й видання 2018 року єдиних настанов Німецького ревматологічного товариства, Австрійського товариства ревматології і реабілітації, Швейцарського ревматологічного товариства та інших науково-медичних асоціацій і організацій, присвячених даній проблемі. У статті наведено та обговорено їх доказову базу, основні принципи та спеціальні рекомендації. Розробку співставлено з настановами Європейської антиревматичної ліги та Американської колегії ревматологів 2015 року і клінічною настановою Фінської медичної асоціації, яку було схвалено Міністерством охорони здоров’я України для використання в первинній ланці як новий клінічний протокол 2016 року.
Постарение популяции является предпосылкой усиления доказательной базы специфических гериатрических синдромов, ревматических заболеваний с поздним дебютом и ревматических болезней пожилого возраста. Среди последних наиболее распространена ревматическая полимиалгия, наличие и ведение которой сопряжено с проблемами переносимости обезболивающей и противовоспалительной терапии и своевременного выявления гигантоклеточного артериита и злокачественных опухолей. В Европе, в немецкоязычных странах в частности, сохраняются значительные различия в подходах к ведению пациентов с ревматической полимиалгией в клинической практике. Этим обусловлено создание и публикация в 2018 году единого руководства Немецкого ревматологического общества, Австрийского общества ревматологии и реабилитации, Швейцарского ревматологического общества и других научно-медицинских ассоциаций и организаций, посвященного данной проблеме. В статье представлены и обсуждены его доказательная база, основные принципы и специальные рекомендации. Разработка сопоставлена с рекомендациями Европейской антиревматической лиги и Американской коллегии ревматологов 2015 года и клинической рекомендацией Финской медицинской ассоциации, одобренной Министерством здравоохранения Украины для применения в первичном звене в качестве нового клинического протокола в 2016 году.
Population’s ageing is a prerequisite for a strengthened evidence base of the specific geriatric syndromes, late-onset rheumatic diseases, and rheumatic diseases of the elderly. Among the latter, the most common is polymyalgia rheumatic whose presence and management are associated with the issues of tolerance to analgesics and anti-inflammatory medications and timely diagnosis of giant cell arteritis and malignancies. In Europe, namely in the German-speaking countries, there is a significant heterogeneity in the approaches to the polymyalgia rheumatica management persisting in the clinical practice. That is why the guidelines of the German Society of Rheumatology, the Austrian Society of Rheumatology and Rehabilitation, the Swiss Society of Rheumatology, and participating expert medical-research societies and other organizations delving in this problem, were elaborated and published in 2018. Its evidence base, overarching principles and specific recommendations are presented and discussed in the article. The guidelines are compared with the 2015 European League Against Rheumatism’s and the American College of Rheumatology’s recommendations for the management of polymyalgia rheumatica, and the Finnish Medical Association’s guidelines recommended by the Ministry of Health of Ukraine for use in primary care as a new clinical protocol in 2016.
ревматична поліміалгія; лікування; стандарти; огляд
ревматическая полимиалгия; лечение; стандарты; обзор
polymyalgia rheumatica; treatment; standards; review
Введение
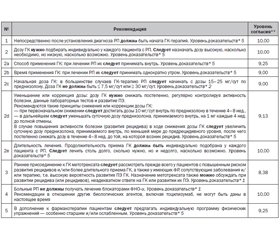
Рекомендации DGRh/ÖGR/SGR (2018) по ведению РП
Заключение
- Бекетова Т.В., Сатыбалдыев А.М., Денисов Л.Н. Международные рекомендации по ведению больных гигантоклеточным артериитом и ревматической полимиалгией: итоги 2015 года. Научно-практическая ревматология. 2016. 54(4). 390-394. doi: 10.14412/1995-4484-2016-390-394.
- Головач И.Ю. Основные принципы новых диагностических критериев (2012) и рекомендаций ACR/EULAR 2015 по менеджменту и лечению ревматической полимиалгии. Укр. ревматологічний журнал. 2016. 2(64). 3-7.
- Сатыбалдыев А.М. Эволюция диагностики ревматической полимиалгии. Научно-практическая ревматология. 2019. 57(6). 693-698. doi: 10.14412/1995-4484-2019-693-698.
- Dasgupta B., Cimmino M.A., Maradit-Kremers H. et al. 2012 provisional criteria for polymyalgia rheumatica: a European League Against Rheumatism / American College of Rheumatology collaborative initiative. Ann. Rheum. Dis. 2012. 71. 484-492. doi: 10.1136/annrheumdis-2011-200329.
- Dejaco C., Singh Y.P., Perel P. et al.; European League Against Rheumatism; American College of Rheumatology. 2015 Recommendations for the management of polymyalgia rheumatica: a European League Against Rheumatism / American College of Rheumatology collaborative initiative. Ann. Rheum. Dis. 2015. 74. 1799-1807. doi: 10.1136/annrheumdis-2015-207492.
- Buttgereit F., Brabant T., Dinges H. et al. S3-Leitlinie zur Behandlung der Polymyalgia rheumatica. Evidenzbasierte Leitlinie der Deutschen Gesellschaft für Rheumatologie (DGRh), der Österreichischen Gesellschaft für Rheumatologie und Rehabilitation (ÖGR) und der Schweizerischen Gesellschaft für Rheumatologie (SGR) und der beteiligten medizinisch-wissenschaftlichen Fachgesellschaften und weiterer Organisationen. Z. Rheumatol. 2018. 77(5). 429-441. doi: 10.1007/s00393-018-0476-8.
- Buttgereit F., Dejaco C., Matteson E.L., Dasgupta B. Polymyalgia rheumatica and giant cell arteritis: a systematic review. JAMA. 2016. 315(22). 2442-2458. doi: 10.1001/jama.2016.5444.
- Dejaco C., Matteson E.L., Buttgereit F. Diagnostics and treatment of polymyalgia rheumatica. Z. Rheumatol. 2016. 75(7). 687-700. doi: 10.1007/s00393-016-0105-3.
- Dejaco C., Duftner C., Buttgereit F. et al. The spectrum of giant cell arteritis and polymyalgia rheumatica: revising the concept of the disease. Rheumatology (Oxford). 2017. 56(4). 506-515. doi: 10.1093/rheumatology/kew273.
- Hellmich B. Management der Polymyalgia rheumatica und der Großgefäßvaskulitiden. Internist (Berl.). 2016. 57(11). 1069-1078. doi: 10.1007/s00108-016-0131-x.
- Leung J.L., Owen C.E., Buchanan R.R.C., Liew D.F.L. Management of polymyalgia rheumatica. J. Pharm. Pract. Res. 2019. 49(5). doi: 10.1002/jppr.1610.
- Mackie S.L., Dejaco C., Appenzeller S. et al. British Society for Rheumatology guidelines on diagnosis and treatment of giant cell arteritis. Rheumatology. 2020. 59(3). Е1-Е23. doi: 10.1093/rheumatology/kez672.
- Matteson E.L., Buttgereit F., Dejaco C., Dasgupta B. Glucocorticoids for Management of Polymyalgia Rheumatica and Giant Cell Arteritis. Rheum. Dis. Clin. North Am. 2016. 42(1). 75-90. doi: 10.1016/j.rdc.2015.08.009.
- Matteson E.L., Dejaco C. Polymyalgia rheumatica. Ann. Intern. Med. 2017. 166(9). ITC65-ITC80. doi: 10.7326/AITC201705020.
- Muratore F., Pazzola G., Pipitone N., Salvarani C. Recent advances in the diagnosis and treatment of polymyalgia rheumatica. Exp. Rev. Clin. Immunol. 2016. 12(10). 1037-1045. doi: 10.1080/1744666X.2016.1178572.
- Yurdakul F.G., Bodur H., Sivas F. et al. Clinical features, treatment and monitoring in patients with polymyalgia rheumatica. Arch. Rheumatol. 2015. 30(1). 28-33. doi: 10.5606/Arch Rheumatol.2015.4643.
- Москаленко В.Ф., Пузанова О.Г. Впровадження програми розробки національних клінічних керівництв у Німеччині. Науковий вісник Національного медичного університету імені О.О. Богомольця. 2010. 2(29). 48-55. URL: http://www.irbis-nbuv.gov.ua/cgi-bin/irbis_nbuv/cgiirbis_64.exe?C21COM=2&I21DBN=UJRN&P21DBN=UJRN&IMAGE_FILE_DOWNLOAD=1&Image_file_name=PDF/nvnmu_2010_2_8.pdf.
- Lally L., Forbess L., Hatzis C., Spiera R. Brief Report: A prospective open-label phase IIa trial of tocilizumab in the treatment of polymyalgia rheumatica. Arthritis Rheumatol. 2016. 68(10). 2550-2554. doi: 10.1002/art.39740.
- Hancock A.T., Mallen C.D., Muller S. et al. Risk of vascular events in patients with polymyalgia rheumatica. CMAJ. 2014. 186(13). Е495-Е501. doi: 10.1503/cmaj.140266.
- Naschitz J.E., Slobodin G., Yeshurun D. et al. A polymyalgia rheumatica-like syndrome as presentation of metastatic cancer. J. Clin. Rheumatol. 1996. 2(6). 305-308.
- Naschitz J.E., Slobodin G., Yeshurun D. et al. Atypical polymyalgia rheumatica as a presentation of metastatic cancer. Arch. Intern. Med. 1997. 157(20). 2381.
- Bellan M., Boggio E., Sola D., Gibbin A., Gualerzi A., Favretto S., Guaschino G., Bonometti R., Pedrazzoli R., Pirisi M., Sainaghi P.P. Association between rheumatic diseases and cancer: results from a clinical practice cohort study. Intern. Emerg. Med. 2017. 12(5). 621-627. doi: 10.1007/s11739-017-1626-8.
- Dasgupta B., Dolan A.L., Panayi G.S., Fernandes L. An initially double-blind controlled 96 week trial of depot methylprednisolone against oral prednisolone in the treatment of polymyalgia rheumatica. Br. J. Rheumatol. 1998. 37(2). 189-195. PMID: 9569075.
- Cutolo M., Hopp M., Liebscher S. et al. Modified-release prednisone for polymyalgia rheumatica: a multicentre, randomized, active-controlled, double-blind, parallel-group study. Rmd. Open. 2017. 3(1). Е000426. doi: 10.1136/rmdopen-2016-000426.
- Van der Goes M.C., Jacobs J.W., Boers M. et al. Monitoring adverse events of low-dose glucocorticoid therapy: EULAR recommendations for clinical trials and daily practice. Ann. Rheum. Dis. 2010. 69(11). 1913-1919. doi: 10.1136/ard.2009.124958.
- Miloslavsky E.M., Naden R.P., Bijlsma J.W. et al. Development of a Glucocorticoid Toxicity Index (GTI) using multicriteria decision analysis. Ann. Rheum. Dis. 2017. 76(3). 543-546. doi: 10.1136/annrheumdis-2016-210002.
- Dachverband Osteologie. DVO guidelines 2009 for prevention, diagnosis and therapy of osteoporosis in adults. Osteologie. 2011. 20. 55-74.
- Prophylaxe, Diagnostik und Therapie der Osteoporose bei Männer ab dem 60. Lebensjahr und bei postmenopausalen Frauen. Leitlinie des Dachverbands der Deutschsprachigen Wissenschaftlichen Osteologischen Gesellschaften e.V. 2014. Kurzfassung und Langfassung. URL: www.dv-osteologie.org/uploads/Leitlinie%202014/Leitlinie%20Osteoporose%202014%20Kurzfassung%20und%20Langfassung%20Version%201a%2012%2001%202016.pdf.
- Ayoub W.T., Franklin C.M., Torretti D. Polymyalgia rheumatica. Duration of therapy and long-term outcome. Am. J. Med. 1985. 79(3). 309-315.
- Cimmino M.A., Parodi M., Caporali R., Montecucco C. Is the course of steroid-treated polymyalgia rheumatica more severe in women? Ann. N.Y. Acad. Sci. 2006. 1069. 315-321.
- Barraclough K., Liddell W.G., du Toit J. et al. Polymyalgia rheumatica in primary care: a cohort sudy of the diagnostic criteria and outcome. Fam. Pract. 2008. 25(5). 328-333. doi: 10.1093/fampra/cmn044.
- Cantini F., Salvarani C., Olivieri I. et al. Erythrocyte sedimentation rate and C-reactive protein in the evaluation of disease activity and severity of polymyalgia rheumatica: a prospective follow-up study. Semin. Arthritis Rheum. 2000. 30(1). 17-24.
- Gonzalez-Gay M.A., Rodriguez-Valverde V., Blanco R. et al. Polymyalgia rheumatica without significantly increased erythrocyte sedimentation rate. A more benign syndrome. Arch. Intern. Med. 1997. 157(3). 317-320.
- Kremers H.M., Reinalda M.S., Crowson C.S. et al. Relapse in a population based cohort of patients with polymyalgia rheumatica. J. Rheumatol. 2005. 32(1). 65-73.
- Lee J.H., Choi S.T., Kim J.S. et al. Clinical characteristics and prognostic factors for relapse in patients with polymyalgia rheumatica (PMR). Rheumatol. Int. 2013. 33(6). 1475-1480. doi: 10.1007/s00296-012-2580-4.
- Myklebust G., Gran J.T. Prednisolone maintenance dose in relation to starting dose in the treatment of polymyalgia rheumatica and temporal arteritis. A prospective two-year study in 273 patients. Scand. J. Rheumatol. 2001. 30(5). 260-267.
- Salvarani C., Cantini F., Macchioni P. et al. Distal musculoskeletal manifestations in polymyalgia rheumatica: a prospective followup study. Arthritis Rheum. 1998. 41(7). 1221-1226.
- Наказ МОЗ України «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України» № 751 від 28.09.2012 (Із змінами, внесеними згідно з наказами Міністерства охорони здоров’я України № 1422 від 29.12.2016, № 1752 від 26.09.2018). URL: https://zakon.rada/gov.ua/laws/show/z2001-12. Accessed: 14.03.2020.
- Настанова 01095. Ревматична поліміалгія / Настанови на засадах доказової медицини, cтворені DUODECIM Medical Publications, Ltd. Адаптовані для України групою експертів МОЗ України. URL: https://guidelines.moz.gov.ua/documents/3811.

/20.jpg)
/21.jpg)