Журнал «Травма» Том 21, №6, 2020
Вернуться к номеру
Инструментальные и биохимические показатели состояния костной ткани при остеомаляции и остеопорозе
Авторы: Игнатьев А.М., Турчин Н.И.
Одесский национальный медицинский университет, г. Одесса, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
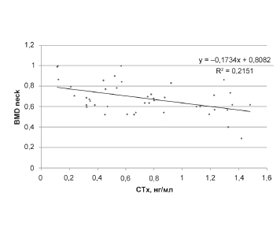
Актуальність. Зниження мінеральної щільності кісткової тканини (МЩКТ), що виникає при остеомаляції (ОМ) й остеопорозі (ОП), супроводжується зменшенням міцності кісткових структур і зростанням ризику переломів. Незважаючи на однаковий клінічний результат (переломи), морфоструктурні, етіологічні та патогенетичні характеристики ОП і ОМ якісно розрізняються. Мета дослідження: вивчити діагностичні критерії остеомаляції й остеопорозу в постменопаузі. Матеріали та методи. Обстежено 157 пост-менопаузальних (ПМ) жінок віком 57,5 ± 1,2 року, серед яких у 103 був діагностований ОП (група І) та у 24 морфометрично був встановлений діагноз остеомаляції (ОМ) (група ІІ), контрольну групу (III) становили 30 практично здорових жінок. Проведена рентгенівська денситометрія (остеоденситометр Hologic Discovery, США). Рівень 25(ОН)D у сироватці крові визначали імуноферментним методом на аналізаторі EUROIMMUN (Німеччина). Маркер резорбції КТ С-термінальний телопептид колагену 1-го типу (СТх), остеокальцин (ОК) і паратгормон (ПТГ) — імунохемілюмінесцентним методом, рівень фосфору — спектрофотометричним методом на аналізаторі Cobas 6000 (Roche Diagnostics, Швейцарія). Рівень остеопротегерину (ОПГ) визначали методом імуноферметного аналізу на апараті AxsymSystem (Abbot, Німеччина). Статистичну обробку проводили за допомогою прикладних програм Microsoft Office Excel і Statistica 10.0. Для математичної обробки використовували t-критерій Стьюдента. При оцінці сили зв’язку коефіцієнтів кореляції використовували шкалу Чеддока. Результати. Аналіз отриманих даних показав зниження МЩКТ (р < 0,05) в І та ІІ групах. Проте BMD neck, Т-критерій neck, Z-критерій neck у групі жінок з ОМ були значуще зниженими (р < 0,05) порівняно з групою осіб з ОП. Рівні 25(ОН)D, ОК, ОПГ були також зниженими (р < 0,05) у ІІ групі жінок порівняно з І групою. Були отримані більш високі (р < 0,05) показники ПТГ і СТх у групі пацієнток з ОМ порівняно з групою з ОП. Кореляційний аналіз отриманих результатів показав зв’язок рівня 25(ОН)D з показниками структурно-функціональних змін КТ: 25(ОН)D і СТх (r = –0,669; р = 0,001), 25(ОН)D і BMD neck (r = 0,736; р = 0,002). Також виявлений прямий зв’язок між BMD neck і СТх (r = –0,463; р = 0,002). Висновки. У ПМ жінок з ОМ порівняно з ПМ жінками з ОП виявлені значуще більші (р < 0,05) зміни структурно-функціонального стану КТ, біохімічних маркерів резорбції та ремоделювання КТ, а також більш низький (р < 0,05) рівень 25(ОН)D. Уміст 25(ОН)D має високу інформативність щодо прогнозування та діагностики зниження МЩКТ і ризику переломів. Біохімічний маркер резорбції СТХ має високу інформативність щодо прогнозування, своєчасної діагностики й ефективності лікування зниження МЩКТ.
Актуальность. Снижение минеральной плотности костной ткани (МПКТ), возникающее при остеомаляции (ОМ) и остеопорозе (ОП), сопровождается уменьшением прочностных свойств костных структур и ростом риска переломов. Несмотря на одинаковый клинический исход (переломы), морфоструктурные, этиологические и патогенетические характеристики ОП и ОМ качественно различаются. Цель исследования: изучить диагностические критерии остеомаляции и остеопороза в постменопаузе. Материалы и методы. Обследовано 157 постменопаузальных (ПМ) женщин в возрасте 57,5 ± 1,2 года, у 103 из которых был диагностирован ОП (группа І) и у 24 морфометрически был установлен диагноз остеомаляции (ОМ) (группа ІІ), контрольную группу (III) составляли 30 практически здоровых женщин. Проведена рентгеновская денситометрия (остеоденситометр Hologic Discovery (USA)). Уровень 25(ОН)D в сыворотке крови определяли иммуноферментным методом на анализаторе EUROIMMUN (Германия). Маркер резорбции КТ С-терминальный телопептид коллагена 1-го типа (СТх), остеокальцин (ОК) и паратгормон (ПТГ) — иммунохемилюминесцентным методом, уровень фосфора — спектрофотометрическим методом на анализаторе Cobas 6000 (Roche Diagnostics, Швейцария). Уровень остеопротегерина (ОПГ) определяли методом иммуноферментного анализа на аппарате AxsymSystem (Abbot, Германия), статистическую обработку проводили с помощью прикладных программ Microsoft Office Excel и Statistica 10.0. Для математической обработки использовали t-критерий Стьюдента. При оценке силы связи коэффициентов корреляции использовали шкалу Чеддока. Результаты. Анализ полученных данных показал снижение МПКТ (р < 0,05) в І и ІІ группах. Однако BMD neck, Т-критерий neck, Z-критерий neck в группе женщин с ОМ были значимо снижены (р < 0,05) в сравнении с группой с ОП. Уровни 25(ОН)D, ОК, ОПГ были также снижены (р < 0,05) во ІІ группе женщин по сравнению с І группой. Были получены более высокие (р < 0,05) показатели ПТГ и СТх в группе пациенток с ОМ в сравнении с группой лиц с ОП. Корреляционный анализ полученных результатов показал связь уровня 25(ОН)D с показателями структурно-функциональных изменений КТ: 25(ОН)D и СТх (r = –0,669; р = 0,001), 25 (ОН)D и BMD neck (r = 0,736; р = 0,002). Также выявлена прямая связь между BMD neck и СТх (r = –0,463; р = 0,002). Выводы. У ПМ женщин с ОМ в сравнении с ПМ женщинами с ОП выявлены значимо большие (р < 0,05) изменения структурно-функционального состояния КТ, биохимических маркеров резорбции и ремоделирования КТ, а также более низкий (р < 0,05) уровень 25(ОН)D. Содержание 25(ОН)D обладает высокой информативностью в плане прогнозирования и диагностики снижения МПКТ и риска переломов. Биохимический маркер резорбции СТх обладает высокой информативностью в плане прогнозирования, своевременной диагностики и эффективности лечения снижения МПКТ.
Background. A decrease in bone mineral density (BMD), which occurs in osteomalacia (OM) and osteoporosis (OP), is accompanied by a decrease in the strength properties of bone structures and an increase in the risk of fractures. Despite the same clinical outcome (fractures), the morphostructural, etiological, and pathogenetic characteristics of OP and OM differ qualitatively. The purpose of our work was to study the diagnostic criteria for osteomalacia and osteoporosis in postmenopausal women. Materials and methods. We examined 157 postmenopausal (PM) women aged 57.5 ± 1.2 years, of which 103 women were diagnosed with OP (group I) and 24 were morphometrically diagnosed with osteomalacia (group II), control group (III) included 30 apparently healthy women. X-ray densitometry was performed (osteodensitometer Hologic Discovery (USA)). The blood serum level of 25(OH)D was determined by the enzyme immunoassay on a EUROIMMUN analyzer (Germany). Bone resorption marker C-terminal telopeptide of collagen type 1 (CTx), osteocalcin (OC), and parathyroid hormone (PTH) were assessed by the immunochemiluminescent assay, phosphorus level — by spectrophotometric method using a Cobas 6000 analyzer (Roche Diagnostics, Switzerland). The level of osteoprotegerin (OPG) was determined by enzyme-linked immunosorbent assay on an Axsym analyzer (Abbot, Germany). Statistical processing was performed using Microsoft Office Excel and Statistica 10.0 software. Student’s t-test was used for mathematical processing. When assessing the strength of the correlation coefficients, the Chaddock scale was used. Results. The analysis of the data obtained showed a decrease in BMD (p <0.05) in groups I and II. However, BMD neck, T-test neck, Z-test neck in the group of women with OM were significantly reduced (p < 0.05) in comparison with the group with OP. The levels of 25(OH)D, OC, OPG were also reduced (p < 0.05) in the second group of women compared with the first group. We obtained higher (p < 0.05) indices of PTH and CTx in the group of patients with OM in comparison with the group with OP. The correlation analysis of the obtained results showed a relationship between the level of 25(OH)D and indicators of structural and functional changes in BMD: 25(OH)D and CTx (r = –0.669; p = 0.001), 25(OH)D and BMD neck (r = 0.736; p = 0.002). There was also a direct relationship between BMD neck and CTx (r = –0.463; p = 0.002). Conclusions. The PM women with OM, in comparison with the PM women with OP, developed significantly larger (p < 0.05) changes in the structural and functional state of bone tissue, biochemical markers of bone tissue resorption and remodeling, as well as lower (p < 0.05) level of 25(OH)D. The 25(OH)D level is highly informative in terms of predicting and diagnosing a decrease in BMD and the risk of fractures. The biochemical marker of CTx resorption has a high informative value in terms of predicting, timely diagnosis, and the effectiveness of the treatment.
постменопауза; остеопороз; остеомаляція; діагностика
постменопауза; остеопороз; остеомаляция; диагностика
postmenopausal; osteoporosis; osteomalacia; diagnosis

/23.jpg)
/24.jpg)