Введение
Распространенность артериальной гипертензии (АГ) среди взрослого населения составляет 30–45 %, а среди лиц старше 60 лет достигает 60 % [1]. К сожалению, в настоящее время, несмотря на широкий выбор антигипертензивных препаратов, менее 50 % пациентов, которые принимают терапию, достигают показателей офисного систолического артериального давления (САД) ниже 140 мм рт. ст. [1, 2]. Уровень САД ≥ 140 мм рт. ст. ассоциирован с развитием смертности и инвалидности в ~70 % случаев, при этом наибольшее число смертей в течение года, связанных с уровнем САД, происходит вследствие ишемической болезни сердца (4,9 млн), геморрагических (2,0 млн) и ишемических инсультов (1,5 млн) [3]. Как офисные, так и внеофисные значения АД имеют независимую и непрерывную взаимосвязь с частотой инсульта, инфаркта миокарда, внезапной смерти, сердечной недостаточности, заболеваний периферических артерий, фибрилляции предсердий, а также с терминальной почечной недостаточностью, когнитивной дисфункцией и деменцией [4–7]. Результаты как предыдущих, так и недавних метаанализов указывают, что снижение САД ниже 140 мм рт. ст. способствует уменьшению относительного риска всех сердечно-сосудистых событий (включая смертность); аналогичный положительный эффект наблюдался при снижении САД ниже 130 мм рт. ст. [8]. Данные недавнего метаанализа показали, что при исходном уровне САД выше 160 мм рт. ст. его снижение на каждые 10 мм рт. ст. до 130–139 мм рт. ст. способствовало уменьшению частоты основных сердечно-сосудистых событий и смерти [9]. Установленный положительный эффект снижения САД до 130 мм рт. ст. послужил основанием для пересмотра его целевых значений у пациентов с АГ, что и отмечено в последних Европейских рекомендациях по лечению АГ (2018 г.) [10].
Согласно публикациям последних лет, D-гиповитаминоз имеют свыше 1 миллиарда людей в мире [11, 12], что подчеркивает неизбежно высокую коморбидность с АГ. Результаты нескольких метаанализов рандомизированных плацебо-контролируемых исследований продемонстрировали достоверное снижение как САД (–6,2 (–12,32; –0,04) мм рт. ст.), так и диастолического артериального давления (ДАД) (–3,1 (–5,5; –0,6) мм рт. ст.) у лиц с АГ при приеме препаратов витамина D по сравнению с плацебо [13–15]. Наибольший эффект в снижении САД (на 14 мм рт. ст. по сравнению с плацебо) получен на фоне однократного применения эргокальциферола в дозе 100 000 МЕ в плацебо-контролируемом исследовании [16]. Применение холекальциферола в дозе 2000 и 4000 МЕ/сут привело к снижению САД на 3,4 и 4,0 мм рт. ст. соответственно (р = 0,04) [14]. Несмотря на то что данные клинических исследований, оценивающих эффективность препаратов витамина D в снижении АД, неоднозначны, D-гиповитаминоз нуждается в коррекции. Учитывая, что применение холекальциферола дает возможность получения эффекта в снижении АД у пациентов с АГ, этот шанс следует использовать для повышения эффективности терапии обоих заболеваний.
Целью исследования был расчет затрат на снижение АД при комплексной антигипертензивной терапии АГ с приемом холекальциферола и без него.
Материалы и методы
Нами проведено проспективное контролируемое рандомизированное сравнительное одноцентровое клиническое исследование пациентов с эссенциальной АГ II степени. Верификацию диагноза АГ проводили согласно Европейским рекомендациям [17]. Критериями исключения из исследования были: симптоматическая АГ, наличие острой коронарной или цереброваскулярной патологии на момент обследования, острые воспалительные заболевания, хроническая сердечная недостаточность выше II ФК (NYHA), гемодинамически значимые нарушения ритма сердца, требующие постоянного приема противоаритмических препаратов, прием глюкокортикостероидов, саркоидоз, активная форма туберкулеза легких, бронхиальная астма, хроническая обструктивная болезнь легких, активный воспалительный процесс любой локализации, хроническая почечная недостаточность с клиренсом креатинина 60 мл/мин и ниже, нарушения функции печени, сахарный диабет, онкологические заболевания, анемия и другие тяжелые сопутствующие заболевания, способные оказывать влияние на исследуемые параметры. Протокол исследования был одобрен комитетом по биомедицинской этике ГрГМУ. По мере включения в исследование был сформирован алфавитный список из 154 пациентов. Каждому второму пациенту независимо от исходного уровня витамина D в крови в дополнение к антигипертензивной терапии был назначен витамин D в виде лекарственного средства холекальциферола в дозе 2000 МЕ/сут. Эти пациенты составили основную группу (АГ(+Х)). На протяжении 3 мес. холекальциферол принимали 78 человек, продолжили прием до 6 мес. 20 человек, и 9 пациентов продолжали принимать препарат в среднем 8,7 ± 2,1 мес. Группу сравнения (АГ(–Х)) составили пациенты, не принимавшие холекальциферол. Все пациенты обследовались при включении в исследование (исходно) и повторно минимум через 12 мес. и максимум через 18 мес. (в среднем через 15,4 ± 1,9 мес.). Полностью закончили участие в исследовании 78 пациентов группы АГ(+Х) и 76 больных из группы АГ(–Х).
Оценка обеспеченности организма витамином D проводилась по уровню общего витамина D (25(OH)D total) в сыворотке крови методом иммуноферментного анализа на базе научно-исследовательской лаборатории ГрГМУ с применением оригинальных реагентов DRG (Марбург, Германия). Уровень 25(OH)D в крови ниже 20 нг/мл расценивался как дефицит, 20–30 нг/мл — как недостаточность и 30–80 нг/мл — как оптимальный для организма.
Источником информации о ценах на лекарственные средства в Республике Беларусь послужила электронная база данных информационной службы «Фармасервис» (www.tabletka.by). Количество дней лечения рассчитывалось при условии, что пациенты принимали изучаемый препарат в количестве не менее 90 % от назначенной дозы (0,9) в течение 80 % дней в году (0,8) [18].
Для оценки затрат на комплексную антигипертензивную терапию с учетом приема холекальциферола и диуретика пациенты были разделены на четыре группы:
— группа D(–)Х(–) (n = 52) — не принимавшие ни диуретик в составе комбинированной антигипертензивной терапии, ни холекальциферол для коррекции уровня витамина D в организме;
— группа D(–)Х(+) (n = 47) — не принимавшие диуретик, но получавшие холекальциферол 2000 МЕ/сут ежедневно;
— группа D(+)Х(–) (n = 24) — не принимавшие холекальциферол, но получавшие диуретик в составе комбинированной антигипертензивной терапии;
— группа D(+)Х(+) (n = 31) — принимавшие и диуретик, и холекальциферол 2000 МЕ/сут.
Длительность приема холекальциферола составила в группе D(–)Х(+) 4,5 ± 2,3 мес., в группе D(+)Х(+) — 4,4 ± 2,2 мес. и не различалась между группами.
Статистическая обработка результатов осуществлялась с использованием программы Statistica 10.0. Данные представлены в абсолютных значениях, в процентах, в виде медианы (Me) и межквартильного размаха (Q25–Q75), а также в виде среднего значения и стандартного отклонения (M ± SD) в зависимости от характера их распределения (по критерию Шапиро — Уилка). Связь между переменными представлена значением корреляции Спирмена (R). Рассчитывался показатель «динамика» как разность значений после и до назначенной терапии. Нулевая гипотеза отвергалась на уровне значимости p < 0,05.
Результаты
На протяжении проспективного наблюдения все пациенты находились на комбинированной антигипертензивной терапии, прием препаратов и их средние дозы в группах АГ(–Х) и АГ(+Х) представлены в табл. 1, из которой видно, что по принимаемым препаратам группы не различались.
Группы АГ(–Х) и АГ(+Х) были сопоставимы по возрасту (51,1 ± 8,7 года и 52,0 ± 6,0 года соответственно), полу (59 женщин, 17 мужчин и 65 женщин, 13 мужчин соответственно), длительности АГ (5,0 (3,0–10,0) и 5,0 (3,0–10,0) года соответственно), индексу массы тела (31,2 (27,4–34,9) и 29,4 (25,8–33,0) кг/м2 соответственно) и уровню 25(ОН)D в крови (табл. 2).
Частота встречаемости дефицита, недостаточности, оптимального содержания витамина D в организме в группах исходно не различалась, как представлено на рис. 1.
При обследовании в конце наблюдения оптимальный уровень витамина D определялся у 83 % обследованных в группе АГ(+Х) чаще (p = 0,001), чем в группе АГ(–Х), и чаще (p = 0,00001) по сравнению с исходными данными. Дефицит витамина D в группе АГ(+Х) встречался реже (р = 0,0008), чем в группе АГ(–Х), и по сравнению с исходными данными (р < 0,00001). В группе АГ(+Х) недостаточность диагностирована реже по сравнению с исходными данными (р = 0,006), а между группами достоверно не различалась (р = 0,25). При повторном обследовании уровень 25(ОН)D в крови повысился в обеих группах по сравнению с его исходными значениями, но в группе АГ(+Х) стал достоверно выше (р = 0,0000001), чем в группе АГ(–Х). Динамика его прироста в группе АГ(+Х) была больше (р = 0,000005), чем в группе АГ(–Х) (табл. 2).
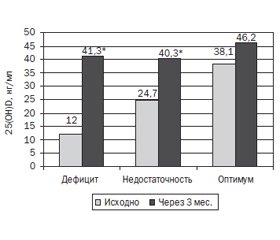
Через 3 мес. приема холекальциферола наибольший прирост 25(OH)D в сыворотке крови (27,8 (19,2–40,9) нг/мл) был у лиц с исходным дефицитом витамина D — 12,0 (8,1–16,3) нг/мл, и после терапии уровень 25(OH)D в крови составил 41,3 (36,7–50,0) нг/мл (p = 0,000006), как представлено на рис. 2.
У лиц с исходным дефицитом витамина D его оптимального уровня достигли 89 % обследованных. У лиц с недостаточностью 25(OH)D в крови исходно (24,4 (22,2–27,1) нг/мл) его уровень также достоверно (p = 0,00001) повысился — 40,3 (34,7–42,9) нг/мл, прирост составил 20,1 (7,8–34,9) нг/мл, оптимального уровня достигли 81 % обследованных. У лиц с оптимальным уровнем 25(OH)D в крови исходно (38,1 (33,7–44,1) нг/мл) не произошло достоверного повышения его уровня — 46,2 (43,2–48,3) нг/мл, прирост — 1,4 (–4,6–16,4) нг/мл. Превышения верхней границы оптимального уровня 25(ОН)D в сыворотке крови не было.
При повторном обследовании в обеих группах произошло снижение как САД, так и ДАД, при этом в группе АГ(+Х) снижение САД было более выраженным (р = 0,005), чем в группе АГ(–Х) (табл. 2).
Как видно из представленных в табл. 3 данных, на фоне проводимой терапии во всех группах произошло достоверное снижение как САД, так и ДАД по сравнению с их исходными значениями (p < 0,05 во всех случаях). По завершении исследования группы не различались по уровню САД и ДАД (p > 0,05 во всех случаях), при этом значение отрицательной динамики как САД, так и ДАД было максимальным в группе D(+)Х(+) и достоверно отличалось от аналогичного показателя во всех остальных группах. В конце наблюдения уровень 25(ОН)D в крови достоверно (р < 0,05) повысился по сравнению с исходным в группах D(+)Х(+) и D(–)Х(+), в последней он стал достоверно выше по сравнению со всеми группами сравнения. В группе D(+)Х(+) установлены корреляционные взаимосвязи как динамики САД (R = 0,42; р = 0,02), так и динамики ДАД (R = 0,42; р = 0,02) c длительностью приема холекальциферола.
Обсуждение
Как видно из представленных в табл. 2 расчетов, несмотря на то что в группе АГ(+Х) имелись дополнительные затраты на холекальциферол и стоимость медикаментозной терапии на 1 человека была выше, чем в группе АГ(–Х) (106,8 и 91,5 $ соответственно), стоимость снижения 1 мм рт. ст. САД в группе АГ(+Х) была на 3,9 $ меньше, чем в группе АГ(–Х). Поскольку в группе АГ(+Х) САД снизилось в среднем на 16,6 мм рт. ст., то затраты 1 пациента на антигипертензивную терапию при комплексном лечении с холекальциферолом уменьшались на 64,74 $ по сравнению с пациентом, получающим только антигипертензивное лечение. Целевых значений САД (< 140 мм рт. ст.) достигли 63,5 % пациентов в группе АГ(–Х) и 79,5 % в группе АГ(+Х) (р = 0,03). Целевых значений ДАД (< 90 мм рт. ст.) достигли 89,5 и 88,4 % пациентов соответственно (р > 0,05), динамика снижения ДАД между группами также не различалась. Таким образом, экономические затраты на снижение САД при более частом достижении его целевых значений были наиболее выгодными при комплексной терапии с использованием холекальциферола.
Анализ показателя «затраты — эффективность» для снижения АД с учетом приема диуретика в составе антигипертензивной терапии и холекальциферола показал, что наименьшими затраты на снижение 1 мм рт. ст. у 1 человека будут при включении в комплексную терапию холекальциферола (табл. 3). Хотя добавление холекальциферола увеличивало стоимость медикаментозной терапии (129,5 $ на 1 человека) в группе –D(+)Х(+), однако в этой группе было наибольшее снижение САД (–27,4 мм рт. ст.). Соответственно, стоимость снижения 1 мм рт. ст. САД у 1 человека составила 4,7 $. В то же время, хотя в группе D(–)Х(–) стоимость медикаментозной терапии была наименьшей (82,0 $ на 1 человека), САД в этой группе снижалось всего на 8,7 мм рт. ст. Это повышало затраты на снижение 1 мм рт. ст. в расчете на 1 человека до 9,4 $, что было в два раза больше, чем в группе D(+)Х(+). В группе D(+)Х(–) стоимость медикаментозной терапии для снижения 1 мм рт. ст. САД у 1 человека составила 7,1 $, что было на 2,4 $ больше, чем в группе D(+)Х(+). Соответственно, для уменьшения САД на 27,4 мм рт. ст. снижение затрат в расчете на 1 человека составило 65,76 $. Также менее выгодными оказались затраты на снижение 1 мм рт. ст. САД у 1 человека в группе D(–)Х(+), в которой затраты оказались в 2,3 раза выше — 10,6 против 4,7 $ в группе D(+)Х(+). Как видно из представленных в табл. 3 данных, аналогичные результаты, но с меньшими цифрами экономической выгоды получены и для ДАД. Таким образом, очевидно, что экономические затраты на снижение САД и ДАД были наименьшими при комплексной терапии с использованием холекальциферола и диуретика, с наибольшим снижением АД в этой группе.
/44.jpg)
При назначении терапии АГ врач всегда преследует несколько задач: достижение целевого АД, предотвращение гипертонических кризов, максимальное снижение общего риска развития сердечно-сосудистых осложнений и летальных исходов от них. Для последнего необходимо стабильное поддержание АД на целевом уровне, что крайне сложно в реальной клинической практике. В современных условиях пациенты часто навязывают врачу расчет экономических затрат при назначении им комплексной терапии. В медицинских журналах не много публикаций, приводящих экономическую оценку назначенной терапии. Результаты наших расчетов свидетельствуют, что иногда более затратная, на первый взгляд, терапия может быть экономически более выгодной для достижения долгосрочных целей.
Выводы
Результаты нашего исследования свидетельствуют, что комплексная терапия АГ с использованием холекальциферола ведет к коррекции не только АД, но и статуса витамина D в организме. Прием холекальциферола в дозе 2000 МЕ/сут на протяжении 3 мес. позволяет достичь оптимального уровня витамина D в организме в 83 % случаев, независимо от антигипертензивной терапии, и не изменяет содержание витамина D в крови при его исходно оптимальном уровне. Прием холекальциферола в дозе 2000 МЕ/сут от 6,5 до 12 мес. позволяет достичь оптимального уровня витамина D в крови в 100 % случаев. Наибольшая динамика повышения уровня 25(ОН)D в крови в ответ на прием холекальциферола наблюдается при исходном его уровне < 20 нг/мл.
Комплексная терапия АГ с использованием холекальциферола достоверно чаще сопровождается достижением целевых значений САД и экономически более выгодна, чем использование только антигипертензивной терапии. Наибольшее снижение как САД, так и ДАД, с меньшими экономическими затратами установлено при комплексной терапии с использованием холекальциферола и диуретика.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Информация о финансировании. Нефинансируемая научно-исследовательская работа.
Благодарности. Выражаем благодарность профессору В.В. Поворознюку, способствующему публикации статьи в журнале.
Информация о вкладе каждого автора: Якубова Л.В. — сбор и обработка материалов, анализ полученных данных, написание текста; Снежицкий В.А. — концепция и дизайн исследования; Вдовиченко В.П. — анализ полученных данных, написание текста.
Список литературы
1. Chow C.K., Teo K.K., Rangarajan S. et al. PURE Study Investigators. Prevalence, awareness, treatment, and control of hypertension in rural and urban communities in high-, middle-, and low-income countries. JAMA. 2013. 310. 959-968. doi: 10.1001/jama.2013.184182.
2. Banegas J.R., Lopez-Garcia E., Dallongeville J. et al. Achievement of treatment goals for primary prevention of cardiovascular disease in clinical practice across Europe: the EURIKA study. Eur. Heart J. 2011. 32. 2143-2152. doi: 10.1093/eurheartj/ehr080.
3. Forouzanfar M.H., Liu P., Roth G.A. et al. Global burden of hypertension and systolic blood pressure of at least 110 to 115 mm Hg, 1990–2015. JAMA. 2017. 317. 165-182. doi: 10.1001/jama.2016.19043.
4. Lewington S., Clarke R., Qizilbash N., Peto R., Collins R. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002. 360 (9349). 1903-13. doi: 10.1016/s0140-6736(02)11911-8.
5. Lip G., Coca A., Kahan T., Boriani G. et al. Hypertension and cardiac arrhythmias: executive summary of a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Eur. Heart J. Cardiovasc. Pharmacother. 2017. 3. 235-250. doi: 10.1093/europace/eux091.
6. Gottesman R.F., Albert M.S., Alonso A. et al. Associations between midlife vascular risk factors and 25-year incident dementia in the Atherosclerosis Risk in Communities (ARIC) cohort. JAMA Neurol. 2017. 74. 1246-1254. doi: 10.1001/jamaneurol.2017.1658.
7. Rovio S.P., Pahkala K., Nevalainen J. et al. Cardiovascular risk factors from childhood and midlife cognitive performance: the Young Finns study. J. Am. Coll. Cardiol. 2017. 69. 2279-2289. doi: 10.1016/j.jacc.2017.02.060.
8. Thomopoulos C., Parati G., Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 7. Effects of more vs. less intensive blood pressure lowering and different achieved blood pressure levels — updated overview and meta-analyses of randomized trials. J. Hypertens. 2016. 34. 613-622. doi: 10.1097/HJH.0000000000000881.
9. Ettehad D., Emdin C.A., Kiran A. et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016. 387. 957-967. doi: 10.1016/S0140-6736(15)01225-8.
10. Williams B., Mancia G., Spiering W. et al., ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur. Heart J. 2018. 39 (33). 3021-3104. doi: 10.1093/eurheartj/ehy339.
11. Płudowski P., Karczmarewicz E., Bayer M. et al. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe — recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Endokrynol. Pol. 2013. 64. 319-327. doi: 10.5603/ep.2013.0012.
12. Jankovskaja L.V., Snezhickij V.A., Povoroznjuk V.V., Mojseenok A.G., Egorchenko N.P. Vzaimosvjaz’ urovnja vitamina D s vozrastom, polom, diagnozom i faktorami serdechno-sosudistogo riska. Med. zhurn. 2017. 2 (60). 115-120. (in Russian).
13. Burgaz A., Orsini N., Larsson S.C., Wolk A. Blood 25-hydroxyvitamin D concentration and hypertension: a meta-analysis. J. Hypertens. 2011. 29 (4). 636-645. doi: 10.1097/HJH.0b013e32834320f9.
14. Forman J.P., Scott J.B., Ng K. et al. Effect of vitamin D supplementation on blood pressure in blacks. Hypertension. 2013. 61 (4). 779-785. doi: 10.1161/HYPERTENSIONAHA.111.00659.
15. Witham M.D., Nadir M.A., Struthers A.D. Effect of vitamin D on blood pressure: a systematic review and meta-analysis. Hypertens. 2009. 27 (10). 1948-1954. doi: 10.1097/HJH.0b013e32832f075b.
16. Sugden J.A., Davies J.I., Witham M.D., Morris A.D., Struthers A.D. Vitamin D improves endothelial function in patients with Type 2 diabetes mellitus and low vitamin D levels. Diabet. Med. 2008. 25 (3). 320-325. doi: 10.1111/j.1464-5491.2007.02360.x
18. Mancia G. ESH/ESC Guidelines for the management of arterial hypertension. Journal of Hypertension. 2013. 31 (7). 1281-1357. doi: 10.1097/01.hjh.0000431740.32696.cc.
19. Kozhanova I.N., Romanova I.S., Hapaljuk A.V., Stepanova M.D. Osnovy farmakojepidemiologicheskogo i farmakojekonomicheskogo analiza ispol''zovanija lekarstvennyh sredstv pri hronicheskih zabolevanijah. Uchebno-metodicheskoe posobie, Belorusskaja medicinskaja akademija poslediplomnogo obrazovanija. 2006. 39. (in Russian).

/42.jpg)
/43.jpg)
/44.jpg)