Вступ
Протягом останніх десятиліть синдром обструктивного апное сну (СОАС) був визнаний незалежним фактором ризику розвитку артеріальної гіпертензії (АГ) і додатково спостерігалася висока поширеність СОАС у пацієнтів із рефрактерною АГ. СОАС — це розлад дихання, що характеризується повторюваним припиненням вентиляції під час сну, спричиненим недостатнім тонусом м’язів дихальних шляхів (гіпопное) та колапсом дихальних шляхів (апное). Апное та гіпопное характеризуються наявністю хропіння, зниженням рівня кисню в крові, фрагментацією сну, денною сонливістю [1].
Поширеність середнього та тяжкого ступенів розладів дихання сну, що характеризується показником «індекс апное/гіпопное сну» (АГІ) (виміряний як ≥ 15 події/год), серед 30–49-річних чоловіків становить 10 % (95% довірчий інтервал (ДІ) 7–12), 17 % (95% ДІ 15–21) — серед 50–70-річних чоловіків, 3 % (95% ДІ 2–4) — серед 30–49-річних жінок та 9 % (95% ДІ 7–11) — серед 50–70-річних жінок [2]. Виявлення СОАС надзвичайно важливе в пацієнтів з АГ. Ці два стани часто співіснують (до 50 % пацієнтів з АГ мають супутню СОАС), і СОАС часто сприяє підвищенню АТ у пацієнтів із резистентною АГ [3]. СОАС може збільшити серцево-судинний ризик, ініціювати або сприяти прогресуванню АГ, розвитку атеросклерозу, ішемічної хвороби серця та таких ускладнень, як серцева недостатність, аритмії, інфаркт міокарда та інсульт [4]. Однією з причин цього є підвищена жорсткість артерій. Але сучасних даних недостатньо, оскільки наявні дослідження включали різні категорії пацієнтів [5–10].
Діагноз СОАС установлювався за допомогою інструментальних методів обстеження: лабораторної полісомнографії та/або (амбулаторним) домашнім тестуванням із портативним монітором [11]. Портативний монітор може бути використаний для діагностики СОАС, коли він застосовується як частина комплексної оцінки сну в пацієнтів із високою достовірністю попереднього тестування середнього та тяжкого апное [12].
Лікування постійним позитивним тиском у дихальних шляхах (СPAP-терапія) є найкращим методом лікування легкого, середнього та тяжкого ступенів СОАC, що повинен пропонуватися як варіант лікування для всіх пацієнтів із СОАС [12]. CPAP-терапія призначається для лікування середнього та тяжкого ступенів СОАС як стандартна терапія та легкого ступеня СОАС як варіант, а також як допоміжна терапія для зниження АТ у пацієнтів з АГ та СОАС [11]. Незважаючи на загальне використання на практиці, вплив CPAP-терапії на зміни жорсткості артерій у даних пацієнтів не досліджувався.
Метою дослідження було оцінити зміни жорсткості артерій у пацієнтів з АГ та СОАС та можливості її корекції за допомогою CPAP-терапії.
Матеріали та методи
Ми включили в дослідження 185 пацієнтів з АГ (49,8 ± 0,8 року), із них 36 (19,5 %) — жінки та 149 (80,5 %) — чоловіки, які перебували на лікуванні у відділі вторинних та легеневих гіпертензій у ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України». Діагноз АГ установлювався при виявленні рівня офісного систолічного артеріального тиску (оф. САТ) > 140 мм рт.ст. та/або > 90 мм рт.ст. діастолічного артеріального тиску (ДАТ) [13] або при прийомі пацієнтом антигіпертензивної терапії. Ми виключили пацієнтів похилого віку (≥ 80 років), хворих із будь-якою другою вторинною формою АГ, з іншими формами порушення дихання, сну (хронічна обструктивна хвороба легень, бронхіальна астма, гіповентиляція, пов’язана з нервово-м’язовими розладами, виражена серцева недостатність), з інфарктом міокарда та інсультом протягом 3 місяців, декомпенсованим цукровим діабетом (HbA1с > 11 %), тяжкою хронічною хворобою нирок (визначається як швидкість клубочкової фільтрації ≤ 30 мл/хв/1,73 м2), постійною або стійкою фібриляцією передсердь, психічними розладами та пацієнтів, які зловживають алкоголем.
Суб’єктивну сонливість оцінювали методом опитування за шкалою сонливості Епворта (ESS) [14]. Параметри часу сну реєстрували за допомогою двоканального портативного монітора (SOMNOcheck micro, Weinmann, Німеччина), визначали насичення крові киснем (SрO2), частоту серцевих скорочень вимірювали за допомогою пульсоксиметричного датчика (CMS 50B) та плетизмограми. Обструктивне апное визначали як припинення потоку повітря зі збереженням торакоабдомінальних рухів. АГІ визначали як кількість апное плюс епізоди гіпопное на годину сну. Індекс десатурації киснем вказує кількість десатурацій кисню за годину сну. Діагноз СОАС був підтверджений у пацієнтів із кількістю обструктивних подій (апное, гіпопное та пробудження, пов’язані з респіраторними подіями) більше 15 подій/год або більше 5 подій/год у пацієнтів, які повідомили про будь-яке з таких станів: денна сонливість, ненавмисні епізоди сну під час неспання, несвіжий сон, втома, безсоння, пробудження із затримкою дихання, задишкою або ядухою, що описувались пацієнтом або родичами [15, 16]. Як рекомендовано, тяжкість СОАС визначали як легку, коли AГІ становив ≥ 5 та < 15, середню — при AГІ ≥ 15 та ≤ 30 та тяжку — при AГI > 30 за годину.
Добове моніторування артеріального тиску проводили за допомогою портативного приладу ABPM-04 (Meditech, Угорщина) на недомінантному плечі протягом 24 годин за стандартною методикою. Вимірювання здійснювали з інтервалом у 15 хвилин протягом дня та кожні 30 хвилин протягом ночі. Для контролю якості методу ми розглянули щонайменше 70 % успішного вимірювання АТ у денний та нічний періоди [13].
Для оцінки жорсткості артерій та визначення швидкості пульсової хвилі ми використовували прилад SphygmoCor (AtCor Medical, Сідней, Австралія) та визначали центральний АТ за стандартним протоколом методом швидкісного аналізу пульсової хвилі та методом апланаційної тонометрії із зазначеним на пристрої програмним забезпеченням [17, 18]. Індекс аугментації (AIx) розраховували за стандартною формулою як різницю між другим (P2) і першим систолічним піковим тиском (P1), вираженим у відсотках від центрального пульсового артеріального тиску (цПАТ): AIx (%) = [(P2 – P1)/PP] × 100. Усі значення AIx були скориговані за частотою серцевих скорочень 75 уд/ хв. Кілька оцінок AIx проводили щоразу і для статистичного аналізу використовували вимірювання з найвищим індексом оператора.
Усі ехокардіографічні вимірювання здійснювались відповідно до рекомендованих стандартів Американського товариства ехокардіографії за допомогою апарата Imagic Agile (Kontron Medical, Франція). Виконані базові вимірювання розмірів лівого передсердя (ЛП), шлуночка в діастолі та систолі, а також товщини міжшлуночкової перегородки, задньої стінки лівого шлуночка та розрахування маси міокарда лівого шлуночка (ММЛШ); для розрахунку індексу ММЛШ (ІММЛШ) ми використовували стандартні формули: розділили ММЛШ на площу поверхні тіла [19]. Фракцію викиду лівого шлуночка обчислювали методом Сімпсона: (діастолічний об’єм – систолічний об’єм)/діастолічний об’єм.
Усі пацієнти підгрупи отримували CPAP-терапію за допомогою установлювального пристрою протягом однієї ночі. Оптимальний тиск CPAP-терапії для кожного пацієнта був установлений на мінімальному рівні тиску повітря, необхідного для скасування хропіння, обструктивних респіраторних явищ та обмеження потоку повітря протягом 95 % ночі. Кожен пацієнт отримував стандартизовані вказівки на початку CPAP-терапії. Потім даний фіксований оптимальний тиск підтримувався за допомогою CPAP-маски протягом усього дослідження. Прихильність до CPAP-терапії автоматично вимірювалась за допомогою вбудованого програмного забезпечення, що відповідає стандартам CPAP-терапії, під час регулярного обстеження в період спостереження. Як правило, пацієнти вважаються адекватно прихильними до лікування CPAP-терапією, якщо середнє використання CPAP становило щонайменше 5 год/ніч.
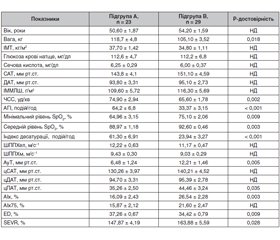
Протокол дослідження був затверджений місцевим етичним комітетом ДУ «ННЦ «Інститут кардіо-логії імені М.Д. Стражеска» НАМН України». Усі пацієнти підписали інформовану згоду перед тим, як брати участь у дослідженні. Усі пацієнти пройшли клінічне та спеціальне обстеження. Отже, їх розподілили на групи: із СОАС (n = 148) та без СОАС (контрольна група, n = 37). Усім пацієнтам були призначені антигіпертензивні препарати відповідно до Рекомендацій ESH/ESC 2013 року для лікування артеріальної гіпертензії з урахуванням індивідуальних показань та переносимості різних засобів. Усім пацієнтам із середнім та тяжким ступенями СОАС рекомендували CPAP-терапію, що титрували в лабораторії сну до оптимального тиску. У 10-місячне подальше дослідження були включені 105 пацієнтів, які були розподілені на 4 підгрупи: A — пацієнти з АГ та СОАС на CPAP-терапії (n = 23), середній терапевтичний тиск — 8,30 ± 1,81 GPa; B — пацієнти з АГ та СОАС без CPAP-терапії (n = 29); С — пацієнти з АГ та легким ступенем СОАС (n = 29); D — пацієнти з АГ без СОАС (контрольна підгрупа, n = 24).
Статистичний аналіз
Весь статистичний аналіз проводили за допомогою програмного забезпечення SPSS версії 21 (SPSS, Чикаго, Іллінойс). Для базового порівняння СОАС у контрольних групах та підгрупах із точки зору характеристик пацієнтів дані артеріального тиску та жорсткості артерій порівнювали за допомогою незалежних t-тестів, оскільки дані зазвичай розподілялись. Для кореляційного аналізу використовували ранговий тест Спірмена. Внутрішньогрупові зміни від вихідного рівня до кінця спостереження оцінювали за допомогою парного t-тесту. Значення Р < 0,05 вважалося статистично значущим.
Результати
У дослідження були включені 185 пацієнтів з артеріальною гіпертензією. Вони були розподілені на 2 групи: група із СОАС — 148 пацієнтів (середній AГI — 38,1 ± 2,5 події/год) і контрольна група — 37 пацієнтів без СОАС (середній AГI — 3,02 ± 0,25 події/год) (P < 0,001). Пацієнти обох груп були порівнянними за віком, зростом, рівнем загального холестерину та оф. САТ та ДАТ. Вихідні клінічні характеристики пацієнтів із групи СОАС та конт-рольної групи наведені в табл. 1.
У пацієнтів групи СОАС порівняно з контрольною групою були вищими індекс маси тіла (ІМТ) (P < 0,001), рівень сечової кислоти (P = 0,048), рівень глюкози натще (P = 0,045), поширеність цукрового діабету (P < 0,02) та оцінка денної сонливості за шкалою Епворта (ESS) (P = 0,003).
Пацієнти обох груп мали порівнянні рівні оф. САТ — 145,60 ± 1,67 проти 138,40 ± 3,66 мм рт.ст. (P = 0,057) і ДАТ — 93,60 ± 1,18 проти 89,10 ± 2,11 мм рт.ст. Ми припускаємо, що в дослідженні деякі пацієнти із СОАС мали масковану АГ.
На початку дослідження в пацієнтів групи СОАС спостерігався вищий показник швидкості поширення пульсової хвилі по артеріях еластичного типу (ШППХел) — на 1,09 ± 0,44 м/с (P = 0,014) та цСАТ — на 8,22 ± 3,68 мм рт.ст. (P = 0,027) порівняно з пацієнтами без СОАС. У пацієнтів контрольної групи ШППХел незалежно корелювала з віком (b = 0,347; P = 0,003), але в той же час кореляцій у пацієнтів із СОАС не виявлено. ЦСАТ у пацієнтів із СОАС був незалежно пов’язаний із розміром ЛП (b = 0,014; P = 0,016), ММЛШ (b = –0,036; P = 0,029) та тиском аугментації (АуТ) (b = 0,087; P = 0,022). У пацієнтів без СОАС таких кореляцій виявлено не було.
У 107 пацієнтів, яким була рекомендована CPAP-терапія, діагностовано середній та тяжкий ступені СОАС. 59 пацієнтів (із них 55,1 %) отримували CPAP-терапію із середнім терапевтичним тиском 7,87 ± 0,23 GPа; мінімальний тиск — 4,0 GPа, максимальний тиск — 12,0 GPа, медіана — 8,0 GPа. Після регресійного аналізу було встановлено, що прихильність до CPAP-терапії була незалежно пов’язана з масою тіла (b = 0,346; р = 0,005), індексом десатурації (b = 0,432; р = 0,010) та тривалістю хропіння (b = 0,369; Р < 0,001). Через 10 місяців були проаналізовані дані 23 пацієнтів, у яких використовували CPAP-терапію, оскільки 36 із 59 пацієнтів відмовились від CPAP-терапії з різних причин.
У 10-місячне спостережне дослідження були включені 105 пацієнтів віком 51,96 ± 1,04 року; 22 особи (21 %) — жінки. Усі вони були розподілені на 4 підгрупи: A — пацієнти з АГ із СОАС на CPAP-терапії (n = 23); B — пацієнти з АГ та без СОАС-терапії (n = 29); C — пацієнти з AГ та легким ступенем СОАС (n = 29); D — пацієнти з АГ без СОАС (конт-рольна підгрупа, n = 24). Як антигіпертензивну терапію пацієнти отримували інгібітори ангіотензинперетворюючого ферменту (55 пацієнтів — 52,4 %), антагоністи кальцію (51 пацієнт — 48,6 %), бета-адреноблокатори (66 пацієнтів — 62,9 %), діуретики (80 пацієнтів — 76,2 %), блокатори рецепторів ангіотензину (44 пацієнти — 41,9 %), засоби центральної дії (8 пацієнтів — 7,6 %), блокатори альфа-рецепторів (2 пацієнти — 1,9 %), антагоністи мінералокортикоїдних рецепторів (7 пацієнтів — 6,7 %).
Характеристики пацієнтів підгруп на початку дослідження наведені в табл. 2, 3.
Пацієнти, які отримували CPAP-терапію (підгрупа А), характеризувалися більшим AГI, індексом десатурації та нижчим рівнем середнього і мінімального SpO2. Оскільки вони мали тяжкий ступінь СОАС, такі пацієнти особливо потребували лікування постійним позитивним тиском у дихальних шляхах. Показники рівнів офісного АТ, центрального АТ, віку, ІМТ, ШППХ не відрізнялися між підгрупами А та В. Таким чином, пацієнти з АГ та СОАС підгруп А та В були порівнянними за клінічними характеристиками, особливо за віком, АТ та отримували подібну антигіпертензивну терапію.
Пацієнти з легким ступенем СОАС (підгрупа C) та контрольної групи (підгрупа D) також були порівнянними за демографічними та клінічними параметрами на початку дослідження (вік, оф. САТ 143,5 ± 3,8 мм рт.ст. проти 140,3 ± 4,9 мм рт.ст.; оф. ДАТ 89,0 ± 2,7 мм рт.ст. проти 91,0 ± 2,8 мм рт.ст.), судинними характеристиками (ШППХ, цСАТ 132,83 ± 3,65 мм рт.ст. проти 128,38 ± 4,66 мм рт.ст.), характеристиками сну: вищим АГІ (9,10 ± 0,51 проти 3,20 ± 0,28 події/год), вищим індексом десатурації (5,33 ± 0,80 проти 2,75 ± 0,56 події/год) у підгрупі C проти підгрупи D.
Вплив CPAP-терапії на параметри, що вивчаються, та показники сну наведений у табл. 4. CPAP-терапія в поєднанні з антигіпертензивною терапією знизила рівні оф. АТ із досягненням цільових значень САТ у 65,2 % пацієнтів, а ДАТ — у 69,6 % пацієнтів та сприяла зниженню частоти серцевих скорочень (ЧСС) на 7,70 ± 2,82 уд/хв. Крім того, через 10 місяців лікування пацієнти підгрупи на CPAP-терапії продемонстрували помітне поліпшення еластичних властивостей артерій зі значним зниженням ШППХел — із 12,20 ± 0,63 м/с до 10,05 ± 0,43 м/с, Р = 0,009 із досягненням нормальних значень (< 10 м/с) у 14 (60,9 %) пацієнтів. Зміни рівнів цАТ були зіставлені зі змінами рівнів оф. АТ при значному зниженні цСАТ — на 10,50 ± 3,84 мм рт.ст. (P = 0,012) та цДАТ — на 7,61 ± 2,82 мм рт.ст. (P = 0,013). Подібне суттєве поліпшення відзначене для показників перфузії міокарда: збільшення SEVR (P = 0,006) та зменшення ED (P = 0,007).
/49.jpg)
Показники ШППХел знижуються більш помітно в пацієнтів із початково вищим рівнем даних показників. Після багатофакторного регресійного аналізу абсолютне значення зниження АуТ (b = 0,266, P < 0,001), початкового рівня сечової кислоти в сироватці (b = –0,347, P = 0,028), жіноча стать (b = –0,584, P = 0,001) та початковий AIx75 (b = 0,667, P = 0,001) були визначені як незалежні фактори, що сприяють зменшенню рівня цСАТ через 10 місяців CPAP-терапії в поєднанні з антигіпертензивною терапією.
На відміну від підгрупи А в пацієнтів підгрупи В (n = 29) рівень САТ також суттєво знизився — на 9,21 ± 4,10 мм рт.ст. (від 151,10 ± 4,59 до 141,90 ± 4,12 мм рт.ст., Р = 0,033), але його середній рівень не перевищував цільовий рівень (< 140 мм рт.ст.) наприкінці періоду спостереження.
Цільові значення САТ були досягнуті в 17 (58,6 %) пацієнтів та в 13 (44,8 %) — значення ДАТ. Динаміка показників еластичних властивостей артерій у пацієнтів підгрупи B була протилежною пацієнтам підгрупи A: показники ШППХел достовірно збільшились — на 1,06 ± 0,48 м/с (від 11,17 ± 0,47 до 12,15 ± 0,49 м/с, Р = 0,036) (рис. 1). У пацієнтів з АГ та СОАС на CPAP-терапії рівень показників ШППХел перевищував нормальне значення (< 10 м/с) у 21 (75,9 %) пацієнта. Достовірних змін в інших гемодинамічних параметрах не виявлено. Початковий рівень показників ШППХел (b = 1,098, P < 0,001) був незалежним фактором збільшення ШППХел після 10 місяців динамічного спостереження.
У пацієнтів підгрупи С (n = 29) протягом 10 місяців антигіпертензивної терапії динаміки оф. АТ не відзначали, а спостерігали незначне збільшення САТ (із 143,45 ± 3,77 до 145,93 ± 3,20 мм рт.ст., Р = 0,58) і ДАТ (із 89,03 ± 2,70 до 90,31 ± 2,68 мм рт.ст., Р = 0,687). Наприкінці подальшого спостереження САТ перевищив цільовий рівень у 18 (62,1 %) пацієнтів, а ДАТ — у 17 (58,6 %) пацієнтів. ШППХел суттєво збільшилася — на 1,14 ± 0,44 м/с (із 10,94 ± 0,37 до 12,18 ± 0,49 м/с, Р = 0,015). Початковий рівень АуТ (b = 1,777, P = 0,031), вік (b = 0,867, P = 0,003) та початкове значення Aix (b = –1,507, P = 0,043) були визначені як незалежні фактори, що сприяють збільшенню показників ШППХел через 10 місяців подальшого спостереження.
/50.jpg)
У пацієнтів підгрупи D (n = 24) динаміка показників оф. АТ була недостовірною, але середнє значення САТ досягло цільового рівня (від 140,29 ± 4,92 до 138,50 ± 4,31 мм рт.ст., Р = 0,643), а ДАТ трохи перевищив цільовий рівень (від 90,59 ± 2,79 до 90,92 ± 2,99 мм рт.ст., Р = 0,990) у кінці спостереження. Цільові рівні оф. САТ були досягнуті в 15 (62,5 %) пацієнтів та оф. ДАТ — у 13 (54,2 %) пацієнтів. ШППХел зменшилася недостовірно — на 0,49 ± 0,40 м/с (із 10,29 ± 0,37 до 9,80 ± ± 0,45 м/с, Р = 0,228) із досягненням нормального значення (< 10 м/с). Досягнення нормальних показників ШППХел відбулося в 14 (58,3 %) пацієнтів. Динаміка ШППХел недостовірно корелювала з будь-якими іншими факторами (табл. 5).
/50_2.jpg)
Як видно з табл. 5, зміни показників еластичних властивостей артерій були різними в різних підгрупах. Таким чином, у пацієнтів підгрупи А (на CPAP-терапії) спостерігалося достовірне покращення показників еластичних властивостей артерій за рахунок зменшення показників ШППХел через 10 місяців CPAР-терапії — із 12,22 ± 0,63 м/с до 10,05 ± 0,43 м/с, Р = 0,009.
У той же час у пацієнтів підгрупи B з АГ та СОАС середнього та тяжкого ступенів після 10 місяців медикаментозної терапії показник ШППХел збільшився з 11,17 ± 0,47 м/с до 12,15 ± 0,49 м/с, Р = 0,036. Така ж ситуація була в підгрупі С у пацієнтів із легким ступенем СОАС та на медикаментозній терапії: показник ШППХел збільшився з 10,94 ± 0,37 м/с до 12,18 ± 0,49 м/с, Р = 0,015. У підгрупі D (контрольна група) не було різниці між показниками ШППХел.
Можна сказати, що комбінована антигіпертензивна терапія та CPAP-терапія призводять до поліпшення показників еластичних властивостей артерій у пацієнтів з АГ та СОАС.
Обговорення
Підвищення жорсткості артерій — це складний процес, що відображає стан здоров’я артерій і пов’язаний із розвитком та прогресуванням атеросклерозу в різних частинах артеріального русла [21]. Жорсткість артерій також пов’язана з прогресуванням уражень органів-мішеней, таких як ураження нирок, міокарда, ретинопатія та гіпоперфузія скелетних м’язів [22–24]. У сучасних рекомендаціях жорсткість артерій розглядається як предиктор серцево-судинних подій [25–30], таких як інфаркт міокарда, інсульт та серцева недостатність, незалежно від інших традиційних факторів ризику, включаючи артеріальну гіпертензію [31].
Багато факторів ризику та патофізіологічних механізмів, що пов’язують жорсткість артерій із серцево-судинними захворюваннями, існує у пацієнтів із СОАC, включаючи ожиріння та АГ. Параметри або жорсткість артерій допомагають розшарувати пацієнтів із низьким або високим серцево-судинним ризиком, якщо їх додати до традиційних факторів ризику, та виявити пацієнтів із підозрою на субклінічне пошкодження органів-мішеней [32–34].
Отже, підвищена жорсткість артерій може відігравати певну роль у підвищенні ризику серцево-судинних ускладнень у пацієнтів із СОАC. Рання діагностика жорсткості артерій дозволяє прогнозувати клінічне ураження органів-мішеней шляхом модифікації факторів серцево-судинного ризику. А оцінка жорсткості артерій у пацієнтів з АГ та СОАC може бути ефективним методом для моніторингу прогресування захворювання та ефективності лікування.
Існує кілька досліджень, що дозволяють оцінити жорсткість артерій у пацієнтів із СОАC, однак їх результати суперечливі, оскільки вони включали різних пацієнтів. Ураховуючи високу поширеність СОАC серед пацієнтів з артеріальною гіпертензією, ми відібрали пацієнтів із діагностованою есенціальною артеріальною гіпертензією.
Так, у дослідженні А. Noda та ін. було показано, що АуТ та Aix були значно вищими в пацієнтів із СОАC, ніж у контрольній групі (9,0 ± 4,1 проти 6,4 ± 3,4 мм рт.ст.). АуТ також був достовірно більшим у пацієнтів з артеріальною гіпертензією (11,4 ± 3,5 мм рт.ст., n = 14, P < 0,001) або в нормотензивних пацієнтів із СОАC (7,9 ± 3,9 мм рт.ст., n = 31, P = 0,013), ніж у конт-рольній групі. А АуТ значно зменшився в 19 пацієнтів із СОАC, які отримували CPAP-терапію [35]. Таким чином, у даному дослідженні були зіставлені гіпертоніки з нормотензивними пацієнтами на відміну від нашого дослідження, де всі включені пацієнти мали АГ.
У дослідженні Claudi E. Korcarz було показано, що в пацієнтів із СОАС та без нього були схожі показники офісного та центрального САТ (122,8 ± 15,1 проти 119,1 ± 11,8 мм рт.ст., Р = 0,100), офісного та центрального ДАТ (77,1 ± 9,4 проти 77,4 ± ± 8,6 мм рт.ст., P = 0,834) та ШППХел (9,06 ± 2,15 проти 8,51 ± 1,88 м/с; усіди P > 0,10), найімовірніше, тому що 61,2 % пацієнтів із СОАС та 32,5 % — без нього приймали антигіпертензивну терапію (Р = 0,014). Крім того, у середньому в пацієнтів із порушенням дихання під час сну спостерігався легкий ступінь СОАС (17,6 ± 16,2 проти 2,2 ± 1,3 події/год). Був зроблений висновок про те, що негативний вплив індексу десатурації на показники ШППХ спостерігався серед нормотензивних осіб і посилювався зі старінням [36].
У нашому дослідженні пацієнти з АГ та СОАC порівняно з пацієнтами без СОАC мали значно вищий показник ШППХел та рівень цСАТ, і ми спостерігали погіршення даних показників протягом 10 місяців без належного лікування.
Drager et al. рандомізував 24 пацієнтів з тяжким ступенем СОАC без супутніх захворювань, які не отримували лікування або CPAP-терапії протягом 4 місяців. Після цього періоду лікування CPAP вони виявили достовірне зниження жорсткості артерій за оцінкою показників ШППХ (10,4 ± 1,0 проти 9,3 ± 0,9 м/с, P < 0,001) [37].
Kohler та співавт. в іншому рандомізованому клінічному дослідженні повідомили, що AIx достовірно зменшився з 14,5 до 9,1 % у пацієнтів із середнім та тяжким ступенями СОАC після 4 тижнів CPAP-терапії порівняно з фіктивною CPAP-терапією [38]. На противагу цьому Jones et al. не виявили значного зниження AIx (15,5 ± 11,9 % проти 16,6 ± 11,7 %, P = 0,08) у 43 пацієнтів з AГI > 15 за годину через 12 тижнів CPAP-терапії або фіктивної CPAP-терапії. Важливим обмеженням цього дослідження і, можливо, причиною того, що в останньому дослідженні не було значного впливу CPAP-терапії на AIx, була дуже низька прихильність до CPAP-терапії — лише 3 години на ніч [39].
У нашому дослідженні поєднання CPAP-терапії та антигіпертензивної терапії призводило до досягнення цільового офісного рівня артеріального тиску на відміну від пацієнтів із СОАC без CPAP-терапії. Отже, якщо величина зниження систолічного АТ, що спостерігається в нашому дослідженні, все ще зберігається протягом тривалого періоду, це може покращити прогноз у пацієнтів з АГ.
Це дослідження додало нові дані до міркувань про потенційне значення СОАC та його CPAP-терапію в пацієнтів з артеріальною гіпертензією. По-перше, наші дані підтвердили, що СОАC сприяв підвищенню серцево-судинного ризику в пацієнтів з АГ через негативний серцево-метаболічний профіль та підвищену жорсткість артерій. По-друге, наші дані показали, що тривала CPAP-терапія в поєднанні з антигіпертензивним лікуванням знижує жорсткість артерій та сприяє досягненню належного контролю артеріального тиску. По-третє, СОАC навіть легкого ступеня сприяв прогресуванню жорсткості артерій та перешкоджав досягненню цільового рівня артеріального тиску, незважаючи на антигіпертензивне лікування в пацієнтів з артеріальною гіпертензією.
З огляду на це дані результати можуть мати клінічно значуще значення і справляти важливий економічний вплив на систему охорони здоров’я, оскільки існує висока поширеність обструктивного апное сну в пацієнтів з артеріальною гіпертензією [1, 2].
Сильними сторонами нашого дослідження є: набір достатнього обсягу вибірки пацієнтів, 10 місяців спостереження пацієнтів на CPAP-терапії та без неї, включення обраних пацієнтів без супутніх захворювань, як це зазвичай спостерігається в пацієнтів із гіпертонічною хворобою, та узагальнення результатів дослідження.
Це дослідження мало кілька потенційних обмежень. По-перше, це було одноцентрове пілотне дослідження. По-друге, пацієнти в підгрупі CPAP-терапії показали більш серйозний СОАC на вихідному рівні, виміряний AГI, нижчий рівень SрO2 і вищу денну сонливість, ніж підгрупа без СОАC.
Висновки
1. Наявність синдрому обструктивного апное сну в пацієнтів з артеріальною гіпертензією пов’язана зі збільшенням жорсткості артерій еластичного типу, високим рівнем центрального систолічного артеріального тиску та гіршим досягненням цільового рівня артеріального тиску при медикаментозному лікуванні.
2. Поєднання CPAP-терапії з антигіпертензивним лікуванням у пацієнтів з АГ та синдромом обструктивного апное сну середнього та тяжкого ступенів покращило досягнення цільового рівня артеріального тиску та сприяло зменшенню жорсткості артерій і зниженню центрального артеріального тиску.
3. Синдром обструктивного апное сну в нашому дослідженні негативно впливав на жорсткість артерій.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Отримано/Received 12.04.2021
Рецензовано/Revised 26.04.2021
Прийнято до друку/Accepted 07.05.2021
Список литературы
1. Somers V.K., White D.P., Amin R., Abraham W.T., Costa F. et al. Sleep apnea and cardiovascular disease: an American Heart Association/American College оf Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council On Cardiovascular Nursing. In collaboration with the National Heart, Lung, and Blood Institute National Center on Sleep Disorders Research (National Institutes of Health). Circulation. 2008, Sep 2. 118(10). 1080-1111. doi: 10.1161/Circulation AHA.107.189375. Epub 2008, Aug 25.
2. Peppard P.E., Young T., Barnet J.H., Palta M., Hagen E.W. et al. Increased prevalence of sleep-disordered brea-thing in adults. Am. J. Epidemiol. 2013, May 1. 177(9). 1006-1014. doi: 10.1093/aje/kws342. Epub 2013, Apr 14.
3. Pedrosa R.P., Drager L.F., Gonzaga C.C., Sousa M.G., de Paula L.K. et al. Obstructive sleep apnea: the most common secondary cause of hypertension associated with resistant hypertension. Hypertension. 2011. 58. 811-817. doi: 10.1161/HYPERTENSIONAHA.111.179788.
4. Floras J.S. Sleep apnea and cardiovascular risk. J. Cardiol. 2014 Jan. 63(1). 3-8. doi: 10.1016/j.jjcc.2013.08.009. Epub 2013, Sep 29.
5. Baguet J.P., Nadra M., Barone-Rochette G., Ormezzano O., Pierre H. et al. Early cardiovascular abnormalities in newly diagnosed obstructive sleep apnea. Vasc. Health Risk Ma-nag. 2009. 5. 1063-1073. Epub 2009, Dec 29. doi: 10.2147/vhrm.s8300.
6. Kaynak D., Göksan B., Kaynak H., Degirmenci N., Daglioglu S. Is there a link between the severity of sleep-disordered breathing and atherosclerotic disease of the carotid arteries? Eur. J. Neurol. 2003 Sep. 10(5). 487-493. doi: 10.1046/j.1468-1331.2003.00658.x.
7. Baguet J.P., Hammer L., Lévy P., Pierre H., Launois S. et al. The severity of oxygen desaturation is predictive of carotid wall thickening and plaque occurrence. Chest. 2005 Nov. 128(5). 3407-3412. doi: 10.1378/chest.128.5.3407.
8. Drager L.F., Bortolotto L.A., Lorenzi M.C., Figueiredo A.C., Krieger E.M. et al. Early signs of atherosclerosis in obstructive sleep apnea. Am. J. Respir. Crit. Care Med. 2005, Sep 1. 172(5). 613-618. Epub 2005, May 18. doi: 10.1164/rccm.200503-340OC.
9. Tsioufis C., Thomopoulos K., Dimitriadis K., Amfilochiou A., Tousoulis D. et al. The incremental effect of obstructive sleep apnoea syndrome on arterial stiffness in newly diagnosed essential hypertensive subjects. J. Hypertens. 2007 Jan. 25(1). 141-146. doi: 10.1097/HJH.0b013e32801092c1.
10. Protogerou A.D., Laaban J.P., Czernichow S., Kostopoulos C., Lekakis J., Safar M.E., Blacher J. Structural and functional arterial properties in patients with obstructive sleep apnoea syndrome and cardiovascular comorbidities. J. Hum. Hypertens. 2008 Jun. 22(6). 415-422. Epub 2007, Dec 13. doi: 10.1038/sj.jhh.1002318.
11. Epstein L.J., Kristo D., Strollo P.J. Jr, Friedman N., Malhotra A. et al. Adult Obstructive Sleep Apnea Task Force of the American Academy of Sleep Medicine. Clinical guideline for the evaluation, management and long-term care of obstructive sleep apnea in adults. J. Clin. Sleep Med. 2009, Jun 15. 5(3). 263-276. PMCID: PMC2699173.
12. Collop N.A., Anderson W.M., Boehlecke B., Claman D., Goldberg R. et al. Clinical guidelines for the use of unattended portable monitors in the diagnosis of obstructive sleep apnea in adult patients. Portable Monitoring Task Force of the American Aca-demy of Sleep Medicine. J. Clin. Sleep Med. 2007. 3. 737-747. PMCID: PMC2556918.
13. Mancia G., Fagard R., Narkiewicz K., Redo’n J., Zanchetti A. et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension. TheTask Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Journal of Hypertension. 2013. 31. 1281-1357 doi: 10.1097/01.hjh.0000431740.32696.cc.
14. Johns M.W. A new method for measuring daytime sleepiness: the Epworth Sleepiness Scale. Sleep. 1991. 14. 540-545. doi: 10.1093/sleep/14.6.540.
15. Iber C., Ancoli-Israel S., Chesson A.L., Quran S.F. The AASM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. Westchester, IL: American Academy of Sleep Medicine, 2007.
16. Kapur V.K., Auckley D.H., Chowdhuri S., Kuhlmann D.C., Mehra R., Ramar K., Harrod C.G. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline J. Clin. Sleep Med. 2017, Mar 15. 13(3). 479-504. doi: 10.5664/jcsm.6506.
17. SphygmoCor; AtCor Medical, Sydney, Australia (www.atcormedical.com).
18. Chen C.H., Nevo E., Fetics B., Pak P.H., Yin F.C., Maughan W.L., Kass D.A. et al. Estimation of central aortic pressure waveform by mathematical transformation of radial tonometry pressure validation of generalized transfer function. Circulation. 1997. 95. 1827-1836. doi: 10.1161/01.cir.95.7.1827.
19. Roberto M. Lang, Michelle Bierig, Richard B. Devereux, Frank A. Flachskampf, Elyse Foster Patricia A Pellikka et al. Re-commendations for chamber quantification. Eur. J. Echocardiogr. 2006. 7. 79-108. doi: 10.1016/j.euje.2005.12.014.
20. Dustan H.P. 50th anniversary historical article: hypertension. J. Am. Coll. Cardiol. 1999. 33. 595-597. doi: 10.1016/s0735-1097(99)00069-8.
21. Cruickshank J.K., Rezailashkajani M., Goudot G. Arterial stiffness, fatness, and physical fitness: ready for intervention in childhood and across the life course? Hypertension. 2009 Apr. 53(4). 602-4. doi: 10.1161/HYPERTENSIONAHA.108.128033. Epub 2009, Mar 9.
22. Ikonomidis I., Lekakis J., Papadopoulos C., Triantafyllidi H., Paraskevaidis I. et al. Incremental value of pulse wave velocity in the determination of coronary microcirculatory dysfunction in never-treated patients with essential hypertension. Am. J. Hypertens. 2008 Jul. 21(7). 806-813. doi: 10.1038/ajh.2008.172. Epub 2008, May 22.
23. Triantafyllidi H., Arvaniti C., Lekakis J., Ikonomidis I., Siafakas N. et al. Cognitive impairment is related to increased arterial stiffness and microvascular damage in patients with never-treated essential hypertension. Am. J. Hypertens. 2009 May. 22(5). 525-530. doi: 10.1038/ajh.2009.35. Epub 2009, Mar 5.
24. Mule G., Cottone S., Vadala A., Volpe V., Mezzatesta G., Mongiovì R., Piazza G., Nardi E., Andronico G., Cerasola G. Relationship between albumin excretion rate and aortic stiffness in untreated essential hypertensive patients. Journal of Internal Medicine. 2004. 256. 22-29. doi: 10.1111/j.1365-2796.2004.01338.x.
25. Roman M.J., Devereux R.B., Kizer J.R., Lee E.T., Galloway J.M. Tauqeer Ali, Jason G. Umans, Barbara V. Howard. Central pressure more strongly relates to vascular disease and outcome than does brachial pressure: the Strong Heart Study. Hypertension. 2007 Jul. 50(1). 197-203. doi: 10.1161/HYPERTENSIONAHA.107.089078.
26. Mitchell G.F., Hwang S.J., Vasan R.S., Larson M.G., Pencina M.J. Arterial stiffness and cardiovascular events: the Framingham heart study. Circulation. 2010, Feb 2. 121(4). 505-511. doi: 10.1161/CIRCULATIONAHA.109.886655. Epub 2010, Jan 18.
27. Tine Willum Hansen, Jan A. Staessen, Christian Torp-Pedersen, Susanne Rasmussen, Lutgarde Thijs Hans Ibsen, Jørgen Jeppesen. Prognostic value of aortic pulse wave velocity as index of arterial stiffness in general population. Circulation. 2006. 113. 664-670. doi: 10.1161/CIRCULATIONAHA.105.579342.
28. Inoue N., Maeda R., Kawakami H., Tomoki Shokawa, Hideya Yamamoto, Chikako Ito, Hideo Sasaki. Aortic pulse wave velocity predicts cardiovascular mortality in middle-aged and elderly Japanese men Circ. J. 2009. Vol. 73. № 3. P. 549-553. doi: 10.1253/circj.cj-08-0492.
29. Laurent S., Alivon M., Beaussier H., Boutouyrie P. Aortic stiffness as a tissue biomarker for predicting future cardiovascular events in asymptomatic hypertensive subjects. Ann. Med. 2012 Jun. 44. Suppl. 1. 93-97. doi: 10.3109/07853890.2011.653398.
30. Muiesan M.L., Salvetti M., Paini A., Monteduro C., Rosei C.A. Pulse wave velocity and cardiovascular risk stratification in a general population: the Vobarno study. J. Hypertens. 2010 Sep. 28(9). 1935-1943. doi: 10.1097/HJH.0b013e32833b4a55.
31. Mattace-Raso F.U., van der Cammen T.J., Hofman A., van Popele N.M., Bos M.L., Maarten A.D.H. Schalekamp, Roland Asmar, Robert S. Reneman, Arnold P.G. Hoeks, Monique M.B. Breteler, Jacqueline C.M. Witteman. Arterial stiffness and risk of coronary heart disease and stroke: the Rotterdam study. Circulation. 2006, Feb 7. 113(5). 657-663. doi: 10.1161/CIRCULATIONAHA.105.555235.
32. Redfield M.M., Jacobsen S.J., Borlaug B.A., Rodeheffer R.J., Kass D.A. Age- and gender-related ventricular-vascular stiffening: a community-based study. Circulation. 2005, Oct 11. 112(15). 2254-2262. doi: 10.1161/CIRCULATIONAHA.105.541078.
33. Ikonomidis I., Lekakis J., Stamatelopoulos K., Markomihelakis N., Kaklamanis P.G., Mavrikakis M. Aortic elastic properties and left ventricular diastolic function in patients with Adamantiades-Behcet’s disease. J. Am. Coll. Cardiol. 2004, Mar 17. 43(6). 1075-1081. doi: 10.1016/j.jacc.2003.10.042.
34. Eren M., Gorgulu S., Uslu N., Celik S., Dagdeviren B., Tezel T. Relation between aortic stiffness and left ventricular diastolic function in patients with hypertension, diabetes, or both. Heart. 2004 Jan. 90(1). 37-43. doi: 10.1136/heart.90.1.37.
35. Noda A., Nakata S., Fukatsu H., Yasuda Y., Miyao E., Miyata S., Yasuma F., Murohara T., Yokota M., Koike Y. Aortic pressure augmentation as a marker of cardiovascular risk in obstructive sleep apnea syndrome. Hypertens Res. 2008 Jun. 31(6). 1109-1114. doi: 10.1291/hypres.31.1109.
36. Korcarz C.E., Gepner A.D., Peppard P.E., Young T.B., Stein J.H. The Effects of Sleep-Disordered Breathing on Arterial Stiffness are Modulated by Age. Sleep. 2010 Aug. 33(8). 1081-1085. doi: 10.1164/rccm.200703-500OC.
37. Drager L.F., Bortolotto L.A., Figueiredo A.C., Krie–ger E.M., Lorenzi G.F. Effects of continuous positive airway pressure on early signs of atherosclerosis in obstructive sleep apnea. Am. J. Respir. Crit. Care Med. 2007. 176. 706-712. doi: 10.1164/rccm.200703-500OC.
38. Kohler M., Pepperell J.C., Casadei B., Craig S., Crosthwaite N., Stradling J.R., Davies R.J.O. CPAP and measures of cardiovascular risk in males with OSAS. Eur. Respir. J. 2008. 32. 1488-1496. doi: 10.1183/09031936.00026608.
39. Jones A., Vennelle M., Connell M., Graham McKillop, David E. Newby, Neil J. Douglas, Renata L. Riha. The effect of continuous positive airway pressure therapy on arterial stiffness and endothelial function in obstructive sleep apnea: a randomized controlled trial in patients without cardiovascular disease. Sleep Med. 2013. 14. 1260-1265. doi: 10.1016/j.sleep.2013.08.786.

/47.jpg)
/48.jpg)
/49.jpg)
/50.jpg)
/50_2.jpg)