Резюме
Мета дослідження — рандомізація патогенетичних факторів, що зумовлюють ризик розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання, та створення математичної моделі прогнозування її розвитку. Матеріали та методи. Групи дослідження включали 80 дітей, середній вік пацієнтів — 1,6 ± 0,3 року. Основну групу становили 40 дітей, хворих на гострі запальні бактеріальні захворювання респіраторного тракту, що з урахуванням гематологічної картини була розділена на дві підгрупи: перша підгрупа — 26 дітей з анемією запалення, яка була визначена на 4–5-й день від початку захворювання; друга підгрупа — 14 дітей без анемії. Група порівняння — 20 дітей із залізодефіцитною анемією без запальних проявів. Контрольна група — 20 умовно здорових дітей. Для виявлення ознак, які найбільшою мірою пов’язані з розвитком анемії запалення, використовувався метод факторного аналізу. Основою моделювання для підбору факторних комплексів була обрана кореляційна матриця Спірмена з подальшим визначенням факторного навантаження. Аналіз прогностичної значущості окремих ознак як факторів ризику розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання, проводили на основі розрахунку показника відносного ризику (RR) у таблицях спряженості 2 × 2 з визначенням 95% довірчих інтервалів та критерію хі-квадрат Пірсона (χ2). До найбільш значущих факторів були віднесені інформативні ознаки зі значенням RR більше за 1,0. Для прогнозування ймовірності розвитку анемії запалення використовувався метод бінарної логістичної регресії. Результати. У результаті проведеного факторного аналізу було виокремлено 5 факторів, які мають власні значення більше від 1,0 та описують 70,5 % загальної дисперсії змінних, що вивчалися. Фактор 1 — фактор метаболізму заліза описував 21,5 % загальної дисперсії та включав 2 змінні: кількість еритроцитів та рівень гепсидину. Фактор 2 — фактор анемії описував 14,6 % загальної дисперсії та включав рівень гемоглобіну. Фактор 3 — фактор оксидативного стресу описував 12,7 % загальної дисперсії та включав 2 змінні: вміст нітротирозину та рівень інтерлейкіну-6. Фактор 4 — прозапальний фактор описував 12,2 % загальної дисперсії та включав дані щодо вмісту фосфоліпази А2 та тяжкості перебігу запального захворювання. Фактор 5 — фактор депонування заліза описував 8,9 % загальної дисперсії та включав дані щодо вмісту феритину. На наступному етапі, розрахувавши показник RR, ми визначили 5 факторів ризику, що мають найбільший вплив на розвиток анемії запалення: вміст феритину (≥ 73,2 ± 4,6 нг/мл), наявність грамнегативної мікрофлори як бактеріального агента, що викликала розвиток запального захворювання, наявність фебрильної лихоманки в пацієнта, повторний епізод запального захворювання, рівень гепсидину (≥ 1,9 ± 0,11 нг/мл). Висновки. На підставі результатів проведеного факторного аналізу було сформовано прогностичну модель щодо розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання. За результатами факторного аналізу встановлено, що провідний внесок у патогенез розвитку анемії запалення робили порушення метаболізму заліза на тлі запального процесу, у тому числі процесів депонування заліза, оксидативного стресу та рівня інтерлейкіну-6. Визначені фактори ризику та результати прогностичного моделювання доцільно використовувати щодо групи високого ризику розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання.
Background. Randomization of pathogenetic factors that determine the risk of developing anemia of inflammation in young children with acute inflammatory bacterial diseases of the respiratory system, and the creation of a mathematical model for predicting its development were the purposes of the study. Materials and methods. The study groups included 80 children, the average age of the patients was 1.6 ± 0.3 years. The basic group consisted of 40 children with acute inflammatory bacterial respiratory diseases, which, taking into account the hematological picture, was divided into two subgroups: the first subgroup — 26 children with anemia of inflammation, which was determined 4–5 days after the onset of the disease; the second subgroup — 14 children without anemia. The comparison group enrolled 20 children with iron deficiency anemia without inflammatory manifestations. The control group consisted of 20 apparently healthy children. To identify the signs that are most associated with the development of anemia of inflammation, the method of factor analysis was used. The basis of modeling for the selection of factor complexes was the Spearman correlation matrix with the subsequent determination of the factor loading. The analysis of the prognostic significance of individual signs as risk factors for the development of anemia of inflammation in young children with acute inflammatory bacterial respiratory diseases was carried out based on calculating the relative risk (RR) index in 2 x 2 contingency tables with the determination of 95% confidence intervals (95% CI) and Pearson’s χ2 test. The most significant factors included informative signs with an RR value of more than 1.0. To predict the probability of developing anemia of inflammation, the method of binary logistic regression was used. Results. The factorial analysis results demonstrated five factors that have eigenvalues greater than 1.0 and describe 70.5 % of the total dispersion of the variables. Factor 1, the “factor of iron metabolism”, described 21.5 % of the total variance and included 2 variables: the number of red blood cells and the level of hepcidin. Factor 2, the “anemia factor”, described 14.6 % of the total dispersion and included hemoglobin levels. Factor 3, “oxidative stress factor”, described 12.7 % of the total dispersion and included 2 variables: nitrotyrosine content and IL-6 level. Factor 4, the “pro-inflammatory factor”, described 12.2 % of the total dispersion and included data on phospholipase A2 content and the severity of the inflammatory disease. Factor 5, “iron deposition factor”, described 8.9 % of the total dispersion and included ferritin level data. At the next stage, calculating the RR index, we identified five risk factors that have the greatest influence on the development of anemia of inflammation: ferritin content (≥ 73.2 ± 4.6 ng/ml), the presence of gram-negative microflora as a bacterial agent that caused the development of inflammatory diseases, the presence of febrile fever in the patient, repeated episode of inflammatory disease, hepcidin level (≥ 1.9 ± 0.11 ng/ml). Conclusions. Based on the results of the conducted factor analysis, a prognostic model was formed for the development of anemia of inflammation in young children with acute inflammatory bacterial respiratory diseases. According to the results of factor analysis, it was found that the leading contribution to the pathogenesis of the development of anemia of inflammation was made by disorders of iron metabolism against the background of the inflammatory process, including the processes of iron deposition; oxidative stress, and interleukin-6. It is advisable to use certain risk factors and the results of predictive modeling regarded to the group of high risk of developing anemia of inflammation in young children with acute inflammatory bacterial respiratory diseases.
Вступ
Патофізіологія анемії запалення багатофакторна [1]. Процес еритропоезу порушується внаслідок дії запальних цитокінів, які знижують проліферацію еритроїдних попередників і рівень еритропоетину [2]. Крім того, знижується рівень сироваткового заліза при анемії запалення у відповідь на підвищення синтезу гепсидину, що є маркером метаболізму заліза в організмі. Він викликає деградацію феропортину, експортера заліза, що призводить до секвестрації заліза всередині клітин і подальшого зниження вмісту заліза в плазмі [3]. Однак ми припускаємо, що в разі розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання, розуміння ланок її патогенезу та, як наслідок, чинників, які визначають ризик її розвитку, може значно розширюватися.
Мета дослідження — рандомізація патогенетичних факторів, що зумовлюють ризик розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання, та створення математичної моделі прогнозування її розвитку.
Матеріали та методи
Під спостереженням перебували 80 дітей віком від 1 місяця до 3 років (середній вік пацієнтів становив 1,6 ± 0,3 року). Основну групу становили 40 дітей, хворих на гострі запальні бактеріальні захворювання респіраторного тракту. З урахуванням гематологічної картини основна група була розділена на дві підгрупи. До складу першої підгрупи увійшли 26 дітей з анемією запалення, що була визначена на 4–5-й день від початку захворювання шляхом загального аналізу крові. Другу підгрупу становили 14 дітей без анемії. Група порівняння представлена 20 дітьми із залізодефіцитною анемією без запальних проявів. До складу контрольної групи увійшли 20 умовно здорових дітей. Групи спостереження були репрезентативні за віком і статтю дітей. Ураховувалися строки госпіталізації дитини та початок застосування антибактеріальної терапії від початку захворювання. Для визначення тяжкості перебігу гострого бронхіту було використано шкалу Acute Bronchitis Severity Score (ABSS) [5]. Для визначення тяжкості перебігу гострої пневмонії було застосовано шкалу Pediatric Respiratory Severity Score (PRESS) [6].
Було проведене визначення вмісту нітротирозину, феритину, фосфоліпази А2, інтерлейкіну-6, гепсидину, еритропоетину, вітаміну D шляхом імуноферментного аналізу з використанням комерційних наборів: Nitrotyrosine, ELISA (Hucult Biotech); Ferritin ELISA (ORGENTEC Diagnostika GmbH, Німеччина); Enzyme-Linked Immunosorbent Assay (ELISA) Kit For Phospholipase A2 Lipoprotein Associated (LpPLA2); Human IL-6 (Interleukin-6) ELISA Kit (Elabsciene Biotechnology Inc., США); Human Hepc (Hepcidin) ELISA Kit (Elabscience, США); EPO (Erythropoietin) ELISA (Biomerica, Німеччина); 25OH Vitamin D Total ELISA (DIAsource ImmunoAssays S.A., Бельгія).
Вміст сироваткового заліза було визначено біохімічним методом на аналізаторі Midray BS-200. Визначення загальної здатності зв’язування заліза сироватки крові було виконано біохімічним методом на аналізаторі Midray BS-200 з використанням комерційного набору CORMAY IBC (PZ CORMAY S.A., Польща).
Математичний аналіз та статистична обробка даних проводились із використанням ліцензійного пакета програм Statisticа for Windows 13.0 (JPZ8041382130ARCN10-J) та IBM SPSS Statistics v.23. Застосовували метод кореляційного аналізу з визначенням коефіцієнта рангової кореляції Спірмена. Для виявлення ознак, які найбільшою мірою пов’язані з розвитком анемії запалення, використовувався метод факторного аналізу. Основою моделювання для підбору факторних комплексів була обрана кореляційна матриця Спірмена з подальшим визначенням факторного навантаження показників, що вивчалися. Для вибірки показників із високим факторним навантаженням на комплекс (понад 0,7) використовували метод ортогонального обертання VARIMAX. Факторний аналіз із використанням обертання VARIMAX виконаний з урахуванням результатів початкового аналізу та використанням для опису дисперсії масиву даних головних компонент. Для виявлення стійких груп факторів, що характеризуються спільністю досліджуваних параметрів для всієї вибірки, проводився кластерний аналіз. Процедура класифікації об’єктів здійснювалася за допомогою ієрархічної кластеризації методом центроїдної кластеризації, графічне відображення якого було продемонстровано побудовою дендрограми. Мірою відстані між сформованими кластерами була евклідова відстань. Аналіз прогностичної значущості окремих ознак як факторів ризику розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання, проводили на основі розрахунку показника відносного ризику (RR) у таблицях спряженості 2 × 2 з визначенням 95% довірчих інтервалів (95% ДІ) та критерію хі-квадрат Пірсона (χ2). До найбільш значущих факторів були віднесені інформативні ознаки зі значенням RR більше за 1,0. Для прогнозування ймовірності розвитку анемії запалення використовувалося рівняння логістичної регресії: р = 1/(1 + еxp(–z)), де z = a0 + a1 • x1 + a2 • x2 + ... + an • xn; x1, .., xn — незалежні змінні, а0, ..., аn — коефіцієнти регресії. Якщо розраховане значення р ≥ 0,5, то даного хворого слід віднести до групи ризику щодо розвитку анемії запалення. Якщо ж розраховане значення р < 0,5, то імовірність розвитку анемії запалення досить низька. Якість побудованої моделі оцінювали за її чутливістю та специфічністю [7]. Статистичну значущість моделі оцінювали за Omnibus Test (універсальний критерій коефіцієнтів) та прогностичною категоріальною валідністю тесту.
Проведені дослідження відповідали етичним нормам інституційного та національного дослідницького комітету, Гельсінській декларації 1964 року, включно з наступними поправками, й етичним стандартам. Інформовану згоду було отримано від батьків кожного пацієнта, залученого в дослідження. Повні дані, надані батьками дітей, які перебували під спостереженням, і лікарями, підтверджують результати дослідження, є конфіденційними і загальнонедоступними.
Результати та обговорення
Ми провели аналіз взаємозв’язків між показниками, які, імовірно, мали б значення щодо розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання. Ми виокремили такі потенційні предиктори: вік пацієнта, день захворювання та тяжкість перебігу, тривалість антибактеріальної терапії, показники гемограми (гемоглобін, еритроцити, лейкоцити, сироваткове залізо, загальна залізозв’язуюча здатність сироватки крові, коефіцієнт насичення трансферину залізом) та вміст нітротирозину, феритину, фосфоліпази А2, інтерлейкіну-6 (ІЛ-6), гепсидину, еритропоетину, вітаміну D.
У результаті проведеного факторного аналізу було виокремлено 5 факторів, які мають власні значення більше 1 та описують 70,5 % загальної дисперсії змінних, що вивчалися (табл. 1).
На наступному етапі дослідження, використовуючи метод головних компонент, було створено матрицю факторних навантажень (табл. 2).
/41.jpg)
Згідно з отриманими результатами, найбільшої значущості набував фактор 1, що описував 21,5 % загальної дисперсії та включав 2 змінні з провідним факторним навантаженням: кількість еритроцитів (факторне навантаження –0,835) та рівень гепсидину (факторне навантаження –0,870). Умовно даний фактор був позначений як фактор метаболізму заліза. Його першочергове фундаментальне значення в розвитку анемії запалення є цілком закономірним. Адже збільшення рівня гепсидину зумовлює обмеження пулу позаклітинного заліза, запобігання його вивільненню з клітин та доступності для еритропоезу, призводить до секвестрації заліза в кишечнику. Даний процес є можливим за рахунок депонування заліза в клітинах ретикулоендотеліальної системи [3]. У відповідь на даний процес маніфестує анемія залізоперерозподільного генезу [2]. Індукований гепсидином стан залізодефіциту виступає як механізм імунного захисту для зменшення доступності заліза для позаклітинних бактеріальних агентів [8]. Тож логічним виглядає визначення наступного фактора. Другий фактор описував 14,6 % загальної дисперсії та включав рівень гемоглобіну (факторне навантаження –0,745). Умовно даний фактор був позначений як фактор анемії.
Третій фактор описував 12,7 % загальної дисперсії та включав 2 змінні з провідним факторним навантаженням: вміст нітротирозину (факторне навантаження 0,840) та рівень ІЛ-6 (факторне навантаження 0,772). Умовно даний фактор був позначений як фактор оксидативного стресу. Секвестрація заліза призводить до недостатнього транспортування кисню в тканини, що, зі свого боку, зумовлює збільшення концентрації медіаторів запалення, у відповідь на функціонування яких спостерігається генерація активованих кисне- та азотовмісних метаболітів, які призводять до посилення оксидативного стресу в організмі. У низці інших медіаторів запалення ІЛ-6 безпосередньо впливає на гепатоцити, стимулюючи синтез гепсидину [9], порушує захоплення заліза еритроїдними попередниками та сприяє збереженню заліза в макрофагах шляхом стимуляції експресії феритину [10].
Четвертий фактор описував 12,2 % загальної дисперсії та включав дані щодо вмісту фосфоліпази А2 (факторне навантаження –0,713) та тяжкості перебігу запального захворювання (факторне навантаження –0,772). Умовно даний фактор був позначений як прозапальний фактор. Адже однією з найбільш помітних функцій фосфоліпази А2 є її здатність ініціювати запальну відповідь. Фосфоліпаза А2 при гідролізі окислених фосфоліпідів призводить до утворення медіаторів запалення — лізофосфатидилхоліну й окислених жирних кислот [11]. Окрім того, слід зазначити, що грамнегативні бактерії з широким спектром специфічності містять на зовнішній мембрані фосфоліпазу А2 [12].
П’ятий фактор описував 8,9 % загальної дисперсії та включав дані щодо вмісту феритину (факторне навантаження 0,908). Умовно даний фактор був позначений як фактор депонування заліза. Складно переоцінити роль феритину в розвитку анемії залізоперерозподільного генезу. Адже прозапальні цитокіни, ініціювавши механізм перерозподілу заліза, індукують експресію феритину, що є основним цитоплазматичним протеїном депо заліза в ретикулоендотеліальній системі [13]. Феритин відображає стан заліза в організмі, що з урахуванням захисного механізму депонування при анемії запалення не досягає критично низьких показників [14].
З урахуванням отриманих даних факторного аналізу було виконано кластерний аналіз провідних патогенетичних факторів. За результатами ієрархічного кластерного аналізу, визначену низку патогенетичних факторів розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання, було диференційовано на 2 кластери (рис. 1).
Дані ієрархічного кластерного аналізу демонструють, що на початковому етапі формується асоціативний взаємозв’язок між рівнем гемоглобіну та вмістом феритину в сироватці крові (кластер 1).
Далі за результатами кластерного аналізу сформовано агломерацію між прозапальними маркерами (фосфоліпаза А2 та ІЛ-6), тяжкістю перебігу запального захворювання, маркером метаболізму заліза гепсидином і, що є цілком логічним, кількістю еритроцитів (кластер 2).
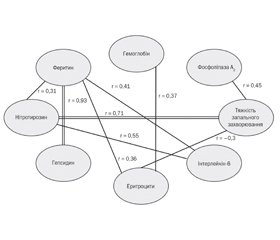
Для уточнення структурних взаємозв’язків, що мають патогенетичне значення для розвитку анемії запалення, ми провели кореляційний аналіз змінних, який продемонстрував наявність значущих взаємозв’язків між усіма визначеними чинниками, що впливають на патогенез розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання (рис. 2).
/43_2.jpg)
З огляду на ймовірну роль великої кількості факторів у розвитку анемії запалення в дітей, хворих на гострі запальні бактеріальні захворювання органів дихання, на наступному етапі дослідження ми проаналізували на підставі розрахунку RR вплив анамнестичних (стать дитини, вік пацієнта, акушерський анамнез матері, повторний епізод запального захворювання) факторів, даних лабораторних досліджень (вміст феритину, гепсидину, вітаміну D3, еритропоетину, заліза, залізозв’язуча здатність сироватки крові, насичення трансферином заліза, особливості патогенної мікрофлори, лейкоцитарна формула), особливостей клінічного перебігу захворювання (тяжкість захворювання, лихоманка, тривалість захворювання, початок антибактеріальної терапії). Ми визначили 5 факторів ризику, що мають найбільший вплив на розвиток анемії запалення в дітей, хворих на гострі запальні бактеріальні захворювання органів дихання. Під час роботи було виключено ті фактори, відносний ризик яких становив 1,0 та менше, що дозволило вважати їх малозначущими (табл. 3).
Методом бінарної логістичної регресії було створено математичну модель прогнозування розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання.
За результатами проведеної логістичної регресії модель прогнозу ймовірності розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання, мала вигляд рівняння:
Z = 1/(1 + еxp( –2,2629 + 0,03314X1 – 0,09066X2 + 0,494X3 + 0,2473X4 + 0,00534X5),
де коефіцієнти регресії для кожної з маркерних ознак подані для кожної змінної Х1–Х5, а коефіцієнт –2,2629 є константою: Х1 — феритин (коефіцієнт регресії 0,03314); Х2 — грамнегативна мікрофлора збудника захворювання (коефіцієнт регресії 0,09066); Х3 — фебрильна лихоманка (коефіцієнт регресії 0,097); Х4 — повторний епізод захворювання (коефіцієнт регресії 0,494); Х5 — гепсидин (коефіцієнт регресії 0,00534).
Якщо розраховане значення р ≥ 0,5, то пацієнта слід віднести в групу хворих, в яких з високою ймовірністю може розвинутися анемія запалення. При значенні р < 0,5 імовірність розвитку анемії запалення низька.
Класифікаційна здатність моделі визначалася за даними навчальної вибірки і становила 74,8 %. Чутливість моделі дорівнювала 78,3 %, а специфічність — 80,5 %. Результати Omnibus Test (універсальний критерій коефіцієнтів моделі) підтвердили статистичну значущість даної моделі (χ2 = 32,325; df = 5; р = 0,015). Коефіцієнт прогностичної категоріальної валідності тесту становив r = 0,62.
Таким чином, установлення факторів ризику в дитини, хворої на гострі запальні бактеріальні захворювання органів дихання, щодо розвитку анемії запалення за допомогою результатів запропонованого рівняння логістичної регресії дозволяє спрогнозувати вірогідність її маніфестації. Отримані результати дослідження мають значення для лікувально-профілактичної тактики щодо конкретного пацієнта з метою запобігання виникненню та/або прогресуванню анемії запалення.
Висновки
1. На підставі результатів проведеного факторного аналізу було сформовано прогностичну модель щодо розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання.
2. За результатами факторного аналізу встановлено, що провідний внесок у патогенез розвитку анемії запалення робили порушення метаболізму заліза на тлі запального процесу, у тому числі процесів депонування заліза, оксидативного стресу та рівня інтерлейкіну-6.
3. Основними факторами ризику, що мали вплив на розвиток анемії запалення в дітей, хворих на гострі запальні бактеріальна захворювання органів дихання, є вміст феритину (≥ 73,2 ± 4,6 нг/мл), наявність грамнегативної мікрофлори як бактеріального агента, що викликав розвиток запального захворювання, наявність фебрильної лихоманки в пацієнта, повторний епізод запального захворювання, рівень гепсидину (≥ 1,90 ± 0,11 нг/мл).
4. Визначені фактори ризику та результати прогностичного моделювання доцільно використовувати щодо групи високого ризику розвитку анемії запалення в дітей раннього віку, хворих на гострі запальні бактеріальні захворювання органів дихання.
Інформація про фінансування. Робота виконана у рамках науково-дослідницької роботи кафедри «Активність ендогенних антимікробних пептидів у дітей з гострими та рецидивуючими захворюваннями органів дихання», номер держреєстрації 0116U005346.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Отримано/Received 26.04.2021
Рецензовано/Revised 10.05.2021
Прийнято до друку/Accepted 15.05.2021
Список литературы
1. Boshuizen M., van Bruggen R., Zaat S., Schultz M., Aguilera E., Motos A. et al. Development of a model for anemia of inflammation that is relevant to critical care. Intensive Care Medicine Experimental. 2019. 7(S1). https://doi.org/10.1186/s40635-019-0261-2.
2. Ganz T. Anemia of Inflammation. New England Journal оf Medicine. 2019. 381(12). 1148-1157. https://doi.org/10.1056/nejmra1804281.
3. Meyron-Holtz E. Mammalian Tissue Oxygen Levels Modulate Iron-Regulatory Protein Activities in Vivo. Science. 2004. 306(5704). 2087-2090. https://doi.org/10.1126/science.1103786.
4. Bancalari E., Claure N., Sosenko I. Bronchopulmonary dysplasia: changes in pathogenesis, epidemiology and definition. Seminars in Neonatology. 2003. 8(1). 63-71. PMID: 12667831.
5. Mwachari C., Nduba V., Nguti R., Park D.R., Sanguli L., Cohen C.R. Validation of a new clinical scoring system for acute bronchitis. International Journal of Tuberculosis and Lung Disease. 2007. 11(11). 1253-1259. PMID: 17958990.
6. Yumiko M., Kazuko S., Asako N. Pediatric Respiratory Severity Score (PRESS) for Respiratory Tract Infections in Children. Austin Virol and Retrovirology. 2015. 2(1). 10-19.
7. Lyakh Yu.E., Gurianov V.G. Mathematic modeling for classification problems in biomedicine. Ukrainian journal of telemedicine and medical telematics. 2012. 10(2). 69-76. (in Ukrainian).
8. Michels K., Zhang Z., Bettina A., Cagnina R., Stefanova D., Burdick M. et al. Hepcidin-mediated iron sequestration protects against bacterial dissemination during pneumonia. JCI Insight. 2017. 2(6). https://doi.org/10.1172/jci.insight.92002.
9. Varga E., Pap R., Jánosa G., Sipos K., Pandur E. IL-6 Regulates Hepcidin Expression Via the BMP/SMAD Pathway by Altering BMP6, TMPRSS6 and TfR2 Expressions at Normal and Inflammatory Conditions in BV2 Microglia. Neurochemical Research. 2021. 46(5). 1224-1238. https://doi.org/10.1007/s11064-021-03322-0.
10. Papanikolaou G., Pantopoulos K. Systemic iron homeostasis and erythropoiesis. IUBMB Life. 2017. 69(6). 399-413. https://doi.org/10.1002/iub.1629.
11. Astudillo A., Balboa M., Balsinde J. Selectivity of phospholipid hydrolysis by phospholipase A2 enzymes in activated cells leading to polyunsaturated fatty acid mobilization. Biochimica Et Biophysica Acta (BBA) — Molecular And Cell Biology Of Lipids. 2019. 1864(6). 772-783. https://doi.org/10.1016/j.bbalip.2018.07.002.
12. Istivan T., Coloe P. Phospholipase A in Gram-negative bacteria and its role in pathogenesis. Microbiology. 2006. 152(5). 1263-1274. https://doi.org/10.1099/mic.0.28609-0.
13. Wessling-Resnick M. Iron Homeostasis and the Inflammatory Response. Annual Review оf Nutrition. 2010. 30(1). 105-122. https://doi.org/10.1146/annurev.nutr.012809.104804.
14. Weiss G., Ganz T., Goodnough L. Anemia of inflammation. Blood. 2019. 133(1). 40-50. https://doi.org/10.1182/blood-2018-06-856500.
/42.jpg)

/41.jpg)
/43_2.jpg)
/43.jpg)