У педіатричній популяції, особливо в немовлят і дітей раннього і молодшого віку, дегідратація часто ускладнює перебіг різних захворювань. Причиною цього є вищий рівень обміну речовин, неможливість повідомити про свої потреби й недостатнє ентеральне надходження рідини, а також збільшення позаниркових втрат рідини. До екстраренальних втрат належить виділення рідини через дихальну систему, шкіру й випорожнення [1].
Загальна кількість води в організмі в немовлят і дітей вища, ніж у дорослих. У немовлят вона становить 70 % від загальної ваги, тоді як у дітей більш старшого віку й дорослих вона становить 65 і 60 % відповідно. Загальний об’єм рідини в організмі людини розподіляється у двох основних секторах: 2/3 знаходиться у внутрішньоклітинному відділі, а інша третина розподіляється між інтерстиціальним простором (75 %) і плазмою (25 %). Дегідратація спричиняє зменшення загальної кількості води в організмі як у внутрішньоклітинному, так і в позаклітинному об’ємі рідини. Об’єм дефіциту рідини тісно корелює з ознаками й симптомами зневоднення [2].
Серед причин зневоднення в дітей провідне місце посідають інфекційні діареї. Іншими поширеними захворюваннями, що можуть призводити до втрат рідини, є синдром циклічного блювання (СЦБ), недіабетичний кетоз і кетоацидоз, діабетичний кетоацидоз, нецукровий діабет, опіки й надмірне потовиділення.
Гострі інфекційні діареї належать до найпоширеніших захворювань дитячого віку. З ними пов’язано близько 10 % дитячих смертей і майже 70 мільйонів втрачених людських життів на рік у всьому світі. Найбільша захворюваність реєструється серед дітей перших п’яти років життя [3]. В етіології інфекційних діарей відіграють роль вірусні, бактеріальні й паразитарні патогени. На даний час до найпоширеніших збудників належать ротавіруси, норовіруси, а також ентеральні аденовіруси, саповірус та астровіруси. Серед бактеріальних чинників частими причинами захворювань у дітей є сальмонели, кампілобактер і шигела, а до збудників поширених паразитарних інфекційних діарей належать криптоспоридії, лямблії та амеби [4]. Клінічна картина гострих інфекцій шлунково-кишкового тракту зазвичай включає симптоми загальної інтоксикації, зокрема лихоманку, зниження апетиту й млявість/слабкість, прояви місцевого ураження у вигляді діареї, блювання, больового синдрому, а також симптоми зневоднення. В основі розвитку інтоксикаційних проявів лежить запальна відповідь організму на вторгнення патогенних чинників. Токсичні прояви можуть також посилюватись проявами ендогенної інтоксикації через виснаження механізмів підтримання гомеостазу. Діарея виникає внаслідок порушення реабсорбції води або підвищення її секреції в кишечнику. У розвитку діареї можуть брати участь різні механізми, і їх спектр залежить від етіології захворювання. У деяких випадках діарея стає результатом порушення клітинних механізмів абсорбції і секреції води. Наприклад, при холері цей механізм є достатньо вивченим. Патогенні вібріони, які колонізують кишечник, виділяють ентеротоксин, що проникає всередину клітин епітелію. У клітинах токсин каталізує АДФ-рибозилювання регуляторної альфа-субодиниці аденілатциклази, викликаючи підвищення цАМФ. Це, у свою чергу, спричиняє біохімічний каскад, що призводить до порушення роботи іонно-транспортних систем і запуску транспорту електролітів і рідини через мембрану епітеліальної клітини в зворотному напрямку. В іншому варіанті діарея виникає внаслідок місцевого запального процесу в стінці кишечника, що супроводжується запальною гіперсекрецією, порушенням інтеграції кишкового епітелію і підвищенням його проникності для іонів і води. У такий спосіб розвивається діарея, зокрема, при шигельозі й сальмонельозі [5]. Важливу роль у розвитку діареї відіграє осмотичний механізм. Ураження епітеліальних клітин тонкого кишечника, зокрема при вірусних інтестинальних інфекціях, призводить до пригнічення ферментативної активності на поверхні епітелію і розвитку мальабсорбції [6]. Крім того, у патологічний процес також залучається нервова система кишечника. Її стимуляція патогенними факторами збудників інфекційних діарей призводить до порушень моторики й гіперсекреції [7].
Окрім діареї, при інфекційних діареях до втрат рідини й електролітів може призводити також блювання. Цей синдром спостерігається в більшості дітей з гострими інфекційними діареями. Блювання не тільки спричиняє втрати рідини й електролітів, але й часто перешкоджає проводити ентеральне харчування і прийом рідини. Механізм розвитку блювання при інфекційних діареях ще остаточно не з’ясований. Визнається, що ключова роль у регуляції належить декільком ядрам у довгастому мозку. Серед цих ядер, як вважається, головним є ядро одиночного тракту (nucleus tractus solitarius, NTS) у дорсальному вагусному комплексі. Стимули, що провокують блювання, надходять до NTS зі шлунково-кишкового тракту та інших вісцеральних органів через блукаючий нерв, вестибулярну систему й вищі ділянки мозку, включно з корою головного мозку, гіпоталамусом, мозочком і заднім полем (area postrema). Останнє є тригерною зоною хеморецепторів і важливим компонентом блювальної дуги. NTS має взаємні зв’язки з вищими центрами центральної нервової системи, включно з парабрахіальним ядром, гіпоталамусом, лімбічною системою і кінцевим мозком, забезпечуючи інтеграцію різних сенсорних, афективних та емоційних реакцій на нудоту й блювання [8]. При інфекційних діареях провідна роль, як вважається, належить активації ентерохромафінних клітин стінки кишечника з вивільненням серотоніну (5-гідрокситриптамін), що призводить до активації аферентних гілок блукаючого нерва, пов’язаних зі стовбуровими структурами мозку, відповідальними за блювання [9].
Лихоманка також часто є складовою клінічної картини інфекційних захворювань, зокрема інфекційних діарей. У нормі через шкіру й дихальні шляхи відбувається близько 50 % добових втрат рідини [10]. Зростання температури тіла супроводжується компенсаторним зростанням випаровування з поверхні шкіри й дихальних шляхів. За даними експериментальних досліджень було визначено, що підвищення температури понад 39 °С супроводжується збільшенням випаровування з перспірацією на 0,06 мл/кг/год. А випаровування зі шкіри при температурі понад 39,5 °С збільшується в 6–8 разів порівняно з базальним рівнем [11].
Іншою частою причиною розвитку синдрому дегідратації в дитячому віці є синдром циклічного блювання. Це хронічне захворювання, що характеризується раптовими епізодами нудоти й блювання. Частота СЦБ серед дітей становить 0,04–2 %. Дорослі також страждають від цього захворювання. Наприклад, є дані, що цей синдром спостерігається в 3–14 % дорослих, які обстежуються з приводу нудоти й блювання невідомого походження. У середньому діагноз СЦБ уперше встановлюється в дітей віком 5,2 року, а серед дорослих пацієнтів — у віці 25,4 року [12]. Згідно з Римськими критеріями IV (Rome IV), для діагностики синдрому циклічного блювання в пацієнта мають бути стереотипні епізоди блювання з гострим початком і тривалістю менше від 1 тижня. Повинно бути щонайменше три дискретні епізоди за попередній рік і два епізоди за останні 6 місяців, що відбуваються з інтервалом не менше від 1 тижня. Між цими епізодами блювання немає, але можуть спостерігатись певні більш легкі симптоми [13].
Симптоми захворювання характеризуються блюванням і дифузними болями в животі в епігастральній ділянці. Перебіг СЦБ зазвичай має чотири фази: продромальна (прееметична), гостра (блювання, гіперемезис), відновлення й ремісія (міжепізодична). Деякі пацієнти описують ауру під час продромальної фази, що триває від декількох хвилин або до годин і зазвичай характеризується болем в животі, анорексією, млявістю, блідістю або вегетативними симптомами, такими як пітливість або слиновиділення. Епізоди блювання можуть провокуватись емоційним стресом, виснажливими станами, такими як недосипання, голодування й інфекції. Є дані, що деякі харчові продукти (наприклад, шоколад, сир і глутамат натрію) і менструальні цикли також можуть спровокувати загострення хвороби. Гостра фаза зазвичай починається вранці або в середині дня і характеризується інтенсивною постійною нудотою з повторним блюванням. Середня тривалість симптомів гострої фази в дітей становить 3,4 дня. При ендоскопічному дослідженні в пацієнтів у гострій фазі СЦБ можуть виявлятись ознаки пептичного езофагіту й геморагічні ураження слизової шлунка. Під час фази відновлення блювання припиняється, нормалізується енергетичний баланс, покращується апетит. Після одужання пацієнт переходить у безсимптомну фазу, що вважається ремісією. Середньорічна частота загострень СЦБ становить у середньому 9,6 епізоду на рік [12].
На даний час патогенез СЦБ остаточно не з’ясований. У літературі озвучуються різні гіпотези. Серед імовірних механізмів може бути активація осі «гіпоталамус — гіпофіз — надниркові залози», що запускається психологічним або фізичним стресом. Крім того, серед можливих причин називається аномальне спорожнення шлунка (наприклад, при синдромі подразненого кишечника й синдромі гастроезофагеального рефлюксу), дисфункція вегетативної нервової системи, дисфункція мітохондрій, підвищений рівень греліну, харчова алергія, психічні розлади (наприклад, тривожність і депресія) і цукровий діабет. Дослідження також показують тісний взаємозв’язок СЦБ і головних болів при мігрені, особливо в пацієнтів дитячого віку. Хоча ця остання асоціація не до кінця зрозуміла, вона свідчить про можливий механізм, у якому основну роль відіграють розлади центральної нервової системи [12, 14].
Дегідратація і тяжкий перебіг захворювань у дітей тісно корелюють з підвищенням концентрації кетонових тіл у крові й кетонурією [15, 16]. Кетогенез — це метаболічний шлях, що виробляє кетонові тіла, які забезпечують альтернативну форму енергії для організму. Кетонові тіла утворюються внаслідок метаболізму жирних кислот у мітохондріях печінки під час низки фізіологічних і патологічних станів, пов’язаних зі зміненим метаболізмом глюкози або відносним дефіцитом глюкози або глікогену. Організм постійно виробляє невелику кількість кетонових тіл, які за нормальних обставин можуть виробляти по 22 молекули аденозинтрифосфату (АТФ), і це регулюється головним чином інсуліном. Коли запаси вуглеводів значно зменшуються або збільшується концентрація жирних кислот, відбувається стимуляція кетогенного шляху й збільшується вироблення кетонових тіл. Це може відбуватись при зниженні концентрації інсуліну, недостатньому або незбалансованому харчуванні, інфекціях та інтоксикаціях, емоційній і фізичній травмі, прийомі лікарських засобів тощо [17, 18]. Кетонові тіла включають три види хімічних речовин: ацетоацетат, ацетон і β-гідроксибутират. Кетони в основному використовуються як поживний матеріал клітинами серця, нирок, центральної нервової системи й скелетних м’язів. Ці тканини виробляють фермент сукциніл-коензим А-оксокислотну трансферазу. Це дозволяє їм виробляти ацетил-коензим А з кетонових тіл і, зрештою, АТФ через цикл трикарбонових кислот. Діти раннього віку більш сприйнятливі до кетозу через зменшення запасів глікогену й пропорційно більшу центральну нервову систему, ніж у дорослих [19]. Підвищення концентрації кетонів у клінічній картині супроводжується зазвичай не тільки симптомами дегідратації, але й порушенням поведінки, сплутаністю свідомості, нудотою, блюванням або болем у животі [18]. У тяжких випадках накопичення кетонових тіл, через їх кислу реакцію, призводить до кетоацидозу, як це спостерігається при неконтрольованому діабеті. Для визначення варіанта кетоацидозу без захворювання на діабет зазвичай використовується термін «недіабетичний кетоацидоз» [20].
Втрати рідини при діареї, блюванні, лихоманці в поєднанні з порушенням апетиту й зменшенням ентерального надходження рідини призводять до дефіциту води й електролітів. Залежно від ступеня зневоднення в пацієнта можуть бути наявні різні ознаки й симптоми. Дегідратація класифікується таким чином: легка — при втраті маси від 3 до 5 % ваги тіла, помірна — від 6 до 10 % і тяжка — понад 10 %. Оскільки в немовлят загальний вміст води в організмі становить 70–80 % маси тіла, а в дітей старшого віку — близько 60 % маси тіла, немовлята мають втратити більше маси тіла, ніж старші діти, щоб досягти того ж рівня зневоднення. Найточніша оцінка ступеня дегідратації базується на різниці між передморбідною масою тіла (впродовж останніх 2 тижнів) і поточною масою тіла (наприклад, у дитини 10 кг, яка зараз важить 9,5 кг, є дефіцит води 500 мл, що становить 5 % зневоднення). У випадках, коли попередніх даних про вагу немає, використовується анамнез і клінічне обстеження, щоб оцінити ступінь зневоднення. У табл. 1 подана одна з можливих шкал для клінічної оцінки ступеня зневоднення [4].
/59.jpg)
Окрім втрат води, патологічні стани також призводять до дисбалансу електролітів і порушення кислотно-основної рівноваги. Зокрема, при інтенсивному блюванні існує ризик розвитку метаболічного алкалозу. Як відомо, шлунковий секрет зазвичай містить 120−160 ммоль/л аніонів хлору (Cl−), збалансованих катіонами калію, натрію і водню (K+, Na+ і H+). У базальних умовах основним катіоном є Na+, а при стимуляції починає переважати катіон H+, рівень якого зростає до 100 ммоль/л. Концентрація калію зберігається приблизно на одному рівні як у базальному режимі, так і при стимуляції — 10 ммоль/л. При блюванні відбуваються значні втрати іонів Cl− і H+. Втрати Н+ призводять до зростання концентрації HCO3− у сироватці крові й одночасно викликають зменшення секреції HCO3− підшлунковою залозою у дванадцятипалу кишку. У результаті розвивається метаболічний алкалоз, що підтримується також втратами аніонів Cl− [21]. Метаболічний алкалоз, спровокований зменшенням внутрішньоклітинної та інтерстиційної концентрації Н+, у свою чергу, запускає механізм респіраторної компенсації. При цьому стовбурові структури головного мозку пригнічують дихальну функцію і зменшують легеневу вентиляцію, що призводить до затримки діоксиду вуглецю (PaCO2). Зростання бікарбонату на 1 ммоль/л супроводжується збільшенням концентрації PaCO2 на 0,7 мм рт.ст. (від 0,6 до 1,0 мм рт.ст.) в артеріальній крові. Блювання також призводить до швидких втрат іонів натрію. На початку втрата Na+ супроводжується зростанням екскреції K+, однак цей процес швидко призводить до виснаження запасів K+ і гіпокаліємії [22]. Алкалоз і гіпокаліємія зберігаються до того часу, поки не припиниться втрата електролітів через блювання і не поповняться їх запаси.
Діарея, на відміну від блювання, частіше асоціюється з метаболічним ацидозом. Кишковий секрет дистальніше від шлунка, включно із секретом підшлункової залози й жовчовивідних шляхів, є відносно лужним. Зокрема, вміст бікарбонату в панкреатичному секреті становить 70−120 ммоль/л, а в біліарному — 40−60 ммоль/л [21]. Надмірні втрати бікарбонату з фекаліями при діареї призводять до розвитку метаболічного ацидозу. Ацидоз може посилюватися й іншими факторами. Зокрема, голодування й недостатнє надходження поживних речовин буде призводити до виснаження резервів глікогену й викликати кетоз. Метаболічний ацидоз, у свою чергу, теж може призводити до інсулінової резистентності й посилювати кетоацидоз, утворюючи порочне коло [23]. Крім того, гіповолемія і погіршення перфузії тканин при тяжкій дегідратації спричиняють гіперпродукцію молочної кислоти, а погіршення ниркової перфузії і зниження швидкості клубочкової фільтрації сприяють затримці іонів водню, що також посилює ацидоз [1].
При розвитку зневоднення в дитини, незалежно від причини, яка його спровокувала, необхідно проводити своєчасну корекцію водного балансу. Для регідратаційної терапії в педіатричній практиці широко використовуються розчини для пероральної регідратації (оральна регідратаційна сіль (ОРС)). Ці засоби, зокрема, демонструють високу ефективність у пацієнтів з гострими інфекційними діареями, вони включені до переліку життєво необхідних лікарських засобів ВООЗ. ОРС компенсують втрати не тільки рідини, але й життєво важливих електролітів, таких як натрій, калій, а також глюкози. Їх застосування допомагає відновити водно-електролітний баланс, запобігає гіпонатріємії і відновлює енергетичний обмін у дітей із проявами дегідратації. На сьогодні ВООЗ рекомендує такий склад розчину для пероральної регідратаційної терапії (табл. 2).
/60.jpg)
Важливим напрямком терапії також є застосування засобів для зменшення патологічних втрат рідини. Одним з таким засобів є пробіотики й пребіотики. Багаторічний досвід використання свідчить про їх ефективність щодо зменшення тривалості діареї, зокрема при гострих інфекційних діареях у дітей. За даними систематичного огляду восьми рандомізованих клінічних досліджень, пробіотики зменшували тривалість діареї в дітей на 14,0 % (95% довірчий інтервал (ДI) 3,8–24,2 %) і частоту дефекацій на другий день лікування на 13,1 % (95% ДI 0,8–25,3%) [24]. Механізм антидіарейної активності пробіотиків багатобічний. Зокрема, при інфекційних захворюваннях шлунково-кишкового тракту велика роль належить конкурентним спроможностям пробіотичних штамів щодо патогенів. Хоча характер їх взаємодії залишається недостатньо вивченим, вважається, що до основних механізмів пригнічення патогенних мікроорганізмів належать зниження рН у просвіті кишечника, конкуренція за поживні джерела й секреція бактеріоцину або бактеріоциноподібних речовин [25]. Пробіотики також можуть бути корисними у випадку осмотичного варіанта діареї. Наприклад, частою ситуацією є непереносимість лактози, що зазвичай призводить до діареї. Дослідженнями було встановлено, що деякі пробіотики сприяють перетравленню лактози при її непереносимості за рахунок збільшення загальної гідролітичної здатності в тонкому кишечнику й посилення ферментації в товстій кишці [26]. У випадках запального механізму діареї пробіотики також можуть бути корисними завдяки імуномодулючому ефекту. Було відзначено, що пробіотичні штами можуть через індукцію Т-регуляторних клітин пригнічувати продукцію прозапальних факторів, таких як фактор ядерної транскрипції κB –(NF-κB), запобігаючи надмірному запаленню [27]. На цей час вже доведено антидіарейну дію таких пробіотичних штамів, як Saccharomyces boulardii та Lactobacillus rhamnosus GG [4]. Ефективність Saccharomyces boulardii пов’язана з їх здатністю пригнічувати розмноження патогенних мікроорганізмів і протидіяти колонізації ними епітелію кишечника. Є дані про здатність сахароміцетів нейтралізувати бактеріальні фактори патогенності й зменшувати вплив токсинів на клітини-мішені. Вивчені певні переваги Saccharomyces boulardii перед іншими пробіотиками. Зокрема, слід відмітити високу стійкість ліофілізованих форм Saccharomyces boulardii до дії шлункового соку й жовчі, протеолізу, що дозволяє створити достатню терапевтичну концентрацію пробіотика в кишечнику. Ці гриби, на відміну від інших, не руйнуються при температурі внутрішнього середовища людського організму. І, звичайно, як і інші гриби, Saccharomyces boulardii нечутливі до дії антибактеріальних препаратів, що дозволяє ефективно їх застосовувати навіть в умовах проведення антибактеріальної терапії [28]. Результати досліджень свідчать, що S.boulardii дозволяють скоротити тривалість діареї в дітей з гострими інфекційними діареями на 11–38 год [29].
Поруч з препаратами мікробного походження, пробіотиками, успішно застосовуються речовини, які сприяють росту нормальної мікрофлори й допомагають підтримувати гомеостаз кишечника (пребіотики). У клінічній практиці одним з таких пребіотиків, що застосовується найчастіше, є інулін. Інулін являє собою природний неперетравлюваний і не засвоюваний олігосахарид. Інулін стимулює ріст корисних бактерій у товстій кишці, включаючи біфідо- і лактобактерії, модулюючи тим самим склад мікрофлори. Це створює середовище, що захищає від патогенних мікроорганізмів, токсинів і канцерогенів. Крім того, бродіння інуліну призводить до збільшення коротколанцюгових жирних кислот і вироблення молочної кислоти, тим самим знижується рН товстої кишки, що може додатково контролювати ріст патогенних бактерій і сприяти захисним властивостям інуліну [30]. На цей час також накопичені дані про вплив інуліну на регуляцію перистальтики й транзиту кишечника, консистенцію і частоту випорожнень, склад і активність мікробіоти кишечника, модуляцію імунної відповіді й засвоєння мінеральних речовин [31]. На сьогодні в клінічній практиці часто застосовуються комбіновані препарати, що містять пробіотичні штами в поєднанні з пребіотичними речовинами (симбіотики). Симбіотики мають певні переваги порівняно з препаратами, що містять тільки пробіотичні штами. Така комбінація дозволяє посилити біологічну активність пробіотика й підвищити його терапевтичну активність. Зокрема, в одному з досліджень симбіотичного препарату, що містить S.boulardii та інулін, було продемонстровано підвищення стабільності пробіотика в присутності інуліну [32].
Для зменшення патологічних втрат із блюванням і покращення толерантності до ентерального прийому рідини й харчових продуктів у клінічній практиці часто застосовуються симптоматичні протиблювальні засоби. До таких препаратів, упроваджених у педіатричну практику належать, зокрема, ондансетрон і домперидон. В основі дії першого препарату лежить ефект блокування рецепторів основного медіатора серотоніну 5-НТ3. Другий діє через блокаду дофамінових D2-рецепторів. Цікавою альтернативою можуть бути засоби рослинного походження. Зокрема, є дані про високий антиеметичний ефект кореневища імбиру, а саме його активної складової, гінгеролу. Механізм дії досі остаточно не з’ясований, але ймовірно, що він пов’язаний із взаємодією з 5НТ-рецепторами [33]. Є спостереження, які свідчать, що в пацієнтів з гастроентерологічними захворюваннями імбир зменшує тиск на нижній сфінктер стравоходу, полегшує спазми кишечника й запобігає диспепсії, метеоризму й здуттю живота [34]. За даними E. Soltani та співавт. (2018), ефект імбиру для профілактики нудоти й блювання в передопераційній премедикації суттєво не поступається традиційному ондансетрону [35]. Гінгерол також успішно застосовується для подолання блювання при хіміотерапії онкологічних хворих. W.P. Chang зі співавт. у масштабному метааналізі, який охоплював 10 рандомізованих контрольованих досліджень, підтвердили, що імбир зменшує гостру нудоту й блювання, що індуковані хіміотерапією (співвідношення шансів 0,60; 95% ДI 0,42–0,86; P = 0,006) [36].
На даний час в Україні доступний препарат, що поєднує якості ОРС, пробіотика, пребіотика й антиеметичного засобу. До складу препарату Реогель входять такі активні інгредієнти, як інулін, глюкоза, цитрат калію, натрію хлорид, екстракт кореневища імбиру і cахароміцети буларді (Saccharomyces boulardii). 100 мл гелю містить 1700 мг глюкози; 769 мг цитрату калію, що відповідає 475 мг цитрату і 78 мг калію; натрію хлорид — 226,6 мг, що відповідає 124 мг хлору і 102,6 мг натрію. За складом Реогель відповідає рекомендаціям ВООЗ щодо оптимального розчину для пероральної регідратації. Антиеметична активність Реогелю забезпечується натуральним компонентом, екстрактом кореню імбиру, гінгеролом. Крім того, 100 мл Реогелю містить 10 мільярдів Saccharomyces boulardii, які потенціюються пребіотиком інуліном. Препарат являє собою гель, призначений для перорального застосування. Препарат має приємний смак, що забезпечує добрий комплаєнс.
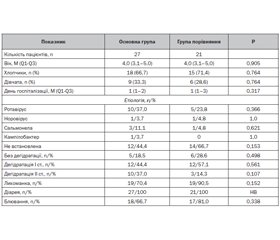
Нами було проведено порівняльне клінічне дослідження ефективності препарату Реогель у дітей віком від 3 до 6 років з гострими інфекційними діареями, які перебували на стаціонарному лікуванні. Для цього методом простої рандомізації за допомогою випадкових чисел діти цієї вікової категорії, госпіталізовані до інфекційного відділення з діагнозом гострої інфекційної діареї, розподілялись на дві групи: основну й групу порівняння. Пацієнти обох груп проходили обстеження й отримували лікування відповідно до локального протоколу. Усі діти отримували регідратаційну терапію, за показаннями призначались антибактеріальні засоби, для полегшення симптомів ситуаційно призначались жарознижуючі препарати (парацетамол) і антиеметики (ондансетрон). Пацієнтам основної групи як регідратаційний засіб призначався препарат Реогель, а в групі порівняння — традиційний ОРС. Препарат Реогель призначався всередину по 10 мл (2 чайні ложки) тричі на добу (з обов’язковим запиванням достатньою кількістю води) відповідно до чинної інструкції. Прийом засобів для пероральної регідратації (традиційний ОРС або Реогель) відбувався впродовж усього часу стаціонарного лікування. Загалом до дослідження було залучено 60 дітей. Для аналізу й статистичної обробки з цієї когорти відібрали пацієнтів, час стаціонарного лікування яких був 3 дні та більше. Основну групу становили 27 дітей, які отримували Реогель, а групу порівняння — 21 дитина. Характеристика груп подана в табл. 3.
/62.jpg)
За демографічними й клінічними характеристиками основна група й група порівняння були статистично еквівалентними. У всіх пацієнтів при госпіталізації спостерігалась діарея, у більшості хворих на момент госпіталізації були наявні лихоманка, скарги на блювання й симптоми дегідратації. Тривалість догоспітального етапу в усіх пацієнтів не перевищувала 3 дні.
Оцінку ефективності Реогелю проводили за допомогою порівняння тривалості основних симптомів захворювання, тривалості застосування парентеральної регідратації і частоти призначення ондансетрону. В усіх випадках спостерігався сприятливий перебіг захворювання й відбувалася виписка пацієнтів у задовільному стані з клінічним одужанням чи покращенням. Випадків летальності й переводу хворих в інший лікувальний заклад чи відділення серед даної когорти пацієнтів не було. У дітей з основної групи і групи порівняння не було зафіксовано епізодів небажаних побічних явищ, пов’язаних з прийомом лікарських засобів, або вимушеної відміни призначеної терапії. Препарат Реогель добре переносився. Усі діти відзначали приємний смак препарату. Дані результатів лікування обох груп наведені в табл. 4.
/63.jpg)
За результатами даного спостереження ми не виявили суттєвої різниці за тривалістю основних клінічних симптомів захворювання, таких як діарея, блювання й симптоми дегідратації, а також за частотою і тривалістю застосування парентеральної регідратації між групами дітей, які отримували Реогель і стандартні засоби для пероральної регідратації (р > 0,05 за критерієм хі-квадрат, тестом Манна — Уїтні). Необхідно відзначити, що в групі дітей, які отримували Реогель, тривалість лихоманки була значно меншою.
В основній групі була меншою частота призначення протиблювального засобу (ондансетрон) порівняно з групою порівняння: 3 (11,1 %) проти 7 (33,3 %) (р = 0,06 за критерієм хі-квадрат).
Оцінюючи ефективність препарату Реогель у дітей з гострими кишковими інфекціями, ми констатуємо, що Реогель не поступається за своїми можливостями щодо відновлення водно-електролітного балансу традиційним засобам ОРС. Природний антиеметичний компонент Реогелю дозволяє зменшити необхідність введення стандартних антиеметичних засобів (ондансетрон). Зважаючи на кращий профіль безпеки природного засобу, від заміни ондансетрону слід очікувати зменшення ризику розвитку небажаних побічних явищ, пов’язаних із прийомом лікарського засобу. Завдяки комплексному складу Реогелю також спрощується процес давання дітям медикаментів, оскільки замість чотирьох окремих препаратів (ОРС, антиеметик, пробіотик і пребіотик) є можливість дати один засіб. Крім того, приємні органолептичні властивості покращують прихильність дитини до прийому медикаменту, що має велике значення в досягненні успіху при лікуванні дегідратації в дітей. Результати цього спостереження дають підставу рекомендувати Реогель як альтернативу традиційному ОРС у дітей з інфекційними діареями, що супроводжуються легким і помірним ступенем дегідратації.
На завершення зазначимо, що дегідратація в дитячому віці може ускладнювати різні патологічні стани. Здебільшого втрати рідини в дитячому віці пов’язані з такими патологічними синдромами, як діарея, блювання й лихоманка. Вчасна корекція водно-електролітного балансу необхідна для запобігання порушенням гемоциркуляції і тяжким розладам метаболізму. Застосування препаратів для пероральної регідратації в поєднанні з симптоматичними засобами, які зменшують патологічні втрати рідини, є основним напрямком лікування захворювань, що супроводжуються синдромом дегідратації, незалежно від його етіології.
Конфлікт інтересів. Не заявлений.
Отримано/Received 02.06.2021
Рецензовано/Revised 21.06.2021
Прийнято до друку/Accepted 29.06.2021
Список литературы
1. Vega R.M., Avva U. Pediatric Dehydration. StatPearls. StatPearls Publishing. 2019. http://www.ncbi.nlm.nih.gov/pubmed/28613793.
2. Hubert P. Déshydratation aiguë du nourrisson. J. Pediatr. Pueric. 2008. 21. 124-32. /pmc/articles/PMC7146766.
3. O’Ryan M.L., Matson D.O., Pickering L.K. Pediatric gastroenteritis. StatPearls Publishing, 2021. https://www.ncbi.nlm.nih.gov/books/NBK499939.
4. Guarino A., Ashkenazi S., Gendrel D., Lo Vecchio A., Shamir R., Szajewska H. ESPGHAN/ESPID Evidence-based Guidelines for the Management of Acute Gastroenteritis in Children in Europe: Update 2014. J. Pediatr. Gastroenterol. Nutr. 2014. 39. 132-52.
5. Stephen J. Pathogenesis of infectious diarrhea. Can. J. Gastroenterol. 2001. 15(10). 669-83.
6. Ramig R.F. Pathogenesis of Intestinal and Systemic Rotavirus Infection. J. Virol. American Society for Microbiology. 2004. 78. 10213-20. http://jvi.asm.org.
7. Hellysaz A., Hagbom M. Understanding the Central Nervous System Symptoms of Rotavirus: A Qualitative Review. Viruses. MDPI AG. 2021. 13. 658. /pmc/articles/PMC8069368.
8. Sanger G.J., Andrews P.L.R. Treatment of nausea and vomiting: Gaps in our knowledge. Auton. Neurosci. Basic Clin. Auton Neurosci. 2006. Р. 3-16. https://pubmed.ncbi.nlm.nih.gov/16934536.
9. Hagbom M., Istrate C., Engblom D., Karlsson T., Rodriguez-Diaz J., Buesa J. et al. Rotavirus stimulates release of serotonin (5-HT) from human enterochromaffin cells and activates brain structures involved in nausea and vomiting. PLoS Pathog. 2011. 7. /pmc/articles/PMC3136449.
10. Dawlett M., Kalia A. Maintenance Fluid Requirements in Disease. Niebuhr V., Urbani M.J., editors. Core Concepts Pediatr. 2nd ed. Dept. of Pediatrics. University of Texas Medical Branch. https://www.utmb.edu/Pedi_Ed/CoreV2/Fluids/Fluids7.html.
11. Voldby A.W., Brandstrup B. Fluid therapy in the perioperative setting-A clinical review. J. Intensive Care. 2016. /pmc/articles/PMC4833950.
12. Hayes W.J., VanGilder D., Berendse J., Lemon M.D., Kappes J.A. Cyclic vomiting syndrome: Diagnostic approach and current management strategies. Clin. Exp. Gastroenterol. 2018. Р. 77-84. /pmc/articles/PMC5833754.
13. Rome Foundation. Rome IV Criteria. 2021. https://theromefoundation.org/rome-iv/rome-iv-criteria.
14. Raucci U., Borrelli O., Di Nardo G., Tambucci R., Pavone P., Salvatore S. et al. Cyclic Vomiting Syndrome in Children. Front. Neurol. 2020. Р. 583425. /pmc/articles/PMC7667239.
15. Donohoe P.B., Kessler R., Beattie T.F. Exploring the clinical utility of blood ketone levels in the emergency department assessment of paediatric patients. Emerg. Med. J. 2006. 23. 783-7. /pmc/articles/PMC2579600.
16. Levy J.A., Waltzman M., Monuteaux M.C., Bachur R.G. Value of point-of-care ketones in assessing dehydration and acidosis in children with gastroenteritis. Acad. Emerg. Med. [Internet]. Acad. Emerg. Med. 2013. 20. 1146-50. https://pubmed.ncbi.nlm.nih.gov/24238317.
17. Cartwright M.M., Hajja W., Al-Khatib S., Hazeghazam M., Sreedhar D., Li R.N. et al. Toxigenic and Metabolic Causes of Ketosis and Ketoacidotic Syndromes. Crit. Care Clin. 2012. Р. 601-31. https://pubmed.ncbi.nlm.nih.gov/22998993.
18. Dhillon K.K., Gupta S. Biochemistry, Ketogenesis. StatPearls. 2018. http://www.ncbi.nlm.nih.gov/pubmed/29630231.
19. Laffel L. Ketone Bodies: a Review of Physiology, Pathophysiology and Application of Monitoring to Diabetes. Diabetes Metab. Res. Rev. 1999. 15. 412-26.
20. Bai K., Fu Y., Liu C., Xu F., Zhu M. Pediatric non-diabetic ketoacidosis: A case-series report. BMC Pediatr. [Internet]. BioMed Central Ltd. 2017.17. /pmc/articles/PMC5735941.
21. Gennari F.J., Weise W.J. Acid-base disturbances in gastrointestinal disease. Clin. J. Am. Soc. Nephrol. American Society of Nephrology. 2008. Р. 1861-8. www.cjasn.org.
22. Jain N., Reilly R. Acid/Base Disorders: Metabolic Alkalosis. Ren. Urol. News. 2017. https://www.renalandurologynews.com/home/decision-support-in-medicine/nephrology-hypertension/acid-base-disorders-metabolic-alkalosis.
23. Souto G., Donapetry C., Calviño J., Adeva M.M. Metabolic acidosis-induced insulin resistance and cardiovascular risk. Metab. Syndr. Relat. Disord. 2011. Р. 247-53. /pmc/articles/PMC3155690.
24. Applegate J.A., Walker C.L.F., Ambikapathi R., Black R.R.E., Liu L., Johnson H. et al. Systematic review of probiotics for the treatment of community-acquired acute diarrhea in children. BMC Public Health. 2013. 13. S16. http://www.ncbi.nlm.nih.gov/pubmed/24564646.
25. Plaza-Diaz J., Ruiz-Ojeda F.J., Gil-Campos M., Gil A. Mechanisms of Action of Probiotics. Adv. Nutr. Oxford University Press. 2019. Р. S49-66. https://doi.org/10.1093/advances/nmy063.
26. Dhama K., Latheef S.K., Munjal A.К., Khandia R., Samad H.А., Iqbal H.M.N. et al. Probiotics in Curing Allergic and Inflammatory Conditions — Research Progress and Futuristic Vision. Recent Pat. Inflamm. Allergy Drug Discov. 2017. 10. 105-18. https://pubmed.ncbi.nlm.nih.gov/28029082.
27. Groeger D., O’Mahony L., Murphy E.F., Bourke J.F., Dinan T.G., Kiely B. et al. Bifidobacterium infantis 35624 modulates host inflammatory processes beyond the gut. Gut Microbes. 2013. 4. 325-39. http://www.ncbi.nlm.nih.gov/pubmed/23842110.
28. Kelesidis T., Pothoulakis C. Efficacy and safety of the probiotic Saccharomyces boulardii for the prevention and therapy of gastrointestinal disorders. Therap. Adv. Gastroenterol. 2012. 5. 111-25. http://www.ncbi.nlm.nih.gov/pubmed/22423260.
29. Dinleyici E.C., Kara A., Dalgic N., Kurugol Z., Arica V., Metin O. et al. Saccharomyces boulardii CNCM I-745 reduces the duration of diarrhoea, length of emergency care and hospital stay in children with acute diarrhoea. Benef. Microbes. 2015. 6. 415-21. http://www.ncbi.nlm.nih.gov/pubmed/25653151.
30. Inulin | C228H382O191. PubChem. Natl. Cent. Biotechnol. Inf. https://pubchem.ncbi.nlm.nih.gov/compound/Inulin.
31. Bărboi O.-B., Ciortescu I., Chirilă I., Anton C., Drug V. Effect of inulin in the treatment of irritable bowel syndrome with constipation (Review). Exp. Ther. Med. 2020. 20. 1-1. /pmc/articles/PMC7579772.
32. Sarwar A., Aziz T., Al-Dalali S., Zhang J., Din J. ud, Chen C. et al. Characterization of synbiotic ice cream made with probiotic yeast Saccharomyces boulardii CNCM I-745 in combination with inulin. LWT. 2021. 141. 110910.
33. Li X., Ao M., Zhang C., Fan S., Chen Z., Yu L. Zingiberis Rhizoma Recens: A Review of Its Traditional Uses, Phytochemistry, Pharmacology, and Toxicology [Internet]. Evidence-based Complement. Altern. Med. 2021. /pmc/articles/PMC7943299.
34. Nikkhah Bodagh M., Maleki I., Hekmatdoost A. Ginger in gastrointestinal disorders: A systematic review of clinical trials. Food Sci. Nutr. 2019. Р. 96-108. /pmc/articles/PMC6341159.
35. Soltani E., Jangjoo A., Afzal Aghaei M., Dalili A. Effects of preoperative administration of ginger (Zingiber officinale Roscoe) on postoperative nausea and vomiting after laparoscopic cholecystectomy. J. Tradit. Complement Med. 2018. 8. 387-90. /pmc/articles/PMC6035306.
36. Chang W.P., Peng Y.X. Does the Oral Administration of Ginger Reduce Chemotherapy-Induced Nausea and Vomiting? A Meta-analysis of 10 Randomized Controlled Trials. Cancer Nurs. 2019. 42. E14-23. https://pubmed.ncbi.nlm.nih.gov/30299420.

/59.jpg)
/60.jpg)
/62.jpg)
/63.jpg)