Вступ
Цукровий діабет (ЦД) є складною проблемою глобального масштабу для будь-якої країни світу, незважаючи на рівень її економічного розвитку [1]. Щорічно у світі відбувається до 3 млн смертей на тлі ЦД, тобто кожні 10 секунд помирає один хворий на діабет.
За висновками IDF, до 2030 року кількість хворих на діабет збільшиться до 552 млн (9,9 %, або один хворий на ЦД на 10 здорових дорослих), а до 2035 року — до 592 млн (10,1 %). Також відмічено, що спостерігається тенденція найбільшого поширення діабету серед урбанізованого (міського) працездатного населення країн, що розвиваються, в осіб віком від 40 до 59 років, приблизно однаково у представників як чоловічої, так і жіночої статі [2–4].
ЦД та розвиток його ускладнень, зокрема ураження нирок та серця, суттєво знижують як якість життя, так і середню його тривалість.
Виявлення у хворих на ЦД нефрологічних та серцевих захворювань на ранніх стадіях належить до важливих завдань як із позиції профілактики, так і для поліпшення перебігу поєднаної патології.
За даними різних авторів, поширеність діабетичної нефропатії (ДН) досягає 12–26 % при ЦД 2-го типу [5, 6].
У багатьох багатоцентрових дослідженнях була підтверджена висока поширеність хронічної хвороби нирок (ХХН), порівнянна з поширеністю ЦД і ішемічної хвороби серця (ІХС), а результати вивчення прогнозу ХХН довели безперечну й самостійну асоціацію розрахункової швидкості клубочкової фільтрації (ШКФ) і альбумінурії із загальною та серцево-судинною смертністю, прогресуванням ХХН до стадії термінальної ниркової недостатності й ризиком розвитку гострого ниркового пошкодження [7]. У даний час ХХН вважається незалежним фактором ризику розвитку серцево-судинної патології [8].
Ретроспективне дослідження, що включало понад 90 000 пацієнтів із ЦД віком 35 і більше років (медіана спостереження — 2,4 року), виявило зв’язок ХХН із виразковими дефектами й ампутаціями нижніх кінцівок, пов’язаними в більшості випадків з периферичним атеросклерозом [9, 10].
У зв’язку з вищезазначеним метою дослідження було вивчення особливостей структурних та функціональних змін у серці у хворих на ЦД 2-го типу з порушенням функції нирок.
Досягнення мети передбачало розв’язання таких завдань:
— дослідити структурні особливості лівого шлуночка серця у хворих із ЦД 2-го типу залежно від функціонального стану нирок;
— вивчити параметри систолічної функції лівого шлуночка у хворих на ЦД 2-го типу з порушеннями функції нирок.
Матеріали та методи
Обстежені 98 хворих на ЦД 2-го типу з ДН віком від 40 до 70 років, які перебували на лікуванні в клініці ДУ «Національний інститут терапії імені Л.Т. Малої НАМН України». Контрольну групу становили 20 здорових осіб.
Дослідження виконані з дотриманням основних положень «Правил етичних принципів проведення наукових медичних досліджень за участю людини», затверджених Гельсінською декларацією, стандартів щодо погодженої участі обстежених, етичної складової виконання досліджень та взяття біоматеріалу.
Усім хворим і особам контрольної групи при госпіталізації проведене загальноклінічне та лабораторне обстеження (клінічні та біохімічні аналізи крові та сечі, альбумінурії, показників вуглеводного обміну тощо), електрокардіографія (ЕКГ), антропометричні вимірювання. Стан компенсації ЦД оцінювали за концентрацією глікованого гемоглобіну HbA1c.
Проведення трансторакальної ехокардіографії здійснювали на ультразвуковому апараті «Ultima PA» (Radmir, Україна) з використанням секторного фазованого датчика з діапазоном частот 2–3 МГц за стандартною методикою згідно з рекомендаціями Американського ехокардіографічного товариства [11]. Визначались товщина міжшлуночкової перегородки лівого шлуночка (ТМШП ЛШ), товщина зад-ньої стінки лівого шлуночка (ТЗС ЛШ) в діастолу, кінцево-діастолічний розмір лівого шлуночка (КДР ЛШ), кінцево-систолічний розмір лівого шлуночка (КСР ЛШ), кінцево-діастолічний об’єм лівого шлуночка (КДО ЛШ), кінцево-систолічний об’єм лівого шлуночка (КСО ЛШ), ударний об’єм (УО), об’єм лівого передсердя (ОЛП), величини, індексовані до площі поверхні тіла (іКДО, іКСО, іОЛП). Систолічна функція ЛШ оцінювалася за показником фракції викиду (ФВ). Кількісний показник ФВ розраховували за формулою:
ФВ = УО/КДО × 100.
Масу міокарда ЛШ (ММЛШ) в М-режимі оцінювали за критеріями Американського ехокардіографічного товариства (2015 р.) [11] з використанням корегованої формули:
ММЛШ = 0,80 × [1,04 × ((КДР ЛШ + ТМШПд + ТЗСд ЛШ)3 – КДР ЛШ3)) + 0,6).
При нормальній вазі ММЛШ індексували до площі поверхні тіла та розраховували за формулою:
ІММЛШ = ММЛШ/S,
де S — площа поверхні тіла (м2).
При ожирінні (ІМТ > 30 кг/м2) ММЛШ індексували до зросту та розраховували за формулою:
ІММЛШ = ММЛШ/Р2,7,
де Р — зріст (м).
Наявність гіпертрофії лівого шлуночка (ГЛШ) встановлювали згідно з рекомендаціями Європейського товариства кардіологів і Європейського товариства гіпертензії (2018 р.) при ІММЛШ ≥ 95 г/м2 у жінок і ≥ 115 г/м2 у чоловіків із нормальною масою тіла та при ІММЛШ ≥ 47 г/м2,7 у жінок і ≥ 50 г/м2,7 у чоловіків з ожирінням [12].
У дослідження не ввійшли хворі на ЦД 1-го типу, із наявністю штучного водія ритму та/або наявністю штучних клапанів серця, з уродженими вадами серця та сечовивідних шляхів, із важкими формами перебігу серцевої недостатності (ІІБ та ІІІ стадій), із гострим інфарктом міокарда, з інфекційними, гематологічними та онкологічними захворюваннями.
Після первинного обстеження залежно від функціонального стану нирок пацієнти були розподілені на групи: І група — хворі на ЦД 2-го типу без ознак нефропатії (n = 36), ІІ група — хворі на ЦД 2-го типу з нормальною ШКФ та альбумінурією (n = 33), ІІІ група — хворі на ЦД 2-го типу зі зниженою ШКФ та альбумінурією (n = 29).
Ліпідний спектр крові (загальний холестерин (ЗХС), холестерин ліпопротеїдів високої щільності (ЛПВЩ), тригліцериди (ТГ)) визначали ферментативним методом.
Математичний аналіз даних проводили з використанням варіаційної статистики за стандартними ліцензійними комп’ютерними програмами. Відмінності між групами середніх величин та їх похибки (М ± m) оцінювали за допомогою критерію Стьюдента — Фішера. Вірогідною вважалася ймовірна похибка менше 5 % (p < 0,05). Перевірку нормальності розподілу показників здійснювали за допомогою тесту Колмогорова — Смирнова.
Результати та обговорення
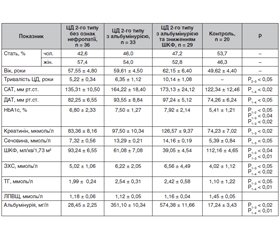
Для кращого розуміння особливостей структурно-функціональних змін у серці при ДН, були відібрані хворі на ЦД 2-го типу з діабетичним ураженням нирок (наявність альбумінурії та зниження ШКФ) або без ниркових порушень і здорові добровольці. Отримані дані наведені в табл. 1.
Так, рівні систолічного (САТ) і діастолічного артеріального тиску (ДАТ), концентрації креатиніну та сечовини крові, показники альбумінурії були суттєво підвищені у хворих на ДН порівняно з конт-ролем та групою із ЦД 2-го типу без ознак нефропатії. Крім того, аналіз досліджуваних показників показав, що розвиток ДН залежить від тривалості та ступеня компенсації ЦД і супроводжується вірогідним зменшенням ШКФ.
У пацієнтів другої та третьої груп виявлено вірогідне підвищення САТ та ДАТ порівняно з показниками першої групи пацієнтів та контролем (р < 0,05). При цьому найвищі значення як САТ, так і ДАТ спостерігались в групі хворих зі зниженням ШКФ < 60 мл/хв (третя група). Отримані дані свідчать про безумовний взаємозв’язок рівня артеріального тиску з прогресуванням діабетичного ураження нирок.
При ДН були виявлені суттєві порушення ліпідного обміну, а саме підвищення вмісту ЗХС і ТГ в сироватці крові. Більш виражені зміни ліпідного спектра крові в пацієнтів із ДН спостерігались при аналізі рівнів ТГ (табл. 1).
Слід зазначити, що в більшості хворих на ЦД і ДН, зокрема, є певні порушення ліпідного обміну, які зберігаються й після корекції показників глюкози крові. Вони настільки характерні, що отримали назву «діабетична дисліпідемія» [13, 14].
Ремоделювання серця являє собою процес комплексного порушення його структури і функції і включає збільшення маси міокарда, дилатацію порожнин і зміну геометричної характеристики шлуночків [15]. Залежно від виду гемодинамічних порушень формуються різні типи ремоделювання [16]. У численних дослідженнях установлено принципове прогностичне значення ремоделювання не тільки у виникненні аритмій, розвитку і прогресуванні серцевої недостатності, а й у серцево-судинній смертності. Показано, що ГЛШ є одним із важливих предикторів кардіоваскулярних ускладнень [17].
Збільшення маси міокарда ЛШ, опосередковане гіпертрофією кардіоміоцитів і розростанням інтерстиціального компонента, виявляється у хворих на ЦД 2-го типу навіть при відсутності підвищеного артеріального тиску [18, 19].
Морфологічний субстрат ремоделювання ЛШ характеризується глибокою перебудовою всіх рівнів структурної організації серця: молекулярних, клітинних, інтерстиціальних, і супроводжується клінічними проявами у вигляді зміни розміру, форми і функціональних можливостей серця у відповідь на дію патологічного фактора [19, 20].
При ДН вплив різноманітних патогенетичних факторів, таких як гіперінсулінемія, альбумінурія, азотемія, дисліпідемія, анемія, призводить до розвитку ендотеліальної дисфункції та активації медіаторів ренін-ангіотензин-альдостеронової системи і факторів росту. Ці процеси є причиною клітинної проліферації, що лежить в основі структурно-функціональної перебудови серцево-судинної системи [17–20].
Ключовими ланками прогресування серцевої недостатності є гіпертрофія міокарда і ремоделювання серця [15, 17]. Однак окремі автори [19] ставлять під сумнів стереотипність процесів зміни геометрії серця й рекомендують вивчати фізіологічні та патогенетичні механізми ремоделювання серця в кожному конкретному випадку.
На процес серцевого ремоделювання впливають гемодинамічні умови, нейрогормональна активація й низка інших факторів, але питання про механізми, які опосередковують істотне збільшення смертності від інфаркту міокарда, у тому числі раптової смерті на фоні гіпертрофії ЛШ у хворих на діабетичну хворобу нирок, залишається дискутабельним. Усе це диктує необхідність з’ясування процесів, що впливають на кардіогемодинаміку в пацієнтів, які страждають на ДН.
Як показали результати дослідження, розвиток нефропатії у хворих на ЦД 2-го типу супроводжується суттєвими змінами досліджуваних показників за даними імпульсної допплер-ехокардіоскопії (табл. 2).
У хворих на ДН (друга та третя групи) виявлене вірогідне (р < 0,05) збільшення лінійних розмірів серця завдяки зростанню ТМШП ЛШ та ТЗС ЛШ порівняно з контролем та хворими на ЦД 2-го типу без ознак нефропатії (табл. 2).
За даними ехокардіоскопії систолічна функція лівого шлуночка була збережена у більшості пацієнтів (ФВ > 45 %). Проте при міжгруповому аналізі відмічена тенденція до зниження даного показника у хворих на ЦД 2-го типу з альбумінурією порівняно з контролем та тенденція до збільшення ФВ у хворих I групи порівняно з другою групою. У групі зі зниженою ШКФ (III група) статистичний аналіз виявив вірогідне зменшення ФВ порівняно з контрольною групою (р < 0,01).
Крім того, як видно з наведених в табл. 2 даних, ехокардіоскопічні показники збільшення лівих камер серця (КДО та КСО) були вірогідно вищими у хворих першої та другої груп порівняно з контролем (р < 0,01).
Аналіз показав, що вірогідне підвищення ММЛШ мало місце у хворих на ДН обох груп, що, очевидно, пов’язано зі зростанням ТМП ЛШ та ТЗС ЛШ.
Для виявлення ГЛШ ми визначали ІММЛШ. ГЛШ була виявлена у більшості пацієнтів (91,3 %) з альбумінурією та збереженою функцією нирок (друга група) і у всіх пацієнтів (100 %) зі зниженням ШКФ (третя група). У той же час у групі хворих на ЦД 2-го типу без ознак нефропатії ГЛШ мала місце лише в 68 % обстежених.
За даними дослідження встановлено, що частота ГЛШ у хворих на ДН зростає при збільшенні тривалості ЦД та артеріальної гіпертензії.
На сьогодні механізм взаємозв’язку альбумінурії і гіпертрофії серця точно не встановлено. Обговорюється можливість загальних схожих структурних змін в базальній мембрані клубочків і в стінці позаниркових судин.
За сучасними уявленнями, наявність альбумінурії відображає генералізовану судинну дисфункцію. Проходження альбуміну та інших макромолекул плазми, таких як ліпопротеїди низької щільності, у судинну стінку може призводити до запальної відповіді, що, у свою чергу, запускає атеросклеротичний процес. Крім того, підвищення мікросудинного тиску і кровотоку, що спостерігаються при ЦД і артеріальній гіпертензії, можуть ушкоджувати ендотелій, призводячи до порушення вазодилатації, надмірного утворення матриксу, потовщення базальних мембран капілярів і склерозу. Такі зміни можуть сприяти порушенню коронарної гемодинаміки, асоційованої з адаптивним підвищенням маси ЛШ. Надалі розвивається зниження коронарного резерву, порушення ангіогенезу й ішемічне пошкодження кардіоміоцитів. Процеси спільності патогенезу альбумінурії і ГЛШ вимагають подальшого вивчення.
Таким чином, отримані нами наукові дані вказують на безумовний взаємозв’язок структурно-функціональних змін у серці з прогресуванням ниркової дисфункції при ЦД 2-го типу. Особливості структурно-функціональної перебудови лівих відділів серця у хворих на ДН з формуванням дисфункцій ЛШ повинні враховуватися у визначенні серцево-судинного прогнозу.
Висновки
У хворих третьої групи, у яких відмічається зниження ШКФ, виявлене збільшення лінійних розмірів серця (р < 0,05) внаслідок метаболічних порушень та значного гемодинамічного навантаження.
Прогресування ДН у хворих на ЦД 2-го типу приводить до зростання ММЛШ (р < 0,05), що проявляється суттєвим збільшенням частоти ГЛШ до 91,3 % у пацієнтів II групи та до 100 % у хворих III групи порівняно з хворими I групи (68 %).
Особливості структурно-функціональної перебудови лівих відділів серця у хворих на ДН із формуванням дисфункцій лівого шлуночка повинні враховуватися у визначенні серцево-судинного прогнозу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Стаття виконана у рамках науково-дослідної роботи «Розробити методи індивідуалізації оцінки хворих на діабетичну нефропатію з урахуванням поліморфізму гена Клото для визначення оптимальних профілактичних та лікувальних заходів», номер держреєстрації 0118U003157.
Отримано/Received 11.08.2021
Рецензовано/Revised 26.08.2021
Прийнято до друку/Accepted 03.09.2021
Список литературы
1. Whiting D.R., Guariguata L., Weil C. et al. IDF diabetes atlas: global estimates of the prevalence of diabetes for 2011 and 2030. Diabetes Res. Clin. Pract. 2011. Vol. 94. Р. 311-321.
2. Дедов И.И., Шестакова М.В. Сахарный диабет: диагностика, лечение, профилактика. МИА, 2011. 808 с.
3. Дедов И.И., Шестакова М.В., Викулова О.К. Государственный регистр сахарного диабета в Российской Федерации: статус 2014 г. и перспективы развития. Сахарный диабет. 2015. Т. 18. № 3. С. 5-22.
4. Сунцов Ю.И., Болотская Л.Л., Казаков И.В. Эпидемиология сахарного диабета и прогноз его распространенности в Российской Федерации. Сахарный диабет. 2011. № 1. C. 15-17.
5. Моисеева В.С., Мухина Н.А. Национальные рекомендации. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции. Клиническая нефрология. 2014. № 2. С. 4-29.
6. Gross J.L., Azevedo M.J., Silveiro S.P. et al. Diabetic nephropathy: diagnosis, prevention, and treatment. Diabetes Care. 2005. Vol. 28. № 1. P. 164-176.
7. Беловол А.Н., Князькова И.И. Сердечно-сосудистые заболевания и сахарный диабет. Здоровье Украины. 2014. Т. 3. № 27. С. 28-29.
8. Моисеев В.С., Кобалава Ж.Д. Кардиоренальные синдромы (патогенетические, клинико-диагностические, прогностические и терапевтические аспекты). Терапевтический архив. 2011. № 12. С. 5-11.
9. Милованова Л.Ю., Милованов Ю.С., Козловская Л.В., Мухин Н.А. Новые маркеры кардиоренальных взаимосвязей при хронической болезни почек. Терапевтический архив. 2013. № 6. С. 17-24.
10. Bansal N., Katz R., Robinson-Cohen C. et al. Absolute rates of heart failure, coronary heart disease, and stroke in chronic kidney disease: an analysis of 3 community-based cohort studies. JAMA Cardiol. 2017. Vol. 2. № 3. Р. 314-318.
11. Lang R.M., Badano L.P., Mor-Avi V. et al. Recomendations for Cardiac Chamber by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2015. Vol. 28(1). P. 1-38.
12. Williams B., Mancia G., Spiering W. et al. ESH Guidelines for the manangement of arterial hypertension The Task Force for the manangement of arterial hypertension of the European Society of Cardiology (ESC) and European Society of Hypertension (ESH). Eur. Heart J. 2018. Vol. 39(33). P. 3021-3104.
13. Kuzin A.I., Vasyliev A.A., Cherednykova M.A., Kame-rer O.V. Diahnostyka ta likuvannia dyslipidemii u khvorykh metabolichnym syndromom: metodychni rekomendatsii pryznacheni dlia likariv-terapevtiv, kardiolohiv, klinichnykh farmakolohiv, endokrynolohiv, diietolohiv, likariv zahalnoi praktyky, studentiv starshykh kursiv medychnykh VUZiv. [Elektronnyi resurs]. 2003. URL: http://www.medlit.pp.ua/12938_особливості_дисліпідемії_при_цукровому_діабеті_2_типу.html [in Ukrainian].
14. Typovi patolohichni protsesy. Patofiziolohiia obminu rechovyn: navchalnyi posibnyk [Elektronnyi resurs]. 2008. URL: http://medbib.in.ua/insulinonezavisimyiy-saharnyiy-diabet-44217.html [in Ukrainian].
15. Bluemke D.А., Kronmal R.A., Lima J.A. et al. The relationship of left ventricular mass and geometry to incident cardiovascular events: the MESA (Multi-Ethnic Study of Atherosclerosis) study. J. Amer. Coll. Cardiol. 2008. Vol. 52. № 25. Р. 2148-2155.
16. Нечесова Т.А., Коробко И.Ю., Кузнецова Н.И. Ремоделирование левого желудочка и методы оценки. Медицинские новости. 2008. № 11. С. 7-13.
17. Tuegel C., Bansal N. Heart failure in patients with kidney disease. Heart. 2017. Vol. 103. № 23. P. 1848-1853.
18. Соколов Е.И. Диабетическое сердце. Mосква: Медицина, 2002. 416 с.
19. Peterson L.R., McKenzie C.R., Schaffer J.E. Diabetic cardiovascular disease: getting to the heart of the matter. Cardiovasc. Transl. Res. 2012. Vol. 5. № 4. Р. 436-445.
20. Wu N., Zhao W., Ye K. et al. Albuminuria Is Associated with Left Ventricular Hypertrophy in Patients with Early Diabetic Kidney Disease International. Journal of Endocrinology. 2014. Р. 8.

/11.jpg)
/12.jpg)