Експериментальне моделювання на тваринах є складовою частиною медицини та біології, його широко використовують для вивчення факторів, які порушують структуру та метаболізм кісткової тканини [1–3]. Остеопороз — це мультифакторне метаболічне захворювання, в патогенезі якого беруть участь безліч ендогенних і екзогенних факторів, що впливають на кісткову тканину, а моделювання на тваринах різних типів остеопорозу дає можливість дослідити специфічність розвитку порушень у різних кістках скелета, тривалість формування патологічного процесу й особливості його проявів у компактній і губчастій кістках, а також дослідити зміни на рівні організму. Використовуючи різні експериментальні моделі остеопорозу, можливо визначити особливості ремоделювання кісткової тканини на основі гістологічного, морфометричного й біохімічного досліджень, а також тестувати біомеханічними методами міцність та якість кістки в умовах різних пускових механізмів, що призводять до остеопорозу, та визначити певні патогенетичні шляхи в розвитку захворювання [1, 4–7]. Використання експериментальних моделей з індукованим остеопорозом дає можливість оцінити дію медикаментозних засобів та інших немедикаментозних методів лікування, оскільки введення їх у клінічну практику без використання моделей на тваринах було б сумнівним [8, 9].
Крім того, на тваринах із модельованим остеопорозом можливо проводити дослідження біоматеріалів, які імплантують у кістку, різних фіксуючих конструкцій з метою вивчення впливу якості кістки на перебудову біоматеріалів або стабільність конструкцій. Модель остеопорозу, відтвореного на тваринах в умовах травматичного ушкодження кісток, дає можливість оцінити стадійно-часові показники репаративного остеогенезу в умовах цієї патології та відзначити фактори ризику, що призводять до незрощень [10].
Все це доводить важливість і необхідність відтворення в експериментальній моделі такого поширеного захворювання, як остеопороз. Остеопороз модулюють на різних видах тварин — мишах, щурах, кролях, собаках, вівцях, мавпах та ін., але в багатьох експериментальних протоколах найчастіше використовують лабораторних щурів і мишей, тому що ці об’єкти дослідження відносно дешеві, ними легко керувати й можливо відтворити моделі остеопорозу різної етіології: внаслідок іммобілізації, дієтичних маніпуляцій, гормональної депривації, дії шкідливих речовин та ін. [1]. У зв’язку з цим у нашому огляді основний акцент зроблено на моделюванні остеопорозу в цих тварин.
Разом із тим експериментальні моделі мають потрійне значення: по-перше, експериментальне відтворення патології в моделі дозволяє виявити існування певного патогенетичного шляху розвитку даної патології; по-друге, в умовах експериментальної моделі дослідник може, використовуючи сучасні методи, вивчати молекулярні, клітинні та системні зміни, що не є можливим в умовах клінічного дослідження пацієнта; і нарешті, по-третє, експериментальна модель патологічного стану є важливим об’єктом для оцінки терапевтичних можливостей лікарських препаратів за даним видом патології [1].
Відбір тварин для будь-яких досліджень повинен базуватися на таких постулатах: 1) доцільність як аналога; 2) інформативність; 3) генетична однорідність організмів, які використовують; 4) фонові знання біологічних властивостей об’єкта; 5) вартість і доступність; 6) можливість узагальнити результати; 7) легкість і пристосування до експериментальних маніпуляцій; 8) врахування екологічних міркувань; 9) етичні та соціальні наслідки [11].
За допомогою різних методів відтворюють первинний і вторинний остеопороз. Шляхом оваріектомії у тварин індукують остеопороз 1-го типу — постменопаузальний. Можливо відтворити і вторинний остеопороз, виконуючи орхіектомію, тиреоїдектомію, пошкодження спинного мозку або сідничного нерва, тенотомію, ампутацію кінцівок, відсутність навантаження на скелет або невагомість, використовуючи хімічні речовини та ін.
Моделювання постменопаузального остеопорозу у тварин шляхом оваріектомії
Найбільш поширеною моделлю остеопорозу є постменопаузальний остеопороз.
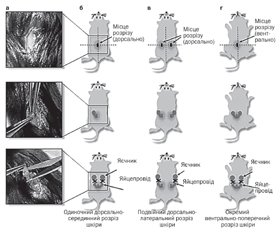
Оваріектомія у гризунів — це процедура, за якою хірургічно відсікаються яєчники (рис. 1). Гормональні зміни, спричинені видаленням яєчників, призводять до зниження рівня в організмі естрогенів, внаслідок чого підвищується негативне ремоделювання кісток, що викликає втрату кісткової тканини, при цьому збільшується крихкість кістки. Оваріектомія розглядається як найбільш поширена доклінічна модель для розуміння патофізіології подій, пов’язаних з менопаузою, також цю модель використовують для розроблення нових стратегій лікування постменопаузального остеопорозу [12].
Зазвичай оваріектомію виконують на зрілих або старих щурах. У старих щурів відсутній ріст кісток, зазвичай через кілька місяців після оваріектомії визначається значна втрата кісткової маси. Однак найчастіше все ж експерименти проводять на зрілих, тобто статевозрілих, щурах (починаючи з 3-місячного віку), які здатні відповідати належним чином на дефіцит статевих гормонів, індукованих оваріектомією [12].
Для вивчення впливу оваріектомії в щурів гістоморфометричні вимірювання проводять на фронтальних гістологічних зрізах у межах прямокутної ділянки на відстані один міліметр від центральної точки метафізарної наросткової пластини, щоб уникнути ділянки первинного остеогенезу [14]. Встановлено, що в ділянці губчастої кістки значення відношення об’єму кісткової тканини (BV)/трабекули плюс кістковий мозок (TV) (%) знижується протягом перших 30 днів після оваріектомії досить швидко, близько на 50 % від початкового значення. Порівняння швидкості втрати кісткової маси необхідно проводити з контрольною групою (хибно оперовані тварини), яку відбирають на початку експерименту. Втрата кісткової маси за умов остеопорозу залежить від зменшення кількості та ширини кісткових трабекул губчастої кістки. Крім того, підвищується сепарація (роз’єднання) кісткових трабекул (Tb. Sp.) внаслідок підвищеної резорбції кісткової тканини. Поряд зі зниженням маси кісткових трабекул виявлені деструктивні зміни, а саме розшарування матриксу з візуалізацією колагенових волокон, вогнища деструкції, зниження щільності остеоцитів. Більшість остеоцитів розташовувалися в широких лакунах з нечіткими краями, що свідчить про остеоцитарний остеолізис [15]. Знижується товщина кортикального шару стегнової та великогомілкової кісток за вимірами від періосту до ендосту. Крім того, підвищується пористість кортексу внаслідок розширення або злиття кісткових каналів.
Для оцінки ремоделювання кісткової тканини відзначають та підраховують кількість остеобластів, оскільки втрата маси кісткової тканини відбувається в умовах дефіциту естрогенів через посилену резорбцію кістки та порушення функції остеобластів [1, 16]. Для точного підрахунку бажано використовувати реакцію на тартрат-стійку кислу фосфатазу.
Однак для повноти уявлень щодо остеопорозу після оваріектомії в дослідженнях на тваринах відзначено, що особливістю його розвитку є непропорційні зміни в різних ділянках скелета, що необхідно враховувати за проведення інших досліджень, наприклад кісткової денситометрії [1, 17]. Крім того, узагальнені дані, отримані різними авторами, показують, що втрата кісткової тканини внаслідок індукованого остеопорозу перебігає в різні терміни: в проксимальному метафізі великогомілкової кістки — після 14 діб, у хребцях поперекового відділу хребта — через 60 діб, у шийці стегнової кістки — через 30 діб. Також отримані дані, що після оваріектомії резорбція кістки спочатку перевищує формування, викликаючи втрату кісткової маси, однак незабаром після цього ремоделювання кісток досягає стаціонарного стану, коли резорбція та формування є збалансованими. Зміни кісткової тканини старих тварин після оваріектомії подібні й настають протягом місяця або менше, залежно від ділянки скелета. На відміну від цього оваріектомія не індукує втрату кісткової маси в епіфізах довгих кісток, дистальному метафізі великогомілкової кістки або у хребцях хвоста.
Про нерівномірність втрати маси кісткової тканини йдеться також в іншому дослідженні. Встановлено, що виконання оваріектомії призводило до зниження в довгих кістках (в дистальному метафазі) об’єму кісткової тканини, але до його збільшення у кортексі дистального метафіза й у середній частині діафіза [18]. При цьому збільшувалась кортикальна пористість, підвищувався ризик діафізарного перелому. Автори зробили висновок, що аналіз одного фактора не є достатнім для прогнозування ризику перелому кістки, оскільки в умовах оваріектомії кісткова відповідь змінюється залежно від типу кістки та ділянки розташування. Отримані на тваринах дані розширюють уявлення щодо остеопорозу внаслідок оваріектомії за його схожістю з постменопаузальним остеопорозом у жінок.
Незважаючи на те, що оваріектомія в щурів є золотим стандартом відтворення постменопаузального остеопорозу, використання мишей, за думкою деяких авторів, може бути особливо корисним для початкової оцінки нових препаратів для лікування остеопорозу, оскільки для мишей потрібно набагато менше ліків, остеопороз у них розвивається швидко та має характерні риси [19].
Цінну інформацію щодо кісткового обміну дає дослідження кісткових маркерів в експериментальних тварин порівняно з хибно оперованими. Після оваріектомії в мишей у сироватці крові виявлено поступове зменшення рівнів лужної фосфатази (ALP), остеокальцину та PІNP, які відображають зниження функції остеобластів і формування кістки, й високий рівень CTX1 — маркера резорбції кістки. Серед досліджених показників саме PІNP і CTX1 рекомендовані до використання як еталони визначення кісткоутворення та резорбції кісток Міжнародною асоціацією остеопорозу (IOF) та Міжнародною федерацією клінічних хіміків [20].
У зв’язку з тим, що оваріектомія як модель остеопорозу найбільш детально досліджена на щурах і мишах, цих тварин найчастіше використовують для оцінки лікарських препаратів, немедикаментозних методів лікування, визначення порушень регенерації кістки, а також її перебудови в умовах використання нових біоматеріалів для імплантації. Однак необхідно відзначити, що в умовах остеопорозу, індукованого оваріектомією, переломи не спостерігались.
Поєднання різних чинників з оваріектомією
Оваріектомія в поєднанні з глюкокортикоїдами
Після виконання двосторонньої оваріектомії рекомендовано додатково в наступні дні використати ін’єкцію метилпреднізолону 1 мг/кг маси тіла тварини на добу протягом 4 тижнів. Цю просту, швидку й ефективну техніку автори рекомендують для індукції остеопорозу у кролів, що розвивається в більш короткий термін порівняно з тільки оваріектомією [21].
Іншу модель поєднання оваріектомії з глюкокортикоїдами було відтворено на щурах. Через два тижні після оваріектомії щури отримували ін’єкцію дексаметазону підшкірно в дозі 0,3 мг/кг маси тіла один раз у два тижні [22]. Щурів виводили з експерименту через один і три місяці. Досліджували плечову, стегнову та великогомілкову кістки. Авторами доведено, що комбінований вплив оваріектомії та дексаметазону значно знижує мінеральний вміст і мінеральну щільність кісткової тканини (МЩКТ) порівняно з хибно оперованими щурами. За даними гістоморфометрії, вже в ранньому терміні дослідження відзначено підвищення резорбції кістки внаслідок активації остеокластів без зміни остеобластогенезу. Підвищену втрату трабекулярних структур спостерігали за допомогою мікро-КТ-аналізу, а за Z-критерієм МЩКТ виявлені виражені остеопоротичні зміни. За відзначення маркерів кісткового метаболізму встановлено підвищену швидкість обміну кісток. За використання цієї моделі можливо в короткий термін імітувати стан кістки постменопаузальних жінок, які отримують терапію глюкокортикоїдами. Цю модель, відтворену на тваринах, автори рекомендують як для діагностики, так і для тестування біоматеріалів, призначених для стабілізації та регенерації кісток.
Оваріектомія в поєднанні з механічним розвантаженням кінцівок
Зрілим (віком 6 міс.) щурам після оваріектомії проводили розвантаження задніх кінцівок [23]. Кісткову масу стегнової та великогомілкової кісток визначали за допомогою двохенергетичної рентгенівської абсорбціометрії (ДРА), а міцнісні властивості кісток — шляхом випробування на вигин та скручування. Автори показали, що внаслідок оваріектомії загальна МЩКТ знижувалась у стегновій (–5,5 %) і великогомілковій кістці (–7,3 %) порівняно з хибно оперованими тваринами. Використання тільки розвантаження задніх кінцівок протягом 4 тижнів не впливало на стан кістки, а за умов дії двох факторів — оваріектомії та розвантаження задніх кінцівок — сприяло втраті МЩКТ у стегновій кістці (–10,5 %) порівняно з тільки оваріектомією. До цієї комбінації факторів стегнова кістка була більш чутливою, ніж великогомілкова, тобто МЩКТ додатково зменшувалась (–5,3 %) від загальної порівняно тільки з оваріектомією. Механічні тести також засвідчили значне зниження міцності кісток в умовах використання цих двох факторів.
Оваріектомія в поєднанні з холодовим стресом
На моделі тварин з остеопорозом, індукованим шляхом оваріектомії, вивчали дію холодового стресу. Щури по 5 хв протягом 7 діб плавали в охолодженій до 8 °С воді [24]. Автори виявили порушення ендокринної системи організму: підвищення у плазмі крові кортикостероїдів, тироксину й тиреотропного гормонів, зниження активності лужної фосфатази та кальцій-залежної АТФази (Са2+-АТФази), а також кальцію в кістці порівняно як з контрольними щурами, так і з тваринами з оваріектомією. Автори зробили висновок, що холодовий стрес у поєднанні з дефіцитом естрогенів справляє негативний вплив на кісткову тканину.
Моделювання на тваринах змін, аналогічних перименопаузальному періоду в жінок
Перименопауза є важливим періодом у житті жінок, в якому вони відчувають низку фізіологічних змін, та кроком до остеопорозу. Однак сучасні моделі перименопаузи на тваринах не здатні адекватно відтворити цей етап у житті жінки. Ані модель природного старіння тварин, ані модель оваріектомії не імітують природний перехідний процес, що є менопаузою. У зв’язку з цим триває пошук моделей, які б були наближені до цього стану. Дефіцит естрогенів може бути досягнутий шляхом хімічної індукції за рахунок розладу оваріальної функції з використанням хімічного 4-вініл-1-циклогексен дипепоксиду (VCD), що призводить до передчасної недостатності яєчників [25, 26]. Дослідження in vivo та in vitro підтвердили, що хімічний засіб VCD може викликати селективну деструкцію первинних і вторинних фолікулів яєчників щурів і мишей шляхом прискорення апоптозу, що імітує перименопаузальний стан [27]. Було доведено, що VCD індукує овотоксичність за допомогою інтерференції з лігандами c-kit/kit і апоптичними сигнальними шляхами. Вплив VCD у гризунів призводить до поступового настання яєчникової недостатності з гормональними та циклічними змінами, що імітують перименопаузальний період у жінок. Ця експериментальна модель може бути використана для дослідження ранніх змін у кістковій тканині під впливом зростаючого дефіциту естрогенів. Загалом VCD-індуковані тварини надають певне уявлення про жіночу перименопаузу, але вони також далекі від ідеальних моделей.
Моделювання остеопорозу шляхом орхіектомії
Виконана на гризунах орхіектомія імітує остеопороз, який розвивається в чоловіків, і тому залишається цінним інструментом для розуміння впливу андрогенного дефіциту на кістку [12, 28]. Проведення орхіектомії у гризунів надано на рис. 2.
У проведеному нами гістологічному аналізі стану хребта через 30 днів після орхіектомії в хребцях шийного, грудного та поперекового відділів спостерігали розрідження трабекулярної мережі, витончення кісткових трабекул з вираженими проявами в ділянках метафізарної спонгіози та в діафізарному відділі. Поперечні сполучні трабекули були практично відсутні, часто зустрічались поодинокі сепаровані короткі кісткові трабекули зі сліпими закінченнями, що свідчить про пригнічення процесів кісткоутворення [29]. У грудному відділі хребта в ділянці метафізарної спонгіози каудальних тіл хребців було особливо вираженим порушення будови трабекулярної мережі. У діафізарній ділянці тіл хребців усіх відділів хребта також відзначено розрідження трабекулярної мережі, що супроводжувалося формуванням кісткових трабекул без поперечно сполучених трабекул. Частина трабекул були стоншеними, зафіксована поява переривчастих ниткоподібних структур. Це відображає активізацію процесів кісткової резорбції, що призводить до мікропереломів кісткових трабекул у краніальних ділянках грудного й поперекового відділів хребта на тлі зниження рівня андрогенів.
/16.jpg)
Орхіектомія в поєднанні з L-тироксином
Цей спосіб моделювання вторинного остеопорозу в самців щурів репродуктивного віку проводили шляхом введення L-тироксину в дозі 25 мкг на 100 г маси тіла протягом 30 діб після орхіектомії [30]. Визначено зниження МЩКТ, що переважало показники після тільки орхіектомії.
Подібно орхіектомії, можливо отримати модель остеопорозу внаслідок впливу бусереліну — синтетичного аналога агоніста гонадотропін-рилізинг-гормону (GnRH) (див. нижче).
Моделювання сенільного остеопорозу
Ідентична модель сенільного (старечого) остеопорозу повинна включати тварин, які зазнають втрати кісткової маси як вікову функцію, що призводить у кінцевому результаті до розвитку остеопенії й остеопорозу [31]. У тварин, які мають більший термін життя, прояви остеопорозу виражені значніше, ніж у тварин з коротким терміном життя [7], проте в експериментальних умовах найчастіше використовують гризунів. Насамперед це лабораторні миші, тривалість життя яких становить 2–2,5 року та які досягають пікової кісткової маси у віці 4–8 місяців, а згодом в них спостерігається стійке зниження кісткової маси під час старіння, або лабораторні щури з аналогічною тривалістю життя. В умовах старіння цих тварин можливо виявити особливості змін у кістковій тканині на тканинному, клітинному та молекулярному рівнях.
Старечий остеопоротичний фенотип демонструють миші C57BL/6, в яких спостерігається зниження губчастої та кортикальної маси кістки та її якості залежно від віку [32]. Однак у динаміці втрати компактної та губчастої кісток у цих мишей існують деякі відмінності. Відзначено, що об’ємна частка губчастої кістки була найбільшою у віці 6–8 тижнів, однак із 6-го тижня до 24 місяців відбувається її зменшення. Вікове зниження об’єму губчастої кістки було більш вираженим у самок мишей, ніж у самців. Товщина кортексу збільшувалась у мишей з 1 до 3 місяців, а потім поступово зменшувалась. Знання особливостей цих вікових змін морфології кісток має вирішальне значення для інтерпретації реакції скелета в умовах різних методів фармакологічного або нефармакологічного втручання. Крім того, в мишей C57BL/6 зафіксоване зниження диференціації мезенхімальних стовбурових клітин в остеобласти на тлі підвищення диференціації в адипоцити, що також впливає на якість кістки.
Відтворена лінія мишей SAMP6 (Senescence-accelerated mouse-prone 6) [33], яка була першою моделлю в дослідженні сенільного остеопорозу. Характерною особливістю мишей цієї лінії була наявність остеопорозу зі спонтанними переломами [34]. Крім того, миші SAMP6 мають багато характеристик, що збігаються із сенільним остеопорозом людини, зокрема формування деформацій тіл хребців. Особливістю лінії мишей SAMP8 є розвиток саркопенії та переломів [35]. Це розширює можливості дослідників і робить цю модель важливою для різноспрямованого вивчення клітинних і молекулярних механізмів сенільного остеопорозу [36].
Щоб найкраще охарактеризувати старіння мишей, у Центрі старіння Джексона (Jackson Aging Center) [37] було проведене вивчення тривалості життя 31 генетично різноманітної інбредної лінії мишей, у яких кожні 6, 12 і 18 місяців досліджували різні показники організму, в тому числі й кістки, що дає можливість врахувати ці дані при плануванні та проведенні досліджень.
Моделювання остеопорозу в умовах гіпокінезії або мікрогравітації
Одним із методів індукування остеопорозу у тварин є створення умов гіпокінезії. У моделях на тваринах імітують ситуацію відсутності механічної стимуляції на організм або на кінцівки. В основному для цього використовують гризунів — щурів або мишей.
Існує кілька інвазивних і неінвазивних методів [1]. До неінвазивних методів відносять утримання тварин у клітках-пеналах, де вони знаходяться у стані відсутності рухової активності, а також шляхом бинтування або гіпсування задніх кінцівок. Розвантаження кінцівок у цих умовах пригнічує кісткоутворення та посилює їх резорбцію. Моделювати остеопороз можливо шляхом моделювання умов, що наближуються до космічного польоту, тобто мікрогравітації.
Іммобілізацію задніх кінцівок проводять за допомогою хірургічних методів, а саме нейроектомії сідничного нерва або тенотомії, пошкодження спинного мозку. Використання хірургічних методів для створення моделі остеопорозу в умовах іммобілізації прискорює швидкість втрати кісткової тканини порівняно з іммобілізацією кінцівок тварин нехірургічними методами. У вищеозначених моделях основна частина втрати кісткової тканини відбувається в задніх кінцівках, оскільки вони є ділянками найбільшого механічного розвантаження, при цьому швидкість втрати губчастої кістки вища, ніж компактної. Іммобілізація задніх кінцівок мишей протягом одного або двох тижнів швидко знижує об’єм трабекулярної мережі великогомілкової кістки на близько 50 % від базового рівня [38]. У цієї моделі остеопорозу, на відміну від оваріектомії, періостальне формування кортексу є зниженим, тоді як його ендостальна резорбція підвищується.
Для відтворення іммобілізаційного остеопорозу в щурів пропонується використовувати введення тваринам ботулінового токсину типу А (BTX-A) (Botox(r), Allergan, Irvine, California) [39]. Ботуліновий токсин типу A (BTX-A) є одним із семи нейром’язових блокуючих агентів, що продукуються бактеріями Clostridium botulinum. BTX-A є високоспецифічним для термінальних моторних нервів і має високу здатність після ін’єкції до дифузії в м’язи, викликає м’язову слабкість і параліч. BTX-A у дозі 8 МО вводили щурам у праву ділянку стегнової кістки. Авторами проведено порівняння показників МЩКТ лівої та правої стегнових кісток на початковому рівні та через 14 тижнів за умов дії BTX-A та контрольних щурів після оваріектомії. Вірогідних відмінностей між двома експериментальними групами за показником МЩКТ не було виявлено. Автори зробили висновок, що ця модель може бути аналогом оваріектомії й може бути використана в експериментальних цілях [39].
Моделювання аліментарного остеопорозу
Модель аліментарного дефіциту кальцію відтворюють шляхом утримання тварин на низькокальцієвій зерново-овочевій дієті [10]. У проведеному нами експерименті щури дослідної групи з місячного віку мали такий раціон: 0,03 % кальцію, 0,029 % фосфору, 233 МО вітаміну D, а в контрольних групах — 1,2 % кальцію, 0,8 % фосфору, 233 МО вітаміну D. За даними гістологічного, ультраструктурного та морфометричного дослідження губчастої та компактної речовини стегнової кістки щурів виявлено, що через 5 місяців низькокальцієвої дієти в дослідних тварин обох статей процеси кісткової резорбції переважають над процесами кісткоутворення [40]. При цьому результати морфометричного аналізу свідчать про різну швидкість і механізми втрати кісткової тканини в самців і самиць, а також підтверджують дані, що естрогени відіграють домінуючу роль у захисті губчастої кістки, тоді як андрогени — в захисті компактної кістки.
Розроблені й інші моделі аліментарного остеопорозу. Дефіцит магнію, експериментально індукований у тварин, сприяє порушенню кісткового обміну за рахунок підвищення експресії прозапальних цитокинів. Утримання тварин на раціоні з високим рівнем протеїнів порушує остеогенез, а дієта з високим вмістом жиру сприяє розвитку метаболічного синдрому, що призводить до розвитку вторинного остеопорозу.
Моделювання глюкокортикоїд-індукованого остеопорозу
Глюкокортикоїди шляхом зміни кісткового метаболізму індукують остеопенію й остеопороз, що відрізняється від постменопаузального або сенільного остеопорозу.
Глюкокортикоїдний остеопороз був індукований на 3-місячних щурах-самцях шляхом введення тваринам через пероральний зонд преднізолону ацетату в дозах 1,5, 3,0 і 6,0 мг/кг/д [41]. Для визначення динамічних показників росту кістки щурам перед виведенням з експерименту вводили тетрациклін і кальцеїн з метою подвійного маркування перебудови кістки in vivo. На основі використання широкого спектра методів (біохімічних, гістологічних із морфометрією, механічних тестів, денситометрії, мікро-КТ) автори виявили, що преднізолон значно знижує масу тіла щурів, кісткові біомаркери в сироватці крові та біомеханічні показники. Відзначено, що преднізолон не тільки інгібує кісткоутворення, але й пригнічує резорбцію, що призводить до погіршення кісткової міцності. Крім того, на цій моделі доведено, що ефекти глюкокортикоїдів відрізняються не тільки між кортикальною та трабекулярною кісткою, а й між дослідженими кістками скелета — великогомілковою та стегновою. Щурів молодого віку в умовах індукції глюкокортикоїдами можливо використати як модель для порівняльної оцінки впливу цих препаратів на кістку неповнолітніх пацієнтів, які лікувались глюкокортикоїдами протягом тривалого часу.
Моделювання остеопорозу в умовах гіпотермії
Гіпотермію визначають як один із факторів ризику розвитку остеопенії й остеопорозу [42]. У зв’язку з цим розроблено декілька експериментальних моделей, на яких вивчають вплив гіпотермії на кістку [43–46].
Моделювання легкої гіпотермії виконували шляхом утримання щурів протягом 5 діб у холодовій камері (Т = –20 °С) 5 годин щодня [44]. Ректальну температуру вимірювали кожну добу на початку експерименту, через одну, три й п’ять годин холодового впливу, а також протягом 7 діб після закінчення холодового впливу. В нормі у щурів температура тіла дорівнює 38,5–39,5 °С, на п’яту добу експерименту в молодих щурів (6 міс.) вона знижувалась на 1,82 °С, а у старих щурів (24 міс.) — на 4,13 °С. Гіпотермія справляла негативний вплив на ремоделювання як губчастої, так й компактної кісток. Площа кісткових трабекул у дослідних 6- та 24-місячних щурів на 28-му добу після гіпотермії була нижчою на 16,0 та 16,6 % порівняно з контролем [45]. Кількість остеоцитів на кісткових трабекулах у дослідних 6-місячних тварин також була нижчою, ніж у контрольній групі, на 16,9 %. Виявлена збільшена в 7,5 раза кількість порожніх лакун без остеоцитів. На 28-му добу після гіпотермії в 24-місячних тварин кількість порожнин резорбції з остеокластами перевищувала показники 6-місячних тварин на 33,1 %, а число резорбційних порожнин, заповнених остеобластами і макрофагами, було знижено на 46 %, що вказує на дисбаланс ремоделювання кістки за рахунок підвищення процесів резорбції. Гіпотермія негативно впливала на стан мезенхімальних стромальних клітин кісткового мозку, пригнічуючи їх проліферативну активність і здатність утворювати клітинні колонії [44]. Кількість клітинних колоній та їх площа в культурах кісткового мозку дослідних 6-місячних тварин на 7-му добу культивування, отриманого після холодової дії, була нижчою порівняно з контролем на 34,5 і 40,1 % відповідно.
Досліджували дію гіпотермії, яку моделювали шляхом одноразового утримання щурів у холодовій камері (–32 °С) протягом 3–4 годин до зниження ректальної температури до +12 — +13 °С, при цьому тварини знаходились в активному режимі [43]. Після дії гіпотермії на першу, третю та сьому доби встановлено зменшення просвітів мікросудин і гемокапілярів м’язової тканини внаслідок набряку та вираженої деструкції ендотеліальних клітин, розширення венул. Автори припускають, що виявлені зміни в мікроциркуляторному руслі можуть впливати на стан кісткової тканини у зв’язку з розвитком у кістці гіпоксії.
В іншому експериментальному дослідженні створено модель гіпотермії, яка була відтворена на щурах шляхом примусового плавання по 10 хвилин у холодній воді (температура 8 °С) протягом 10 діб [46]. Після закінчення експерименту в щурів зафіксоване вірогідне зменшення товщини кортикального шару довгих кісток.
Вплив іонізуючого випромінювання на кістку
Вторинний остеопороз у тварин індукують із використанням іонізуючого випромінювання, хіміотерапевтичних агентів і хронічної гіпонатріємії.
Визначено, що у молодих тварин опромінення в низьких дозах (0,1, 0,2 або 0,3 Гр) викликає незначне гальмування темпів росту та формоутворення кісток скелета, але в щурів зрілого віку призводить до розвитку остеопенії, що в першу чергу проявляється в губчастих кістках [47]. Під дією дози 0,1 Гр кісткові трабекули вкорочені в середньому на 6,07–7,23 %, об’ємна щільність первинної спонгіози знижена на 13,9–14,58 %, у хребцях поперекового відділу хребта зафіксоване виражене пригнічення остеопластичних процесів зі зниженням об’єму губчастої кістки на 7–13 %. За опромінення дозою 0,3 Гр зміни були більш виражені. Під дією опромінювання малими дозами радіації сповільнюється мінеральний обмін, знижується кількість макро- та мікроелементів. Найбільш виражені прояви зафіксовані у плечовій кістці зрілих тварин, де зменшення кількості кальцію та магнію досягає критичних показників (20–25 %).
Проведено узагальнення даних літератури щодо змін у скелеті тварин у разі використання більш високих доз опромінювання [48]. Так, після впливу однієї дози 50 Гр у гомілках кролів підвищувалася резорбція в ендостальній ділянці кортексу (4-й тиждень дослідження), що супроводжувалося формуванням кортикальних пор між 12-м і 52-м тижнями. Через 12 тижнів зафіксоване зниження міцності кістки на вигин із незначним відновленням на 52-й тиждень.
Інші моделі остеопорозу
З огляду на те, що остеопороз має мультифакторну природу, для індукції цієї патології використовують різноманітні хімічні речовини, які впливають на різні ланки метаболічних процесів в організмі, проте їх використовують нечасто.
Пролонговане введення бусереліну ацетату (синтетичного аналога агоніста гонадотропін-рилізинг-гормону (GnRH)) щурам-самцям у дозі 25 або 75 мкг/кг викликало значне зниження рівня тестостерону, призводило до порушення мікроструктури кістки, але не впливало на вміст у кістках кальцію [49]. Подібні зміни спостерігались у групі тварин, які зазнали орхіектомії. Змін біомеханічних показників у досліджених групах порівняно з хибно оперованими тваринами не виявлено. Однак введення бусереліну ацетату щурам-самкам призводило, разом з ознаками остеопенії та підвищеної резорбції кістки, до зниження вмісту кальцію в кістках [50]. Отримані дані свідчать про те, що в умовах моделювання остеопорозу, індукованого різними факторами, на результат може впливати стать тварин.
Трансгенні та нокаутні миші в дослідженні остеопорозу
Трансгенними називають тварин з новими властивостями організму, яких створюють шляхом генетичної модифікації, виконаної за допомогою генетичної вставки (інсерції), видалення (делеції) або заміщення гена [51]. При цьому отримані генетичні зміни передаються потомству. Сегмент, який введено в геном рекомбінантної дволанцюгової ДНК, називають трансгеном.
Модель остеопорозу була розроблена з використанням мишей Klotho — трансгенної моделі, отриманої шляхом інсерційної мутації, що порушує локус гена Klotho. У мишей віком 8 тижнів відзначено зниження товщини кортекса діафіза великогомілкової кістки приблизно на 40 %. Гістоморфометричні дослідження, виконані на цій моделі, показали низькі показники як формування кісток (за визначенням поверхні кістки, що вкрита остеобластами до поверхні кісткових трабекул), об’єму (за визначенням на рік новоутвореної кістки на одиницю трабекулярної кістки) та резорбції (за визначенням кількості остеокластів на поверхні кістки та протяжності лакун резорбції). Отримані дані гістоморфометричного дослідження щодо визначення кісткових структурних одиниць (BSU) свідчать про низький кістковий обмін [52]. Має місце значне зниження кісткоутворення (80–90 % від контрольного значення), тоді як показники резорбції кісткової тканини є нижчими (60 %), що нагадує сенільний остеопороз людини. Мишей Klotho розглядають як валідну модель для визначення змін скелета [14].
На трансгенних мишах проведено дослідження гамма-глутамілтрансферази (GGT) — ферменту, який присутній у печінці та бере участь у метаболізмі кісток. Встановлено, що підвищена експресія GGT, виступаючи як цитокін, стимулює остеокластогенез [53].
Фактор інгібування міграції макрофагів (MIF) — це прозапальний та імуномодулюючий цитокін, що, ймовірно, бере участь також у метаболізмі кісток, однак механізм його дії не з’ясований. Фактично трансгенні миші з високою експресією MIF мають підвищений кістковий обмін внаслідок як підвищення резорбції, так й кісткоутворення. Резорбційну активність MIF пов’язують зі здатністю регулювати секрецію остеобластами матриксних металопротеїназ, які підсилюють резорбцію кістки [54].
Кі-86 — білок, що відіграє істотну роль у репарації дволанцюжкових розривів ДНК. Myтантні миші (kі-86–/–) порівняно з диким типом швидше старіють, що на рівні скелета проявляється остеопенією.
Нокаутні миші — це тварини, в яких ділянка ДНК була генетично модифікована таким чином, що експресія конкретного білка відсутня. Створено 126 нокаутних мишей з порушеннями в генах-мішенях з підвищеною частотою аномальних скелетних фенотипів [55]. Використання таких тварин дає великі можливості у визначенні шляхів патогенезу захворювань і розпочинає нову еру в дослідженні остеопорозу.
Виявлені численні ендогенні агенти, що залучені в кістковий метаболізм, і досліджена їх дія на кістку. Відомо, що мережа остеоцитів регулює кісткову масу, виступаючи як механосенсорні клітини. Специфічні трансгенні миші BCL2, в яких мережа остеоцитів повністю порушена, можуть бути моделлю для оцінки функції остеоцитів [16].
Також створена лінія нокаутних мишей з вимкненим маркером старіння — білком регукальцином (Regucalcin, RGN), також відомим як протеїн-30 (senescence marker protein-30, SMP30). Цей білок переважно експресується в печінці та нирках, але відіграє важливу роль у гомеостазі кальцію внаслідок зв’язку з ним. SMP30 захищає клітини від надлишку кальцію та затримує апоптоз. Нокаутні миші з вимкненим SMP30 (SMP30 knockout mice) мають низьку масу тіла й невелику тривалість життя, у них накопичуються нейро- та фосфоліпіди у печінці. У цих мишей розвивається остеопороз внаслідок гіперліпідемії та підвищеної остеокластичної активності на тлі порушення остеобластогенезу [56].
На нокаутних мишах досліджено функцію гену Sox4. Визначено, що зменшення експресії білка Sox4 (+/–) сприяє розвитку остеопорозу. Дослідження функції гену GPC6 за результатами, отриманими на нокаутних мишах, дали можливість розглядати зміни цього гену в асоціації зі змінами МЩКТ.
У разі створення іншої моделі остеопорозу автори керувались тим, що гіпоталамус не тільки має центральне значення в регуляції споживання їжі та жирової маси, а також відіграє важливу роль у регуляції кісткової маси, а гормон мелатонін (MCH), який експресується в гіпоталамусі, бере участь у регуляції енергетичного гомеостазу [57]. Для оцінки фізіологічної ролі рецептора цього гормону створені миші з його відсутністю — MCHR1 (–/–). У таких тварин розвивається остеопороз, зафіксовано зменшення кісткової маси, в основному внаслідок втрати компактної кістки, тоді як маса трабекулярної кістки не змінювалась. Сироваткові рівні С-телопептиду, маркера резорбції кістки в мишей MCHR1 (–/–), були значно підвищені, що свідчить про високий рівень кісткового обміну. Тобто автори довели, що MCHR1-сигналізація бере участь у формуванні підвищеної кісткової маси.
Дотепер виявлені аномальні скелетні фенотипи в нокаутних мишей, асоційованих ще з 153 пріоритетними генами [58]. Серед цих генів — Sox (+/–), недостатність якого викликає сенільний остеопороз. Також доведено, що сенільний остеопороз викликають мутації інших генів — AbI (–/–) та SH3BP2 (–/–). Остеопороз, подібний до постменопаузального, викликають мутації Dok1 (–/–), Dok2 (–/–), TRPV5 (–/–), BK (–/–), BcI6 (–/–), MMP14 (–/–) та ін.
Таким чином, у патогенезі остеопорозу бере участь безліч ендогенних і екзогенних факторів, що різноспрямовано впливають на кісткову тканину. Використання тварин з експериментально модельованим остеопорозом забезпечує можливість оцінити специфічність розвитку порушень у різних кістках скелета, тривалість формування патології у тварин, індукованих різними факторами — оваріектомією, орхіектомією, глюкокортикоїдами тощо, дає можливість дослідити особливості ремоделювання в компактній і губчастій кістках різних ділянок скелета. Дослідження ремоделювання кістки в людини в різних умовах вимагає біопсії кістки — інвазивної процедури, яку пацієнти не завжди легко сприймають. Використання експериментальних тварин при дослідженні впливу різних факторів на кістку відтворює остеопоротичні прояви, що простежуються в кістці людини. Хоча ідеальної моделі остеопорозу не існує, дані, отримані на тваринах, дають цінну інформацію про патогенез цього захворювання, а також про інші патологічні стани скелета. Розроблення нових моделей генетично модифікованих тварин прокладає шлях до розуміння складних ланок патогенезу остеопорозу та відкриває нові підходи до терапії цієї тяжкої хвороби.
Схожість і відмінності експериментальних моделей остеопорозу і патофізіологічних змін у людини внаслідок остеопорозу
Проведений порівняльний аналіз зміни деяких показників скелетної фізіології в людини та мишей [59]. Якщо в людини поздовжній ріст кісток припиняється за умов статевої зрілості, то у щурів повільний ріст кісток відбувається й після статевої зрілості (після 3 міс.), однак втрата кістки в цьому періоді також присутня. Обмін губчастої кістки в мишей, виміряний у дистальному відділі стегнової кістки, становить близько 0,7 % на добу, тоді як у людини у гребені клубової кістки — близько 0,1 % на добу. Тривалість життя кісткової багатоклітинної одиниці в людини становить 6–9 міс., в мишей — 2 тижні. Наступною відмінністю є характер вікових змін у архітектурі губчастої кістки в людей і мишей. У людини з віком зменшуються кількість, товщина та зв’язки між кістковими трабекулами, при цьому спостерігається більше стоншення трабекул у чоловіків, ніж у жінок [60], тоді як у самців і самок мишей (C57BL/6) з віком знижуються кількість і зв’язок кісткових трабекул без змін їх товщини [32]. Однак розрідженість трабекулярної мережі в мишей значно виражена, що також можна пояснити більш високою швидкістю кісткового обміну, проте порушення диференціації та терміну життя остеобластів як у людини, так і в мишей призводить до формування лакун резорбції, не заповнених остеобластами [59]. Зміни в кортексі в мишей і в людини аналогічні, тобто формуються резорбційні порожнини, щільність яких підвищена в ендостальній ділянці, однак старіння мишей (C57BL/6) демонструє, що пори часто займають велику частину внутрішньої кортикальної ділянки метафізу стегнової кістки у 18-місячних мишей, але не виявляються у 6-місячних особин. У мишей C57BL/6J, незважаючи на збільшення маси тіла та МЩКТ скелета, вікові зниження обсягу у хребцях та дистальному відділі стегнової кістки (трабекулярна речовина) відбуваються рано та тривають протягом усього життя. Ці зміни більш виражені у самиць, ніж у самців. Усвідомлення пов’язаних із віком змін у морфології кісток треба враховувати для інтерпретації відповіді кісткової тканини на фармакологічні втручання або генетичні маніпуляції на мишах [32].
Загальні ланки визначені й у трабекулярній мікроструктурі хребців людини та мишей. Зміни в хребцях є надзвичайно неоднорідними в усьому хребті, а зниження щільності трабекулярної мережі в SAMP6 швидше розвивається в каудально розташованих хребцях, ніж у краніальних. Подібні явища спостерігаються також у людей [34]. Ці висновки підкреслюють актуальність використання мишей лінії SAMP6 для досліджень крихкості хребців, пов’язаних із сенільним остеопорозом.
Є й інші спільні ланки в механізмі вікової втрати кісткової маси в людини та мишей, зокрема, це вплив оксидативного стресу та, як наслідок, активація транскрипційних факторів FOXO, відносний гіперглюкокортицизм і підвищене окиснення ліпідів [41, 61].
Слід зазначити, що існують також розбіжності між змінами ділянок скелета в щурів порівняно з кістками жінок. В останніх внаслідок розвитку остеопорозу перші й найбільш тяжкі зміни відбуваються в губчастій кістці тіл хребців, тоді як у старих і зрілих щурів вони переважно починають проявляться в трабекулярній речовині дистального відділу стегнової кістки та проксимальних відділах кісток гомілки. У зв’язку з цим для підтвердження розвитку остеопорозу у тварин досліджують вищезазначені відділи. Визначено, що дистальна ділянка метафіза великогомілкової кістки щурів за архітектурою подібна до такої в дорослих людей. Є ще одна відмінність — у щурів після оваріектомії не виникають переломи, що є характерними для жінок з постменопаузальним остеопорозом.
Однак, з огляду на позитивні сторони експериментальних моделей, відтворених на щурах і мишах, вони отримали широке використання в дослідженні фундаментальних проблем остеопорозу.
Методи оцінки кістки в умовах моделювання остеопорозу
Методи, які використовують для оцінки кісткової маси, архітектури й кісткового обміну у тварин із модельованою остеопенією й остеопорозом, подібні до тих, що використовують для тих самих цілей у людини, проте на тваринах спектр методів значно ширший [1, 19]. Як і в людини, визначають біохімічні маркери у крові та сечі, такі як кальцій, фосфор, магній, а також специфічні білки, що секретують остеобласти й остеокласти під час ремоделювання, а саме: маркери формування кісток, такі як лужна фосфатаза й остеокальцин, маркери резорбції кістки, такі як тартрат-стійка кисла фосфатаза, N- або С- телопептиди колагену I типу.
Сучасні кісткові денситометри дають можливість вимірювати МЩКТ у тварин з модельованим остеопорозом [1]. Двохенергетичну рентгенівську абсорбціометрію часто використовують для оцінки МЩКТ і мінеральної насиченості кістки (BMC) як усього скелета тварин, так і певної локальної ділянки, а її використання можливе в дрібних тварин — мишей і щурів. Деякі переваги перед ДРА має метод периферійної кількісної комп’ютерної томографії (pQCT), що дає змогу аналізувати окремо губчасту й кортикальну кістки. Хоча ДРA і pQCT надають важливу інформацію щодо МЩКТ та ризику переломів, велике значення мають методи гістології з морфометрією, що дають можливість оцінити архітектуру компактної та губчастої кісток, трабекулярний об’єм, кількість остеобластів, остеокластів і остеоцитів, а також визначити динамічні показники формування кісткової тканини, тобто значно розширити уявлення щодо ремоделювання кістки в умовах остеопорозу, індукованого різними чинниками.
На експериментальних моделях тварин можливо провести біомеханічні дослідження. Для оцінки механічних якостей досліджують довгі кістки на вигин у 3–4 місцях і проводять тести на скручування. Тести на стискання або комбінація вигину і стиснення можуть бути застосовані для оцінки хребців і шийки стегнової кістки.
Експериментальні моделі остеопорозу, відтворені на тваринах, за використання різноманітних методів дослідження дають змогу поширити знання щодо механізмів розвитку патології, оцінки змін кісткового обміну та специфічних змін, що виникають у кістці й організмі.
Біоетичні норми роботи з експериментальними тваринами
Обов’язковою умовою проведення експериментів на тваринах є узгодження плану експериментів з комітетом біоетики в установі, де проводяться подібні дослідження. Медико-біологічні дослідження на тваринах виконують в умовах асептики та відповідно до Європейської конвенції, Закону України щодо гуманного ставлення до експериментальних тварин, а також згідно з загальноприйнятими міжнародними стандартами, що засновані на принципах трьох R [62–64]. Це refinement (покращання), тобто гуманізація експериментів (зменшення больового навантаження, використання наркозу під час хірургічного втручання й евтаназії тощо); reduction (скорочення) — визначення оптимальної доцільної кількості тварин для експерименту, необхідного виду тварин та їх віку, вибір адекватної та коректної моделі, обґрунтування об’єктивних методів дослідження; replacement — заміна експериментальних тварин альтернативними моделями, широке впровадження досліджень in vitro та ін.
Виводити тварин із експерименту потрібно тільки під наркозом.
Висновки
Експериментальне дослідження на тваринах в умовах моделювання остеопенії та остеопорозу значно розширює погляд на механізми розвитку первинного та вторинного остеопорозу, дає змогу визначити вплив різних факторів, що порушують кісткову тканину, оцінити дію медикаментозних засобів і нових біоматеріалів. Остеопороз є багатофакторним захворюванням, його клінічні прояви залежать від складного взаємозв’язку факторів довкілля, способу життя та генетичних факторів. Особливістю останніх досягнень у моделюванні остеопорозу є створення трансгенних та нокаутних мишей, на моделях яких можливо виявити складові генетичних уражень, що, безумовно, буде сприяти розробленню нових методів профілактики та терапії цієї тяжкої патології.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці статті.
Внесок авторів: Дєдух Н.В. — збір матеріалу, аналіз літератури, написання та редагування статті; Яковенчук Н.М. — збір літератури, огляд публікацій, аналіз, підготовка рукопису; Нікольченко О.А. — збір літератури, огляд публікацій, редагування статті.
Отримано/Received 21.08.2021
Рецензовано/Revised 08.09.2021
Прийнято до друку/Accepted 12.09.2021
Список литературы
1. Поворознюк В.В., Дедух Н.В., Григорьева Н.В., Гопкалова И.В. Экспериментальный остеопороз. К., 2012. 238 с.
2. Barré-Sinoussi F., Montagutelli X. Animal models are essential to biological research: issues and perspectives. Future Sci OA. 2015. 1(4). FSO 63. doi: 10.4155/fso.15.63.
3. Ferreira G.S., Veening-Griffioen D.H., Boon W.P.C. et al. A standardised framework to identify optimal animal models for efficacy assessment in drug development. PLoS One. 2019. 14. e0218014. doi: 10.1371/journal.pone.0218014.
4. Дедух Н.В., Малышкина С.В., Бенгус Л.М. Экспериментальное моделирование на животных как ступень познания патогенеза остеопороза. Под ред. Корж Н.А., Поворознюк В.В., Дедух Н.В., Зупанец И.А. В кн.: Остеопороз: эпидемиология, клиника, диагностика и лечение. Х.: Золотые страницы, 2002. 236-240.
5. Фролькис В.В., Поворознюк В.В., Евтушенко О.А. Экспериментальный остеопороз (модели, механизмы развития возрастного остеопороза). Под ред. Корж Н.А., Поворознюк В.В., Дедух Н.В., Зупанец И.А. В кн.: Остеопороз: эпидемиология, клиника, диагностика и лечение. Х.: Золотые страницы, 2002. 236-240.
6. Brent M.B., Brüel A., Thomsen J.S. Animal models of disuse-induced bone loss: study protocol for a systematic review. Syst. Rev. 2020. 9(1). 185. doi: 10.1186/s13643-020-01441-3.
7. Фролькис В.В., Поворознюк В.В., Евтушенко О.А. Экспериментальный остеопороз. Здоровье Украины. 2004. 86. 22-25.
8. Iwaniec U.T., Turner R.T. Animal models for osteoporosis. Osteoporosis (Fourth Edition). 2013. Ch. 39. 939-961.
9. Komrakova M., Stuermer E.K., Tezval M. et al. Evaluation of twelve vibration regimes applied to improve spine properties in ovariectomized rats. Bone Reports. 2017. 7. 172-180. doi: 10.1016/j.bonr.2014.12.001.
10. Дєдух Н.В., Нікольченко О.А. Регенерація кістки при аліментарному остеопорозі (експериментальне дослідження). Ортопедия, травматология и протезирование. 2009. 2. 34-40.
11. Turner S.A. Animal models of osteoporosis necessity and limitations. Eur. Pean. Cell. Mater. 2001. 1. 66-81. PMID: 14562261.
12. Sophocleous A., Idris A.I. Rodent models of osteoporosis. Bonekey Rep. 2014. 3. 614. doi: 10.1038/bonekey.2014.109.
13. Ström J.O., Theodorsson A., Ingberg E. et al. Ovariectomy and 17β-estradiol replacement in rats and mice: a visual demonstration. J. Vis. Exp. 2012. 64. e4013. doi: 10.3791/4013.
14. Bonucci E., Ballanti P. Osteoporosis – bone remodeling and animal models. Toxicologic Pathology. 2014. 42. 957-969. doi: 10.1177/0192623313512428.
15. Яковенчук Н.Н., Дедух Н.В. Морфология суставного хряща и субхондральной кости после моделирования остеопороза. Вісник проблем біології і медицини. 2017. 4(3). 324-327. DOI: 10.29254/2077-4214-2017-4-3-141-324-327.
16. Komori T. Animal models for osteoporosis. Eur. J. Pharmacol. 2015. 759. 287-294. doi: 10.1016/j.ejphar.2015.03.028.
17. Song L., Bi Y.N., Zhang P.N. et al. Optimization of the Time Window of Interest in Ovariectomized Imprinting Control Region Mice for Antiosteoporosis Research. BioMed Research. International. 2017. 2017 (Article ID 8417814). 1-10. doi: 10.1155/2017/8417814.
18. Rocabado J.M.R., Kaku M., Nozaki K. et al. A multi-factorial analysis of bone morphology and fracture strength of rat femur in response to ovariectomy. Journal of Orthopaedic Surgery and Research. 2018. 13(318). 1-10. doi: 10.1186/s13018-018-1018-4.
19. Ruosi C., Querques F., Granata F. et al. Cellular and Animal Models for the Identification of Osteoporosis Determinants Increasing Vertebral Compression Fractures Risk. J. Osteopor. Phys. Act. 2015. 3. 159. doi: 10.4172/2329-9509.1000159.
20. Eastell R., Szulc P. Use of bone turnover markers in postmenopausal osteoporosis. Lancet Diabetes Endocrinology. 2017. 5(11). 908-923. doi: 10.1016/S2213-8587(17)30184-5.
21. Kaveh K., Ibrahim R., Zuki M. et al. Osteoporosis Induction in Animal Model. American Journal of Animal and Veterinary Sciences 2010. 5(2). 139-145. Available from: https://healthdocbox.com/Arthritis/80472693-Osteoporosis-induction-in-animal-model.html.
22. Govindarajan P., Khassawna T., Kampschulte M. et al. Implications of combined ovariectomy and glucocorticoid (dexamethasone) treatmenton mineral, microarchitectural, biomechanical and matrix properties of rat bone. Int. J. Exp. Pathol. 2013. 94(6). 387-398. doi: 10.1111/iep.12038.
23. Tou J.C., Foley A., Yuan Y.V. et al. The effect of ovariectomy combined with hindlimb unloading and reloading on the long bones of mature Sprague-Dawley rats. Menopause. 2008. 15(3). 494-502. doi: 10.1097/gme.0b013e318148bbad.
24. Islam N., Chanda S., Ghosh T.K., Mitra C. Cold stress facilitates calcium mobilization from bone in an ovariectomized rat model of osteoporosis. Jpn. J. Physiol. 1998. 48(1). 49-55. PMID: 9538289.
25. Van Kempen T.A., Milner T.A., Waters E.M. Accelerated ovarian failure: a novel, chemically induced animal model of menopause. Brain. Res. 2011. 1379. 176-187. doi: 10.1016/j.brainres.2010.12.064.
26. Wright L.E., Christian P.J., Rivera Z. et al. Comparison of skeletal effects of ovariectomy versus chemically induced ovarian failure in mice. J. Bone Miner. Res. 2008. 23(8). 1296-303. doi: 10.1359/jbmr.080309.
27. Liu W., Wang L.Y., Xing X.X., Fan G.W. Conditions and possible mechanisms of VCD-induced ovarian failure. Altern. Lab. Anim. 2015. 43(6). 385-392. PMID: 26753941.
28. Поворознюк В.В., Гопкалова И.В. Особенности минеральной плотности костной ткани при моделировании разных вариантов вторичного остеопороза у самцов репродуктивного возраста. Проблеми ендокринної патологiї. 2010. 3. 75-82.
29. Гопкалова И.В., Дедух Н.В., Ашукина Н.А., Бенгус Л.М. Морфология костной ткани тел позвонков у самцов крыс после орхиэктомии и введения l-тироксина. Проблеми ендокринної патологiї. 2009. 4. 94-102.
30. Креслов Є.О., Поворознюк В.В., Гопкалова І.В., Караченцев Ю.І. Спосіб моделювання вторинного остеопорозу у самців-щурів репродуктивного віку. Номер патенту: 23141.Опубліковано: 10.05.2007.
31. McGee-Lawrence M.E., Syed F.A. Animal Models of Bone Disease-B. Ed. by P.M. Conn. In: Animal Models for the Study of Human Disease. 2013. 391-417.
32. Glatt V., Canalis E., Stadmeyer L., Bouxsein M.L. Age-related changes in trabecular architecture differ in female and male C57BL/6J mice. J. Bone Miner. Res. 2007. 22. 1197-1207. doi: 10.1359/jbmr.070507.
33. Matsushita M., Tsuboyama T., Kasai R. et al. Age-related changes in bone mass in the senescence-accelerated mouse (SAM). SAM-R/3 and SAM-P/6 as new murine models for senile osteoporosis. Am. J. Pathol. 1986. 125. 276-283. PMID: 3789087.
34. Chen H., Kubo K.Y. Segmental variations in trabecular bone density and microstructure of the spine in senescence-accelerated mouse (SAMP6): A murine model for senile osteoporosis. Exp. Gerontol. 2012. 47(4). 317-322. doi: 10.1016/j.exger.2012.01.005.
35. Zhang N., Chow S., Leung K.S. et al. An animal model of co-existing sarcopenia and osteoporotic fracture in senescence accelerated mouse prone 8 (SAMP8). Experimental gerontology, 2017. 97. 1-8. doi: 10.1016/j.exger.2017.07.008.
36. Histing T., Stenger D., Kuntz S. et al. Increased osteoblast and osteoclast activity in female senescence-accelerated, osteoporotic SAMP6 mice during fracture healing. J. Surg. Res. 2012. 175(2). 271-277. doi: 10.1016/j.jss.2011.03.052.
37. Yuan R., Tsaih S.W., Petkova S.B. et al. Aging in inbred strains of mice: study design and interim report on median lifespans and circulating IGF1 levels. Aging cell. 2009. 8(3). 277-287. doi: 10.1111/j.1474-9726.2009.00478.x.
38. Sakai A. Animal models for bone and joint disease. Animal models of immobilization and unloading. Clin. Calcium. 2011. 21(2). 181-188. doi: CliCa1102181188.
39. Atmaca H., Aydin A., Musaoğlu R. Experimental model of osteoporosis: comparison between ovariectomy and botulinum toxin A. Acta Ortop. Bras. 2013. 21(6). 340-343. doi: 10.1590/S1413-78522013000600009.
40. Нікольченко О.А. Морфологічні особливості репаративного остеогенезу в умовах аліментарного дефіциту кальцію (експериментальне дослідження): автореф. дис... канд. біол. наук: 03.00.11. Київ, 2009. 20.
41. Weinstein R.S., Jilka R.L., Parfitt A.M., Manolagas S.C. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids. Potential mechanisms of their deleterious effects on bone. J. Clin. Invest. 1998. 102(2). 274-282. doi: 10.1172/JCI2799.
42. Пошелок Д.М., Дедух Н.В., Малышкина С.В. Вплив охолодження та гіпотермії на структурно-метаболічні характеристики кістки (літературний огляд). Проблемы криобиологи и криомедицины. 2014. 24(4). 1-13.
43. Дмитренко А.С., Cаган О.В., Перцович В., Жураківський В.М. Зміни ангіоархітектоніки литкового м’язу щура після дії загальної глибокої гіпотермії. Світ медицини та біології. 2010. 3. 67-70. Режим доступу: http://nbuv.gov.ua/UJRN/S_med_2010_3_20.
44. Пошелок Д.М. Ремоделювання кісткової тканини після гіпотермії (експериментальне дослідження). Автореф. дис... канд. біол. наук за спеціальністю 03.00.19 — кріобіологія. Харків, 2015. 16.
45. Пошелок Д.М., Дедух Н.В., Малышкина С.В. Влияние гипотермии на ремоделирование трабекулярной кости крыс. Современная медицина: актуальные вопросы. 2014. 33(7). 70-85.
46. Riesenfeld A. Compact bone changes in cold-exposed rats. Am. J. Phys. Anthrop. 2005. 4. 111-112. doi: 10.1002/ajpa.1330440115.
47. Маркевич О.В. Морфофункціональні зміни скелета в умовах впливу низьких доз іонізуючого опромінення у віковому аспекті (анатомо-експериментальне дослідження) [Текст]: дис... канд. мед. наук. Суми: СумДУ, 2015. 186. Режим доступу: http://essuir.sumdu.edu.ua/handle/123456789/42772.
48. Willey J. Radiation-induced osteoporosis: bone quantity, architecture, and increased resorption following exposure to ionizing radiation. Dissertations. 2008. 181. Available from: https://tigerprints.clemson.edu/all_dissertations/181.
49. Mohamad N.V., Che Zulkepli M.A.A., May Theseira K. et al. Establishing an Animal Model of Secondary Osteoporosis by Using a Gonadotropin-releasing Hormone Agonist. Int. J. Med. Sci. 2018. 15(4). 300-308. doi: 10.7150/ijms.22732.
50. Sakamoto S., Sassa S., Kudo H. et al. Preventive effects of a herbal medicine on bone loss in rats treated with a GnRH agonist. Eur. J. Endocrinol. 2000. 143(1). 139-142. doi: 10.1530/eje.0.1430139. PMID: 10870043.
51. Утко А., Лабунец И.Ф., Бутенко Г.М. Трансгенные мыши в медико-биологических иccледованиях (обзор литературы). Журнал НАМН України. 2014. 20(1). 11-24.
52. Kawaguchi H. Molecular backgrounds of age-related osteoporosis from mouse genetics approaches. Rev. Endocr. Metab. Disord. 2006. 7(1–2). 17-22. doi: 10.1007/s11154-006-9011-3.
53. Hiramatsu K., Asaba Y., Takeshita S. et al. Overexpression of gamma-glutamyltransferase in transgenic mice accelerates bone resorption and causes osteoporosis. Endocrinology. 2007. 148(6). 2708-2715. PMID: 17363454.
54. Onodera S., Sasaki S., Ohshima S. et al. Transgenic mice overexpressing macrophage migration inhibitory factor (MIF) exhibit high-turnover osteoporosis. J. Bone Miner. Res. 2006. 21(6). 876-85. PMID: 16753018.
55. Morris J.A., Kemp J.P., Youlten S.E. et al. An atlas of genetic influences on osteoporosis in humans and mice. Nat. Genet. 2019. 51(2). 258-266. doi: 10.1038/s41588-018-0302-x.
56. Yamaguchi M. Regucalcin and metabolic disorders: Osteoporosis and hyperlipidemia are induced in regucalcin transgenic rats. Mol. Cell. Biochem. 2010. 341(1–2). 119-133. doi: 10.1007/s11010-010-0443-4.
57. Bohlooly Y.M., Mahlapuu M., Andersén H. et al. Osteoporosis in MCHR1-deficient mice. Biochem. Biophys. Res. Commun. 2004. 318(4). 964-969. PMID: 15147966.
58. Kemp J.P., Morris J.A., Medina-Gomez C. et al. Identification of 153 new loci associated with heel bone mineral density and functional involvement of GPC6 in osteoporosis. Nat. Genet. 2017. 49(10). 1468-1475. doi: 10.1038/ng.3949.
59. Jilka R.L. The Relevance of Mouse Models for Investigating Age-Related Bone Loss in Humans. J. Gerontol. Series A. Biol. Sci. Med. Sci. 2013. 68(10). 1209-1217. doi: 10.1093/gerona/glt046.
60. Seeman E. Pathogenesis of bone fragility in women and men. Lancet. 2002. 359. 1841-1850. doi: 10.1016/S0140-6736(02)08706-8.
61. Atmaca H., Aydin A., Musaoğlu R. Experimental model of osteoporosis: comparison between ovariectomy and botulinum toxin A. Acta Ortop. Bras. 2013. 21(6). 340-343. doi: 10.1590/S1413-78522013000600009.
62. Верховна Рада України. Європейська конвенція про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей. Страсбург, 18 березня 1986 року: офіційний переклад. К.: Парламентське видавництво, 2000. Режим доступу: http://zakon2.rada.gov.ua/laws/show/994_137.
63. Верховна Рада України. Закон України № 3447-ИВ від 21.02.2006 «Про захист тварин від жорстокого поводження». К.: Відомості Верховної Ради України, 2006, оновлено 2017 серп. 04. Режим доступу: http://zakon5.rada.gov.ua/laws/show/3447-15.
64. Верховна Рада. Наказ Міністерства освіти і науки, молоді та спорту України № 249 від 01.03.2012 «Про затвердження Порядку проведення науковими установами дослідів, експериментів на тваринах». К.: Офіційний вісник України, 2019. 24. 82. Режим доступу: https://zakon.rada.gov.ua/laws/show/z0416-12.

/14.jpg)
/16.jpg)