Журнал «Здоровье ребенка» Том 16, №8, 2021
Вернуться к номеру
Пробіотики у передчасно народжених дітей. Існуюча практика в Україні та відкриті питання щодо їх застосування
Авторы: Шунько Є.Є. (1), Слюсарєва А.В. (2), Павлишин Г.А. (3), Колоскова О.К. (4), Власова О.В. (4), Олексюк В.М. (5), Банасевич В.В. (6), Гомон Р.О. (7), Васьківська В.П. (8), Носова І.О. (9), Шевчук О.В. (10), Риловникова Т.П. (11)
(1) — Національний університет охорони здоров’я України ім. П.Л. Шупика, м. Київ, Україна
(2) — Полтавський державний медичний університет, м. Полтава, Україна
(3) — Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України, м. Тернопіль, Україна
(4) — Буковинський державний медичний університет, м. Чернівці, Україна
(5) — Хмельницька обласна лікарня, м. Хмельницький, Україна
(6) — Івано-Франківська обласна дитяча клінічна лікарня, м. Івано-Франківськ, Україна
(7) — Вінницька обласна дитяча лікарня, м. Вінниця, Україна
(8) — Житомирська обласна дитяча клінічна лікарня, м. Житомир, Україна
(9) — Львівська обласна клінічна лікарня, м. Львів, Україна
(10) — Рівненська обласна дитяча лікарня, м. Рівне, Україна
(11) — Медичний центр «ДІВА», м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Мета: проаналізувати існуючу практику застосування пробіотиків, порівняти її з міжнародними рекомендаціями з метою розробки алгоритму призначення пробіотиків передчасно народженим немовлятам. Матеріали та методи. У мультицентрове дослідження було включено 821 дитину з відсутністю вроджених вад розвитку, гестаційний вік новонароджених ≤ 32 тижні. Результати. Застосування пробіотиків вірогідно зменшує ризик некротизуючого ентероколіту (НЕК) у передчасно народжених немовлят. Lactobacillus rhamnosus GG ATCC 53103 (Актив Флора бебі) вірогідно знижує ризик розвитку НЕК у передчасно народжених немовлят (ВШ 0,83, р = 0,015) з корекцією певних факторів ризику (гестаційний вік, оцінка за шкалою Апгар, кесарів розтин, застосування штучної вентиляції легень), при цьому такого зв’язку щодо інших пробіотиків не отримано. Висновки. На сьогодні є вагомі аргументи щодо рутинного використання пробіотиків для лікування передчасно народжених немовлят у відділеннях інтенсивної терапії новонароджених (ВІТН), насамперед з метою запобігання розвитку НЕК. Застосування пробіотика L. rhamnosus GG ATCC53103, з дотриманням рекомендацій щодо його безпечності для застосування у передчасно народжених, зменшує ризик розвитку НЕК у цієї категорії пацієнтів. Вибір пробіотика для призначення немовлятам у ВІТН рекомендується проводити за таким алгоритмом: 1) з’ясувати можливість застосування штаму/штамів пробіотика відповідно до рекомендацій ESPGHAN; 2) проаналізувати додаткові речовини, що входять у склад пробіотика, та оцінити їх безпечність для передчасно народжених дітей; 3) визначити якість та безпечність пробіотика, акцентуючи увагу на кількості проведених досліджень, і гарантії виробника щодо застосування саме у передчасно народжених дітей.
Purpose: to analyze the existing practice of using probiotics, compare it with international recommendations to develop an algorithm for prescribing probiotics to premature infants. Materials and methods. The multicenter study included 821 children with no birth defects and gestational age of newborns ≤ 32 weeks. Results. The use of probiotics significantly reduces the risk of necrotizing enterocolitis (NEC) in premature infants. Lactobacillus rhamnosus GG ATCC 53103 (Active Flora Baby) significantly reduces the risk of NEC in premature infants (OR 0.83, p = 0.015) with correction of certain risk factors (gestational age, Apgar score, cesarean section, use of artificial ventilation), while such a relationship with other probiotics was not obtained. Conclusions. Today, there are strong arguments for the routine use of probiotics to treat premature infants in neonatal intensive care units (NICU), primarily to prevent the development of NEC. The application of probiotic L. rhamnosus GG ATCC53103, in compliance with its safety recommendations for use in premature infants, reduces the risk of NEC in this category of patients. The choice of a probiotic for prescribing to infants in NICU is recommended to be carried out according to the following algorithm: 1) to determine the possibility of using the probiotic strain/strains following the recommendations of ESPGAN; 2) to analyze additional substances of the probiotic and evaluate their safety for premature infants; 3) to determine the quality and safety of the probiotic, focusing on the number of studies conducted, and the manufacturer’s guarantees for use in premature infants.
пробіотики; передчасно народжені діти; некротизуючий ентероколіт; сепсис; Lactobacillus rhamnosus GG
probiotics; premature infants; necrotizing enterocolitis; sepsis; Lactobacillus rhamnosus GG
Вступ
Матеріали та методи
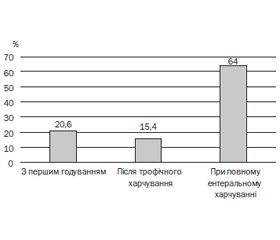
Результати
/21.jpg)
/22.jpg)
Обговорення
Висновки
- Puhan M.A., Schunemann H.J., Murad M.H. et al. A grade working group approach for rating the quality of treatment effect estimates from network meta-analysis. BMJ. 2014. 349. g5630.
- Lee J.S., Polin R.A. Treatment and prevention of necrotizing enterocolitis. Semin. Neonatol. 2003. 8. 449-59.
- Eaton S., Rees C.M., Hall N.J. Current Research on the Epidemiology, Pathogenesis, and Management of Necrotizing Enterocolitis. Neonatology. 2017. 111. 423-430.
- Niño D.F., Sodhi C.P., Hackam D.J. Necrotizing enterocolitis: new insights into pathogenesis and mechanisms. Nat. Rev. Gastroenterol. Hepatol. 2016. 13. 590-600.
- Lim J.C., Golden J.M., Ford H.R. Pathogenesis of neonatal necrotizing enterocolitis. Pediatr. Surg. Int. 2015. 31. 509-518.
- Torrazza R.M., Neu J. The altered gut microbiome and necrotizing enterocolitis. Clin. Perinatol. 2013. 40. 93-108.
- Patel R.M., Underwood M.A. Probiotics and necrotizing enterocolitis. Semin. Pediatr. Surg. 2018 Feb. 27(1). 39-46. doi: 10.1053/j.sempedsurg.2017.11.008. Epub 2017 Nov 6.
- Neu J. Preterm infant nutrition, gut bacteria, and necrotizing enterocolitis. Curr. Opin. Clin. Nutr. Metab. Care. 2015. 18. 285-288.
- Underwood M.A. Impact of probiotics on necrotizing enterocolitis. Semin. Perinatol. 2017. 41. 41-51.
- Embleton N.D., Zalewski S., Berrington J.E. Probiotics for prevention of necrotizing enterocolitis and sepsis in preterm infants. Curr. Opin. Infect. Dis. 2016. 29. 256-261.
- Yu W., Sui W., Mu L. et al. Preventing necrotizing enterocolitis by food additives in neonates: A network meta-analysis revealing the efficacy and safety. Medicine (Baltimore). 2017. 96. e6652.
- Janvier A., Malo J., Barrington K.J. Cohort study of probiotics in a North American neonatal intensive care unit. J. Pediatr. 2014. 164. 980-985.
- Fernandez-Carrocera L.A., Solis-Herrera A., Cabanillas-Ayon M. et al. Double-blind, randomised clinical assay to evaluate the efficacy of probiotics in preterm newborns weighing less than 1500 g in the prevention of necrotising enterocolitis. Arch. Dis. Child Fetal. Neonatal. Ed. 2013. 98(1). F5-F9.
- Rolnitsky A., Ng E., Asztalos E., Shama Y., Karol D., Findlater C., Garsch M. A Quality Improvement Intervention to Reduce Necrotizing Enterocolitis in premature infants with Probiotic Supplementation. Pediatr. Qual. Saf. 2019 Sep 9. 4(5). e201.
- Chowdhury T., Ali M.M., Hossain M.M. et al. Efficacy of probiotics versus placebo in the prevention of necrotizing enterocolitis in preterm very low birth weight infants: a double-blind randomized controlled trial. J. Coll. Physicians Surg. Pak. 2016. 26. 770-4.
- Fujii T., Ohtsuka Y., Lee T. et al. Bifidobacterium breve enhances transforming growth factor beta1 signaling by regulating Smad7 expression in preterm infants. J. Pediatr. Gastroenterol. Nutr. 2006. 43. 83-8.
- Sun J., Marwah G., Westgarth M., Buys N., Ellwood D., Gray P.H. Effects of Probiotics on Necrotizing Enterocolitis, Sepsis, Intraventricular Hemorrhage, Mortality, Length of Hospital Stay, and Weight Gain in Very Preterm Infants: A Meta-Analysis. Adv. Nutr. 2017 Sep 15. 8(5). 749-763. doi: 10.3945/an.116.014605. Print 2017 Sep.
- Isayama T., Lee S.K., Mori R., Kusuda S., Fujimura M., Ye X.Y., Shah P.S. Canadian Neonatal Network; Neonatal Research Network of Japan. Comparison of mortality and morbidity of very low birth weight infants between Canada and Japan. Pediatrics. 2012. 130. e957-e965.
- Luoto R., Isolauri E., Lehtonen L. Safety of Lactobacillus GG Probiotic in Infants with Very Low Birth Weight: Twelve Years of Experience. Clinical Infectious Diseases. 2010 May 1. 50. 9. 1327-1328.
- Probiotics. https://www.starship.org.nz/guidelines/probiotics-infloran
- Стандарти медичної допомоги новонародженим в Польщі. За ред. проф., д-ра габ. мед. наук М.К. Боршевської-Корнацької.
- Robertson C., Savva G.M., Clapuci R., Jones J., Maimouni H., Brown E., Minocha A. Incidence of necrotising enterocolitis before and after introducing routine prophylactic Lactobacillus and Bifidobacterium probiotics. Arch. Dis. Child Fetal. Neonatal. Ed. 2019 Oct 30. pii: fetalneonatal-2019-317346. d
- Taylor R.S. Probiotics to prevent necrotizing enterocolitis: Too cheap and easy? Paediatr. Child Health. 2014. 19. 351-352.
- Viswanathan S., Lau C., Akbari H., Hoyen C., Walsh M.C. Survey and evidence based review of probiotics used in very low birth weight preterm infants within the United States. J. Perinatol. 2016. 36. 1106-1111.
- Denkel L.A., Schwab F., Garten L., Geffers C., Gastmeier P., Piening B. Protective effect of dual-strain probiotics in preterm infants: a multi-center time series analysis. PLoS ONE. 2016. 11. e0158136.
- Statement from FDA Commissioner Scott Gottlieb, MD, on advancing the science and regulation of live microbiome-based products used to prevent, treat, or cure diseases in humans. https://www.fda.gov/news-events/press-announcements/statement-fda-commissioner-scott-gottlieb-md-advancing-science-and-regulation-live-microbiome-based
- Van den Akker C.H.P., van Goudoever J.B., Szajewska H. et al. Probiotics for preterm infants: a strain specific systematic review and network meta-analysis. J. Pediatr. Gastroenterol. Nutr. 2018. 67(1). 103-122.
- Bafeta A., Koh M., Riveros C., Ravaud P. Harms reporting in randomized controlled trials of interventions aimed at modifying microbiota: a systematic review. Ann. Intern. Med. 2018. 169. 240-247.
- Escribano E., Zozaya C., Madero R., Sánchez L., van Goudoever J., Rodríguez J.M., de Pipaon M.S. Increased incidence of necrotizing enterocolitis associated with routine administration of Infloran™ in extremely preterm infants. Benef. Microbes. 2018. 9. 683-690.
- Costa R.L., Moreira J., Lorenzo A., Lamas C.C. Infectious complications following probiotic ingestion: a potentially underestimated problem? A systematic review of reports and case series. BMC Complement. Altern. Med. 2018. 18. 329.
- Serce O., Benzer D., Gursoy T., Karatekin G., Ovali F. Efficacy of Sacharomyces boulardii on necrotizing enterocolitis or sepsis in very low birth weight infants: A randomized controlled trial. Early Hum. Dev. 2013. 89. 1033-6.
- Esaiassen E., Cavanagh P., Hjerde E., Simonsen G.S., Stoen R., Klingenberg C. Bifidobacterium longum Subspecies infantis Bacteremia in 3 extremely preterm infants receiving probiotics. Emerg. Infect. Dis. 2016. 22. 1664-1666.
- Al Tawil K., Sumaily H., Ahmed I.A. et al. Risk factors, characteristics and outcomes of necrotizing enterocolitis in late preterm and term infants. J. Neonatal. Perinatal. Med. 2013. 6. 125-130.
- Underwood M.A. Arguments for routine administration of probiotics for NEC prevention. Curr. Opin. Pediatr. 2019 Apr. 31(2). 188-194. doi: 10.1097/MOP.0000000000000732.
- Manzoni P., Mostert M., Leonessa M.L., Priolo C., Farina D., Monetti C. et al. Oral supplementation with Lactobacillus casei subspecies rhamnosus prevents enteric colonization by Candida species in preterm neonates: a randomized study. Clin. Infect. Dis. 2006. 42. 1735-1742.
- Dermyshi E., Wang Y., Yan C., Hong W., Qiu G., Gong X., Zhang T. The “Golden Age” of Probiotics: A Systematic Review and Meta-Analysis of Randomized and Observational Studies in Preterm Infants. Neonatology. 2017. 112. 9-23.
- Braga T.D., da Silva G.A.P., de Lira P.I.C., de Carvalho Lima M. Efficacy of Bifidobacterium breve and Lactobacillus casei oral supplementation on necrotizing enterocolitis in very-low-birth-weight preterm infants: a double-blind, randomized, controlled trial. The American Journal of Clinical Nutrition. 2010. 93(1). 81-86.
- Van den Akker C.H.P., van Goudoever J.B., Shamir R., Domellöf M., Embleton N.D., Hojsak I., Lapillonne A. et al. Probiotics and Preterm Infants: A Position Paper by the ESPGHAN Committee on Nutrition and the ESPGHAN Working Group for Probiotics and Prebiotics. J. Pediatr. Gastroenterol. Nutr. 2020 Feb 7. doi: 10.1097/MPG.0000000000002655.
- Xiong T., Maheshwari A., Neu J., Ei-Saie A., Pammi M. An Overview of Systematic Reviews of Randomized-Controlled Trials for Preventing Necrotizing Enterocolitis in Preterm Infants. Neonatology. 2020. 117(1). 46-56. doi: 10.1159/000504371.
- Bi L.W., Yan B.L., Yang Q.Y., Li M.M., Cui H.L. Which is the best probiotic treatment strategy to prevent the necrotizing enterocolitis in premature infants: A network meta-analysis revealing the efficacy and safety. Medicine (Baltimore). 2019 Oct. 98(41). e17521.
- Jiao X., Fu M.D., Wang Y.Y., Xue J., Zhang Y. Bifidobacterium and Lactobacillus for preventing necrotizing enterocolitis in very-low-birth-weight preterm infants: a systematic review and meta-analysis. World J. Pediatr. 2020 Apr. 16(2). 135-142. doi: 10.1007/s12519-019-00297-5. Epub 2019 Sep 4.
- Vermeulen M.J., Luijendijk A., van Toledo L., van Kaam A.H., Reiss I.K.M. Quality of probiotic products for preterm infants: Contamination and missing strains Acta Paediatr. 2020 Feb. 109(2). 276-279. doi: 10.1111/apa.14976. Epub 2019 Sep 30.

/20.jpg)
/21_2.jpg)
/22_2.jpg)
/23.jpg)