Вступ
Розлад аутистичного спектра (РАС) — це генетично обумовлений стан, при якому виникає дисрегуляція вегетативної іннервації, дискоординована робота імунної системи, порушення метаболічних процесів, зміни функціональної активності мікробіому, що призводить до психоповедінкових та когнітивних змін [7, 21].
Сучасні наукові дослідження висвітлюють тісний двонаправлений взаємозв’язок між мозком та травною системою — вісь «мозок — кишечник — мікробіом» [17, 18]. Особливості взаємодії між центральною та ентеральною нервовими системами, з урахуванням притаманних РАС реакцій вегетативної дезадаптації, підвищеної сенситивності, ендогенного стресу, специфічних особистісних характеристик, харчової поведінки, вказують на виняткову значущість патології шлунково-кишкового тракту (ШКТ) при РАС [6, 16]. Процеси кишкової моторики, абсорбції, секреції та їх розлади лежать у сфері контролю автономної ентеральної нервової системи, водночас зазнаючи впливу з боку симпатичної та парасимпатичної мереж. Тому навіть за відсутності пошкодження нейрональної передачі центральна антиноцицептивна дисфункція може визначати розвиток вісцеральної гіпералгезії, яка є патогномонічною для різних типів функціональних розладів органів травлення (ФРОТ).
Отже, за оновленою версією Римських критеріїв (2016), порушення на осі «мозок — кишечник» вважається основним підґрунтям для розвитку ФРОТ.
Доведені загальні механізми патогенезу також пояснюють виникнення синдрому перехреста функціональних порушень, що характеризується одночасним перебігом кількох функціональних розладів або переходом з одного в інший. Літературні дані свідчать про високу частоту виявлення синтропних (перехресних) функціональних розладів ШКТ: у переважної більшості пацієнтів із синдромом подразненого кишечника (СПК) діагностується функціональна диспепсія, майже у половини хворих із СПК виявляються порушення моторної функції біліарного тракту [28, 25]. Синтропія при ФРОТ асоціюється з більш тяжкими клінічними проявами і формує так званий феномен взаємного обтяження. Вочевидь, синтропні функціональні розлади не лише підтримують і посилюють дисрегуляцію діяльності ШКТ, а й призводять до виражених порушень у психоемоційній сфері, що за принципом порочного кола обтяжує перебіг ФРОТ, спричинює резистентність клінічної симптоматики. Означена ситуація відбивається на якості медичної допомоги, створює певні проблеми при визначенні ефективності терапевтичних заходів, що потребує пошуку та впровадження додаткових ефективних лікувально-діагностичних інструментів, зосереджених на процесах центральної та ентеральної нейронної регуляції.
Представником центральної регуляції у кишечнику є ентеральна нервова система (ЕНС), яка простягається від стравоходу до анального отвору і налічує в собі близько 100 млн клітин, що майже співпадає із кількістю нейронів спинного мозку, та складається з двох нервових сплетень: мейснерова та ауербахового. Високорозвинена ЕНС відіграє важливу роль у процесах регуляції гастроінтестинальної рухової та секреторної активності завдяки формуванню ентероентеральних рефлексів і механізмів «пам’яті», синтетичній функції (вироблення близько 30 нейромедіаторів, подібних до нейромедіаторів центральної нервової системи (ЦНС)), продукції гормонів, участі в активації імунної відповіді та виникненні запальних реакцій, циркадних ритмів — можливості «занурюватись у сон» з характерною хвильовою активністю [8–10]. Структурним елементом ЕНС є гліальні клітини, що являють собою морфологічний та функціональний еквівалент астроцитів та мікроглії ЦНС і здатні експресувати низку біологічно активних метаболітів нервової системи [8–10].
Останніми роками функція ентеральних гліальних клітин (ЕГК) розширилася від простої нутритивної підтримки кишкових нейронів до ролі основних учасників регуляції запальних подій у кишечнику. Подібно до астроцитів ЦНС, ЕГК фізіологічно експресують білок-нейромедіатор S-100 [10, 11, 13, 22]. У ЦНС надмірна експресія S-100 відповідає за ініціювання гліальної реакції шляхом вивільнення прозапальних медіаторів, які можуть мати шкідливий вплив на різноманітні процеси. Показано, що прозапальний ефект, опосередкований S-100, не обмежується лише мозком: надмірна експресія S-100 пов’язана з виникненням та підтриманням запалення у кишечнику [10, 11, 13].
Поряд із S-100 важливим нейромедіатором є нейронспецифічна енолаза (NSE). Даний протеїн є формою гліколітичного ізоферменту енолази і вважається багатофункціональним білком [12, 14, 22]. Слід зазначити, що експресується NSE не лише у цитоплазмі нейронів та нейроендокринних клітинах гіпофізу, а й у щитоподібній залозі, легенях, підшлунковій залозі та кишечнику [12, 14], це вказує на його роль у багатьох патологічних процесах. На жаль, роботи, присвячені дослідженням ролі S-100 та NSE у процесах цереброінтестинальної взаємодії, досі поодинокі.
Відомо, що за умов ендогенного стресу нервові клітини потребують енергії та підвищення рівня регуляторних пептидів [19, 20]. Гіперпродукція нейромедіаторів, які беруть участь у процесах дозрівання та взаємодії нервових клітин, не лише дозволяє виявляти тонкі зсуви метаболічних розладів у нервовій системі, а й опосередковано вказує на наявність субклінічного запалення при функціональних розладах ШКТ. Означене вказує на доцільність дослідження особливостей цереброінтестинальних процесів у дітей з РАС з урахуванням показників S-100 та NSE.
Мета: аналіз цереброінтестинальної взаємодії з урахуванням ролі нейромедіаторів NSE та S-100 у дітей з РАС.
Матеріали та методи
У дослідженні взяли участь 66 дітей віком від 2 до 4 років із підтвердженим діагнозом РАС, середній вік пацієнтів становив 3,67 ± 0,17 року. Діти, хворі на РАС, були розподілені на 2 підгрупи: А — із супутніми ФРОТ (45 дітей), В — без супутньої патології травної системи (21 дитина). Гендерний склад досліджуваних груп виявився нерівномірним: хлопчиків було 62,10 ± 4,85 %, а дівчаток — 37,90 ± 4,85 %, р < 0,05. Критерії включення: підтверджений діагноз РАС, наявність інформованої згоди на участь у клінічному дослідженні. Критерії виключення: наявність органічної патології ЦНС (гостра енцефалопатія, дитячий церебральний параліч, епілепсія, генетичні захворювання з ураженням ЦНС), спадкові розлади метаболізму (фенілкетонурія, хвороба Вільсона тощо), захворювання ШКТ органічної природи (виразкова хвороба шлунка, гепатит, холецистит тощо).
Для оцінки ступеня клінічних проявів РАС у дітей було застосовано загальновизнану рейтингову шкалу Childhood autism rating scale (CARS) (Schopler et al., 1980, 1988), яка складається з 15 доменів, що характеризують поведінку, пов’язану з аутистичними розладами. Кожен домен оцінюється за шкалою від 1 до 4 балів, вищі бали вказують на більш тяжкий перебіг РАС. Сумарна кількість балів дозволяє визначити ступінь тяжкості процесу: до 30 балів — обстежена дитина перебуває в неаутичному діапазоні, 30–33 бали — аутизм легкого ступеня, 33–36 балів — аутизм середнього ступеня тяжкості, 37–60 балів — тяжкий аутизм.
Визначення сироваткової концентрації NSE та протеїну S-100 проводили імунохімічним способом із електрохемілюмінесцентною детекцією (ECLIA) у сертифікованій лабораторії (GCLP 2011, ISO 9001:2000, сертифікат акредитації МОЗ України № 012850). Референтними показниками відповідно до стандартів лабораторії вважались: для NSE — від 0 до 16,3 нг/мл, для протеїну S-100 — від 0 до 0,105 мкг/л.
ФРОТ діагностували на підставі Римських критеріїв IV (2016). З урахуванням нововведень останнього перегляду окремо визначались явища синтропії (overlap syndrome) при ФРОТ, що характеризується залученням у патологічний процес двох і більше органів однієї системи [1, 2].
Включення дітей у дослідження здійснювалось за умови наявності письмової інформованої згоди батьків або офіційних опікунів пацієнтів, після надання детальної інформації щодо процедури та мети роботи.
Отримані цифрові дані опрацьовані статистично за допомогою комп’ютерного пакета програм Microsoft Excel. Статистична обробка даних передбачала оцінку нормальності розподілу даних. Безперервні та категоріальні змінні визначались як середнє значення (М), стандартне відхилення (m), відносне значення (%). Нормально розподілені числові змінні порівнювали із застосуванням незалежного вибіркового t-тесту. Чисельні змінні, які розподілялись ненормально, порівнювали із застосуванням U-критерію Манна — Уїтні. Для оцінки сили та напрямку кореляційного зв’язку розраховували коефіцієнт Спірмена (r). Під час аналізу таблиць спряженості nxm, а також при зіставленні часток у групах порівняння використовували χ2-критерій Пірсона та точний тест Фішера. Статистична значущість показників визначалася на рівні р ≤ 0,05.
Результати
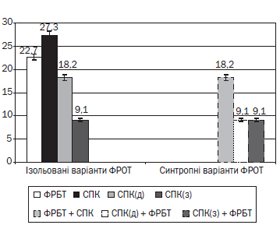
У 68,20 ± 4,66 % обстежених дітей з РАС виявлено ФРОТ. Вивчення структури супутніх ФРОТ продемонструвало, що РАС супроводжуються переважно функціональними розладами біліарного тракту (ФРБТ) — 22,70 ± 4,19 % (при цьому у 12,90 ± 6,02 % ФРБТ за панкреатичним типом розладу сфінктера Одді) та СПК — 27,30 ± 4,46 % (із переважанням діареї — 18,20 ± 3,86 %, із переважанням запору — 9,10 ± 2,88 %). В окремих випадках (18,2 %) було діагностовано синтропні (перехресні) функціональні розлади травної системи. Так, наявні клінічні ознаки ФРБТ і СПК із запором та ФРБТ і СПК із діареєю виявлено в однакової кількості дітей з РАС (9,10 ± 2,88 %) (рис. 1).
Для оцінки перебігу РАС за умов супутніх функціональних розладів органів травлення проводили порівняльний аналіз показників САRS в двох групах дітей. При цьому у групі В (РАС без супутніх ФРОТ) співвідношення легкий/середній ступінь : тяжкий ступінь становило 5,5 : 1,0 (85,00 ± 3,57 % та 15,40 ± 3,61 %, р < 0,05), що свідчило про переважання легких форм над тяжкими.
Подібне співвідношення у групі А (РАС із супутніми ФРОТ) становило 1,0 : 2,2 (31,1 ± 4,63 % та 68,9 ± 4,63 %, р < 0,05), що свідчило про зменшення кількості дітей з легким перебігом із одночасним збільшенням тяжких форм аутистичних розладів при супутніх ФРОТ.
Отримані результати демонстрували вірогідне переважання тяжких форм у групі А порівняно з групою В (рис. 2).
Для оцінки вираженості клінічних проявів у дітей з РАС проводили детальний аналіз за трьома доменами шкали САRS, які виявили максимальну кількість балів: емоційна відповідь, адаптація до змін та схильність до посилення нервового напруження та страхів.
При цьому у групі В не відмічалось вираженого зростання кількості балів за означеними доменами, незалежно від ступеня тяжкості РАС. Натомість у групі А кількість балів, отриманих за САRS, відповідала тяжкому перебігу РАС, що простежувалось (на рівні +4) переважно у таких доменах: підвищення емоційної відповіді — 85,00 ± 10,50 %, р < 0,05, порушення адаптації до змін — 90,00 ± 8,83 %, р < 0,05, схильність до посилення нервового напруження та страхів — 80,00 ± 11,70 %, р < 0,05.
Отже, за отриманими даними, перебіг РАС у дітей, які мали супутні ФРОТ, був більш тяжким. При зіставленні тяжкості аутистичних проявів у дітей груп порівняння виявлено статистично значущі відмінності залежно від варіанта ФРОТ: при СПК на рівні p = 0,004, при ФРБТ — p = 0,009, а за умов синтропії — p = 0,041.
У дітей групи А асоціативний зв’язок між тяжким перебігом РАС та супутніми ФРОТ було підтверджено за критерієм Краксела — Уолліса (р < 0,001). Характерно, що рівень асоціацій варіював залежно від клінічних проявів ФРОТ і був найбільш високим при РАС із СПК (р < 0,001) та РАС із ФРБТ + СПК (р < 0,001), що збігалося із результатами аналізу шкали САRS, які демонстрували значущість (на рівні +4) доменів: підвищена емоційна відповідь — 35,71 ± 20,50 %, порушення адаптації — 42,00 ± 4,94 %, схильність до посилення нервового напруження та страхів — 57,14 ± 21,6 %. Вочевидь, супутні ФРОТ супроводжуються додатковими психоемоційними реакціями, що позначається на клінічних характеристиках аутистичних розладів.
Узагальнюючи особливості перебігу РАС, можна дійти висновку, що наявність синтропних ФРОТ свідчить про більш глибоке ураження на осі «мозок — кишечник», що клінічно відбивається підсиленням порушень комунікації і соціальної взаємодії, наростанням стереотипних рухів, негативізмом, а також реєструється за зсувами у психоемоційних та адаптаційних параметрах САRS.
З огляду на виявлені клінічні особливості та психоадаптаційні характеристики у дітей з РАС слід вважати, що супутні ФРОТ здатні підсилювати реакції ендогенного стресу у результаті неповного дозрівання нейрональних структур травної системи, розбалансування цереброінтестинальної взаємодії, активації прозапальних субстанцій, нейрометаболічних зсувів та процесів субклінічного запалення. Вочевидь, означені процеси супроводжуються залученням регуляторних нейромедіаторів, які можуть слугувати маркерами вираженості патологічних зсувів.
Проведений у роботі аналіз продемонстрував вірогідне підвищення рівня нейромедіаторів NSE та S-100 у дітей з РАС. При цьому детальне вивчення показників NSE та S-100 з урахуванням супутніх ФРОТ дозволило окреслити певні особливості (табл. 1, 2).
Так, у дітей з РАС спостерігалось достеменне підвищення рівня S-100 та NSE відносно референтних показників. Співставлення означених показників у групах порівняння показало, що концентрація протеїну S-100 виявилась достеменно вищою у дітей із супутніми ФРОТ (р < 0,05).
У той же час рівень NSE, хоча і був дещо вищим у групі А (20,7 ± 7,1 нг/мл), не виявив вірогідних відмінностей порівняно із групою В (p = 0,163).
Аналіз рівня нейромедіаторів у дітей з РАС залежно від нозологічної форми ФРОТ показав, що у пацієнтів із СПК спостерігалось більш істотне підвищення рівня S-100 (0,35 ± 0,12 мкг/л) порівняно із ФРБТ (0,13 ± 0,06 мкг/л, р < 0,001) (рис. 3). А за умов синтропії у дітей з РАС рівень S-100 виявився найбільш високим (0,65 ± 0,19 мкг/л) і вірогідно відрізнявся від показників, отриманих при ізольованих формах, зокрема при ФРБТ (р = 0,031).
Проведений кореляційний аналіз підтвердив наявність прямого зв’язку між підвищенням концентрації S-100 та наявністю супутніх ФРОТ при РАС: СПК (r = 0,34); синтропії СПК + ФРБТ (r = 0,48).
При визначенні діагностичних характеристик показника S-100 у дітей з РАС було встановлено, що найбільшу діагностичну значущість за умов синтропних ФРОТ має його порогове значення (cut-off) на рівні 0,164 мкг/л (Se = 58,3; Sp = 53,7).
Обговорення
Результати проведеного дослідження щодо цереброінтестинальної взаємодії при РАС співвідносяться із сучасними поглядами щодо важливості ідентифікації клінічних фенотипів РАС з урахуванням поєднаних станів для кращого розуміння патофізіології у різних пацієнтів та оптимізації терапевтичної тактики [3, 15, 28]. На сьогодні супутня патологія травної системи вважається найбільш поширеним соматичним станом при РАС. Результати низки масштабних досліджень вказують на запор як на основну проблему у хворих на РАС із супутньою гастроентерологічною патологією [3, 4, 26]. Деякі автори навіть пропонують виділяти окремий «ендофенотип» хворих на РАС із патологією ШКТ та залучати відповідні коригуючі засоби для лікування хворих [5, 27, 28]. Особливістю даного дослідження є акцент на асоціації між синтропним характером супутньої патології ШКТ та тяжкістю перебігу.
Аналіз отриманих результатів показав підвищення концентрації NSE у всіх дітей із РАС. Ці результати можна обґрунтувати концепцією інтегративної фізіології, а саме асоціацією не тільки між нервовими, імунними процесами та травною системою, але і з метаболічною регуляцією та нейроендокринним впливом [23–25].
За умов РАС виявлено особливості концентрації нейропротеїну S-100 залежно від типу функціонального розладу ШКТ. Так, у дітей з РАС за відсутності ФРОТ рівень S-100 майже не змінювався, у дітей із ізольованим ФРБТ (без залучення кишечника) рівень S-100 значно не відрізнявся від такого, що встановлений у хворих на РАС без супутніх ФРОТ. Натомість значне підвищення рівня S-100 визначалося при аутистичних розладах, що перебігали на фоні синтропних порушень травної системи.
Отже, супутні ФРОТ обтяжують перебіг РАС у дітей, негативно впливаючи на процеси цереброінтестинальної взаємодії, що відбивається зміною концентрації регулюючих нейромедіаторів та клінічно проявляється посиленням поведінкових розладів, порушенням адаптаційних процесів, підвищенням емоційної відповіді та нервового напруження.
Висновки
1. Перебіг РАС у дітей характеризується високою частотою (68,20 ± 4,66 %) функціональних розладів травної системи, у структурі яких домінують синдром подразненого кишечника (27,30 ± 4,46 %), функціональні розлади біліарного тракту (22,7 ± 4,19 %), синтропні функціональні порушення (18,20 ± 3,86 %).
2. Наявність синтропних порушень травної системи обтяжує перебіг РАС, про що свідчить виявлений асоціативний зв’язок між ступенем тяжкості психоповедінкових розладів та функціональними порушеннями кишкового та біліарного тракту (p < 0,001).
3. Залучення ентерогліальних структур за умов супутніх ФРОТ при РАС супроводжується підвищенням рівня нейромедіаторів NSE (p = 0,59) та S-100 (p < 0,001). Показано діагностичну цінність протеїну S-100 при СПК та синтропних варіантах ФРОТ у дітей з РАС, що доводить значущість нейрональних систем у механізмах розвитку субклінічного запалення при функціональних розладах травної системи.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про фінансування. Дослідження не має окремого додаткового фінансування та проведено в рамках науково-дослідної роботи кафедри педіатрії № 2 Одеського національного медичного університету.
Інформація про внесок кожного автора. Стоєва Т.В. — дизайн дослідження, аналіз отриманих даних; Браткова Л.Б., Соболєва Х.Б., Крилов Є.Б., Щербак І.Г. — збір матеріалу, аналіз отриманих даних, підготовка статті; Тіткова О.В. — статистична обробка отриманих даних.
Отримано/Received 11.01.2022
Рецензовано/Revised 21.01.2022
Прийнято до друку/Accepted 26.01.2022
Список литературы
1. Drossman D.A. Functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV. Gastroenterology. 2016. S0016-5085(16)00223-7. Advance online publication. https://doi.org/10.1053/j.gastro.2016.02.032
2. Stoieva T.V., Dzhagiashvili O.V, Larionov O.P., Fedin M.V. Peculiarties of syntropic functional disorders of the digestive system against the ground of connective tissue dysplasia. Deutscher Wissenschaftsherold. 2018. 1. 9-13. DOI: 10.19221/201813
3. Penzol M.J., Salazar de Pablo G., Llorente C., Moreno C., Hernández P., Dorado M.L., Parellada M. Functional Gastrointestinal Disease in Autism Spectrum Disorder: A Retrospective Descriptive Study in a Clinical Sample. Frontiers in psychiatry. 2019. 10. 179. https://doi.org/10.3389/fpsyt.2019.00179
4. Fulceri F., Morelli M., Santocchi E., Cena H., Del Bianco T., Narzisi A., Calderoni S., Muratori F. Gastrointestinal symptoms and behavioral problems in preschoolers with Autism Spectrum Disorder. Digestive and liver disease: official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver. 2016. 48(3). 248-254. https://doi.org/10.1016/j.dld.2015.11.026
5. Wasilewska J., Klukowski M. Gastrointestinal symptoms and autism spectrum disorder: links and risks — a possible new overlap syndrome. Pediatric health, medicine and therapeutics. 2015. 6. 153-166. https://doi.org/10.2147/PHMT.S85717
6. Lefter R., Ciobica A., Timofte D., Stanciu C., Trifan A. A Descriptive Review on the Prevalence of Gastrointestinal Disturbances and Their Multiple Associations in Autism Spectrum Disorder. Medicina (Kaunas, Lithuania). 2019. 56(1). 11. https://doi.org/10.3390/medicina5601001
7. Barrea C., Jadot A., Debray F.G., Vrancken G., Leroy P. Comment j’explore… un trouble du spectre de l’autisme chez l’enfant [How I explore… autism spectrum disorder in a child]. Revue medicale de Liege. 2021. 76(10). 761-767.
8. Grubišić V., Gulbransen B.D. Enteric glia: the most alimentary of all glia. The Journal of physiology. 2017. 595(2). 557-570. https://doi.org/10.1113/JP271021
9. Vergnolle N., Cirillo C. Neurons and Glia in the Enteric Nervous System and Epithelial Barrier Function. Physiology (Bethesda, Md.). 2018. 33(4). 269-280. https://doi.org/10.1152/physiol.00009.2018
10. Rosenberg H.J., Rao M. Enteric glia in homeostasis and disease: From fundamental biology to human pathology. iScience. 2021. 24(8). 102863. https://doi.org/10.1016/j.isci.2021.102863
11. do Carmo Neto J.R., Braga Y., da Costa A., Lucio F.H., do Nascimento T.C., Dos Reis M.A., Celes M., de Oliveira F.A., Machado J.R., da Silva M.V. Biomarkers and Their Possible Functions in the Intestinal Microenvironment of Chagasic Megacolon: An Overview of the (Neuro)inflammatory Process. Journal of immunology research. 2021. 2021. 6668739. https://doi.org/10.1155/2021/6668739
12. Haque A., Polcyn R., Matzelle D., Banik N.L. New Insights into the Role of Neuron-Specific Enolase in Neuro-Inflammation, Neurodegeneration, and Neuroprotection. Brain sciences. 2018. 8(2). 33. https://doi.org/10.3390/brainsci8020033
13. Zheng Z., Zheng P., Zou X. Peripheral Blood S100B Levels in Autism Spectrum Disorder: A Systematic Review and Meta-Analysis. Journal of autism and developmental disorders. 2021. 51(8). 2569-2577. https://doi.org/10.1007/s10803-020-04710-1
14. Chen H., Chen Y., Zhong J.M. Detection and diagnostic value of serum NSE and S100B protein levels in patients with seizures associated with mild gastroenteritis: A retrospective observational study. Medicine. 2020. 99(48). e23439. https://doi.org/10.1097/MD.0000000000023439
15. Toscano C.V.A., Carvalho H.M., Ferreira J.P. Exercise Effects for Children With Autism Spectrum Disorder: Metabolic Health, Autistic Traits, and Quality of Life. Percept Mot. Skills. 2018 Feb. 125(1). 126-146. doi: 10.1177/0031512517743823. Epub 2017 Dec 9. PMID: 29226773.
16. Cerdó T., Diéguez E., Campoy C. Early nutrition and gut microbiome: interrelationship between bacterial metabolism, immune system, brain structure, and neurodevelopment. Am. J. Physiol. Endocrinol. Metab. 2019 Oct 1. 317(4). E617-E630. doi: 10.1152/ajpendo.00188.2019. Epub 2019 Jul 30. PMID: 31361544.
17. Cryan J.F., O’Riordan K.J., Cowan C.S.M., Sandhu K.V., Bastiaanssen T.F.S., Boehme M. et al. The Microbiota-Gut-Brain Axis. Physiol. Rev. 2019 Oct 1. 99(4). 1877-2013. doi: 10.1152/physrev.00018.2018. PMID: 31460832.
18. Wang S., Harvey L., Martin R., van der Beek E.M., Knol J., Cryan J.F., Renes I.B. Targeting the gut microbiota to influence brain development and function in early life. Neurosci. Biobehav. Rev. 2018 Dec. 95. 191-201. doi: 10.1016/j.neubiorev.2018.09.002. Epub 2018 Sep 6. PMID: 30195933.
19. El-Ansary A., Hassan W.M., Daghestani M., Al-Ayadhi L., Ben Bacha A. Preliminary evaluation of a novel nine-biomarker profile for the prediction of autism spectrum disorder. PLoS One. 2020 Jan 16. 15(1). e0227626. doi: 10.1371/journal.pone.0227626. PMID: 31945130; PMCID: PMC6964874.
20. Hewitson L., Mathews J.A., Devlin M., Schutte C., Lee J., German D.C. Blood biomarker discovery for autism spectrum disorder: A proteomic analysis. PLoS One. 2021 Feb 24. 16(2). e0246581. doi: 10.1371/journal.pone.0246581. PMID: 33626076; PMCID: PMC7904196.
21. Hyman S.L., Levy S.E., Myers S.M. Сouncil on children with disabilities, section on developmental and behavioral pediatrics. Identification, Evaluation, and Management of Children With Autism Spectrum Disorder. Pediatrics. 2020 Jan. 145(1). e20193447. doi: 10.1542/peds.2019-3447. Epub 2019 Dec 16. PMID: 31843864.
22. Ayaydın H., Kirmit A., Çelik H., Akaltun İ., Koyuncu İ., Bilgen Ulgar Ş. High Serum Levels of Serum 100 Beta Protein, Neuron-specific Enolase, Tau, Active Caspase-3, M30 and M65 in Children with Autism Spectrum Disorders. Clin. Psychopharmacol. Neurosci. 2020 May 31. 18(2). 270-278. doi: 10.9758/cpn.2020.18.2.270. PMID: 32329316; PMCID: PMC7242104.
23. Lázaro C.P., Pondé M.P., Rodrigues L.E. Opioid peptides and gastrointestinal symptoms in autism spectrum disorders. Braz. J. Psychiatry. 2016 Jul-Sep. 38(3). 243-6. doi: 10.1590/1516-4446-2015-1777. Epub 2016 Jun 14. PMID: 27304256; PMCID: PMC7194264.
24. Pandol S. The Future of Physiology: 2020 and Beyond. Front Physiol. 2021 Apr 12. 12. 674951. doi: 10.3389/fphys.2021.674951. Erratum in: Front Physiol. 2021 Sep 29. 12. 776954. PMID: 33912078; PMCID: PMC8075049.
25. Liddle R.A. Neuropods. Cell Mol. Gastroenterol. Hepatol. 2019. 7(4). 739-747. doi: 10.1016/j.jcmgh.2019.01.006. Epub 2019 Jan 30. PMID: 30710726; PMCID: PMC6463090.
26. Restrepo B., Angkustsiri K., Taylor S.L., Rogers S.J., Cabral J., Heath B. et al. Developmental-behavioral profiles in children with autism spectrum disorder and co-occurring gastrointestinal symptoms. Autism Res. 2020 Oct. 13(10). 1778-1789. doi: 10.1002/aur.2354. Epub 2020 Aug 6. PMID: 32767543; PMCID: PMC7689713.
27. Garcia-Gutierrez E., Narbad A., Rodríguez J.M. Autism Spectrum Disorder Associated With Gut Microbiota at Immune, Metabolomic, and Neuroactive Level. Front Neurosci. 2020 Oct 8. 14. 578666. doi: 10.3389/fnins.2020.578666. PMID: 33117122; PMCID: PMC7578228.
28. Al-Beltagi M. Autism medical comorbidities. World J. Clin. Pediatr. 2021 May 9. 10(3). 15-28. doi: 10.5409/wjcp.v10.i3.15. PMID: 33972922; PMCID: PMC8085719.
/22.jpg)

/20.jpg)
/21.jpg)