Журнал «Здоровье ребенка» Том 17, №5, 2022
Вернуться к номеру
Інгаляційна анестезія та стрес у дітей з онкологічними захворюваннями
Авторы: Снісарь В.І., Миронов Д.В.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
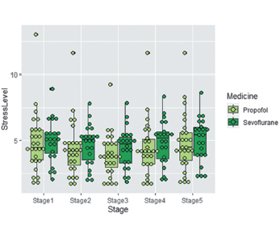
Актуальність. Діти, хворі на рак, піддаються безлічі операцій та процедур, що вимагають анестезії під час гострої фази хвороби або в період ремісії. Невід’ємним елементом безпечного плану анестезії є врахування прямих пухлинних ефектів. Локалізація пухлинного процесу, особливості організму дитини, яка страждає від раку, його реакція на стресову ситуацію вимагають від анестезіолога уважного підходу до вибору анестетика та врахування всіх можливих ускладнень під час проведення анестезії. Багато дослідників порівнювали ефекти різних анальгетиків та анестетиків, особливо севофлюрану та пропофолу, а саме вплив на біль, здатність запобігти інтраопераційному стресу або зменшити його, а також післяопераційне відновлення та профіль побічних ускладнень після різних оперативних втручань. Однак не було проведено порівняльного вивчення севофлюрану та пропофолу при хірургічному лікуванні онкологічних захворювань у дітей. Мета дослідження — порівняння знеболювальних та антистресових ефектів інгаляційної та внутрішньовенної анестезії в дітей з онкологічною патологією шляхом вивчення в них реакції гемодинаміки, рівня кортизолу, прозапальних цитокінів та показників варіабельності серцевого ритму. Матеріали та методи. Обстежені 49 дітей з онкологічною патологією (перша група), яким оперативним шляхом проводилось лікування. Пацієнти були розподілені на дві підгрупи залежно від варіанта анестезіологічної допомоги — севофлюран/фентаніл (у 26 дітей) та пропофол/фентаніл (у 23 дітей). У структурі оперативного втручання переважала лапаротомія (36 дітей) із видаленням пухлинного процесу. Торакальні операції проводились у 13 онкологічних випадках. Для порівняння оцінки особливостей севофлюрану та пропофолу в дітей із раком в обстеження були включені 49 дітей (друга група), яких оперують із приводу різної травматологічної патології. Оцінювалися показники гемодинаміки (частота серцевих скорочень (ЧСС), систолічний, діастолічний, середній артеріальний тиск (АТ сер.) та пульсовий АТ), кількість циркулюючих клітин крові, включаючи нейтрофіли, лімфоцити, тромбоцити, рівень С-реактивного білка та інтерлейкіну-6 (IL-6), фактор некрозу пухлини, рівень кортизолу в плазмі. Активність вегетативної нервової системи вимірювали за допомогою показників варіабельності серцевого ритму. Результати. Під час анестезії при інгаляційній та внутрішньовенній анестезії ЧСС і АТ сер. мали однакову спрямованість і зменшувалися у всіх пацієнтів, що перебували під наглядом, але у дітей із раком АТ сер. при використанні севофлюрану знижувався більше. Показник рівня випробуваного стресу при онкологічних операціях та застосуванні інгаляційної анестезії був меншим порівняно з внутрішньовенною анестезією. На тлі пропофолу в цих пацієнтів рівень кортизолу підвищувався до 286,80 нмоль/л (ІКР 244,90–374,50), а при інгаляційній анестезії — до 303,20 нмоль/л (ІКР 299,90–398,60; p = 0,0494). Аналогічна динаміка спостерігалася і в рівні IL-6, різниця приросту якого становила 7 %. Показники варіабельності серцевого ритму свідчили, що ні севофлюран, ні пропофол не змінювали потужності низькочастотної складової спектра LF. Тільки в групі онкологічних хворих значення «дуже» низькочастотної амплітуди (VLF) спектра вказували на підвищення актвності симпатичного відділу вегетативної нервової системи після внутрішньовенної анестезії (p < 0,05). Висновки. Сказати переконливо про якусь перевагу між інгаляційною та внутрішньовенною анестезією в зниженні рівня інтраопераційного стресу при онкологічних захворюваннях поки що неможливо. Вид пухлинного процесу, його давність, ступінь потенційно великих фізіологічних розладів повинні визначати план анестезії та вибір відповідного анестетика.
Background. Children with cancer undergo many operations and procedures that require anesthesia in the acute phase of the disease or during remission. An integral element of a safe anesthesia plan is the consideration of direct tumor effects. The localization of the tumor process, the features of the body of a child suffering from cancer, his reaction to a stressful situation force an anesthesiologist to select an anesthetic carefully and consider all possible complications during anesthesia. Many researchers have compared the effects of different analgesics and anesthetics, especially sevoflurane and propofol, namely their effect on pain, ability to prevent or reduce intraoperative stress, as well as the postoperative recovery and adverse complications after various surgical interventions. However, a comparative study of sevoflurane and propofol in the surgical treatment of cancers in children has not been conducted. The aim of the study: to сompare the analgesic and anti-stress effects of inhalation and intravenous anesthesia in children with cancer by studying their hemodynamic response, level of cortisol, proinflammatory cytokines, and heart rate variability indicators. Materials and methods. We have examined forty-nine children with cancer (the first group) who were treated surgically. They were divided into two subgroups depending on the type of anesthetic care — sevoflurane/fentanyl (n = 26) and propofol/fentanyl (n = 23). In the structure of surgical interventions, laparotomy with removal of the tumor prevailed (36 children). Thoracic operations were performed in 13 oncological cases. To compare the characteristics of sevoflurane and propofol in patients with cancer, 49 children (the second group) operated for various traumatological pathologies were included in the examination. Hemodynamic indicators (heart rate, systolic, diastolic blood pressure, mean arterial pressure, pulse pressure), the number of circulating blood cells, including neutrophils, lymphocytes, platelets, the level of C-reactive protein and interleukin-6, tumor necrosis factor, plasma cortisol were evaluated. The activity of the autonomic nervous system was measured using indicators of heart rate variability. Results. During inhalation and intravenous anesthesia, heart rate and mean arterial pressure had the same direction and decreased in all observed patients, but in children with cancer, mean arterial pressure decreased more with sevoflurane. The level of stress during oncological operations and the use of inhalation anesthesia was lower compared to intravenous anesthesia. Against the background of propofol, the cortisol level in these patients increased to 286.80 nmol/l (interquartile range 244.90–374.50), and during inhalation anesthesia — to 303.20 nmol/l (interquartile range 299.90–398.60; p = 0.0494). Similar dynamics was observed for the level of interleukin-6, the difference in its increase was 7 %. Heart rate variability indicators showed that neither sevoflurane nor propofol changed the power of the low-frequency component of the spectrum. Only in the group of cancer patients, the value of the “very” low-frequency component of the spectrum indicated an increase in the activity of the sympathetic division of the autonomic nervous system after intravenous anesthesia (p < 0.05). Conclusions. It is still not possible to say convincingly about any advantage between inhalation and intravenous anesthesia in reducing the level of intraoperative stress in cancer. The type of the tumor process, its duration, the degree of potentially large physiological disorders should determine the plan of anesthesia and the choice of an appropriate anesthetic.
діти; онкологічна патологія; анестезія; севофлюран; пропофол; стрес
children; cancer; anesthesia; sevoflurane; propofol; stress
Вступ
Матеріали та методи
Результати та їх обговорення
Висновки
- Moro E.T., Leme F.C., Noronha B.R., Saraiva G.F., de Matos Leite N.V., Navarro L.H. Quality of recovery from anesthesia of patients undergoing balanced or total intravenous general anesthesia. Prospective randomized clinical trial. J. Clin. Anesth. 2016. Vol. 35. P. 369-375. doi: 10.1016/j.jclinane.2016.08.022.
- Basha A.S., Al-Zaben K.R., Al Mustafa M.M., Alghanem S.M. A balanced anesthesia with dexmedetomidine decreases postoperative nausea and vomiting after laparoscopic surgery. Saudi Med. J. 2009. Vol. 30. P. 1537-1541.
- Siampalioti A., Karavias D., Zotou A., Kalfarentzos F., Filos K. Anesthesia management for the super obese: is sevoflurane superior to propofol as a sole anesthetic agent? A double-blind randomized controlled trial. Eur. Rev. Med. Pharmacol. Sci. 2015. Vol. 19. P. 2493-2500.
- Latham G.J. Anesthesia for the Child with Cancer. Аnesthesiology Clin. 2014. Vol. 32. P. 185-213. doi: 10.1016/j.anclin.2013.10.002.
- Broadhead M., Walker I. Anaesthesia for oncology and other medical procedures in children. Core Topics in Paediatric Anaesthesia. ed. by I. James, I. Walker. Cambridge University Press, 2013. Р. 366-375.
- Gupta A., Stierer T., Zuckerman R., Sakima N., Parker S.D., Fleisher L.A. Comparison of recovery profile after ambulatory anesthesia with propofol, isoflurane, sevoflurane and desflurane: a systematic review. Anesth. Analg. 2004. Vol. 98(3). P. 632-641. doi: 10.1213/01.ane.0000103187.70627.57.
- Hasani A., Gecaj-Gashi A., Llullaku S., Jashari H. Postoperative analgesia in children after propofol versus sevoflurane anesthesia. Pain Med. 2013. Vol. 14(3). P. 442-446. doi: 10.1111/pme.12031.
- Shah A., Adaroja R.N. Comparison of haemodynamic changes with propofol and sevoflurane anaesthesia during laparoscopic surgery. National Journal of Medical Research. 2011. Vol. 1 (2). P. 76-79.
- Pieters B.J., Penn E., Nicklaus P., Bruegger D., Mehta B., Weatherly R. Emergence delirium and postoperative pain in children undergoing adenotonsillectomy: a comparison of propofol vs sevoflurane anesthesia. Pediatr. Anesth. 2010. Vol. 20(10). P. 94. doi: 10.1111/j.1460-9592.2010.03394.x.
- Салтанов А.И., Матинян Н.В. Общая анестезия в клинике детской онкологии. М.: ООО «Издательство «Медицинское информационное агентство», 2016. 256 с.
- Овечкин А.М., Любошевский П.А. Хирургический стресс-ответ, его патофизиологическая значимость и способы модуляции. Избранные лекции по регионарной анестезии и лечению послеоперационной боли. Под ред. А.М. Овечкина, Е.С. Горобца, Е.М. Шифмана. Петрозаводск: Интел-Тек, 2009. С. 22-48.
- Paola A., Carlo L., Cinzia D.R., Valter P., Pierluigi N., Liliana S. Stress Response to Surgery, Anesthetics Role and Impact on Cognition. J. Anesth. Clin. Res. 2015. Vol. 6. Article No. 539. doi: 10.4172/2155-6148.1000539.
- Шейх-Заде Ю.Р., Цветковский С.П. Способ оценки функционального состояния сердечно-сосудистой системы: пат. 2013990 РФ. МПК A 61 B 5/02 (1990.01). № 4868231/14; заявл. 03.10.90; опубл. 15.06.94.
- Yuki K., Matsunami E., Tazawa K., Wang W., DiNardo J.A., Koutsogiannaki S. Pediatric Perioperative Stress Responses and Anesthesia. Transl. Perioper Pain Med. 2017. Vol. 2(1). P. 1-12.
- Schmeling D., Coran A.G. The hormonal and metabolic response to stress in the neonate. Pediatric Surgery International. 1990. Vol. 5. P. 307-321. doi: 10.1007/BF00177096.
- Kim Y.K., Maes M. The role of the cytokine network inpsychological stress. Acta Neuropsychiatrica. 2003. Vol. 15. P. 148-155. doi: 10.1034/j.1601-5215.2003.00026.x.

/13.jpg)
/12.jpg)
/14.jpg)
/15.jpg)
/16.jpg)