Журнал «Боль. Суставы. Позвоночник» Том 12, №3, 2022
Вернуться к номеру
Клініко-лабораторна характеристика хворих на системний червоний вовчак із суглобовим синдромом
Авторы: Яременко О.Б., Коляденко Д.І.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
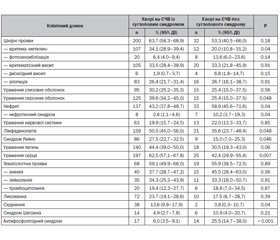
Актуальність. Ураження суглобів є однією з типових і часто перших ознак системного червоного вовчака (СЧВ) й спостерігається майже в 90 % пацієнтів як у дебюті, так і впродовж захворювання. При цьому особливості клінічних і лабораторних змін у хворих без залучення суглобів залишаються недостатньо вивченими. Мета — вивчити частоту суглобового синдрому у хворих на СЧВ та оцінити його зв’язок з клініко-лабораторними проявами захворювання. Матеріали та методи. Проаналізовано дані 376 хворих з діагнозом СЧВ, серед яких 325 жінок (86,4 %) та 51 чоловік (13,6 %). Сформовано 2 групи хворих: І — із суглобовим синдромом у вигляді артриту та/або артралгій на момент звернення (n = 316), ІІ — без суглобового синдрому (n = 60). Проведено оцінку залучення різних органів і систем, а також рівнів маркерів запалення та спектра специфічних автоантитіл. Результати. У хворих на СЧВ із суглобовим синдромом значно частіше (34,1 проти 20,0 %, p = 0,04) спостерігали еритематозний висип на обличчі у вигляді «метелика». Ураження серозних оболонок частіше мало місце у хворих на СЧВ із суглобовим синдромом (39,6 %), ніж у пацієнтів без нього (25,4 %, р = 0,048). Нефрит з нефротичним синдромом у 4 рази частіше спостерігали у хворих на СЧВ без артритів/артралгій порівняно з пацієнтами із суглобовим синдромом (10,2 проти 2,6 %, p = 0,04). Частота антифосфоліпідного синдрому також була значно вищою у хворих на СЧВ без суглобового синдрому (25,5 проти 6,0 %, p < 0,001). Група хворих на СЧВ із суглобовим синдромом мала більшу, ніж група хворих без ураження суглобів, частоту синдрому Рейно (27,5 проти 15,0 %, p = 0,046), лімфаденопатії (50,5 проти 35,6 %, p = 0,048), ураження серця (62,5 проти 42,4 %, р = 0,007), схуднення (13,6 проти 3,8 %, р = 0,04) та позитивності за антитілами до двоспіральної ДНК (65,0 проти 45,7 %, р = 0,03). Значення індексу активності СЧВ SLEDAI було вірогідно вищим у хворих на СЧВ із наявним суглобовим синдромом (11 (6–16) проти 7,5 (4–14) бала, р = 0,01). Хворі на СЧВ із суглобовим синдромом отримували вірогідно вищі дози пероральних глюкокортикоїдів (10 (10–20) мг/д у преднізолоновому еквіваленті) порівняно з пацієнтами без м’язово-скелетних проявів (6,25 (3,75–12,5) мг/д, р = 0,01). Висновки. Висип на обличчі у вигляді «метелика», серозити, ураження серця, лімфаденопатія, синдром Рейно, схуднення та позитивність за антитілами до двоспіральної ДНК вірогідно частіше спостерігаються у хворих на СЧВ із суглобовим синдромом. Водночас нефрит з нефротичним синдромом та антифосфоліпідний синдром частіше мають місце у хворих на СЧВ без ураження суглобів. Суглобовий синдром у хворих на СЧВ асоціюється з вищим індексом активності захворювання та потребою у більш високих дозах глюкокортикоїдів.
Background. Damage of the joints is one of the typical and often the first signs of systemic lupus erythematosus (SLE), however the peculiarities the of clinical and laboratory changes in patients without articular manifestations (AM) remain insufficiently studied. The purpose was to study the frequency of AM in the patients with SLE and to evaluate its interconnection with clinical and laboratory manifestations of the disease. Materials and methods. 376 patients with SLE were examined. 2 groups were formed: I — with AM presented as arthritis and/or arthralgia at the time of application (n = 316), II — without AM (n = 60). The involvement of various organs and systems, as well as the levels of inflammatory markers and the spectrum of specific autoantibodies, were evaluated. Results. Patients with SLE and AM had erythematous rash on the face in the form of a “butterfly” more often than the patients without AM (34.1 vs. 20.0 %, p = 0.04). Serositis was more often observed in patients with AM (39.6 %) compared to the patients without AM (25.4 %, p = 0.048). Nephritis with nephrotic syndrome was 4 times more frequent in patients without arthritis/arthralgia compared to the subjects with AM (10.2 vs. 2.6 %, p = 0.04). The frequency of antiphospholipid syndrome was also significantly higher in patients without AM (25.5 vs. 6.0 %, p < 0.001). The group of the patients with SLE and AM had a higher frequency of Raynaud’s syndrome (27.5 vs. 15.0 %, p = 0.046), lymphadenopathy (50.5 vs. 35.6 %, p = 0.048), heart involvement (62.5 vs. 42.4 %, p = 0.007), weight loss (13.6 vs. 3.8 %, p = 0.04) and positivity for antibodies to dsDNA (65.0 vs. 45.7 %, p = 0.03), than the patients without AM. The median value of SLEDAI was significantly higher in the patients with SLE and AM (11 (6–16) points vs. 7.5 (4–14) points, р = 0.01). Also they received significantly higher doses of oral glucocorticoids (10 (10–20) mg/d in prednisolone equivalent) compared to the subjects without AM (6.25 (3.75–12.5) mg/d, p = 0.01). Conclusions. Rash on the face in the form of a “butterfly”, serositis, heart involvement, lymphadenopathy, Raynaud’s syndrome, weight loss, and anti-dsDNA positivity are significantly more common in SLE patients with AM. Nephritis with nephrotic syndrome and antiphospholipid syndrome occur more often in patients with SLE without AM. Presence of arthritis/arthralgia in patients with SLE is associated with a higher index of disease of activity and the need for higher doses of glucocorticoids.
системний червоний вовчак; суглобовий синдром; артрит; артралгії
systemic lupus erythematosus; articular syndrome; arthritis; arthralgia