Резюме
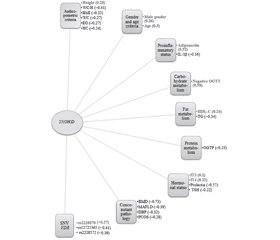
Актуальність. Дефіцит вітаміну D пов’язаний із порушенням толерантності до глюкози, інсулінорезистентністю, метаболічним синдромом і підвищеним ризиком цукрового діабету 2-го типу. Мета: вивчити роль рівня вітаміну D, пов’язаного з однонуклеотидними варіантами (single nucleotide variants — SNV) гена рецептора вітаміну D (vitamin D receptor — VDR), у розвитку метаболічно нездорового ожиріння (МНО) у дітей. Матеріали та методи. Обстежено 210 дітей з ожирінням віком 6–18 років. Основну групу (n = 125) становили пациєнти з МНО. Контрольну групу (n = 85) представили діти з метаболічно здоровим ожирінням (МЗО). У рандомізовано обраних 31 дитини основної та 21 дитини контрольної груп проведено повногеномне секвенування (CeGaТ, Germany). В усіх дітей вимірювали рівень сироваткового 25-гідроксивітаміну D (Synevo, Ukraine). Для верифікації результатів розраховували коефіцієнт кореляції Спірмена (r) і p-значення для кожної змінної, а також проводили біоінформаційний аналіз. Результати. Середній рівень 25-гідроксивітаміну D у сироватці крові був вірогідно нижчим у пацієнтів із МНО і становив 14,57 ± 1,63 нг/мл, а в дітей із МЗО — 28,82 ± 1,93 нг/мл (t = 5,64; p = 0,00061). При МНО рівень 25-гідроксивітаміну D у сироватці пов’язаний з наступними предикторами (p < 0,05). Високозначущі фактори (0,7 ≤ |r| < 1): остеопенія (r = –0,73). Фактори середньої значущості (0,3 ≤ |r| < 0,7): пролактинемія (r = –0,57); індекс співвідношення окружності талії до зросту > 0,5 (r = –0,41); AA генотип SNP VDR rs12721365 (r = –0,41) та AA генотип SNP VDR rs2228572 (r = –0,39); метаболічно-асоційована жирова хвороба печінки (r = –0,39); фізіологічна постпрандіальна глікемія (r = 0,38); рівень інтерлейкіну-1β (r = –0,36); тригліцеридемія (r = –0,34); індекс маси тіла (r = –0,33); адипонектинемія (r = 0,32); артеріальна діастолічна гіпертензія (r = –0,32). Низькозначущі фактори (0 < |r| < 0,3): синдром полікістозних яєчників (r = –0,28); GG генотип SNP VDR rs2228570 (r = 0,27); окружність талії (r = –0,27); екстремальне ожиріння (r = –0,27); чоловіча стать (r = 0,26); окружність стегон (r = –0,24); рівні ліпопротеїнів високої щільності (r = 0,24); гамма-глутамілтранспептидази сироватки (r = –0,23); вільного тироксину (r = 0,22); тиреотропного гормону (r = –0,22); вільного трийодтироніну (r = 0,2). Висновки. Розвиток кардіометаболічного ризику та дефіциту вітаміну D у дітей із ожирінням пов’язують із наявністю генотипів AA/AG SNV VDR rs12721365, rs2228572, rs2228570.
Background. Vitamin D deficiency is associated with impaired glucose tolerance, insulin resistance, metabolic syndrome, and an increased risk of developing type 2 diabetes. Aim: to study the role of vitamin D levels associated with single nucleotide variants (SNV) of the vitamin D receptor (VDR) gene in the development of metabolically unhealthy obesity (MUO) in children. Materials and methods. Two hundred and ten obese children aged 6–18 years were examined. The main group (n = 125) was represented by children with MUO. The control group (n = 85) included children with metabolically healthy obesity (MHO). Whole genome sequencing (CeGat, Germany) was performed in 31 randomly selected children of the main and 21 children of the control group. The level of serum 25-hydroxyvitamin D (Synevo, Ukraine) was measured in all children. Verification of results: calculation of Spearman’s correlation coefficient (r) and p-value for each variable. Results. The mean serum level of 25-hydroxyvitamin D was significantly lower in children with MUO than in those with MHO: 14.57 ± 1.63 ng/mL versus 28.82 ± 1.93 ng/mL (t = 5.64, p = 0.00061). In patients with MUO, serum 25-hydroxyvitamin D levels are associated with the following predictors. Highly significant factors (0.7 ≤ |r| < 1): osteopenia (r = –0.73). Factors of average significance (0.3 ≤ |r| < 0.7): prolactinemia (r = –0.57); waist circumference/height ratio > 0.5 (r = –0.41); AA genotype SNP VDR rs12721365 (r = –0.41) and AA genotype SNP VDR rs2228572 (r = –0.39); metabolic-associated fatty liver disease (r = –0.39); physiological postprandial glycemia (r = 0.38); level of interkeukin-1β (r = –0.36); triglyceridemia (r = –0.34); body mass index (r = –0.33); adiponectinemia (r = 0.32); arterial diastolic hypertension (r = –0.32). Low-significant factors (0 < |r| < 0.3): polycystic ovary syndrome (r = –0.28); GG genotype SNP VDR rs2228570 (r = 0.27); waist circumference (r = –0.27); extreme obesity (r = –0.27); male sex (r = 0.26); hip circumference (r = –0.24); levels of high-density lipoprotein cholesterol (r = 0.24); serum gamma-glutamyl transpeptidase (r = –0.23); free thyroxine (r = 0.22); thyroid-stimulating hormone (r = –0.22); free triiodothyronine (r = 0.2). Conclusions. The development of cardiometabolic risk and vitamin D deficiency in obese children is associated with the presence of AA/AG genotypes SNV VDR rs12721365, rs2228572, rs2228570.
Список литературы
1. Абатуров О.Є., Нікуліна А.О., Русакова О.О. Етіопатогенетичні особливості гіперпролактинемії в дитячому віці. Здоров’я дитини. 2021. 8(16). 529-536. doi: 10.22141/2224-0551.16.8.2021.248708.
2. Abaturov A., Nikulina A. Taste preferences and obesity. Pediatria Polska — Polish Journal of Paediatrics. 2022. 97(1). 1-6. doi: 10.5114/polp.2022.115139.
3. Abaturov A.E., Nikulina A.O. Association of leptin receptor gene polymorphisms and meta-inflammation markers with metabolically unhealthy obesity in children. Zaporozhye Medical Journal. 2021. 23(5). 696-702. doi: 10.14739/2310-1210.2021.5.227291.
4. Alathari B.E., Sabta A.A., Kalpana C.A. et al. Vitamin D pathway-related gene polymorphisms and their association with metabolic diseases: a literature review. J. Diabetes Metab. Disord. 2020. 19(2). 1701-1729. doi: 10.1007/s40200-020-00561-w.
5. Alberti K.G., Zimmet P., Kaufman F. et al. The IDF consensus definition of the metabolic syndrome in children and adolescents. International Diabetes Federation. 2017. 17-19. Available from: https://www.idf.org/e-library/consensus-statements/61-idf-consensus-definition-of-metabolic-syndrome-in-children-and-adolescents.
6. Al-Mutawa A., Anderson A.K., Alsabah S. et al. Nutritional Status of Bariatric Surgery Candidates. Nutrients. 2018. 10(1). 67. doi: 10.3390/nu10010067.
7. Areco V.A., Kohan R., Talamoni G. et al. Intestinal Ca2+ absorption revisited: A molecular and clinical approach. World. J Gastroenterol. 2020. 26(24). 3344-3364. doi: 10.3748/wjg.v26.i24.3344.
8. Battaglia S., Karasik E., Gillard B. et al. LSD1 dual function in mediating epigenetic corruption of the vitamin D signaling in prostate cancer. Clin. Epigenet. 2017. 9. 82. doi: 10.1186/s13148-017-0382-y.
9. Benetti E., Mastrocola R., Chiazza F. et al. Effects of vitamin D on insulin resistance and myosteatosis in diet-induced obese mice. PLoS One. 2018 Jan 17. 13(1). e0189707. doi: 10.1371/journal.pone.0189707.
10. Bennour I., Haroun N., Sicard F. et al. Vitamin D and Obesity/Adiposity — A Brief Overview of Recent Studies. Nutrients. 2022 May 13. 14(10). 2049. doi: 10.3390/nu14102049.
11. Berardi G., Vitiello A., Abu-Abeid A. et al. Micronutrients Deficiencies in Candidates of Bariatric Surgery: Results from a Single Institution over a 1-Year Period. Obes. Surg. 2023. 33(1). 212-218. doi: 10.1007/s11695-022-06355-8.
12. Bikle D.D. Vitamin D: Production, Metabolism and Mechanisms of Action. In: Feingold K.R., Anawalt B., Blackman M.R. et al., eds. Endotext [Internet]. South Dartmouth (MA). MDText.com, Inc.; 2000.
13. Carlberg C. Vitamin D and Its Target Genes. Nutrients. 2022 Mar 24. 14(7). 1354. doi: 10.3390/nu14071354.
14. Cojic M., Kocic R., Klisic A. et al. The Effects of Vitamin D Supplementation on Metabolic and Oxidative Stress Markers in Patients With Type 2 Diabetes: A 6-Month Follow Up Randomized Controlled Study. Front. Endocrinol. (Lausanne). 2021. 12. 610893. doi: 10.3389/fendo.2021.610893.
15. Cui X., Pertile R., Eyles D.W. The vitamin D receptor (VDR) binds to the nuclear matrix via its hinge domain: a potential mechanism for the reduction in VDR mediated transcription in mitotic cells. Mol. Cell. Endocrinol. 2018. 472. 18-25. doi: 10.1016/j.mce.2017.11.015.
16. Danikiewicz A., Hudzik B., Nowak J. et al. Serum Gamma Glutamyltransferase Is Associated with 25-Hydroxyvitamin D Status in Elderly Patients with Stable Coronary Artery Disease. Int. J. Environ. Res. Public Health. 2020 Dec 2. 17(23). 8980. doi: 10.3390/ijerph17238980.
17. Deelen P., Bonder M.J., van der Velde K.J. et al. Genotype harmonizer: automatic strand alignment and format conversion for genotype data integration. BMC Res. Notes. 2014. 7. 901. doi: 10.1186/1756-0500-7-901.
18. Draznin B., Aroda V.R., Bakris G. et al.; American Diabetes Association Professional Practice Committee. 6. Glycemic Targets: Standards of Medical Care in Diabetes 2022. Diabetes Care. 2022. 45(Suppl. 1). 83-96. doi: 10.2337/dc22-S006.
19. Elkins C., Fruh Sh., Jones L. et al. Clinical Practice Recommendations for Pediatric Dyslipidemia. Journal of Pediatric Health Care. 2019. 33(4). 494-504. doi: 10.1016/j.pedhc.2019.02.009.
20. Faridi K.F., Lupton J.R., Martin S.S. et al. Vitamin D deficiency and non-lipid biomarkers of cardiovascular risk. Arch. Med. Sci. 2017. 13(4). 732-737. doi: 10.5114/aoms.2017.68237.
21. Fiamenghi V.I., Mello E.D. Vitamin D deficiency in children and adolescents with obesity: a meta-analysis. J. Pediatr. (Rio J.). 2021. 97(3). 273-279. doi: 10.1016/j.jped.2020.08.006.
22. Flynn J.T., Kaelber D.C., Baker-Smith C.M. et al. Subcommittee on screening and management of high blood pressure in children. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents. Pediatrics. 2017 Sep. 140(3). e20171904. doi: 10.1542/peds.2017-1904.
23. Giha H.A., AlDehaini D.M.B., Joatar F.E. et al. Hormonal and metabolic profiles of obese and nonobese type 2 diabetes patients: implications of plasma insulin, ghrelin, and vitamin D levels. Cardiovasc. Endocrinol. Metab. 2022. 11(1). e0256. doi: 10.1097/XCE.0000000000000256.
24. Hanel A., Carlberg C. Time-resolved gene expression analysis monitors the regulation of inflammatory mediators and attenuation of adaptive immune response by vitamin D. Int. J. Mol. Sci. 2022. 23. 911. doi: 10.3390/ijms23020911.
25. Haussler M.R., Whitfield G.K., Kaneko I. et al. Molecular mecha–nisms of vitamin D action. Calcif. Tissue Int. 2013. 92(2). 77-98. doi: 10.1007/s00223-012-9619-0.
26. Hongshan J., Rong L., Shou-Wei D. et al. Skewer: a fast and accurate adapter trimmer for next-generation sequencing paired-end reads. BMC Bioinformatics. 2014. 15. 182. doi: 10.1186/1471-2105-15-182.
27. Huey S.L., Acharya N., Silver A. et al. Effects of oral vitamin D supplementation on linear growth and other health outcomes among children under five years of age. Cochrane Database Syst. Rev. 2020. 12(12). CD012875. doi: 10.1002/14651858.CD012875.pub2.
28. Jiang S., Zhang H., Li X. et al. Vitamin D/VDR attenuate cisplatin-induced AKI by down-regulating NLRP3/Caspase-1/GSDMD pyroptosis pathway. J. Steroid Biochem. Mol. Biol. 2021. 206. 105789. doi: 10.1016/j.jsbmb.2020.105789.
29. Kanis J.A., McCloskey E.V., Johansson H. et al. A reference standard for the description of osteoporosis. Bone. 2008. 42(3). 467-75. doi: 10.1016/j.bone.2007.11.001.
30. Kanis J.A., Melton III L.J., Christiansen C. et al. The diagnosis of osteoporosis. Journal of Bone and Mineral Research. 1994. 9(8). 1137-41.
31. Karampela I., Vallianou N., Magkos F. et al. Obesity, Hypovitaminosis D, and COVID-19: the Bermuda Triangle in Public Health. Curr. Obes. Rep. 2022. 11(3). 116-125. doi: 10.1007/s13679-022-00471-3.
32. Khashim Alswailmi F., Shah S.I.A., Nawaz H. et al. Molecular Mechanisms of Vitamin D-Mediated Immunomodulation. Galen Med. J. 2021 Jun 5. 10. e2097. doi: 10.31661/gmj.v10i0.2097.
33. Li H., Durbin R. Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics. 2009. 25(14). 1754-1760. doi: 10.1093/bioinformatics/btp324.
34. Malden S., Gillespie J., Hughes A. et al. Obesity in young children and its relationship with diagnosis of asthma, vitamin D deficiency, iron deficiency, specific allergies and flat-footedness: a systematic review and meta-analysis. Obes. Rev. 2021. 22(3). e13129. doi: 10.1111/obr.13129.
35. Migliaccio S., Di Nisio A., Mele C. et al. Obesity and hypovitaminosis D: causality or casualty? Int. J. Obes. Suppl. 2019. 9(1). 20-31. doi: 10.1038/s41367-019-0010-8.
36. Mose L.E., Wilkerson M.D., Hayes D.N. et al. ABRA: improved coding indel detection via assembly-based realignment. Bioinformatics. 2014. 30(19). 2813-2815. doi: 10.1093/bioinformatics/btu376.
37. Nakhl S., Sleilaty G., Chouery E. et al. FokI vitamin D receptor gene polymorphism and serum 25-hydroxyvitamin D in patients with cardiovascular risk. Arch. Med. Sci. Atheroscler. Dis. 2019 Dec 31. 4. e298-e303. doi: 10.5114/amsad.2019.91437.
38. Nakhl S., Sleilaty G., El Samad S. et al. Association between vitamin D deficiency and lipid and non-lipid markers of cardiovascular diseases in the middle east region. Eur. J. Clin. Nutr. 2019 Jun. 73(6). 850-858. doi: 10.1038/s41430-018-0280-1.
39. Pahuja D.N., DeLuca H.F. Stimulation of intestinal calcium transport and bone calcium mobilization by prolactin in vitamin D-deficient rats. Science. 1981. 214(4524). 1038-1039. doi: 10.1126/science.7302575.
40. Peplies J., Börnhorst C., Günther K. et al. IDEFICS consortium. Longitudinal associations of lifestyle factors and weight status with insulin resistance (HOMA-IR) in preadolescent children: the large prospective cohort study IDEFICS. Int. J. Behav. Nutr. Phys. Act. 2016 Sep 2. 13(1). 97. doi: 10.1186/s12966-016-0424-4.
41. Pramono A., Jocken J.W.E., Adriaens M.E. et al. The association between vitamin D receptor polymorphisms and tissue-specific insulin resistance in human obesity. Int. J. Obes. (London). 2021. 45(4). 818-827. doi: 10.1038/s41366-021-00744-2.
42. Raffin M., Bonnot O., Giannitelli M. et al. Hormonal Risk Factors for Osteoporosis: Different Profile Among Antipsychotics. J. Child. Adolesc. Psychopharmacol. 2018. 28(10). 719-726. doi: 10.1089/cap.2017.0158.
43. RefSeq: NCBI Reference Sequence Database. Available from: https://www.ncbi.nlm.nih.gov/refseq.
44. Szymczak-Pajor I., Drzewoski J., Śliwińska A. The Molecular Mechanisms by Which Vitamin D Prevents Insulin Resistance and Associated Disorders. Int. J. Mol. Sci. 2020 Sep 11. 21(18). 6644. doi: 10.3390/ijms21186644.
45. Trollfors B. Ethnicity, gender and seasonal variations all play a role in vitamin D deficiency. Acta Paediatr. 2022. 111(8). 1596-1602. doi: 10.1111/apa.16372.
46. Uitterlinden A.G., Fang Y., Van Meurs J.B. et al. Genetics and biology of vitamin D receptor polymorphisms. Gene. 2004. 338(2). 143-156. doi: 10.1016/j.gene.2004.05.014.
47. Wimalawansa S.J. Associations of vitamin D with insulin resistance, obesity, type 2 diabetes, and metabolic syndrome. J. Steroid Biochem. Mol. Biol. 2018 Jan. 175. 177-189. doi: 10.1016/j.jsbmb.2016.09.017.
48. World Health Organization. Obesity and overweight. Geneva, Switzerland: World Health Organization. Available from: https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight.
49. Wu M., Lu L., Guo K., Lu J. et al. Vitamin D protects against high glucose-induced pancreatic β-cell dysfunction via AMPK-NLRP3 inflammasome pathway. Mol. Cell. Endocrinol. 2022 May 1. 547. 111596. doi: 10.1016/j.mce.2022.111596.
50. Xiao P., Cheng H., Li H. et al. Vitamin D Trajectories and Cardiometabolic Risk Factors During Childhood: A Large Population-Based Prospective Cohort Study. Front. Cardiovasc. Med. 2022 Mar 16. 9. 836376. doi: 10.3389/fcvm.2022.836376.
51. Xiao P., Dong H., Li H. et al. Adequate 25-hydroxyvitamin D levels are inversely associated with various cardiometabolic risk factors in Chinese children, especially obese children. BMJ Open Diabetes Res. Care. 2020 Feb. 8(1). e000846. doi: 10.1136/bmjdrc-2019-000846.