Журнал «Здоровье ребенка» Том 18, №2, 2023
Вернуться к номеру
Вплив селену на перебіг запальних захворювань верхніх відділів шлунково-кишкового тракту в дітей
Авторы: Сорокман Т.В., Сокольник С.В., Макарова О.В.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
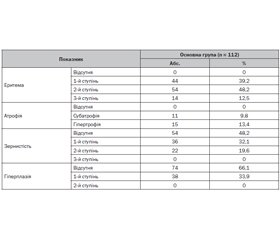
Актуальність. Порушення гомеостазу есенціальних мікроелементів в організмі дітей відіграють істотну роль в етіології, патогенезі та терапії низки захворювань. Досліджень, присвячених обміну біоелементів при захворюваннях шлунково-кишкового тракту, зокрема вмісту селену (Se), проводилося недостатньо. Мета: оцінити вплив селену на перебіг запальних захворювань верхніх відділів шлунково-кишкового траку в дітей. Методи. У дослідження включено 112 дітей шкільного віку, хворих на запальні захворювання верхніх відділів шлунково-кишкового тракту, які становили основну групу дослідження (55 дітей із хронічним гастритом (ХГ) і 57 дітей із хронічним гастродуоденітом (ХГД)), і 20 практично здорових дітей відповідного віку, які становили групу порівняння. Верифікація діагнозу ХГ і ХГД базувалася на клінічно-ендоскопічних даних за Хьюстонською модифікацією Сіднейської класифікації хронічних гастритів (1996) з оцінкою топографії та морфології. Кількісне визначення Se у плазмі крові здійснювали за допомогою мас-спектрометрії. Результати. Середній рівень Se у плазмі крові в дітей із запаленням слизової оболонки шлунка й дванадцятипалої кишки становив 75,82 ± 11,23 мкг/л, у дітей групи порівняння — 85,42 ± 9,44 мкг/л (р > 0,05). Нами не встановлено гендерної та вікової різниці в показниках Se у плазмі крові. Дефіцит Se в плазмі крові у дітей із ХГ і ХГД виявили в 78 випадках (69,6 %), у той час як у групі порівняння зниження рівня Se спостерігалося лише в 4 дітей (20 %). Вірогідних відмінностей щодо вмісту Se в дітей із ХГ і ХГД не встановлено. Однак аналіз показників залежно від активності запального процесу виявив вірогідні відмінності: при першому ступені активності запального процесу в слизовій оболонці рівень Se в плазмі крові був вірогідно нижчий (66,2 ± 6,1 мкг/мл), тоді як при другому він становив 78,5 ± 7,3 мкг/мл (р < 0,05), при третьому — 86,9 ± 9,3 мкг/мл (р < 0,01). Висновок. Встановлено зміни концентрації есенціального мікроелементу селену в плазмі крові дітей із хронічними запальними захворюваннями верхніх відділів шлунково-кишкового тракту, які можуть впливати на загальний стан дітей і перебіг захворювання, а також мають враховуватися під час проведення терапії запальних захворювань, що потребує більш широкого наукового обґрунтування.
Background. Impaired homeostasis of the essential microelements in the body of children plays a significant role in the etiology, pathogenesis and therapy of a number of diseases. Studies on the exchange of bioelements in gastrointestinal diseases, in particular, the content of selenium (Se), have not been conducted enough. Aim: to evaluate selenium influence on the course of inflammatory diseases of the upper gastrointestinal tract in children. Materials and methods. The study included 112 school-age children with inflammatory diseases of the upper gastrointestinal tract (55 with chronic gastritis (CG), 57 with chronic gastroduodenitis (CGD)) as the main group and 20 practically healthy children of the corresponding age as the comparison group. Verification of CG and CGD diagnosis was based on clinical and endoscopic data according to the Houston modification of the Sydney classification of chronic gastritis (1996) with assessment of topography and morphology. Quantitative determination of Se in blood plasma was carried out using mass spectrometry. Results. The average level of Se in blood plasma of children with inflammation of the gastric and duodenal mucosa was (75.82 ± 11.23) μg/l, in children of the comparison group — (85.42 ± 9.44) μg/l (p > 0.05). We did not find gender and age differences in Se plasma levels. Deficiency of Se in the blood of children with CG and CGD was found in 78 cases (69.6 %), while in the comparison group, a decrease in Se level was observed in only 4 children (20 %). There were no significant differences in the content of Se in children with CG and CGD. However, the analysis of indicators depending on the activity of the inflammatory process revealed probable differences: with the first degree of the activity of the inflammatory process in the mucous membrane, the level of Se in the blood plasma was significantly lower ((66.2 ± 6.1) μg/ml), while with the second it was (78.5 ± 7.3) μg/ml (p < 0.05) and with the third — (86.9 ± 9.3) μg/ml (p < 0.01). Conclusions. The concentration of selenium, the essential trace element, in the blood plasma of children with chronic inflammatory diseases of the upper gastrointestinal tract was found to be probably lower than that of healthy children. The level of selenium in the blood plasma of these children probably positively correlated with the degree of inflammation in the mucous membrane of the gastroduodenal region. Changes in the concentration of selenium can affect the general condition of children, the duration and severity of the disease, which must be taken into account during the treatment of inflammatory diseases.
діти; хронічний гастрит; хронічний гастродуоденіт; селен
children; chronic gastritis; chronic gastroduodenitis; selenium