Журнал "Гастроэнтерология" Том 57, №2, 2023
Вернуться к номеру
Оцінка морфологічних змін гастродуоденальної зони пацієнтів із хронічним панкреатитом у коморбідності із хронічним вірусним гепатитом С
Авторы: Хомин Г.О., Бабінець Л.С., Галабіцька І.М.
Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України, м. Тернопіль, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
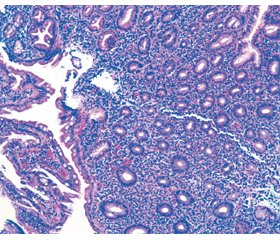
Актуальність. Вірусний гепатит С (ВГС) позиціонується не тільки як хвороба печінки, але й як системна (генералізована) інфекція, яка впливає на інші органи, зокрема підшлункову залозу (ПЗ) і органи гастродуоденальної зони (ГДЗ). Стан слизової оболонки (СО) органів ГДЗ при поєднаному перебігу хронічного панкреатиту (ХП) і хронічного ВГС (ХВГС) є мало вивченим, однак надзвичайно актуальним, оскільки важливий для клінічного перебігу, якості життя пацієнтів, а також для оцінки безпечності проведеного (етіотропного та ін.) і планованого відновного комплексного лікування таких пацієнтів. Мета: оцінити морфологічні зміни слизової оболонки гастродуоденальної зони пацієнтів із хронічним панкреатитом у коморбідності із хронічним вірусним гепатитом С, пролікованим етіотропно. Матеріали та методи. Було обстежено 30 пацієнтів із ХП і 65 — із ХП у коморбідності із ХВГС після проведеного етіотропного лікування ВГС. Пацієнти незалежно від встановленого генотипу ВГС отримали курс лікування софосбувіром у дозі 400 мг і велпатасвіром 100 мг вранці після їжі протягом 3 місяців (деякі пацієнти отримували замість велпатасвіру даклатасвір у дозі 60 мг також вранці після їжі курсом 3 місяці). Період після констатованого і пролікованого ВГС до проведення обстеження становив у середньому (2,35 ± 0,61) року. Усім пацієнтам було проведено морфологічне дослідження біоптатів СО шлунка і дванадцятипалої кишки, взятих під час езофагогастроскопії. Оцінку підготовлених препаратів проводили за міжнародними системами OLGA та OLGIM, оцінювалися 5 гастробіоптатів (1 — з кута шлунка, 2 — з тіла і 2 — з антрума) з описом основних патоморфологічних змін за візуально-аналоговою шкалою. Для виявлення Н. pylori використовували забарвлення альціановим жовтим та толуїдиновим синім. Було також запропоновано власну систему оцінки морфологічного стану СО ГДЗ. Результати. Виявлені структурні зміни свідчать про наявність хронічного атрофічного гастриту із помірною дисплазією залозистого епітелію. Стадія хронічного гастриту за системою OLGA ІІІ. Стадія хронічного гастриту за системою OLGIM ІІІ. Таким чином, практично безсимптомний перебіг доволі значимих гастродуоденальних змін на тлі ХП у поєднанні із ХВГС потребує додаткового лікувального впливу, а також проведення оцінки комплексного лікування за впливом на СО ГДЗ. При змінах СО ГДЗ при ХП на тлі ХВГС на відміну від таких при ізольованому ХП визначається вірогідно вищий рівень щільності запального інфільтрату (помірний (2+) проти легкого (1+)), що супроводжується помірною нейтрофільною інфільтрацією (2+) проти легкої (1+) і легкою лімфогістіоцитарною інфільтрацією (1+) проти відсутності такої (0), появою кишечної метаплазії (2+) та помірної неметапластичної атрофії залоз (2+) проти відсутності метаплазії (0) і легкої неметапластичної атрофії залоз (1+), а також зонами метапластичної атрофії (1+), яка проявлялась появою клітин Панета та бокалоподібних клітин. При ХП із ХВГС СО має зміни за атрофічним типом. Метаплазія проявляється зміною клітинного фенотипу: повна кишечна метаплазія І–ІІ типу проявляється появою клітин Панета та бокалоподібних клітин; неповна — наявністю призматичного епітелію та бокалоподібних клітин; товстокишечна метаплазія — розширенням залоз і відсутністю клітин Панета. Висновки. Було доведено, що стан слизової шлунка і дванадцятипалої кишки у групі пацієнтів із ХП+ХВГС був вірогідно тяжчим від такого при ізольованому ХП: виявлено у 2,68 раза частіше наявність лімфогістіоцитарної інфільтрації СО, у 12,65 раза частіше — неметапластичної атрофії залоз (у групі ізольованого ХП атрофії залоз практично не було), у 10,64 раза — метапластичної атрофії (у групі ХП її не було), у 2,31 раза — гострої лейкоцитарної інфільтрації, у 7,30 раза — дисплазії епітелію СО (при ізольованому ХП дисплазію виявляли мінімальну), у 3,07 раза — ерозій епітелію СО, у 3,88 раза — вогнищевої гіперплазії залоз, у 12,89 раза — кишечної метаплазії, якої при ХП практично не було. У цілому було встановлено, що загальна кількість наявних патологічних ознак слизової оболонки у групі ХП із коморбідним ХВГС у 2,76 раза більша, ніж таких при ізольованому ХП.
Background. Viral hepatitis C (HCV) is not only as a liver disease but also as a systemic (generalized) infection that affects other organs, in particular, the pancreas and gastroduodenal zone. The state of the gastrointestinal mucosa in combined course of chronic pancreatitis (CP) and chronic HCV is little studied, but extremely relevant, as it is important for the clinical course, the quality of life of patients, as well as for assessing the safety of the performed (etiotropic, etc.) and planned restorative comprehensive treatment of such patients. The purpose is to evaluate the morphological changes of the gastroduodenal mucosa of patients with chronic pancreatitis associated with chronic viral hepatitis C who were treated etiotropically. Materials and methods. Thirty patients with CP and 65 patients with CP in comorbidity with chronic HCV after etiotropic treatment of HCV were examined. Regardless of the HCV genotype, they received a course of treatment with sofosbuvir at a dose of 400 mg and velpatasvir 100 mg in the morning after meals for 3 months (some patients took daclatasvir at a dose of 60 mg also in the morning after meals for 3 months instead of velpatasvir). The period after diagnosed and treated HCV before the examination was on average (2.35 ± 0.61) years. All patients underwent a morphological study of gastric and duodenal biopsy samples obtained by esophagogastroscopy. The prepared samples were evaluated according to the international OLGA and OLGIM systems based on the evaluation of 5 gastric biopsies (1 from the corner of the stomach, 2 from the body, and 2 from the antrum) with a description of the main pathomorphological changes evaluated on a visual analog scale. Alcian yellow and toluidine blue were used to detect H.pylori. An own system for assessing the morphological state of the gastroduodenal mucosa was also proposed. Results. The detected structural changes indicate the presence of chronic atrophic gastritis with moderate dysplasia of the glandular epithelium. Stage of chronic gastritis according to the OLGA system was III. Stage of chronic gastritis according to the OLGIM system was III. Thus, the practically asymptomatic course of quite significant gastroduodenal changes in CP combined with chronic HCV requires additional therapeutic influence, as well as an assessment of comprehensive treatment based on the effect on the gastroduodenal mucosa. In case of changes in gastroduodenal mucosa in CP on the background of chronic HCV, in contrast to those with isolated CP, a significantly higher level of inflammatory infiltrate density (moderate (2+) vs. mild (1+)) is determined, which is accompanied by moderate neutrophilic infiltration (2+) vs. mild (1+) and mild lymphohistiocytic infiltration (1+) versus no such infiltration (0), the appearance of intestinal metaplasia (2+) and moderate non-metaplastic glandular atrophy (2+) versus the absence of metaplasia (0) and mild non-metaplastic glandular atrophy (1+), as well as zones of metaplastic atrophy (1+), which was manifested by the appearance of Paneth cells and goblet cells. In CP with chronic HCV, mucosa has atrophic changes. Metaplasia is manifested by a change in cellular phenotype: complete intestinal metaplasia type I–II is manifested by the appearance of Paneth cells and goblet cells; incomplete — by the presence of columnar epithelium and goblet cells; colonic metaplasia — by enlargement of the glands and the absence of Paneth cells. Conclusions. It was proved that the state of the gastric and duodenal mucosa in the group of patients with CP and chronic HCV was significantly severe than that in isolated CP: lymphohistiocytic infiltration of the mucous membrane was detected 2.68 times more often, non-metaplastic infiltration glandular atrophy (there was practically no glandular atrophy in the group of isolated CP) — 12.65 times more often, metaplastic atrophy (it was not detected in the group of CP) — 10.64 times more often, acute leukocyte infiltration — 2.31 times more often, dysplasia of the mucosal epithelium (with isolated CP, mild dysplasia was detected) — 7.30 times more often, erosion of the mucosal epithelium — 3.07 times more often, focal hyperplasia of the glands — 3.88 times more often, intestinal metaplasia — 12.89 times more often, which was practically absent in CP. In general, the total number of pathological signs of the mucous membrane in the group of CP with comorbid chronic HCV was found to be 2.76 times higher than that in isolated CP.
хронічний панкреатит; хронічний вірусний гепатит С; морфологічні зміни слизової оболонки шлунка і дванадцятипалої кишки; лімфогістіоцитарна інфільтрація; кишечна метаплазія
chronic pancreatitis; chronic viral hepatitis C; morphological changes in the gastric and duodenal mucosa; lymphohistiocytic infiltration; intestinal metaplasia
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Abdel A.S. Improvement of glycemic state among responders to sofosbuvir-based treatment regimens: single center experience / A.S. Abdel, A. Elsharkawy, R. Fouad, et al. J Med Virol. 2017. Vol. 89. P. 2181-2187. DOI: 10.1002/jmv.24897.
- Babinets L.S. Possibilities of complex rehabilitation of patients with type 2 diabetes and concomitant chronic pancreatitis in ambulatory practice / L.S. Babinets, H.M. Sasyk, I.M. Halabitska, V.R. Mykuliak. Balneologia. 2021. Vol. (1). P. 12-15.
- Babinets L.S. Specific aspects of clinical course in case of combination of chronic pancreatitis and concomitant viral hepatitis C / L.S. Babinets, O.R. Shaihen, H.O. Homyn, I.M. Halabitska. Wiadomosci lekarskie (Warsaw, Poland: 1960). 2019. Vol. 72(4). P. 95-599.
- Bitton S. Exocrine pancreatic insufficiency / S. Bitton, M.J. Pettei. Pediatr Rev. 2016 Feb. Vol. 37(2). P. 85-7. doi: 10.1542/pir.2015-0084.
- Chevaliez S. Clinical utility of hepatitis C virus core antigen quantification in patients with chronic hepatitis C / S. Chevaliez, A. Soulier, L. Poiteau, M. Bouvier-Alias, J.M. Pawlotsky. J Clin Virol. 2014. Vol. 61. P. 145-148. DOI: 10.1016/j.jcv.2014.05.014.
- Dominguez-Munoz J.E. A Spanish multicenter study to estimate the prevalence and incidence of chronic pancreatitis and its complications / J.E. Dominguez-Munoz, A. Lucendo, L.F. Carballo, et al. Rev Esp Enferm Dig. 2014 Apr. Vol. 106(4). P. 239-45.
- Glucose metabolism changes in patients with chronic hepatitis C treated with direct acting antivirals / S. Drazilova, M. Janicko, L. Skladany et al. Can J Gastroenterol Hepatol. 2018. P. 6095097. doi: 10.1155/2018/6095097.
- European Association for Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2015. J Hepatol. 2015. Vol. 63. P. 199-236. DOI: 10.1016/j.jhep.2020.08.018.
- European Union HCV Collaborators. Hepatitis C virus prevalence and level of intervention required to achieve the WHO targets for elimination in the European Union by 2030: a modelling study. Lancet Gastroenterol Hepatol. 2017. Vol. 2. P. 325-336.
- Glecaprevir/pibrentasvir in patients with chronic HCV and recent drug use: an integrated analysis of 7 phase III studies / G.R. Foster, G.J. Dore, S. Wang et al. Drug Alcohol Depend. 2019. Vol. 194. P. 487-494. DOI: 10.1016/j.drugalcdep.2018.11.007.
- Global epidemiology and genotype distribution of the hepatitis C virus infection / E. Gower, C. Estes, S. Blach, K. Razavi-Shearer, H. Razavi. J Hepatol. 2014. Vol. 61. P. S45-S57. DOI: 10.1016/j.jhep.2014.07.027.
- Hagstrom H. Alcohol consumption in concomitant liver di–sease: how much is too much? Curr Hepatol Rep. 2017. Vol. 16. P. 152-157. DOI: 10.1007/s11901-017-0343-0.
- Hepatitis C virus infection in children and adolescents / G. Indolfi, P. Easterbrook, G. Dusheiko et al. Lancet Gastroenterol Hepatol. 2019. Vol. 4. P. 477-487. DOI: 10.1016/S2468-1253(19)30046-9.
- Epidemiology of chronic pancreatitis: burden of the disease and consequences / P. Levy, E. Dominguez-Munoz, C. Imrie et al. United European Gastroenterol J. 2014 Oct. Vol. 2(5). P. 345-54. DOI: 10.1177/2050640614548208.
- Lew D. Chronic pancreatitis: current status and challenges for prevention and treatment / D. Lew, E. Afghani, S. Pandol. Dig Dis Sci. 2017 Jul. Vol. 62(7). P. 1702-1712. doi: 10.1007/sl0620-017-4602-2. doi: 10.1007/s10620-017-4602-2.
- Lohr J.M. Synopsis of recent guidelines on pancreatic exocrine insufficiency / J.M. Lohr, M.R. Oliver, L. Frulloni. Uni–ted European Gastroenterol J. 2013 Apr. Vol. l(2). P. 79-83. doi: 10.1177/2050640613476500.
- Eradication of hepatitis C virus infection in patients with cirrhosis reduces risk of liver and non-liver complications / P. Nahon, V. Bourcier, R. Layese et al. Gastroenterology. 2017. Vol. 152. P. 142-156, e2. DOI: 10.1053/j.gastro.2016.09.009.
- Dried blood spots: a tool to ensure broad access to hepatitis C screening, diagnosis, and treatment monitoring / A. Soulier, L. Poiteau, I .Rosa et al. J Infect Dis. 2016. Vol. 213. P. 1087-1095. DOI: 10.1093/infdis/jiv423.
- Moderate, excessive or heavy alcohol consumption: each is significantly associated with increased mortality in patients with chronic hepatitis C / Z.M. Younossi, L. Zheng, M. Stepanova et al. Aliment Pharmacol Ther. 2013. Vol. 37. P. 703-709. 123. DOI: 10.1111/apt.12265.
- Dixon M.F. Classification and grading of gastritis. The updated Sydney system. International Workshop on the Histopathology of gastritis, Houston 1994 / M.F. Dixon, R.M. Genta, J.H. Yardley. Am J Surg Pathol. 1996. Vol. 20. P. 1161-1181. DOI: 10.1097/00000478-199610000-00001.
- McGraw Hill M. Theory and practice of Histological Techniques / Hill McGraw, D.C. Washington, J.D. Bancroft, M. Gamble. Churchill Livingstone, New York, 2002. 672 р.
- Kiernan J.A. Histological and Histochemical Methods, Theo–ry and Practice, 5th ed. Bunbury, Oxford, UK, 2015. 528 р.
- High prevalence of glucose abnormalities in patients with hepatitis C virus infection: a multivariate analysis considering the liver injury / C. Hernandez, J. Genesca, J.I. Esteban et al. Diabetes Care. 2004. Vol. 27. P. 1171-1175.
- Bruchfeld A. Hepatitis C infection, time in renal-replacement therapy, and outcome after kidney transplantation / A. Bruchfeld, H. Wilczek, C.G. Elinder. Transplantation. 2004. Vol. 78. P. 745-750.
- Mayo M.J. Extrahepatic manifestations of hepatitis C infection. Am J Med Sci. 2003. Vol. 325. P. 135-148.
- Hepatic immunohistochemical staining with a monoclonal antibody against HCV-E2 to evaluate antiviral therapy and reinfection of liver grafts in hepatitis C viral infection / C. Verslype, F. Nevens, N. Sinelli et al. J Hepatol. 2003. Vol. 38. P. 208-214.
- Pancreatic islets from type 2 diabetic patients have functional defects and increased apoptosis that are ameliorated by metformin / P. Marchetti, S. Del Guerra, L. Marselli et al. J Clin Endocrinol Metab. 2004. Vol. 89. P. 5535-5541.
- Insulin secretory function is impaired in isolated human islets carrying the Gly(972)→Arg IRS-1 polymorphism / P. Marchetti, R. Lupi, M. Federici et al. Diabetes. 2002. Vol. 51. P. 1419-1424.
- Ultrastructural evidences of HCV infection in hepatocytes of chronically HCV-infected patients / V. Falcon, N. Acost-Rivero, G. Chinea et al. Biochem Biophys Res Commun. 2003. Vol. 305. P. 1085-1090.
- Association of diabetes and hepatitis C infection: epidemiologic evi–dence and pathophysiologic insights / G. Bahtiyar, J.J. Shin, A. Aytaman, J.R. Sowers, S.I. McFarlane. Curr Diab Rep. 2004. Vol. 4. P. 194-198.
- Epidemiology of Virus Infection and Human Cancer / C.J. Chen, W.L. Hsu, H.I. Yang et al. Recent Results Cancer Res. 2014. Vol. 193. P. 11-32. doi: 10.1007/978-3-642-38965-8_2.
- Possible Association Between Hepatitis C Virus and Malignancies Different From Hepatocellular Carcinoma: A Systematic Review / S. Fiorino, L. Bacchi-Reggiani, D. de Biase et al. World J Gastroente–rol. 2015. Vol. 21(45). P. 12896-953. doi: 10.3748/wjg.v21.i45.12896.
- HCV Inhibits Antigen Processing and Presentation and Induces Oxidative Stress Response in Gastric Mucosa / V. De Re, M.P. Simula, R. Cannizzaro et al. Proteomics Clin Appl. 2008. Vol. 2(9). P. 1290-9. doi: 10.1002/prca.200800059.
- Extrahepatic Morbidity and Mortality of Chronic Hepatitis C / F. Negro, D. Forton, A. Craxi et al. Gastroenterology. 2015. Vol. 149(6). P. 1345-60. doi: 10.1053/j.gastro.2015.08.035.
- Hayes J.D. Oxidative Stress in Cancer / J.D. Hayes, A.T. Dinkova-Kostova, K.D. Tew. Cancer Cell. 2020. Vol. 38(2). P. 167-97. doi: 10.1016/j.ccell.2020.06.001.
- Pol S. Extrahepatic Cancers and Chronic HCV Infection / S. Pol, A. Vallet-Pichard, O. Hermine. Nat Rev Gastroenterol Hepatol. 2018. Vol. 15(5). P. 283-90. doi: 10.1038/nrgastro.2017.172.