Журнал "Гастроэнтерология" Том 57, №2, 2023
Вернуться к номеру
Ефективність пробіотичних бактерій, які синтезують гідролазу солей жовчних кислот, у лікуванні синдрому подразненої кишки з діареєю
Авторы: Поліщук С.П., Неверовський А.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
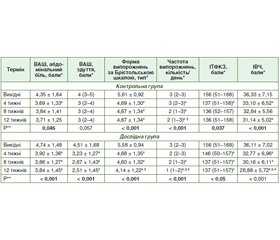
Актуальність. Одним з механізмів розвитку синдрому подразненої кишки з діареєю (СПК-Д) є мальабсорбція жовчних кислот. Окрім застосування секвестрантів жовчних кислот, у лікуванні ймовірної мальабсорбції жовчних кислот перспективними є пробіотичні бактерії, що здатні синтезувати гідролазу солей жовчних кислот (ГСЖК). Метою дослідження було порівняти ефективність комбінованого лікування (пробіотик на основі штамів Lactobacillus, Streptococcus, Bifidobacterium, Saccharomyces boulardii і холестирамін) з монотерапією холестираміном у лікуванні СПК-Д. Матеріали та методи. Рандомізоване дослідження тривалістю 12 тижнів включало 108 пацієнтів із СПК-Д, розподілених на контрольну групу (n = 51), що отримувала лише холестирамін, і дослідну (n = 57), що отримувала комбінацію холестираміну й досліджуваного пробіотика. Перед початком лікування лабораторно визначалась відносна активність ГСЖК досліджуваних пробіотичних капсул. Упродовж етапів дослідження пацієнти оцінювались за допомогою клінічних шкал. Результати. Відносна активність ГСЖК капсул з досліджуваним пробіотиком була (2,07 ± 0,06) од/мл порівняно з (1,00 ± 0,04) од/мл капсул з L.plantarum і (0,03 ± 0,01) од/мл — з L.plantarum без генів ГСЖК (p < 0,05). У дослідній групі вираженість здуття і значення індексу вісцеральної чутливості були нижчими через 8 і 12 тижнів, а значення типу випорожнень за Брістольською шкалою і їх денна частота — через 12 тижнів порівняно з контрольною групою, p < 0,05. За шкалою «СПК — адекватне поліпшення» клінічний ефект досягався більш часто в дослідній групі порівняно з контрольною через 12 тижнів, співвідношення шансів становило 1,31 (95% ДІ 1,03–1,68), p = 0,038. Висновки. Додавання пробіотика на основі штамів бактерій, що здатні синтезувати ГСЖК, є ефективнішим у зменшенні клінічних проявів СПК-Д і досягненні терапевтичного ефекту порівняно з монотерапією холестираміном.
Background. One of the mechanisms of the of irritable bowel syndrome with diarrhea (IBS-D) is bile acid malabsorption (BAM). In addition to the use of bile acid sequestrants, probiotic bacteria synthesizing bile salt hydrolase (BSH) are promising in the treatment of probable BAM. The purpose of the study was to compare the effectiveness of combined treatment (a probiotic based on strains of Lactobacillus, Streptococcus, Bifidobacterium, Saccharomyces boulardii and cholestyramine) with cholestyramine monotherapy in the treatment of IBS-D. Materials and methods. A 12-week randomized study included 108 patients with IBS-D divided into a control group (n = 51) receiving only cholestyramine and an experimental group (n = 57) receiving a combination of cholestyramine and the study probiotic. At baseline, the relative activity of BSH of the study probiotic capsules was determined. During the stages of the study, patients were examined using clinical scales. Results. The relative activity of BSH of the capsules with the studied probiotic was (2.07 ± 0.06) U/ml compared to (1.00 ± 0.04) U/ml of capsules with L.plantarum and (0.03 ± 0.01) U/ml — with L.plantarum without BSH genes. In the experimental group, the severity of bloating and visceral sensitivity index were lower after 8 and 12 weeks, and the value of the stool type according to the Bristol scale and its daily frequency — after 12 weeks compared to the control group, p < 0.05. According to the scale of IBS-adequate relief, the percentage of achieving a clinical effect was higher in the experimental group compared to the controls after 12 weeks, odds ratio was 1.31 (95% confidence interval 1.03–1.68), p = 0.038. Conclusions. Additional prescription of a probiotic with BSH synthesizing bacterial strains is more effective in improving clinical manifestations of IBS-D and achieving a therapeutic effect compared to cholestyramine monotherapy.
синдром подразненої кишки; пробіотики; мальабсорбція жовчних кислот; гідролаза солей жовчних кислот
irritable bowel syndrome; probiotics; bile acid malabsorption; bile salt hydrolase
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Fikree A., Byrne Р. Management of functional gastrointestinal disorders. Clin Med. (Lond.). 2021. № 21. Р. 44-52. doi: 10.7861/clinmed.2020-0980.
- Worldwide Prevalence and Burden of Functional Gastrointestinal Disorders, Results of Rome Foundation Global Study / A. Sperber, S.I. Bangdiwala, D.A. Drossman et al. Gastroenterology. 2021. № 160. Р. 99-114. doi: 10.1053/j.gastro.2020.04.014.
- Functional gastrointestinal disorders: an update for the psychiatrist / M.P. Jones, M.D. Crowell, K.W. Olden, F. Creed. Psychosoma–tics. 2007. № 48. Р. 93-102. doi: 10.1176/appi.psy.48.2.93.
- High prevalence of irritable bowel syndrome in medical outpatients in Japan / M. Shinozaki, S. Fukudo, M. Hongo et al. J Clin Gastroenterol. 2008. № 42. Р. 1010-1016. doi: 10.1097/MCG.0b013e318150d006.
- Lacy B.E., Patel N.K. Rome Criteria and a Diagnostic Approach to Irritable Bowel Syndrome. J Clin Med. 2017. № 6. Р. 99. doi: 10.3390/jcm6110099.
- Global prevalence of irritable bowel syndrome according to Rome III or IV criteria: a systematic review and meta-analysis / P. Oka, H. Parr, B. Barberio et al. Lancet Gastroenterol Hepatol. 2020. № 5. Р. e8.
- Holtmann G.J., Ford A.C., Talley N.J. Pathophysiology of irritable bowel syndrome. Lancet Gastroenterol Hepatol. 2016. № 1. Р. 133-146. doi: 10.1016/S2468-1253(16)30023-1.
- Camilleri M., Sellin J.H., Barrett K.E. Pathophysiology, Eva–luation, and Management of Chronic Watery Diarrhea. Gastroentero–logy. 2017. № 152. Р. 515-532. doi: 10.1053/j.gastro.2016.10.014.
- The Microbiome and Irritable Bowel Syndrome — A Review on the Pathophysiology, Current Research and Future Therapy / P.P. Chong, V.K. Chin, C.Y. Looi et al. Front Microbiol. 2019. № 10. Р. 1136. doi: 10.3389/fmicb.2019.01136.
- Min Y.W., Rezaie A., Pimentel M. Bile Acid and Gut Microbiota in Irritable Bowel Syndrome. J Neurogastroenterol Motil. 2022. № 28. Р. 549-561. doi: 10.5056/jnm22129.
- Camilleri M. Bile Acid diarrhea: prevalence, pathogenesis, and therapy. Gut Liver. 2015. № 9. Р. 332-339. doi:10.5009/gnl14397.
- Farrugia A., Arasaradnam R. Bile acid diarrhoea: pathophysiology, diagnosis and management. Frontline Gastroenterol. 2020. № 12. Р. 500-507. doi: 10.1136/flgastro-2020-101436.
- Bowel Disorders / F. Mearin, B.E. Lacey, L. Chang et al. Gastroenterology. 2016. S0016-5085(16)00222-5. doi: 10.1053/j.gastro.2016.02.031.
- Lee K.J. Pharmacologic Agents for Chronic Diarrhea. Intest Res. 2015. № 13. Р. 306-312.
- Guts and Gall: Bile Acids in Regulation of Intestinal Epithelial Function in Health and Disease / P. Hegyi, J. Maléth, J.R. Walters et al. Physiol Rev. 2018. № 98. Р. 1983-2023. doi: 10.1152/physrev.00054.2017.
- British Society of Gastroenterology guidelines on the ma–nagement of irritable bowel syndrome / D.H. Vasant, P.A. Paine, C.J. Black et al. Gut Liver. 2021. № 70. Р. 1214-1240. doi: 10.1136/gutjnl-2021-324598.
- ACG Clinical Guideline: Management of Irritable Bowel Syndrome / B.E. Lacy, M. Pimentel, D.M. Brenner et al. Am J Gastroenterol. 2021. № 116. Р. 17-44. doi: 10.14309/ajg.0000000000001036.
- Managing Chronic Diarrhea From a Gut Microbiota-Bile Acid Perspective / Z. Ling, F. Xiao-dong, J. Wei et al. Clinical and Translational Gastroenterology. 2020. № 11. e00208. https://doi.org/10.14309/ctg.0000000000000208.
- Pathophysiology and Clinical Management of Bile Acid Diarrhea / J. Marasco, C. Cremon, M.R. Barbaro et al. J Clin Med. 2022. № 11. Р. 3102. doi: 10.3390/jcm11113102.
- A positive diagnostic strategy is safe and saves endoscopies in patients with irritable bowel syndrome: A five-year follow-up of a randomized controlled trial / A.L. Engsbrov, L.M. Begtrup, P. Haastrup et al. Neurogastroenterol Motil. 2021. № 33. e14004. doi: 10.1111/nmo.14004.
- Functional bowel disorders. A multicenter comparison of health status and development of illness severity index / D.A. Drossman, Z. Li, B.B. Toner et al. Dig Dis Sci. 1995. № 40. Р. 986-995.
- The Visceral Sensitivity Index: development and validation of a gastrointestinal symptom-specific anxiety scale / J.S. Labus, R. Bolus, L. Chang et al. Aliment Pharmacol Ther. 2004. № 20. Р. 89-97. doi: 10.1111/j.1365-2036.2004.02007.x.
- Miller L.E. Study design considerations for irritable bowel syndrome clinical trials. Ann Gastroenterol. 2014. № 27. Р. 338-345.
- New insight into the catalytic properties of bile salt hydrolase / J. Bi, F. Fang, S. Lu et al. J Mol Catal B-Enzym. 2013. № 96. Р. 46-51. doi: 10.1016/j.molcatb.2013.06.010.
- Efficacy of Probiotics for Irritable Bowel Syndrome: A Systematic Review and Network Meta-Analysis / T. Zhang, C. Zhang, J. Zhang et al. Front Cell Infect Microbiol. 2022. № 12. Р. 859967. doi: 10.3389/fcimb.2022.859967.
- Probiotics and irritable bowel syndrome / C. Dai, C.Q. Zheng, M. Jiang et al. World J Gastroenterol. 2013. № 19. Р. 5973-5980. doi: 10.3748/wjg.v19.i36.5973.
- Manipulating the Microbiome: An Alternative Treatment for Bile Acid Diarrhoea / E.M. Hillman, S. Rijpkema, D. Carson et al. Microbiology Research. 2021. № 12. Р. 335-353. https://doi.org/10.3390/microbiolres12020023.
- In Vitro Bile Salt Hydrolase (BSH) Activity Screening of Different Probiotic Microorganisms / J.G. Hernández-Gómez, A. López-Bonilla, G. Trejo-Tapia et al. Foods. 2021. № 10. Р. 674. doi: 10.3390/foods10030674.
- Taxonomic profiling and populational patterns of bacterial bile salt hydrolase (BSH) genes based on worldwide human gut microbiome / Z. Song, Y. Cai, X. Lao et al. Microbiome. 2019. № 7. Р. 9. doi: 10.1186/s40168-019-0628-3.
- Canadian Association of Gastroenterology Clinical Practice Guideline on the Management of Bile Acid Diarrhea / D.C. Sadowski, M. Camilleri, W.D. Chey et al. Clin Gastroenterol Hepatol. 2020. № 18. Р. 24-41. doi: 10.1016/j.cgh.2019.08.062.
- Probiotic VSL#3 Treatment Reduces Colonic Permeability and Abdominal Pain Symptoms in Patients With Irritable Bowel Syndrome / P. Boonma, J.M. Shapiro, E.B. Hollister et al. Front Pain Res (Lausanne). 2021. № 2. Р. 691689. doi: 10.3389/fpain.2021. –691689.
- Li Y.J., Dai C., Jiang M. Mechanisms of Probiotic VSL#3 in a Rat Model of Visceral Hypersensitivity Involves the Mast Cell-PAR2-TRPV1 Pathway. Dig Dis Sci. 2019. № 64. Р. 1182-1192.