Журнал "Гастроэнтерология" Том 57, №3, 2023
Вернуться к номеру
Взаємозв’язок між рівнем зонуліну й показниками вуглеводного обміну в пацієнтів з метаболічно-асоційованою жировою хворобою печінки в поєднанні із цукровим діабетом 2 типу
Авторы: Дідик О.К., Чернявський В.В., Шипулін В.П.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
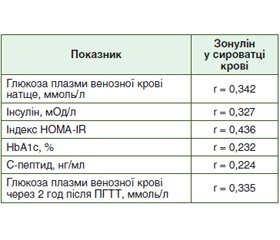
Мета дослідження: визначити взаємозв’язок між рівнем зонуліну і показниками вуглеводного обміну в пацієнтів з метаболічно-асоційованою жировою хворобою печінки (МАЖХП) у поєднанні із цукровим діабетом (ЦД) 2 типу. Матеріали та методи. У дослідженні взяли участь 78 пацієнтів з МАЖХП у поєднанні із ЦД 2 типу, яких було обстежено й розподілено на 2 групи. До першої групи входили 42 пацієнти з МАЖХП у поєднанні із ЦД 2 типу без синдрому надмірного бактеріального росту (СНБР). До другої групи — 36 пацієнтів з МАЖХП у поєднанні із ЦД 2 типу і СНБР. Групу контролю становили 20 практично здорових осіб. Уміст зонуліну в сироватці крові визначали методом ELISA з використанням тест-систем IDK Zonulin ELISA, KR5601 (Immunodiagnostic AG, Німеччина). Результати. При дослідженні вмісту зонуліну в сироватці крові було виявлено вірогідне його підвищення в пацієнтів з МАЖХП у поєднанні із ЦД 2 типу без СНБР — 70,78 ± 2,09 нг/мл і з СНБР — 82,64 ± 2,71 нг/мл порівняно з контрольною групою — 13,26 ± 1,53 нг/мл (р < 0,001). При порівнянні показників вуглеводного обміну було виявлено вірогідне підвищення рівня глюкози крові натще — 10,25 ± 0,30 ммоль/л і 10,43 ± 0,33 ммоль/л, інсуліну — 22,66 ± 0,64 мОд/л і 22,96 ± 0,7 мОд/л, індексу НОМА-IR — 10,4 ± 0,4 і 10,87 ± 0,66, HbA1c — 8,89 (8,03–9,95) % і 8,61 (8,02–10,34) %, С-пептиду — 5,44 ± 0,06 нг/мл і 5,95 ± 0,10 нг/мл у пацієнтів з МАЖХП у поєднанні з ЦД 2 типу без СНБР і з СНБР відповідно порівняно з контрольною групою (р < 0,001). Показники рівня глюкози плазми венозної крові натще, інсуліну, HbA1c та індекс НОМА-IR у пацієнтів першої та другої груп вірогідно не відрізнялися (р > 0,05), а рівень С-пептиду був вірогідно підвищеним у пацієнтів другої групи порівняно з пацієнтами першої групи (р < 0,001). При проведенні кореляційного аналізу між рівнем зонуліну в сироватці крові та показниками вуглеводного обміну в пацієнтів з МАЖХП у поєднанні з ЦД 2 типу без СНБР і з СНБР було виявлено пряму кореляцію середньої сили з рівнем глюкози, інсуліну та індексом HOMA-IR і прямий слабкий кореляційний зв’язок між рівнем зонуліну в сироватці крові та HbA1c і C-пептидом. Висновки. У пацієнтів з МАЖХП у поєднанні із ЦД 2 типу без СНБР і з СНБР виявили зростання зонуліну в сироватці крові, що свідчило про підвищення в них кишкової проникності. Уміст зонуліну в сироватці крові асоціювався з гіперглікемією та гіперінсулінемією. Отже, порушення проникності кишкового бар’єра патогенетично пов’язане з розвитком інсулінорезистентності.
Background. The purpose of the study was to determine the relationship between serum zonulin level and indicators of carbohydrate metabolism in patients with metabolic-associated fatty liver disease (MAFLD) combined with type 2 diabetes mellitus (DM). Materials and methods. The study involved 78 patients with MAFLD and type 2 DM, who were examined and divided into 2 groups. The first group consisted of 42 patients with МAFLD and type 2 DM without small intestinal bacterial overgrowth (SIBO). The second group included 36 patients with МAFLD and type 2 DM in combination with SIBO. The control group consisted of 20 practically healthy persons. The content of serum zonulin was determined by the enzyme-linked immunosorbent assay (ELISA) using the IDK Zonulin ELISA test systems, KR5601 (Immundiagnostik AG, Germany). Results. The study of the content of serum zonulin revealed its significant increase in patients with MAFLD combined with type 2 DM without SIBO — (70.78 ± 2.09) ng/ml and with SIBO — (82.64 ± 2.71) ng/ml compared to the control group — (13.26 ± 1.53) ng/ml (p < 0.001). When comparing the parameters of carbohydrate metabolism, a significant increase was found in fasting blood glucose — (10.25 ± 0.30) mmol/l and (10.43 ± 0.33) mmol/l, insulin — (22.66 ± 0.64 mU/l) and (22.96 ± 0.70) mU/l, НOMA-IR — 10.4 ± 0.4 and 10.87 ± 0.66, HbA1c — 8.89 (8.03–9.95) % and 8.61 (8.02–10.34) %, C-peptide — (5.44 ± 0.06) ng/ml and (5.95 ± 0.10) ng/ml in patients with MAFLD combined with type 2 diabetes without and with SIBO, respectively, as compared to the control group (p < 0.001). Indicators of fasting plasma glucose, insulin, HbA1c and the НOMA-IR in patients of the first and second groups did not differ significantly (p > 0.05), and the level of C-peptide was increased significantly in patients of the second group compared to the first one (p < 0.001). Correlation analysis between serum zonulin level and indicators of carbohydrate metabolism in patients with MAFLD combined with type 2 DM without and with SIBO found a moderate positive correlation with levels of glucose, insulin and HOMA-IR, and a weak correlation was found between serum zonulin level with HbA1c and C-peptide. Conclusions. An increase in serum zonulin was found in patients with MAFLD combined with type 2 DM without and with SIBO, which indicated an increase in the intestinal permeability. The content of serum zonulin was associated with hyperglycemia and hyperinsulinemia. Thus, impaired intestinal permeability is pathogenetically associated with the development of insulin resistance.
метаболічно-асоційована жирова хвороба печінки; цукровий діабет 2 типу; синдром надмірного бактеріального росту; зонулін; вуглеводний обмін
metabolic-associated fatty liver disease; type 2 diabetes; small intestinal bacterial overgrowth; zonulin; carbohydrate metabolism
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ethnicity and nonalcoholic fatty liver disease / K. Bambha et al. Hepatology. 2012. Vol. 55. № 3. P. 769-780. doi: 10.1002/hep.24726.
- Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity / J.D. Browning et al. Hepatology. 2004. Vol. 40. № 6. P. 1387-1395. doi: 10.1002/hep.20466.
- Incidence and natural course of fatty liver in the general population: the Dionysos study / G. Bedogni et al. Hepatology. 2007. Vol. 46. № 5. P. 1387-1391. doi: 10.1002/hep.21827.
- Vernon G., Baranova A., Younossi Z.M. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011. Vol. 34. № 3. P. 274-285. doi: 10.1111/j.1365-2036.2011.04724.x.
- Ong J.P., Younossi Z.M. Epidemiology and natural history of NAFLD and NASH. Clin Liver Dis. 2007. Vol. 11. № 1. P. 1-16. doi: 10.1016/j.cld.2007.02.009.
- Prevalence and associated factors of non-alcoholic fatty liver disease in patients with type-2 diabetes mellitus / N.C. Leite et al. Liver international. 2009. Vol. 29. № 1. P. 113-119. doi: 10.1111/j.1478-3231.2008.01718.x.
- Nonalcoholic steatohepatitis, insulin resistance, and metabolic syndrome: further evidence for an etiologic association / G. Pagano et al. Hepatology. 2002. Vol. 35. № 2. P. 367-372. doi: 10.1053/jhep.2002.30690.
- The metabolic syndrome as a predictor of nonalcoholic fatty liver disease / M. Hamaguchi et al. Ann Intern Med. 2005. Vol. 143. № 10. P. 722-728. doi: 10.7326/0003-4819-143-10-200511150-00009.
- Effect of adipose tissue insulin resistance on metabolic parame–ters and liver histology in obese patients with nonalcoholic fatty liver disease / R. Lomonaco et al. Hepatology. 2012. Vol. 55. № 5. P. 1389-1397. doi: 10.1002/hep.25539.
- Relationship between hepatic/visceral fat and hepatic insulin resistance in nondiabetic and type 2 diabetic subjects / A. Gastaldelli et al. Gastroenterology. 2007. Vol. 133. № 2. Р. 496-506. doi: 10.1053/j.gastro.2007.04.068.
- Insulin resistance in non-diabetic patients with non-alcoholic fatty liver disease: sites and mechanisms / E. Bugianesi et al. Diabetologia. 2005. Vol. 48. № 4. Р. 634-642. doi: 10.1007/s00125-005-1682-x.
- Petersen M.C., Shulman G.I. Roles of Diacylglycerols and Ceramides in Hepatic Insulin Resistance. Trends Pharmacol Sci. 2017. Vol. 38. № 7. P. 649-665. doi: 10.1016/j.tips.2017.04.004.
- Brenner D.A., Paik Y.H., Schnabl B. Role of Gut Microbiota in Liver Disease. J Clin Gastroenterol. 2015. Vol. 49. № 1. P. 25-27. doi: 10.1097/MCG.0000000000000391.
- Leung C., Rivera L., Furness J.B., Angus P.W. The role of the gut microbiota in NAFLD. Nat Rev Gastroenterol. Hepatol. 2016. Vol. 13. № 7. P. 412-425. doi: 10.1038/nrgastro.2016.85.
- Ohlsson B., Orho-Melander M., Nilsson P.M. Higher Levels of Serum Zonulin May Rather Be Associated with Increased Risk of Obesity and Hyperlipidemia, Than with Gastrointestinal Symptoms or Disease Manifestations. Int J Mol Sci. 2017. Vol. 18. № 3. P. 582. doi: 10.3390/ijms18030582.
- Interactions between Gut Microbiota and Immunomodulatory Cells in Rheumatoid Arthritis / H. Xu et al. Mediators Inflamm. 2020. P. 1430605. doi: 10.1155/2020/1430605.
- Sturgeon C., Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016. Vol. 4. № 4. e1251384. Published 2016 Oct 21. doi: 10.1080/21688370.2016.1251384.
- Sasso М. et al. Controlled attenuation parameter (CAP): a novel VCTE™ guided ultrasonic attenuation measurement for the evaluation of hepatic steatosis: preliminary study and validation in a cohort of patients with chronic liver disease from various causes / M. Sasso et al. Ultrasound Med. Biol. 2010. Vol. 36. № 11. Р. 1825-1835. doi: 10.1016/j.ultrasmedbio.2010.07.005.
- Erratum. 2. Classification and diagnosis of diabetes: Standards of Care in Diabetes-2023. Diabetes Care 2023; 46(Suppl. 1): S19-S40 / N.A. ElSayed et al. Diabetes Care. 2023. Vol. 46. № 5. Р. 1106. doi: 10.2337/dc23-er05.
- Current Research on the Pathogenesis of NAFLD/NASH and the Gut-Liver Axis: Gut Microbiota, Dysbiosis, and Leaky-Gut Syndrome / T. Kobayashi et al. Int. J. Mol. Sci. 2022. Vol. 23. № 19. Р. 11689. Published 2022 Oct 2. doi: 10.3390/ijms231911689.
- Evaluation of circulating zonulin as a potential marker in the pathogenesis of nonalcoholic fatty liver disease / O.M. Hendy et al. APMIS. 2017. Vol. 125. № 7. P. 607-613. doi: 10.1111/apm.12696.
- Increased circulating zonulin in children with biopsy-proven nonalcoholic fatty liver disease / L. Pacifico et al. World J Gastroenterol. 2014. Vol. 20. № 45. P. 17107-17114. doi: 10.3748/wjg.v20.i45.17107.
- Circulating zonulin levels in newly diagnosed Chinese type 2 diabetes patients / D. Zhang et al. Diabetes Res Clin Pract. 2014. Vol. 106. № 2. P. 312-318. doi: 10.1016/j.diabres.2014.08.017.
- Circulating zonulin, a marker of intestinal permeability, is increased in association with obesity-associated insulin resistance / J.M. Moreno-Navarrete et al. PLoS One. 2012. Vol. 7. № 5. e37160. doi: 10.1371/journal.pone.0037160.