Журнал "Гастроэнтерология" Том 57, №3, 2023
Вернуться к номеру
Клінічні прояви і показники системи гемостазу у хворих на неалкогольну жирову хворобу печінки з імунною відповіддю до SARS-CoV-2
Авторы: Діденко В.І., Ягмур В.Б., Кленіна І.А., Татарчук О.М., Рубан К.А., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
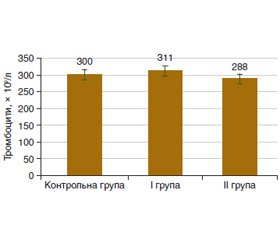
Актуальність. Часто неалкогольна жирова хвороба печінки (НАЖХП) супроводжується такими коморбідними станами, як ожиріння, діабет 2 типу і серцево-судинні захворювання, що є факторами ризику тяжкого перебігу коронавірусної хвороби (COVID-19). Тяжка її форма характеризується респіраторною недостатністю і гіперзапаленням з ризиком подальшої мультиорганної недостатності й порушеннями в системі гемостазу. Мета: визначення клінічних проявів та особливостей гемостазу при неалкогольній жировій хворобі печінки у хворих з імунною відповіддю до SARS-CоV-2. Матеріали та методи. Під спостереженням перебували 37 хворих на НАЖХП, у яких виявлено IgG до SARS-CoV-2. І групу становили 19 пацієнтів, які не хворіли на COVID-19. До ІІ групи увійшли 18 пацієнтів, які хворіли на COVID-19, що підтверджено тестом полімеразної ланцюгової реакції. Хворі І і ІІ груп були вакциновані від коронавірусу. Усім хворим проводили оцінку клінічної симптоматики, стану гемостазу в судинно-тромбоцитарній ланці, стану коагуляції, вмісту фібриногену й інгібітору активатора плазміногену 1 (PAI-1). Результати. У хворих на НАЖХП з імунною відповіддю до SARS-CоV-2 больовий синдром відзначено в 70,3 % випадків: хворі І групи частіше скаржилися на біль у правому (68,4 %) і лівому (52,6 %) підребер’ях, ІІ групи — біль в епігастрії (66,7 %). Серед проявів диспептичного синдрому, який спостерігався у 28 (75,7 %) пацієнтів, у І групі перше місце посіли скарги на здуття живота (31,6 %) і бурчання в животі (21,1 %), у ІІ групі — здуття живота (50,0 %) і гіркоту в роті (27,8 %). Супутня патологія серцево-судинної системи встановлена в 32,4 % випадків. Синтетична функція печінки щодо факторів коагуляції була майже збережена, але спостерігалося вірогідне підвищення вмісту ІІ фактора згортання в пацієнтів І групи (р < 0,05). Встановлено кореляційні зв’язки рівня РАІ-1 із вмістом протромбіну (r = 0,365; p = 0,024) і значенням тромбоцитарного числа (r = 0,368; p = 0,023). Висновки. У пацієнтів з імунною відповіддю до SARS-CоV-2 при НАЖХП відзначені особливості клінічної картини, зокрема, хворі, які не хворіли на COVID-19, у 1,5 раза частіше скаржилися на біль в правому підребер’ї та у 2 рази частіше відзначали бурчання в животі, і в системі гемостазу виявлено тенденцію до підвищення кількості тромбоцитів порівняно з контрольною групою (р > 0,05). Тоді як в групі хворих, які хворіли на COVID-19, за частотою спостереження переважали здуття живота (в 1,6 раза) і гіркота в роті (у 2 рази), і в системі гемостазу відмічено зниження кількості тромбоцитів порівняно з контрольною групою (р > 0,05). У пацієнтів обох груп відзначено підвищення середнього об’єму тромбоцитів на 10 % (р > 0,05). Вірогідне підвищення на 20 % (р < 0,05) вмісту ІІ фактора згортання і на 12 % — рівня РАІ-1 спостерігалося в пацієнтів І групи. Встановлені кореляційні зв’язки РАІ-1 з показниками тромбоцитарної ланки вказують на його участь у функціонуванні системи гомеостазу.
Background. Nonalcoholic fatty liver disease (NAFLD) is often accompanied by comorbid conditions such as obesity, type 2 diabetes, and cardiovascular diseases, which are risk factors for severe coronavirus disease (COVID-19). The latter is characterized by respiratory failure and hyperinflammation with the risk of further multiorgan failure, and disorders in the hemostasis system. Purpose: to determine the clinical manifestations and features of hemostasis in NAFLD in patients with an immune response to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Materials and methods. Thirty-seven patients with NAFLD were under observation, and immunoglobulins G to SARS-CoV-2 were detected in them. Group I consisted of 19 patients who did not suffer from COVID-19. Group II included 18 patients with COVID-19 confirmed by a polymerase chain reaction. Patients of groups I and II were vaccinated against coronavirus. Clinical symptoms, the state of hemostasis in the vascular-platelet link, the state of coagulation, the content of fibrinogen and plasminogen activator inhibitor-1 (PAI-1) were assessed in all patients. Results. Patients with NAFLD and an immune response to SARS-CoV-2 reported a pain syndrome in 70.3 % of cases: group I more often complained of pain in the right (68.4 %) and left (52.6 %) hypochondria, group II — of epigastric pain (66.7 %). Among manifestations of dyspeptic syndrome observed in 28 (75.7 %) patients, in group I complaints of abdominal distension (31.6 %) and stomach rumble (21.1 %) prevailed, in group II — of abdominal distension (50.0 %) and bitter taste in mouth (27.8 %). Concomitant cardiovascular pathology was detected in 32.4 % of cases. The synthetic function of the liver in terms of coagulation factors was almost preserved, but a probable increase in the content of coagulation factor II was observed in patients of group I (p < 0.05). PAI-1 level correlated with prothrombin content (r = 0.365; p = 0.024) and platelet count (r = 0.368; p = 0.023). Conclusions. Patients with an immune response to SARS-CoV-2 in NAFLD had the peculiarities of the clinical picture. In particular, those who did not suffer from COVID-19 complained of pain in the right hypochondrium 1.5 times more often and noted stomach rumble 2 times more often; also, in the hemostasis system, a tendency to increase the number of platelets was revealed compared to the controls (p > 0.05). Meanwhile, among patients with COVID-19, abdominal bloating (by 1.6 times) and bitter taste in mouth (by 2 times) prevailed, and in the hemostasis system, a decrease in the number of platelets was noted compared to the controls (p > 0.05). Patients of both groups had an increase in the average number of platelets by 10 % (p > 0.05). A significant increase by 20 % (p < 0.05) was noted in the content of coagulation factor II and by 12 % in the level of PAI-1 in group I. Correlations of PAI-1 with indicators of the platelet link indicate its participation in the functioning of the homeostasis system.
неалкогольна жирова хвороба печінки; SARS-CоV-2; тромбоцитарна ланка системи гемостазу; ІІ фактор згортання; інгібітор активатора плазміногену 1
nonalcoholic fatty liver disease; SARS-CoV-2; platelet link of the hemostasis system; coagulation factor II; plasminogen activator inhibitor-1
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- NAFLD and cardiovascular diseases: a clinical review / P. Kasper et al. Clin Res Cardiol. 2021. Vol. 110(7). P. 921-937. doi: 10.1007/s00392-020-01709-7.
- Younossi Z.M. Non-alcoholic fatty liver disease — A global public health perspective. J Hepatol. 2019. Vol. 70(3). P. 531-544. doi: 10.1016/j.jhep.2018.10.033.
- SARS-CoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19 / Y. Wang et al. J Hepatol. 2020. Vol. 73(4). P. 807-816. doi: 10.1016/j.jhep.2020.05.002.
- Relevance of SARS-CoV-2 related factors ACE2 and TMPRSS2 expressions in gastrointestinal tissue with pathogenesis of digestive symptoms, diabetes-associated mortality, and disease recurrence in COVID-19 patients / A. Kumar et al. Med Hypotheses. 2020. № 144. P. 110271. doi: 10.1016/j.mehy.2020.110271.
- Ekpanyapong S., Bunchorntavakul C., Reddy K.R. COVID-19 and the Liver: Lessons Learnt from the EAST and the WEST, A Year Later. J Viral Hepat. 2022. Vol. 29(1). P. 4-20. doi: 10.1111/jvh.13590.
- Increased expression of key SARS-CoV-2 entry points in multiple tissues in individuals with NAFLD / A.S. Meijnikman et al. J Hepatol. 2021. Vol. 74(3). P. 748-749. doi: 10.1016/j.jhep.2020.12.007.
- Obesity is a positive modulator of IL-6R and IL-6 expression in the subcutaneous adipose tissue: significance for metabolic inflammation / S. Sindhu et al. PLoS One. 2015. № 10. P. e0133494. doi: 10.1371/journal.pone.0133494.
- Gómez-Mesa J.E., Galindo-Coral S., Montes M.C., Muñoz Martin A.J. Thrombosis and Coagulopathy in COVID-19. Curr Probl Cardiol. 2021. Vol. 46(3). P. 100742. doi: 10.1016/j.cpcardiol.2020.100742.
- Spinosa M., Stine J.G. Nonalcoholic fatty liver disease-evidence for a thrombophilic state? Curr Pharm Des. 2020. Vol. 26(10). P. 1036-1044. doi:10.2174/138 1612826666200131101553.
- Letter to the Editor: Obesity, diabetes, non-alcoholic fatty liver disease and metabolic dysfunction associated fatty liver disease are proinflammatory hypercoagulable states associated with severe disease and thrombosis in Covid-19 / D. Ji et al. Metabolism. 2021. № 115. P. 154437. doi: 10.1016/j.metabol.2020.154437.
- How the association between obesity and inflammation may lead to insulin resistance and cancer / M.N. Amin et al. Diabetes Metab Syndr. 2019. № 13. P. 1213-1224. doi: 10.1016/j.dsx.2019.01.041.
- Inflammation as a link between obesity, metabolic syndrome and type 2 diabetes / N. Esser et al. Diabetes Res Clin Pract. 2014. № 105. P. 141-150. doi: 10.1016/j.diabres.2014.04.006.
- Good or bad: Paradox of plasminogen activator inhibitor 1 (PAI-1) in digestive system tumors / B. Wang et al. Cancer Lett. 2023. № 559. P. 216117. doi: 10.1016/j.canlet.2023.216117.
- Клінічна лабораторна діагностика: підручник / Л.Є. Лаповець та ін. 2-ге видання. Київ: Медицина, 2021. 472 с.
- Functional Characterization of Organoids Derived From Irreversibly Damaged Liver of Patients With NASH / S. McCarron et al. Hepatology. 2021. Vol. 74(4). P. 1825-1844. doi: 10.1002/hep.31857.
- Risk of severe illness from COVID-19 in patients with metabolic dysfunctionassociated fatty liver disease and increased fibrosis scores / G. Targher et al. Gut. 2020. Vol. 69(8). P. 1545-1547. doi: 10.1136/gutjnl-2020-321611.
- Non-alcoholic fatty liver diseases in patients with COVID-19: a retrospective study / Ji D, Qin E, Xu J. et al. J Hepatol. 2020. Vol. 73(2). P. 451-453. doi: 10.1016/j.jhep.2020.03.044.
- Mendelian Randomization Analysis Reveals No Causal Relationship Between Nonalcoholic Fatty Liver Disease and Severe COVID-19 / J. Li et al. Clin Gastroenterol Hepatol. 2022. Vol. 20(7). P. 1553-1560.e78. doi: 10.1016/j.cgh.2022.01.045.
- Prothrombotic factors in histologically proven NAFLD and NASH / A.F.S. Verrijken et al. Hepatology. 2014. № 59. P. 121-129. doi: 10.1002/hep.26510.
- Pulmonary arterial thrombosis in COVID-19 with fatal outcome: results from a prospective, singlecenter, clinicopathologic case series / S. Lax et al. Ann Intern Med. 2020. Vol. 173(5). P. 350-361. doi: 10.7326/M20-2566.
- COVID-19 and metabolic disease: mechanisms and clinical management / C. Steenblock et al. Lancet Diabetes Endocrinol. 2021. Vol. 9(11). P. 786-798. doi: 10.1016/S2213-8587(21)00244-8.