Журнал "Гастроэнтерология" Том 57, №4, 2023
Вернуться к номеру
Оксидативний і нітрозативний стрес — провідні механізми взаємодії хронічного панкреатиту й хронічного обструктивного захворювання легень та індуктори їх прогресування
Авторы: O.S. Khukhlina, I.V. Dudka, T.V. Dudka
Bukovinian State Medical University, Chernivtsi, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
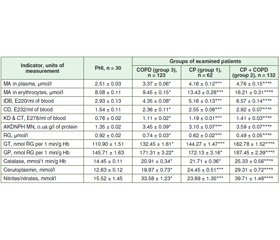
Актуальність. Останнім часом значно зросла частота коморбідності хронічного панкреатиту (ХП) із хронічним обструктивним захворюванням легень (ХОЗЛ), що може супроводжуватися змінами оксидантно-антиоксидантного гомеостазу та активувати каскад реакцій взаємообтяження цих патологій. Мета дослідження: оцінити інтенсивність перекисного окиснення ліпідів, окисної модифікації білків та стан окремих чинників системи антиоксидантного захисту при розвитку та перебігу ХП залежно від наявності коморбідного ХОЗЛ. Матеріали та методи. Обстежено 317 пацієнтів: 62 з ізольованим ХП (1 група), 132 з ХП та коморбідним ХОЗЛ (2 група), 123 особи з ізольованим ХОЗЛ (3 група). У всіх хворих оцінювали вміст у крові ізольованих подвійних зв’язків у сполуках, дієнових кон’югат, кетодієнів та спряжених трієнів, малонового альдегіду, нітритів/нітратів, відновленого глутатіону, активність каталази, глутатіон-S-трансферази, глутатіонпероксидази. Результати. В осіб із ХП та коморбідним ХОЗЛ зареєстровано максимальну серед порівнюваних груп інтенсивність оксидативного стресу із вірогідним підвищенням вмісту малонового альдегіду в 2,0 раза (p < 0,05), ізольованих подвійних зв’язків — у 2,2 раза (p < 0,05), дієнових кон’югат — у 1,9 раза (p < 0,05), кетодієнів та спряжених трієнів — у 1,9 раза (p < 0,05), нітритів/нітратів — у 2,6 раза (p < 0,05). Установлено вірогідне зниження рівнів відновленого глутатіону в еритроцитах: в 1,5 раза — у 1 групі, в 1,9 раза (p < 0,05) — у 2 групі, в 1,2 раза (p < 0,05) — у 3 групі. Виявлено компенсаторне підвищення активності глутатіон-S-трансферази, глутатіонпероксидази та каталази крові: у 1 групі — відповідно в 1,3; 1,2 та 1,5 раза (p < 0,05), у 2 групі — у 1,5; 1,3 та 1,8 раза (p < 0,05), у 3 групі — у 1,2; 1,2 та 1,4 раза (p < 0,05). Висновки. Коморбідний перебіг ХП і ХОЗЛ супроводжується максимальною інтенсивністю оксидативного та нітрозативного стресу порівняно з ізольованим перебігом хвороб. Зареєстровано зростання вмісту в крові проміжних та кінцевих метаболітів перекисного окиснення ліпідів, окиснювальної модифікації білків, концентрації нітритів/нітратів на тлі глибокого дисбалансу чинників антиоксидантного захисту, підвищення рівня церулоплазміну, що вимагає призначення засобів антиоксидантної дії для корекції встановлених порушень та запобігання прогресуванню обох коморбідних захворювань.
Background. The frequency of chronic pancreatitis (CP) comorbidity with chronic obstructive pulmonary disease (COPD) has significantly increased recently. It may be accompanied by changes in oxidant-antioxidant homeostasis and activates a cascade of reactions of mutual burdening of these pathologies. The purpose of the current research was to evaluate the intensity of lipid peroxidation, oxidative modification of proteins and the state of individual factors of the antioxidant defense system in the development and course of CP, depending on the comorbid COPD. Materials and methods. Three hundred and seventeen patients were examined, including 62 patients with CP alone (group 1), 132 CP patients with comorbid COPD (group 2), 123 patients with COPD alone (group 3). The content in blood of isolated double bonds in compounds, conjugated dienes, ketodienes and conjugated trienes, malonic aldehyde, nitrites/nitrates, reduced glutathione, the activity of catalase, glutathione-S-transferase, glutathione peroxidase were evaluated in all patients. Results. In CP patients with comorbid COPD, the maximum oxidative stress intensity among the compared groups was registered. There was a reliable increase in the content of malonic aldehyde — by 2.0 times (p < 0.05), isolated double bonds — by 2.2 times (p < 0.05), conjugated dienes — by 1.9 times (p < 0.05), ketodienes and conjugated trienes — by 1.9 times (p < 0.05), nitrites/nitrates — by 2.6 times (p < 0.05). A reliable decrease in reduced glutathione content of erythrocytes was detected: in group 1 — by 1.5 times, in group 2 — by 1.9 times (p < 0.05), in group 3 — by 1.2 times (p < 0.05). The compensatory increase in the activity of glutathione-S-transferase, glutathione peroxidase and blood catalase was revealed: in group 1 — by 1.3, 1.2 and 1.5 times (p < 0.05); in group 2 — by 1.5, 1.3 and 1.8 times (p < 0.05), in group 3 — by 1.2, 1.2 and 1.4 times, respectively (p < 0.05). Conclusions. The comorbid course of CP and COPD is accompanied by the maximum intensity of oxidative and nitrosative stress compared to the isolated course of the disease. An increase was detected in intermediate and final metabolites of peroxide oxidation in the blood, oxidative modification of proteins, nitrites/nitrates in the blood against the background of a deep imbalance of antioxidant defense factors, an increase in ceruloplasmin content in the blood, which requires the administration of antioxidant agents to correct detected disorders and prevent the progression of both comorbid diseases.
хронічний панкреатит; хронічне обструктивне захворювання легень; оксидативний та нітрозaтивний стрес
chronic pancreatitis; chronic obstructive pulmonary disease; oxidative and nitrosative stress
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Zhelezniakova N.M., Pasiyeshvili T.M. Features of clinical manifestation of chronic obstructive pulmonary disease in patients with chronic pancreatitis. Family Medicine. 2015. 6. 69-72. Available from: http://nbuv.gov.ua/UJRN/simmed_2015_6_23 (in Ukrainian).
- MacNee W. Pulmonary and systemic oxidant/antioxidant imbalance in chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2005. 2(1). 50-60. doi: 10.1513/pats.200411-056sf.
- Kurutas E.B. The importance of antioxidants which play the role in cellular response against oxidative/nitrosative stress: current state. Nutrition Journal. 2016. 15(1). 71. doi: 10.1186/s12937-016-0186-5.
- Unified clinical protocol of primary, secondary (specialized), tertiary (highly specialized) medical care and medical rehabilitation for chronic obstructive pulmonary disease: Order of the Ministry of Health of Ukraine No. 555 dated 27.06.2013. Available from: https://zakon.rada.gov.ua/rada/show/v0555282-13#Text.
- Unified clinical protocol of primary, secondary (specialized) medical care and medical rehabilitation for chronic pancreatitis: Order of the Ministry of Health of Ukraine No. 638 dated 10.09.2014. Avai–lable from: https://zakon.rada.gov.ua/rada/show/v0638282-14#Text.
- Hristich T.N., Hontsariuk D.O. Pathogenetic aspects of chro–nic pancreatitis and chronic obstructive pulmonary disease comorbi–dity. Gastroenterology. 2021. 53 (1). 54-61. doi: 10.22141/2308-2097.53.1.2019.163459 (in Ukrainian).
- Khukhlina O.S., Smandych V.S. Chronic pancreatitis and obesity: mechanisms of mutual burden, features of the clinical course, optimization of treatment: Monograph. Chernivtsi; 2017. 152 p. (in Ukrainian).
- Watson D., Loweth A.C. Oxidative and nitrosative stress in β-cell apoptosis: their contribution to β-cell loss in type 1 diabetes mellitus. British Journal of Biomedical Science. 2009. 66(4). 208-215. doi: 10.1080/09674845.2009.11730278.
- Bast A., Wolf G., Oberbäumer I., et al. Oxidative and nitrosative stress induces peroxiredoxins in pancreatic beta cells. Diabetologia. 2002. 45. 867-876. doi: 10.1007/s00125-002-0846-1.
- Pérez S., Rius-Pérez S., Finamor I., et al. Obesity causes PGC-1α deficiency in the pancreas leading to marked IL-6 upregulation via NF-κB in acute pancreatitis. The Journal of Pathology. 2019. 247. 48-59. doi: 10.1002/path.5166.
- Bhatti J.S., Bhatti G.K., Reddy P.H. Mitochondrial dysfunction and oxidative stress in metabolic disorders — A step towards mitochondria based therapeutic strategies. Biochimica et Biophysica Acta (BBA) — Molecular Basis of Disease. 2017. 1863(5). 1066-1077. doi: 10.1016/j.bbadis.2016.11.010.
- Racanelli А.С., Kikkers S.A., Choi A.M.K., Cloonan S.M. Autophagy and inflammation in chronic respiratory disease. Autophagy. 2018. 14(2). 221-232. doi: 10.1080/15548627.2017.1389823.
- Rius-Pérez S., Torres-Cuevas I., Millán I., Ortega Á.L., Pérez S. PGC-1α, Inflammation, and Oxidative Stress: An Integrative View in Metabolism. Oxid Med Cell Longev. 2020 Mar 9. 2020. 1452696. doi: 10.1155/2020/1452696.
- Cheng C.-F., Ku H.-C., Lin H. PGC-1α as a pivotal factor in lipid and metabolic regulation. International Journal of Molecular Sciences. 2018. 19(11). 3447. doi: 10.3390/ijms19113447.
- Choudhury G., MacNee W. Role of Inflammation and Oxidative Stress in the Pathology of Ageing in COPD: Potential Therapeutic Interventions. COPD: Journal of Chronic Obstructive Pulmonary Di–sease. 2017. 14(1). 122-135. doi: 10.1080/15412555.2016.1214948.
- Rius-Pérez S., Torres-Cuevas I., Monsalve M., Miranda F.J., Pérez S. Impairment of PGC-1 Alpha Up-Regulation Enhances Nitrosative Stress in the Liver during Acute Pancreatitis in Obese Mice. Antioxidants. 2020. 9(9). 887. doi: 10.3390/antiox9090887.
- COPD diagnosis, management, and prevention — 2022 strategy. Global Initiative for Chronic Obstructive Lung Disease. 18 February 2022. Available from: https://goldcopd.org/.
- Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease (COPD): GOLD 2022 report. Available from: https://goldcopd.org/2022-gold-reports/.
- Yao R.-Q., Ren C., Xia Z.-F., Yao Y.-M. Organelle-specific autophagy in inflammatory diseases: a potential therapeutic target underlying the quality control of multiple organelles. Autophagy. 2021. 17(2). 385-401. doi: 10.1080/15548627.2020.1725377.
- Tandon R.K., Garg P.K. Oxidative Stress in Chronic Pancreatitis: Pathophysiological Relevance and Management. Antioxid. Redox Signal. 2011. 15(10). 2757-2766. doi: 10.1089/ars.–2011.4115.
- Görlach A., Bertram K., Hudecova S., Krizanova O. Calcium and ROS: a mutual interplay. Redox Biology. 2015. 6. 260-271. doi: 10.1016/j.redox.2015.08.010.
- Escobar J., Pereda J., Arduini A., Sandoval J., Moreno M.L., Pérez S., et al. Oxidative and nitrosative stress in acute pancreatitis. Modulation by pentoxifylline and oxypurinol. Biochemical Pharmaco–logy. 2012. 83(1). 122-130. doi: 10.1016/j.bcp.2011.09.028.
- Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease 2021 Report. GOLD. 2021. Available from: https://goldcopd.org/.
- Shah S.A., Velardo C., Farmer A., Tarassenko L. Exacerbations in Chronic Obstructive Pulmonary Disease: Identification and Prediction Using a Digital Health System. J Med Internet Res. 2017. 19(3). e69. doi: 10.2196/jmir.7207.
- Kanika G., Khan S., Jena G. Sodium Butyrate Ameliorates l-Arginine-Induced Pancreatitis and Associated Fibrosis in Wistar Rat: Role of Inflammation and Nitrosative Stress. Journal of Bioche–mical and Molecular Toxicology. 2015. 29(8). 349-359. doi: 10.1002/jbt.21698.