Малюкові кольки (МК) — це функціональний шлунково-кишковий розлад, який вражає до 25 % немовлят протягом перших 3 місяців життя, з типовим піком поширеності у віці близько 6 тижнів [1]. Незважаючи на те, що МК є доброякісним і зазвичай самовиліковним станом, вони є джерелом серйозних страждань як для немовляти, так і для батьків, родини, а також медичного персоналу [2].
Саме МК пов’язують з розвитком післяпологової депресії матері, раннім припиненням грудного вигодовування, почуттям провини й розчаруванням батьків, синдромом струшеного немовляти, численними візитами до лікаря, вживанням ліків, непотрібною зміною молочної суміші, довготерміновими несприятливими наслідками, такими як алергія, розлади поведінки й сну [3, 4].
Немає гендерної залежності щодо розвитку МК, а також вірогідної кореляції між типом вигодовування, гестаційним віком, соціально-економічним статусом і порою року [3, 4]. Незважаючи на десятиліття досліджень, на цей момент патогенез МК залишається недостатньо зрозумілим і вважається багатофакторним, зокрема, мають місце порушення шляхів у центральній нервовій системі, психосоціальні причини (наприклад, неадекватні стосунки між дитиною та сім’єю, тривога), причини, пов’язані зі шлунково-кишковим трактом, такі як алергія на коров’яче молоко, гастроезофагеальний рефлюкс або порушення моторики шлунково-кишкового тракту. За останні десятиліття інтерес до ролі мікробіому в патофізіології МК значно зріс. Було висловлено думку, що змінена мікробіота впливає на моторику кишечника й газоутворення, що призводить до колік [5]. Згідно з Rome Criteria IV 2016 року перспективним напрямком ведення дітей з МК було застосування пробіотичних штамів [5].
Раннє дитинство має вирішальне значення для розвитку дитини і впливає на процес формування мікробіому і здоров’я протягом усього життя [6]. З моменту народження кишковий мікробіом (КМ) немовляти починає інтенсивно розвиватися, отримуючи вихідний набір бактерій від матері та факторів зовнішнього середовища. Процес розвитку КМ є ключовим фактором у формуванні здорового імунного захисту організму, і збій у його адекватному розвитку може призвести до довготривалих небажаних наслідків у майбутньому [7]. Цікавим є факт, що розвиток КМ може відбуватися за різними сценаріями. Особливо якщо враховувати, що КМ у ранньому дитинстві швидко еволюціонує щодо бактеріального складу й різноманітності. Дослідження останнього десятиліття свідчать про зв’язок між траєкторією КМ у маленьких дітей і дитячими кольками. Отже, є докази, які свідчать про значно підвищену відносну кількість H2-продукуючих бактерій у КМ дітей з кольками [8]. Було виявлено кілька таксонів, які значною мірою пов’язані з кольками: Acinetobacter, Lactobacillus iners [9], Clostridium, Lactobacillus і Klebsiella [10]. Крім того, фенотип кольок позитивно корелював з умістом Serratia, Vibrio і Pseudomonas [11]. Спостерігалося зниження відносного вмісту біфідобактерій у середньому в 30 разів [9]. Крім того, було виявлено зв’язок МК у немовлят зі штучним вигодовуванням і Escherichia coli [12]. Іншим фактом, який переконливо вказує на зв’язок кишкового мікробіому з виникненням дитячих кольок, є здатність пробіотичних штамів значно покращувати симптоми дитячих кольок.
Ці зміни свідчать про те, що стан кишкового дисбактеріозу може відігравати певну роль у прояві симптомів МК, модулюючи різні нервові, ендокринні, імунні й гуморальні сигнальні шляхи [4, 5, 13].
З огляду на те, що дисбактеріоз може відігравати значну роль у патогенезі МК, існує інтерес до модуляції КМ, включно з використанням пробіотиків.
Згідно з рекомендаціями ESPGHAN 2023, для лікування синдрому малюкових кольок у немовлят на грудному вигодовуванні можна рекомендувати L.reuteri DSM 17938 × 108 КУО на добу курсом щонайменше 21 день або B.lactis BB-12 ×108 КУО на добу тривалістю 21–28 днів [14]. Нововведенням була рекомендація щодо застосування саме B.lactis BB.
Bifidobacterium BB-12® (BB-12®) — це каталазонегативна бактерія паличкоподібної форми, яка була депонована в банку клітинних культур Chr. Hansen у 1983 році. На момент ізоляції BB-12® вважалася приналежною до виду Bifidobacterium bifidum. Сучасні методи молекулярної класифікації перекласифікували BB-12® як Bifidobacterium animalis, а пізніше віднесли до нового виду Bifidobacterium lactis. Згодом було показано, що B.lactis не відповідає критеріям виду, і замість цього вона була включена до Bifidobacterium animalis як підвид. Сьогодні BB-12® класифікується як Bifidobacterium animalis subsp. lactis. Незважаючи на зміну назви протягом багатьох років, штам BB-12® не змінився [15].
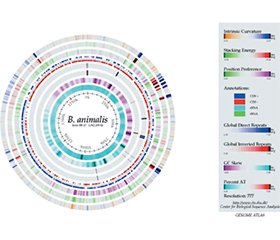
Геном BB-12® складається з однієї кільцевої хромосоми з 1942198 пар основ із 1642 генами, що кодують білки, 4 оперонами рРНК і 52 генами тРНК. Фізичне картування хромосоми BB-12® показало, що послідовність геному була правильно зібрана (рис. 1). Одним з важливих способів використання інформації про послідовність геному є те, що вона дозволяє порівнювати його з геномами інших організмів. З огляду на це стає зрозуміло, що BB-12® є унікальним штамом, який можна відрізнити від усіх інших штамів на ринку, включно зі штамами, які настільки тісно споріднені, що мають ідентичні відбитки ДНК [15].
BB-12® є добре відомим пробіотиком, який позитивно змінює склад кишкової мікробіоти і функцію імунної системи [17]. Ці властивості, імовірно, роблять його потенційно корисним для лікування МК.
Так, першим дослідженням ефективності масляних крапель, які містять B.lactis BB, було рандомізоване подвійне сліпе плацебо-контрольоване дослідження, у яке було залучено 80 немовлят на грудному вигодовуванні (віком 7 тижнів), у яких діагностували МК [18]. З лікувальною метою застосовували 1 мільярд КУО/добу масляних крапель BB-12® або плацебо протягом 28 днів.
Первинна кінцева точка дослідження — кількість немовлят, у яких спостерігалось зниження середньої тривалості щоденного плачу на ≥ 50 % через 28 днів прийому пробіотика.
Вторинні кінцеві точки: кількість епізодів плачу, настрій немовляти, кількість дефекацій і консистенція калових мас, склад КМ, імунні пептиди й коротколанцюгові жирні кислоти.
Результати основного дослідження: 80 % у групі ВВ-12® і 32,5 % у групі плацебо показали зниження на ≥50% у тривалості плачу після 28 днів лікування (рис.2).
Середня добова тривалість епізодів плачу була значно коротшою в групі BB-12® (табл. 1).
При порівнянні зміни середнього значення частоти випорожнень за добу відмінностей між групами дослідження не спостерігалося.
Значне збільшення кількості біфідобактерій було виявлено тільки у відібраних немовлят-респондерів, які отримували BB-12® (р < 0,05), а значне збільшення кількості протеобактерій — у пацієнтів, які увійшли до групи плацебо (р < 0,05).
Ще раніше було визначено, що BB-12® модулює проліферацію мононуклеарних клітин периферичної крові людини й експресію цитокінів [19, 20] із захисною дією проти шлунково-кишкових інфекцій у немовлят і дітей. У контексті МК ці ефекти можуть відповідати за сприятливе формування кишкового мікробіому. Загальновідомо, що позитивна модуляція експресії людського бета-дефензину 2 (HBD-2), кателіцидину (LL-37) і секреторного імуноглобуліну A (sIgA) в просвіт кишечника справляє позитивний вплив на структуру кишкової мікробіоти й вироблення бутирату [21]. Ці ефекти є особливо актуальними при МК, коли має місце дисбактеріоз з підвищеною кількістю протеобактерій і зниженою — біфідобактерій зі зменшенням утворення бутирату [22, 23].
Саме в цьому дослідженні було виявлено, що BB-12® здатна протидіяти всім цим явищам, пригнічуючи зростання протеобактерій і сприяючи збільшенню біфідобактерій і виробленню бутирату в немовлят з кольками. Ці ефекти спостерігалися в переважної більшості немовлят, зарахованих до групи BB-12®.
Цікавим є факт, що зміна кількості біфідобактерій, спричинена лікуванням BB-12®, значно корелювала зі скороченням часу плачу.
Біфідобактерії не здатні виробляти бутират, але через перехресне годування інших коменсальних бактерій вони можуть підвищити рівень бутирату, потенційно впливаючи на багато аспектів фізіології кишечника [24]. Бутират є основним метаболітом КМ, здатний здійснювати широкий спектр корисних дій у кишечнику і на позакишковому рівні [22]. Бутират модулює час кишкового проходження, вісцеральне й центральне сприйняття болю і кишково-мозкову вісь, а також виявляє потужну протизапальну дію [25–27].
Другим дослідженням ефективності масляних крапель, що містять BB-12®, при кольках у малюків було рандомізоване подвійне сліпе плацебо-контрольоване дослідження за участю 192 китайських немовлят, які перебували на грудному вигодовуванні (≤ 12 тижнів), у яких спостерігався надмірний плач і занепокоєння [28]. З лікувальною метою застосовували 1 мільярд КУО/добу масляних крапель BB-12® або плацебо протягом 21 дня.
Первинна кінцева точка дослідження — кількість немовлят, у яких спостерігалось зниження середньої тривалості щоденного плачу на ≥ 50 % через 21 день прийому добавок.
Вторинні кінцеві точки: час щоденного плачу й занепокоєння, кількість дефекацій і консистенція калових мас.
Пошукові кінцеві точки: якість життя, пов’язана зі здоров’ям (HRQoL), для батьків/опікунів, що визначалась за допомогою модуля для вимірювання впливу на сім’ю PedsQLTM, тривалість сну, рівень секреторного імуноглобуліну A, кальпротектину, HBD-2, LL-37 і бутирату в калових масах.
Так, відсоток немовлят, у яких відбулося зменшення епізодів плачу/занепокоєння на ≥ 50 % після 21-денного лікування, був значно вищим у групі BB-12® (61 %) порівняно з групою плацебо (22 %) у кінці лікування (рис. 3).
Було встановлено, що масляні краплі, які містять штам BB-12®, зменшують кількість щоденних епізодів плачу в немовлят (рис. 4).
Також спостерігалося виражене і значуще скорочення часу плачу через 21 день лікування в групі BB-12® порівняно з групою плацебо (рис. 5).
Середня тривалість щоденного сну значно збільшилась порівняно з вихідним рівнем до кінця лікування у групі BB-12® порівняно з групою плацебо (рис. 6).
Наприкінці лікування бали за шкалами «фізичне функціонування», «емоційне функціонування» і «соціальне функціонування» для батьків/опікунів були значно вищими в групі батьків, діти яких приймали ВB-12®, порівняно з групою плацебо (табл. 2).
Отже, підсумовуючи результати наведених досліджень, можна говорити про клінічно значущу користь пробіотичного штаму B.animalis subsp. lactis BB-12® для зменшення основних клінічних проявів у немовлят з МК.
На ринку України штам B.animalis subsp. lactis BB-12® представлений препаратом Лінекс дитячі краплі з вітаміном D, який містить 10 мкг (400 МО) вітаміну D3 (холекальциферолу) та 1 × 109 КУО живих ліофілізованих бактерій Bifidobacterium animalis subsp. lactis BB-12®. Додавання до раціону харчування біфідобактерій BB-12®, що входять до складу препарату, є корисним для підтримки фізіологічного балансу мікрофлори кишечника, зокрема при малюкових кольках.
Конфлікт інтересів. Не заявлений.
Перед застосуванням дієтичної добавки необхідно проконсультуватись з лікарем та ознайомитися з листком-вкладишем. Ви можете повідомити ТОВ «Сандоз Україна», імпортера в Україні, що здійснює функції щодо прийняття претензій від споживача, про небажані явища і скарги на якість при застосуванні дієтичної добавки: +380 44 4952866 (вартість дзвінків згідно з тарифами вашого оператора зв’язку), ua.qa@sandoz.com,patient.safety.ukraine@sandoz.com, www.sandoz.ua. ТОВ «Сандоз Україна», м. Київ, пр.С.Бандери, 28-А (літера Г). Інформація для спеціалістів сфери охорони здоров’я.
BB-12® є зареєстрованою торговою маркою Chr.Hansen, Данія.
Отримано/Received 11.11.2023
Рецензовано/Revised 14.12.2023
Прийнято до друку/Accepted 15.12.2023
Список литературы
1. Wolke D., Bilgin A., Samara M. Systematic review and meta-analysis: fussing and crying durations and prevalence of colic in infants. J. Pediatr. 2017. 185. e4.
2. James-Roberts I.S. In: Barr R.G., St James-Roberts I., Keefe M.R., eds. New Evidence on Unexplained Early Infant Crying: Its Origins, Nature and Management. Skillman, New Jersey: Johnson & Johnson Pediatric Institute. 2001. 5. 24.
3. Johnson J.D., Cocker K., Chang E. Infantile colic: recognition and treatment. Am. Fam. Physician. 2015. 92. 577-582.
4. Zeevenhooven J., Browne P.D., L’Hoir M.P., de Weerth C., Benninga M.A. Infant colic: mechanisms and management. Nat. Rev. Gastroenterol. Hepatol. 2018. 15. 479-496.
5. Zeevenhooven J., Koppen I.J., Benninga M.A. The New Rome IV Criteria for Functional Gastrointestinal Disorders in Infants and Toddlers. Pediatr. Gastroenterol. Hepatol. Nutr. 2017 Mar. 20(1). 1-13.
6. Wong E., Lui K., Day A.S., Leach S.T. Manipulating the neonatal gut microbiome: Current understanding and future perspectives. Arch. Dis. Child. Fetal. Neonatal. Ed. 2022. 107. 346-350.
7. Rodríguez J.M. et al. The composition of the gut microbiota throughout life, with an emphasis on early life. Microb. Ecol. Health Dis. 2015. 26. 26050.
8. Pham V.T., Lacroix C., Braegger C.P., Chassard C. Lactate-utilizing community is associated with gut microbiota dysbiosis in colicky infants. Sci. Rep. 2017. 7. 11176.
9. Rhoads J.M. et al. Infant colic represents gut inflammation and dysbiosis. J. Pediatr. 2018. 203. 55-61e3.
10. Loughman A. et al. Infant microbiota in colic: Predictive associations with problem crying and subsequent child behavior. J. Dev. Orig. Health Dis. 2021. 12. 260-270.
11. de Weerth C., Fuentes S., Puylaert P., de Vos W.M. Intestinal microbiota of infants with colic: Development and specific signatures. Pediatrics. 2013. 131. e550-e558.
12. Savino F. et al. Comparison of formula-fed infants with and without colic revealed significant differences in total bacteria, Enterobacteriaceae and faecal ammonia. Acta Paediatr. 2017. 106. 573-578.
13. Indrio F., Dargenio V.N., Giordano P., Francavilla R. Preventing and treating colic. Adv. Exp. Med. Biol. 2019. 1125. 49-56.
14. Szajewska H., Berni Canani R., Domellöf M., Guarino A., Hojsak I., Indrio F. et al.; ESPGHAN Special Interest Group on Gut Microbiota and Modifications. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J. Pediatr. Gastroenterol. Nutr. 2023 Feb 1. 76(2). 232-247.
15. Jungersen M., Wind A., Johansen E., Christensen J.E., Stuer-Lauridsen B., Eskesen D. The Science behind the Probiotic Strain Bifidobacterium animalis subsp. lactis BB-12(®). Microorganisms. 2014 Mar 28. 2(2). 92-110.
16. Garrigues C., Johansen E., Crittenden R. Pangenomics — An avenue to improved industrial starter cultures and probiotics. Curr. Opin. Biotechnol. 2013. 24. 187-191.
17. Jungersen M., Wind A., Johansen E., Christensen J.E., Stuer-Lauridsen B., Eskesen D. The science behind the probiotic strain bifidobacterium animalis subsp. lactis BB-12®. Microorganisms. 2014. 2. 92-110.
18. Nocerino R., De Filippis F., Cecere G., Marino A., Micillo M., Di Scala C. et al. The therapeutic efficacy of Bifidobacterium animalis subsp. lactis BB-12® in infant colic: A randomised, double blind, placebo-controlled trial. Aliment. Pharmacol. Ther. 2020 Jan. 51(1). 110-120.
19. Lopez P., Gueimonde M., Margolles A., Suarez A. Distinct Bifidobacterium strains drive different immune responses in vitro. Int. J. Food Microbiol. 2010. 138. 157-165.
20. Latvala S., Pietilä T.E., Veckman V. et al. Potentially probiotic bacteria induce efficient maturation but differential cytokine production in human monocyte-derived dendritic cells. World J. Gastroenterol. 2008. 14. 5570-5581.
21. Berni Canani R., De Filippis F., Nocerino R. et al. Specific signatures of the gut microbiota and increased levels of butyrate in children treated with fermented cow’s milk containing heatkilled Lactobacillus paracasei CBA L74. Appl. Environ. Microbiol. 2017. 83. e01206-e1217.
22. Savino F., Quartieri A., De Marco A. et al. Comparison of formulafed infants with and without colic revealed significant differences in total bacteria, Enterobacteriaceae and faecal ammonia. Acta Paediatr. 2017. 106. 573-578.
23. Savino F., Cordisco L., Tarasco V., Calabrese R., Palumeri E., Matteuzzi D. Molecular identification of coliform bacteria from colicky breastfed infants. Acta Paediatr. 2009. 98. 1582-1588.
24. Sanders M.E., Merenstein D.J., Reid G., Gibson G.R., Rastall R.A. Probiotics and prebiotics in intestinal health and disease: from biology to the clinic. Nat. Rev. Gastroenterol. Hepatol. 2019. 16(10). 605-616.
25. van de Wouw M., Boehme M., Lyte J.M. et al. Short-chain fatty acids: microbial metabolites that alleviate stress-induced brain-gut axis alterations. J. Physiol. 2018. 596. 4923-4944.
26. Ejtahed H.S., Hasani-Ranjbar S. Neuromodulatory effect of microbiome on gut-brain axis; new target for obesity drugs. J. Diabetes Metab. Disord. 2019. 18. 263-265.
27. Mittal R., Debs L.H., Patel A.P. et al. Butyrate, neuroepigenetics and the gut microbiome: can a high fiber diet improve brain health? J. Cell. Physiol. 2017. 232. 2359-2372.
28. Chen K., Zhang G., Xie H., You L., Li H., Zhang Y. et al. Efficacy of Bifidobacterium animalis subsp. lactis, BB-12® on infant colic — a randomised, double-blinded, placebo-controlled study. Benef. Microbes. 2021 Nov 16. 12(6). 531-540.

/28.jpg)
/29.jpg)
/30.jpg)
/30_2.jpg)