Журнал "Гастроэнтерология" Том 58, №1, 2024
Вернуться к номеру
Предиктори вісцерального ожиріння в пацієнтів з патологією шлунково-кишкового тракт
Авторы: Степанов Ю.М., Мосійчук Л.М., Кленіна І.А., Татарчук О.М., Петішко О.П., Шевцова О.М.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
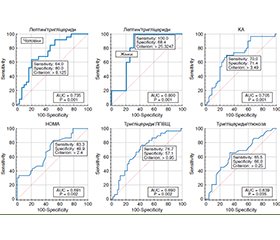
Актуальність. В Україні однією з найважливіших проблем сімейної медицини залишається метаболічний синдром, що сприяє зростанню поширеності хвороб органів травлення. Серед компонентів метаболічного синдрому найбільш прогностично несприятливим дослідники вважають вісцеральне ожиріння. Мета: оптимізація діагностичних підходів до формування групи ризику виявлення вісцерального ожиріння в гастроентерологічних хворих. Матеріали та методи. Обстежено 80 пацієнтів із захворюваннями шлунково-кишкового тракту, серед яких було 56 чоловіків (70,0 %) і 24 жінки (30,0 %). Вік хворих становив від 18 до 66 років, середній вік — (39,04 ± 1,03) року. Для діагностики структури тіла використовували ваги — аналізатори складу тіла TANITA МС-780МА (Японія). У всіх хворих у сироватці крові визначали рівні глюкози, інсуліну, лептину, загального холестерину (ХС), тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), а також розраховували холестерин ліпопротеїнів низької щільності (ХС ЛПНЩ), холестерин ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ), коефіцієнт атерогенності (КА) та коефіцієнт інсулінорезистентності (HOMA-IR). Результати. У гастроентерологічних пацієнтів, які мали вісцеральне ожиріння, встановлені більш виражені зміни ліпідного й вуглеводного обмінів, що характеризувалися зниженням вмісту ХС ЛПВЩ на 16,3 % (р < 0,05), підвищенням ТГ на 41,9 % (р < 0,001), ХС ЛПДНЩ — на 41,7 % (р < 0,01), КА — на 41,6 % (р < 0,01), значення HOMA-IR — на 28,0 % (р < 0,01) порівняно з хворими, у яких вісцеральне ожиріння було відсутнє. За результатами кореляційного аналізу встановлені функціональні зв’язки між кількістю вісцерального жиру і рівнем лептину (r = 0,37; р = 0,0008), інсуліну (r = 0,41; р = 0,001), індексом HOMA-IR (r = 0,48; р = 0,00001), ТГ (r = 0,452; р = 0,017), ХС ЛПНЩ (r = 0,383; р = 0,016), КА (r = 0,566; р < 0,001), індексом ТГ/глюкоза (r = 0,27; р = 0,0181), ХС ЛПВЩ (r = –0,448; р = 0,004). Визначені предиктори розвитку вісцерального ожиріння: коефіцієнт тригліцериди/ліпопротеїди високої щільності (співвідношення шансів (OR) 1,32; р = 0,0001), коефіцієнт тригліцериди/глюкоза (OR 1,17; р = 0,0014), рівень HOMA-IR (OR 1,26; р = 0,0013), коефіцієнт атерогенності (OR 1,13; р = 0,0001), коефіцієнт лептин/тригліцериди (OR 1,35; р = 0,0014). Висновки. Формування групи ризику щодо розвитку вісцерального ожиріння за допомогою визначених діагностичних критеріїв дозволить уже на первинній ланці надання медичної допомоги персоніфікувати тактику ведення гастроентерологічних хворих.
Background. In Ukraine, metabolic syndrome remains one of the most important problems of family medicine, it contributes to an increase in the prevalence of digestive diseases. Among the components of metabolic syndrome, researchers consider visceral obesity to be the most prognostically unfavorable. The purpose is to optimize diagnostic approaches to the formation of a risk group for the detection of visceral obesity in gastroenterology patients. Materials and methods. Eighty patients with gastrointestinal diseases were examined, 56 men (70.0 %) and 24 women (30.0 %). The age of the patients ranged from 18 to 66 years, with an average of (39.04 ± 1.03) years. TANITA MC-780MA body composition analyzer scales (Japan) were used to assess body structure. In all patients, serum levels of glucose, insulin, leptin, total cholesterol, triglycerides (TG), high-density lipoprotein cholesterol (HDL-C) were determined, as well as low-density lipoprotein cholesterol (LDL-C), very low-density lipoprotein cholesterol (VLDL-C), atherogenicity coefficient (AC) and homeostasis model assessment of insulin resistance (HOMA-IR). Results. Gastroenterological patients with visceral obesity had more pronounced changes in lipid and carbohydrate metabolism, which were characterized by a decrease in the content of HDL-C by 16.3 % (p < 0.05), an increase in TG by 41.9 % (p < 0.001), VLDL-C by 41.7 % (p < 0.01), AС by 41.6 % (p < 0.01), HOMA-IR by 28.0 % (p < 0.01) compared to patients without visceral obesity. According to the results of the correlation analysis, functional relationships were found between the amount of visceral fat and the level of leptin (r = 0.37; р = 0.0008), insulin (r = 0.41; р = 0.001), HOMA-IR (r = 0.48; р = 0.00001), TG (r = 0.452; р = 0.017), LDL-C (r = 0.383; р = 0.016), AС (r = 0.566; p < 0.001), TG/glucose ratio (r = 0.27; p = 0.0181), HDL-C (r = –0.448; p = 0.004). Determined predictors for the development of visceral obesity were as follows: triglycerides/high-density lipoprotein ratio (odds ratio (OR) 1.32; p = 0.0001), triglycerides/glucose ratio (OR 1.17; p = 0.0014), HOMA-IR (OR 1.26; p = 0.0013), atherogenicity coefficient (OR 1.13; p = 0.0001), leptin/triglycerides ratio (OR 1.35; p = 0.0014). Conclusions. The formation of a risk group for the detection of visceral obesity with the help of defined diagnostic criteria will allow to personalize the management of gastroenterology patients already at the primary level of medical care.
захворювання органів травлення; вісцеральне ожиріння; діагностичні критерії; ліпідний і вуглеводний обмін; лептин
digestive diseases; visceral obesity; diagnostic criteria; lipid and carbohydrate metabolism; leptin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Krznaric Z. Burden of obesity in gastrointestinal and liver di–seases. United European Gastroenterol. J. 2022. № 10. P. 629-630. doi: 10.1002/ueg2.12302.
- Role of Overweight and Obesity in Gastrointestinal Disease / S. Emerenziani et al. Nutrients. 2019. Vol. 12(1). P. 111. doi: 10.3390/nu12010111.
- Impact of Visceral Obesity on the Risk of Incident Metabolic Syndrome in Metabolically Healthy Normal Weight and Overweight Groups: A Longitudinal Cohort Study in Korea / Y.H. Lee et al. Korean J Fam Med. 2020. Vol. 41(4). P. 229-236. doi: 10.4082/kjfm.18.0122.
- Association of Visceral Adipose Tissue and Insulin Resistance with Incident Metabolic Syndrome Independent of Obesity Status: The IRAS Family Study / M. Mongraw-Chaffin et al. Obesity (Silver Spring). 2021. Vol. 29(7). P. 1195-1202. doi: 10.1002/oby.23177.
- Bosello O., Zamboni M. Visceral obesity and metabolic syndrome. Obes Rev. 2000. Vol. 1(1). P. 47-56. doi: 10.1046/j.1467-789x.2000.00008.x.
- Chukwura C.L., Santo T.J., Waters C.N., Andrews A. ‘Nutrition is out of our control’: soldiers’ perceptions of their local food environment. Public Health Nutr. 2019. Vol. 22(15). P. 2766-2776. doi: 10.1017/S1368980019001381.
- Randomized Controlled Trials to Treat Obesity in Military Po–pulations: A Systematic Review and Meta-Analysis / D. Gravina et al. Nutrients. 2023. Vol. 15(22). P. 4778. doi: 10.3390/nu15224778.
- Assessment of Risk Factors for Development of Overweight and Obesity among Soldiers of Polish Armed Forces Participating in the National Health Programme 2016–2020 / A. Gaździńska et al. International Journal of Environmental Research and Public Health. 2022. Vol. 19(5). P. 3069. doi: 10.3390/ijerph19053069.
- Shuster A., Patlas M., Pinthus J.H., Mourtzakis M. The clini–cal importance of visceral adiposity: a critical review of methods for visceral adipose tissue analysis. Br J Radiol. 2012. Vol. 85(1009). P. 1-10. doi: 10.1259/bjr/38447238.
- Visceral adipose tissue and residual cardiovascular risk: a pathological link and new therapeutic options / A. Cesaro et al. Front Cardiovasc Med. 2023. № 10. P. 1187735. doi: 10.3389/fcvm.2023.1187735.
- Visceral Adiposity and Risk of Stroke: A Mendelian Randomi–zation Study / R. Xu et al. Front Neurol. 2022. No 13. P. 804851. doi: 10.3389/fneur.2022.804851.
- Influences of Visceral Fat Area on the Sites of Esophageal Mucosal Breaks in Subjects with Gastroesophageal Reflux Disea–ses / J.H. Nam et al. Gastroenterol. Res. Pract. 2019. № 17. P. 1-9. doi: 10.1155/2019/9672861.
- Visceral adiposity is associated with an increased risk of functional dyspepsia / J.G. Jung et al. J Gastroenterol Hepatol. 2016. № 31. P. 567-574. doi: 10.1111/jgh.13146.
- Visceral adiposity, genetic susceptibility, and risk of complications among individuals with Crohn’s disease / K.W. Van Der Sloot et al. Inflamm Bowel Dis. 2017. № 23. P. 82-88. doi: 10.1097/MIB.0000000000000978.
- Anthropometric Indicators as a Tool for Diagnosis of Obesity and Other Health Risk Factors: A Literature Review / P. Pique–ras et al. Front. Psychol. 2021. № 12. P. 631179. doi: 10.3389/fpsyg.2021.631179.
- Association of Body Mass Index and Waist Circumference with All-Cause Mortality in Hemodialysis Patients / C.S. Kim et al. J Clin Med. 2020. Vol. 9(5). P. 1289. doi: 10.3390/jcm9051289.
- Central fatness and risk of all cause mortality: systematic review and dose-response meta-analysis of 72 prospective cohort studies / A. Jayedi et al. BMJ. 2020. Vol. 370. P. m3324. doi: 10.1136/bmj.m3324.
- Golia N., Krishan K., Kashyap J.R. Assessment of Obesity by Using Various Anthropometric Measurements among Patients with Coronary Heart Disease Residing in North India. Cureus. 2020. Vol. 12(5). P. e7948. doi: 10.7759/cureus.7948.
- Lebiedowska A., Hartman-Petrycka M., Błońska-Fajfrowska B. How reliable is BMI? Bioimpedance analysis of body composition in underweight, normal weight, overweight, and obese women. Ir J Med Sci. 2021. Vol. 190. P. 993-998. doi: 10.1007/s11845-020-02403-3.
- The bioelectrical impedance analysis (BIA) international database: aims, scope, and call for data / A.M. Silva et al. Eur J Clin Nutr. 2023. Vol. 77. P. 1143-1150. doi: 10.1038/s41430-023-01310-x.
- Obesity as a mortality risk factor in the medical ward: a case control study / S. Soffer et al. BMC Endocr Disord. 2022. № 22. P. 13. doi: 10.1186/s12902-021-00912-5.
- European Guideline on Obesity care in patients with gastrointestinal and liver diseases — joint ESPEN/UEG guideline / S.C. Bischoff et al. Clin Nutr. 2022. Vol. 41(10). P. 2364-2405. doi: 10.1016/j.clnu.2022.07.003.
- A systematic literature review on obesity: Understanding the causes & consequences of obesity and reviewing various machine lear–ning approaches used to predict obesity / M. Safaei et al. Computers in Biology and Medicine. 2021. Vol. 136. P. 104754. doi: 10.1016/j.compbiomed.2021.104754.
- Signaling pathways in obesity: mechanisms and therapeutic interventions / X. Wen et al. Sig Transduct Target Ther. 2022. № 7. P. 298. doi: 10.1038/s41392-022-01149-x.
- Estimated visceral adiposity is associated with risk of cardiometabolic conditions in a population based study / M. Ruiz-Castell et al. Sci Rep. 2021. № 11. P. 9121. doi: 10.1038/s41598-021-88587-9.
- Adipose Tissue Dysfunction as Determinant of Obesity-Asso–ciated Metabolic Complications / M. Longo et al. Int. J. Mol. Sci. 2019. № 20. P. 2358. doi: 10.3390/ijms20092358.