Журнал "Гастроэнтерология" Том 58, №1, 2024
Вернуться к номеру
Метаболічні порушення в пацієнтів із неалкогольною жировою хворобою печінки з імунною відповіддю на SARS-CoV-2
Авторы: Yu.M. Stepanov, V.I. Didenko, I.A. Klenina, O.M. Tatarchuk, O.P. Petishko
State Institution “Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine”, Dnipro, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
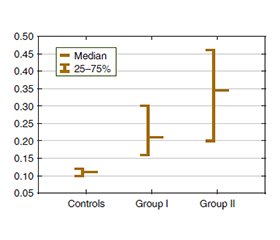
Актуальність. Відомо, що тяжкий гострий респіраторний синдром коронавірусу 2 (SARS-CoV-2) здатний безпосередньо інфікувати гепатоцити. Водночас надлишкова вага та ожиріння є сурогатними маркерами несприятливих наслідків коронавірусної хвороби 2019 (COVID-19). Мета: оцінити зміни ліпідного та вуглеводного метаболізму та їх індексів у сироватці крові пацієнтів із неалкогольною жировою хворобою печінки (НАЖХП) з імунною відповіддю до SARS-CoV-2. Матеріали та методи. Під спостереженням знаходились 37 осіб із НАЖХП, у яких виявлено IgG до SARS-CoV-2. Усі хворі були розподілені на дві групи: перша складалася з 19 учасників без SARS-CoV-2 за даними ПЛР, у другу ввійшли 18 осіб із COVID-19, що був підтверджений ПЛР-тестуванням. В усіх пацієнтів визначали вміст загального холестерину (ХС), тригліцеридів (ТГ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), глюкози, холестерину ліпопротеїнів низької щільності, холестерину ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ), коефіцієнт атерогенності, індекс інсулінорезистентності (HOMA-IR), співвідношення ТГ до глюкози (TG/Gly) та ТГ до ХС ЛПВЩ (TG/HDL-C). Результати. В осіб із НАЖХП з імунною відповіддю до SARS-CоV-2 дисліпідемія проявлялася вірогідним підвищенням медіани вмісту ТГ у І та ІІ групі відповідно в 2,5 та 3,4 раза (р = 0,0001); ХС — в 1,2 раза (р = 0,0425) в обох групах з тенденцією до підвищення; ЛПДНЩ — в 1,8 (р = 0,010) та 2,5 раза (р = 0,0022) відповідно та зниженням медіани ЛПВЩ у І та ІІ групі в 1,7 (р = 0,0016) та 1,9 раза (р = 0,0008) відповідно в сироватці крові. Виявлені зміни призводили до статистично значущого збільшення медіани коефіцієнта атерогенності в І та ІІ групі — у 2,2 (р = 0,0036) та 2,5 раза (р = 0,007). Підвищення індексу HOMA-IR не мало статистично значущої різниці між групами: у хворих І групи відзначено його збільшення в 3,1 раза (р < 0,05) порівняно з контрольною, у ІІ групі — в 3 рази (р < 0,05). Крім того, в обох групах відбувалося статистично вірогідне підвищення індексів TG/Gly та TG/HDL-C порівняно з контролем. Проте виявлені зміни були більш вираженими в пацієнтів ІІ групи, у якій рівні TG/Gly та TG/HDL-C були відповідно в 1,5 (р = 0,038) та 1,9 раза (р = 0,035) вищими, ніж у І групі. Висновки. В осіб з імунною відповіддю до SARS-CоV-2 при НАЖХП встановленo порушення метаболізму ліпідів та вуглеводів. При цьому ознаки дисліпідемії були більш вираженими у хворих із SARS-CoV-2 в анамнезі. Співвідношення TG/Gly та TG/HDL-C доцільно включати в діагностичний алгоритм для оцінки інсулінорезистентності у хворих, що перенесли COVID-19 та мають надлишкову вагу чи ожиріння.
Background. It is known that severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) can directly infect hepatocytes. At the same time, overweight and obesity are surrogate markers of the adverse effects of coronavirus disease 2019 (COVID-19). The purpose of the study: to evaluate changes in lipid and carbohydrate metabolism and their indices in the serum of patients with non-alcoholic fatty liver disease (NAFLD) with an immune response to SARS-CoV-2. Materials and methods. We studied 37 patients with NAFLD who had IgG to SARS-CoV-2. All patients were divided into two groups: group I consisted of 19 participants who were PCR-negative for SARS-CoV-2, group II included 18 patients who had COVID-19, as confirmed by PCR testing. The content of total cholesterol (TC), triglycerides (TG), high-density lipoprotein cholesterol (HDL-C), glucose, low-density lipoprotein cholesterol, very low-density lipoprotein cholesterol (VLDL-C), atherogenicity coefficient, insulin resistance indices (HOMA-IR), TG to glucose (TG/Gly) and TG to HDL-C (TG/HDL-C) ratio were assessed in all patients. Results. Among patients with NAFLD with an immune response to SARS-CoV-2, dyslipidemia manifested by a probable increase in the median TG content in groups I and II by 2.5 and 3.4 times (р = 0.0001), respectively; TC — by 1.2 times (р = 0.0425) in both groups, with a tendency to increase; VLDL-C — by 1.8 (р = 0.010) and 2.5 times (р = 0.0022), respectively, and a decrease in the median content of HDL-C by 1.7 (р = 0.0016) and 1.9 times (р = 0.0008), respectively, in blood serum. The identified changes led to a statistically significant increase in the median atherogenicity coefficient in groups I and II — by 2.2 (р = 0.0036) and 2.5 times (р = 0.007). An increase in the HOMA-IR did not have a statistically significant difference between the groups: in group I, this index increased by 3.1 times (p < 0.05) compared with the controls, in group II — by 3 times (p < 0.05). In addition, patients in both groups had a statistically significant increase in TG/Gly and TG/HDL-C ratio compared to controls. However, the detected changes were more pronounced in group II, where TG/Gly and TG/HDL-C levels were 1.5 (р = 0.038) and 1.9 times (р = 0.035), respectively, higher than in group I. Conclusions. Patients with an immune response to SARS-CoV-2 with NAFLD have disorders of lipid and carbohydrate metabolism. At the same time, the signs of dyslipidemia were more pronounced in participants with a history of SARS-CoV-2. TG/Gly and TG/HDL-C ratio should be included in the diagnostic algorithm for assessing insulin resistance in patients with COVID-19 who are overweight or obese.
неалкогольна жирова хвороба печінки; SARS-CоV-2; ліпідний обмін; вуглеводний обмін
non-alcoholic fatty liver disease; SARS-CoV-2; lipid metabolism; carbohydrate metabolism
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Xie M., Chen Q. Insight into 2019 novel coronavirus — An updated interim review and lessons from SARS-CoV and MERS-CoV. Int J Infect Dis. 2020. Vol. 94. P. 119-124. doi: 10.1016/j.ijid.2020.03.071.
- COVID-19: A Multidisciplinary Review / N. Chams et al. Front. Public Health. 2020. Vol. 8. P. 383. doi: 10.3389/fpubh.2020.00383.
- Whitsett M., Ortiz V., Weinberg E.M. CON: Liver Transplantation in the Times of COVID-19: Patients with COVID-19 Infection Should not Undergo Liver Transplantation. Clinical Liver Disease. 2021. Vol. 18. P. 233-236. doi: 10.1002/cld.1136.
- COVID-19 in a Patient with Liver Cirrhosis / R.F. Beraldo et al. Am J Case Rep. 2021. Vol. 22. P. e929948. doi: 10.12659/AJCR.929948.
- Liver injury during highly pathogenic human coronavirus infections / L. Xu et al. Liver Int. 2020. Vol. 40(5). P. 998-1004. doi: 10.1111/liv.14435.
- High rates of 30-day mortality in patients with cirrhosis and COVID-19 / M. Iavarone et al. J Hepatol. 2020. Vol. 73(5). P. 1063-1071. doi: 10.1016/j.jhep.2020.06.001.
- Risk of severe illness from COVID-19 in patients with metabolic dysfunction-associated fatty liver disease and increased fibrosis scores / G. Targher et al. Gut. 2020. Vol. 69(8). P. 1545-1547. doi: 10.1136/gutjnl-2020-321611.
- SARS-CoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19 / Y. Wang et al. J Hepatol. 2020. Vol. 73(4). P. 807-816. doi: 10.1016/j.jhep.2020.05.002.
- Chen H., Chen Q. COVID-19 Pandemic: Insights into Interactions between SARS-CoV-2 Infection and MAFLD. Int J Biol Sci. 2022. Vol. 18(12). P. 4756-4767. doi: 10.7150/ijbs.72461.
- The Triglyceride/HDL Ratio and Triglyceride Glucose Index as Predictors of Glycemic Control in Patients with Diabetes Mellitus Type 2 / N. Babic et al. Med Arch. 2019. Vol. 73(3). P. 163-168. doi: 10.5455/medarh.2019.73.163-168.
- The triglycerides-glucose index and the triglycerides to high-density lipoprotein cholesterol ratio are both effective predictors of in-hospital death in non-diabetic patients with AMI / J. Guo et al. Peer J. 2022. Vol. 10. P. e14346. doi: 10.7717/peerj.14346.
- Crosstalk Between Plasma Cytokines, Inflammation, and Liver Damage as a New Strategy to Monitoring NAFLD Progression / T.C.M. Сontes-Cal et al. Front Immunol. 2021. Vol. 12. P. 708959. doi: 10.3389/fimmu.2021.708959.
- Діденко В.І., Кленіна І.А., Татарчук О.М., Петішко О.П. Зв’язок імунологічних та біохімічних показників у хворих на хронічні дифузні захворювання печінки залежно від етіологічних факторів розвитку стеатозу і фіброзу печінки. Гастро–ентерологія. 2019. Т. 53. № 2. С. 115-122. doi: 10.22141/2308-2097.53.2.2019.168985.
- Роль сывороточных биомаркеров в диагностике неалкогольной жировой болезни печени / Г.Д. Фадеенко и др. Сучасна гастроентерологія. 2019. № 3(107). С. 58-65.
- Metabolic-associated fatty liver disease is associated with severity of COVID-19 / Y.J. Zhou et al. Liver Int. 2020. Vol. 40(9). P. 2160-2163. doi: 10.1111/liv.14575.
- A systematic review and meta-analysis reveals long and dispersive incubation period of COVID-19 / Y. Wei et al. BMG. medRxiv. 2020.06.20.20134387. P. 1-16. doi: 10.1101/2020.06.20.20134387.
- Yoon H., Shaw J.L., Haigis M.C., Greka A. Lipid metabolism in sickness and in health: emerging regulators of lipotoxicity. Mol Cell. 2021. Vol. 81. P. 3708-3730. doi: 10.1016/j.molcel.2021.08.027.
- Wiebe N., Stenvinkel P., Tonelli M. Associations of Chronic Inflammation, Insulin Resistance, and Severe Obesity with Mortality, Myocardial Infarction, Cancer, and Chronic Pulmonary Disease. JAMA Netw Open. 2019. Vol. 2(8). P. e1910456. doi: 10.1001/jamanetworkopen.2019.10456.
- Agrawal M., Kern P.A., Nikolajczyk B.S. The Immune System in Obesity: Developing Paradigms Amidst Inconvenient Truths. Curr Diab Rep. 2017. Vol. 17(10). P. 87. doi: 10.1007/s11892-017-0917-9.
- Цитокіни, інсулінорезистентність і жорсткість артеріальної стінки в оцінюванні перебігу неалкогольної жирової хвороби печінки / Ю.М. Степанов та ін. Патологія. 2022. Т. 19. № 1(54). С. 5-11. doi: 10.14739/2310-1237.2022.1.245985.
- Аspects of immunological status and carbon metabolism in patients with non-alcoholic fatty liver disease in correlation with its fibrous transformation / Y.M. Stepanov et al. Вісник проблем біології і медицини. 2019. Вип. 3. C. 196-200. doi: 10.29254/2077-4214-2019-3-152-196-200.
- Chronic Adipose Tissue Inflammation Linking Obesity to Insulin Resistance and Type 2 Diabetes / F. Zatterale et al. Front Physiol. 2020. Vol. 10. P. 1607. doi: 10.3389/fphys.2019.01607.
- Inflammatory Markers in Anorexia Nervosa: An Exploratory Study / B. Dalton et al. Nutrients. 2018. Vol. 10. P. 1573. doi: 10.3390/nu10111573.
- NAFLD and cardiovascular diseases: a clinical review / P. Kasper et al. Clinical Research in Cardiology. 2021. Vol. 110(7). P. 921-937. doi: 10.1007/s00392-020-01709-7.